
近日,首都医科大学附属北京天坛医院周大彪教授团队在神经外科领域经典期刊《Journal of Neurosurgery》发表题为”Subventricular zone–associated classification in isocitrate dehydrogenase–wildtype glioblastomas: improved prognostic value through integration of FLAIR with contrast-enhanced imaging”的研究论文。该研究指出了现有基于T1增强影像的胶质母细胞瘤SVZ分型的局限性,并通过整合T2/FLAIR影像进行了改进,强调了非增强成分在胶质母细胞瘤中的重要性,提升了对胶质母细胞瘤的认识,具有重要的临床价值。
首都医科大学附属北京天坛医院博士研究生赵叙喆为本文的第一作者,首都医科大学附属北京天坛医院神经外科周大彪教授为通讯作者。

目 的
以对比增强的T1加权(T1CE)成像为基础的室管膜下区(SVZ)分型对异柠檬酸脱氢酶(IDH)野生型胶质母细胞瘤(GBM)的预后评估价值存在争议。本研究旨在评估将FLAIR成像纳入基于T1CE成像的分型中,以提高预后评估准确性。
方 法
对281例IDH野生型GBM患者进行了回顾性分析。根据术前MRI进行基于T1CE影像的SVZ分型,并整合T2/FLAIR影像以评估其预后估计能力。根据肿瘤与SVZ的关系,分别基于T1CE和T2/FLAIR影像将患者分为SVZ+和SVZ−队列。使用Kaplan-Meier和Cox风险回归分析分别评估无进展生存期(PFS)和总生存期(OS)。根据以上分类进一步将患者分为三个亚组:组1(T1CE和T2/FLAIR影像分型均为SVZ+),组2(T1CE分型为SVZ−但T2/FLAIR分型为SVZ+),组3(T1CE和T2/FLAIR影像分型均为SVZ−)。亚组分析用于评估临床和分子因素及预后的差异。
结 果
T1CE影像为基础的SVZ分型未能区分SVZ+和SVZ−队列的OS(16.0个月vs. 20.0个月,p=0.36)。生存分析显示组1和组2患者的预后相似,组2患者的OS较组3患者差(19.0个月vs. 23.5个月,p=0.024)。logistics回归分析发现较低的Karnofsky表现状态(KPS)(p=0.011)、肿瘤直径(p=0.002)和端粒酶逆转录酶(TERT)启动子突变(p=0.003)与组2GBM的较高发生率相关。此外,基于T2/FLAIR影像的SVZ分型提供了显著的预后价值(17.0个月vs. 23.5个月,p=0.021),通过Cox多因素分析证明其是独立的预后因素(HR 1.79,95% CI 1.08-2.96;p=0.024)。
结 论
本研究强调了基于T1CE影像的SVZ分型在预测IDH野生型GBM患者预后评估方面的局限性。作者因此提出了整合T2/FLAIR影像分型的方法,可以提供更好的预后评估能力。值得注意的是,TERT启动子突变可能是非增强肿瘤浸润SVZ区域的关键因素。建议后续通过大规模队列研究进一步验证这些发现。
引言
胶质母细胞瘤(GBM)是中枢神经系统中最常见的原发性肿瘤之一,占所有恶性脑胶质瘤的一半以上。尽管进行了积极的手术切除并辅以化疗和放疗,GBM患者的预后仍然不容乐观。即使有如肿瘤电场治疗等有希望的进展,其中位总生存期(OS)也很少超过16个月。与GBM患者预后较差显著相关的几个因素包括年龄较大、术前KPS评分较低以及MGMT非甲基化。此外许多研究表明,GBM侵入到室管膜下区(SVZ)也与较差的生存结果有关。SVZ是位于侧脑室旁大约3-5毫米处的一个区域,拥有大量神经干细胞(NSCs),这些细胞携带驱动突变。这种特定的组成在推动累及SVZ区域GBM的侵袭性行为和较差的生存预后方面起到了重要影响。
SVZ+GBM通常被定义为肿瘤强化边界与侧脑室接触。然而,最近的研究对这种传统的基于T1加权对比增强(T1CE)成像的预后分型的有效性提出了质疑。值得注意的是,MRI上观察到的增强仅代表了胶质瘤相关血管的组成,并不能准确反映GBM的实际边界。此外,世界卫生组织(WHO)第5版中枢神经系统肿瘤分类中,与IDH野生型GBM有着不同生物学行为的突变亚群被排除在GBM的诊断中。因此,重新评估基于T1CE成像的SVZ分型在IDH野生型GBM预后分层中的适用性至关重要,特别是考虑到GBM的非增强成分(NECs)中也包含了会影响预后的肿瘤细胞浸润。然而,NECs与SVZ之间关系对GBM患者生存的影响仍不明确。由于使用T2/FLAIR成像可以更好地显示NECs,因此,本研究旨在在SVZ分型中将FLAIR成像与传统的T1CE成像结合,以评估这种结合是否能提高GBM患者的预后评估价值,同时探索其潜在的临床意义。
方法
患者队列
分子信息
所有切除的肿瘤样本均固定于10%的福尔马林中,并包埋于石蜡中以进行病理评估。在5微米厚的切片上进行H&E染色和免疫组织化学分析。通过测序分析包括IDH和端粒酶逆转录酶(TERT)在内的分子标志物,MGMT通过焦磷酸测序或聚合酶链反应测试。免疫组织化学分析用于检测Ki-67、p53、VEGF、GFAP、EGFR和PTEN的表达。根据之前的研究,定义为高(≥30%)或低(<30%)进行分析。
影像信息和SVZ评估
所有患者在肿瘤切除前进行了MRI扫描,并在术后48至72小时内进行术后MRI扫描。肿瘤的切除范围(EOR)通过基于术前和术后MRI的公式:(术前肿瘤体积-术后肿瘤体积)/术前肿瘤体积,计算得出。完全切除(Gross-total Resection)定义为EOR>98%,次全切除(Subtotal Resection)为80%到98%之间,而部分切除(Partial Resection)为EOR小于80%。基于术前MRI,SVZ受累定义为对比增强肿瘤边界至侧脑室边界(<5毫米)或沿脑室壁扩散。随后,所有GBM可以分为两个队列:SVZ+和SVZ-,分别称为“中心型”和“周围型”GBM。同样,基于T2-FLAIR影像的分类与T1CE影像的分类方式相似。影像学评估(EOR和SVZ分型)由一个独立审查小组进行,该小组由一名资深神经外科医生和一名有经验的放射科医生组成,他们对患者的预后情况不知情。两人均在北京天坛医院各自的领域工作了超过二十年。
治疗和预后评估
所有患者都选择了手术切除作为首选治疗,并尝试对每个患者实施最大范围安全切除。手术后,推荐每位患者进行同步放化疗和以替莫唑胺为基础的辅助化疗(Stupp方案)。放疗完成后4周进行常规MRI扫描,随后每3个月或发现任何异常时每1个月进行后续扫描。必要时使用如MRS、PWI和PET-MR等多模态MR技术以确定肿瘤是否进展。所有患者均随访至死亡或在最后一次随访时截尾。肿瘤进展由我们的独立评审小组根据神经肿瘤反应评估标准(RANO)评估。无进展生存期(PFS)从诊断日期计算到肿瘤复发或死亡,而总生存期(OS)指从诊断到死亡或到最后随访时的持续时间。本研究获得当地伦理委员会批准,并获得了患者及其家属的书面知情同意。
统计分析
连续变量以均值±标准差表示,分类变量以数量(百分比)表示。描述性统计用于总结患者和肿瘤的特征。此外,使用Student t检验比较连续变量,使用卡方检验或Fisher精确检验(视情况而定而定)比较组间分类变量。使用Logistic回归识别亚组间差异的术前因素,并计算95%置信区间的比值比。采用Kaplan-Meier方法估计OS和PFS的生存曲线,并用Log-rank检验评估差异。此外,用Cox风险回归模型进行单因素和多因素分析,以评估各种临床和分子特征对OS和PFS的影响。所有统计分析均使用SPSS 24.0软件(IBM公司)进行。统计显著性设定为双侧P值<0.05。
结果
人口统计信息
表1. 基于两种不同分型的SVZ+患者的基线特征以及亚组之间的比较
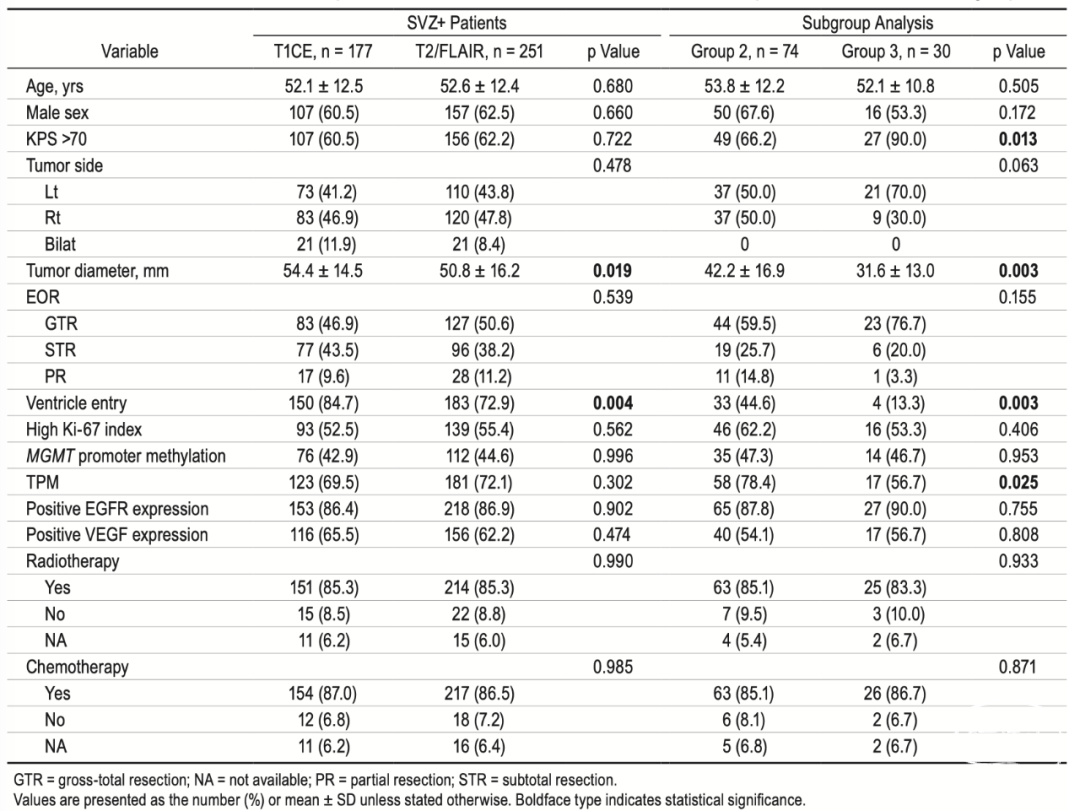
基于T1CE影像的SVZ分类及预后评估
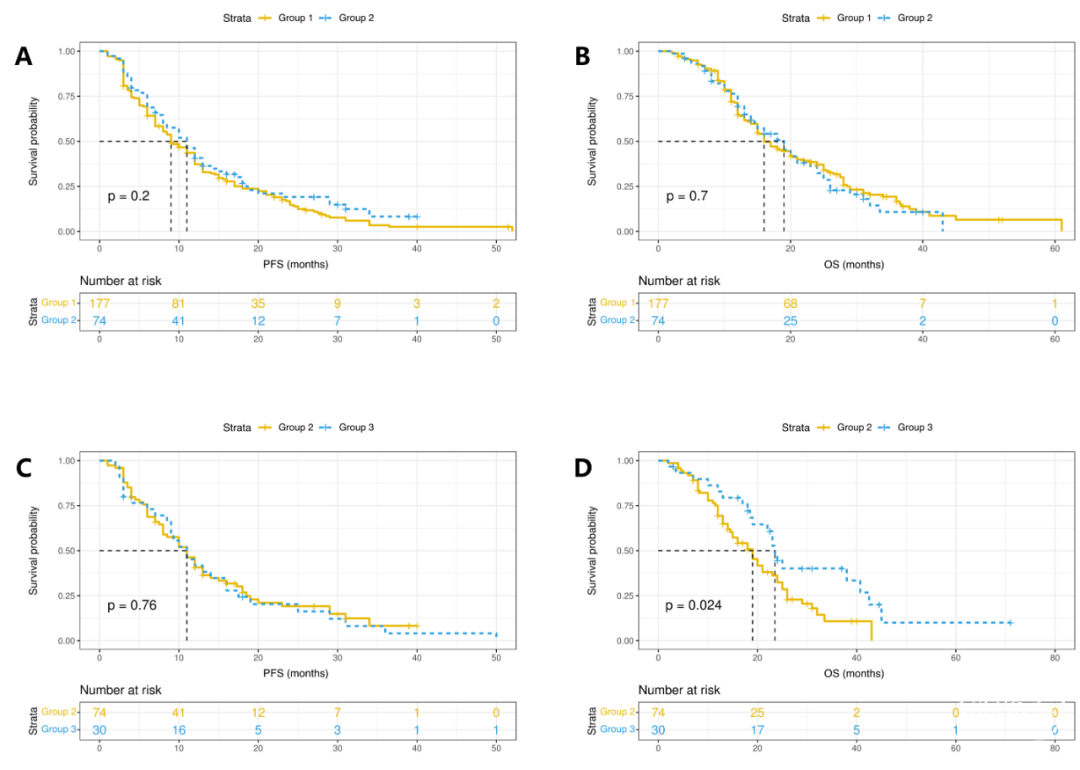
在诊断为GBM的281名患者中,基于T1CE影像,有177名患者(63.0%)被分类为SVZ+。为了评估这种方法的预后评估性能,使用Kaplan-Meier及log-rank检验对PFS和OS进行了分析。SVZ+和SVZ-队列显示出相似的PFS(中位时间:9个月vs. 11.0个月,p=0.22),该分类在OS评估上也未能提供有效的预后区分,两个队列的中位OS分别为16.0个月和20.0个月(p=0.36)(图1)。此外,单因素Cox风险回归分析显示,基于T1CE影像的SVZ分类对PFS(HR 1.17,95% CI 0.90–1.52;p=0.237)或OS(HR 1.14,95% CI 0.86–1.51;p=0.375)没有显著意义(表2)。
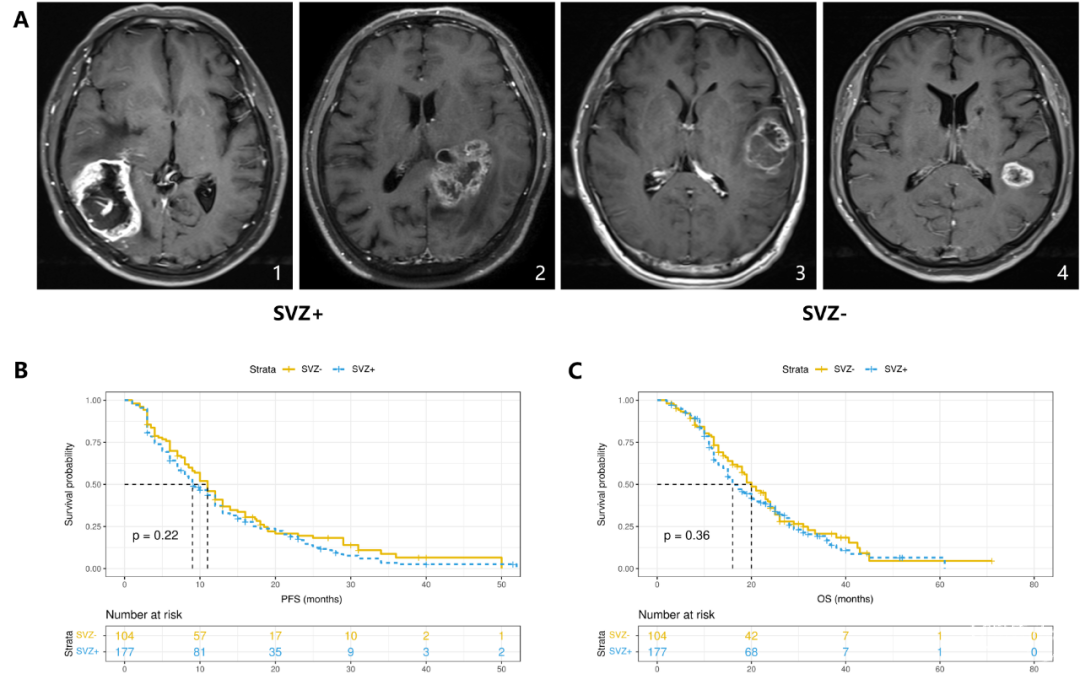
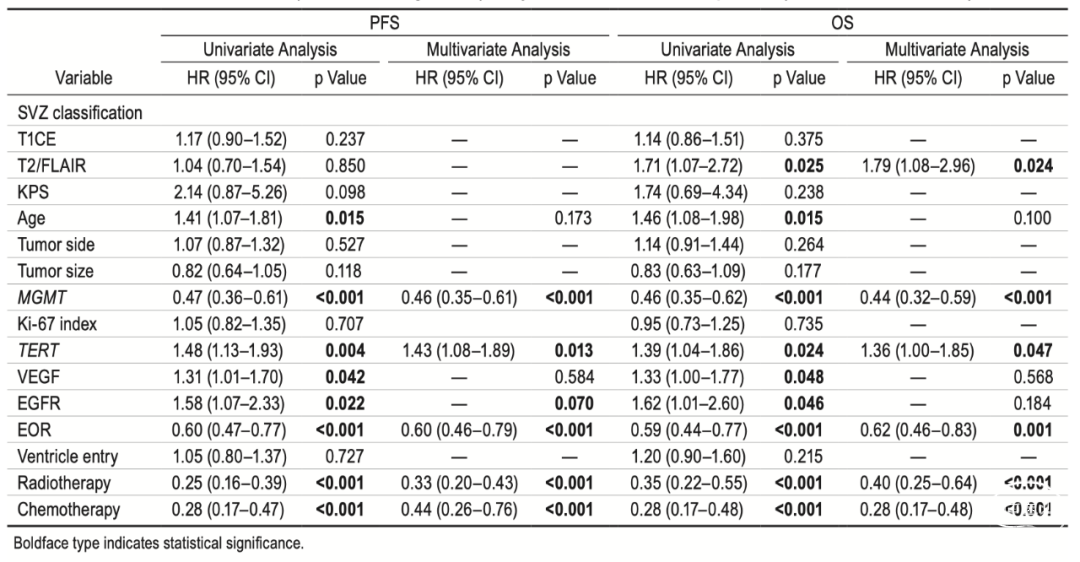
亚组分析
基于上述结果,我们将T2/FLAIR影像整合到基于T1CE影像的SVZ分类中。根据T1CE影像被分类为SVZ+同时FLAIR序列上肿瘤累及SVZ的患者,将其分类为基于FLAIR成像的SVZ+组。此外,根据FLAIR成像中非增强肿瘤部分是否浸润了SVZ区域,将104名之前基于T1CE影像的SVZ-队列的患者分为两个亚组。这样就形成了三个亚组:组1包括根据T1CE和T2/FLAIR成像均分类为SVZ+的患者(n=177;63%),组2包括在T1CE上为SVZ-但在T2/FLAIR影像分类中为SVZ+的患者(n=74;26%),以及组3包含了在T1CE和T2/FLAIR影像上均为SVZ-的患者(n=30;11%)(图2)。组1和组2患者的增强肿瘤部分均远离SVZ,其形态学区别在于非增强肿瘤部分是否累及了SVZ区域。
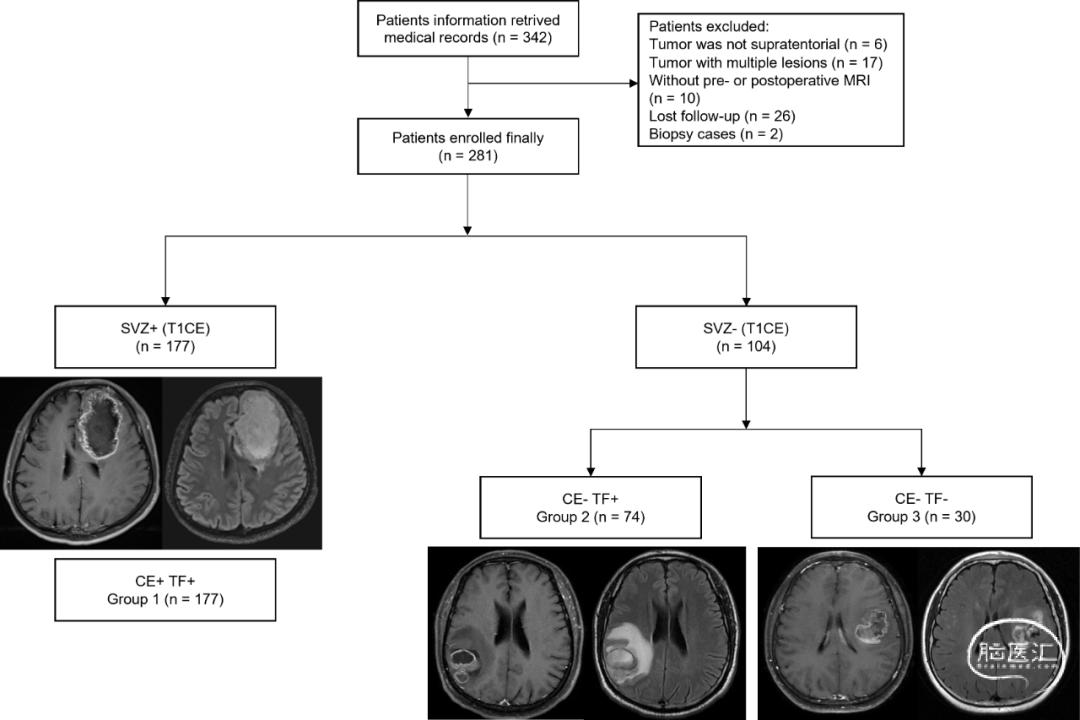
图2. 纳入患者的流程图,根据T1CE (CE) 和T2/FLAIR (TF) 成像的分型结果进一步细分为亚组。
首先,我们比较了各组之间的预后差异。然而,组1和组2之间的PFS或OS并没有显著差异。组1和组2的中位PFS分别为9.0个月和11个月(p=0.2)。同样,两组的中位OS分别为16个月和19个月(p=0.7)。组2和组3患者的中位PFS分别为11.0(95% CI 8.4–13.6)个月和11.0(95% CI 7.5–14.5)个月(p=0.76)。在OS方面,组3患者(中位OS为 23.5个月,95% CI 21.1–25.9)表现出比组2患者(中位OS 19.0个月,95% CI 15.1–22.9个月)更好的生存结果,并有统计学差异(p=0.024)(图3)。在考虑了其他混杂因素后,组3和组2之间的OS差异仍然显著(HR 0.52,95% CI 0.29–0.93;p=0.028)。同样,组3患者的OS显著优于组1患者(HR 0.60,95% CI 0.36–0.99;p=0.05)。
组2和组3基线特征的比较
表3. 组2和组3间的logistic回归分析结果
基于T2/FLAIR影像的SVZ分类的预后表现
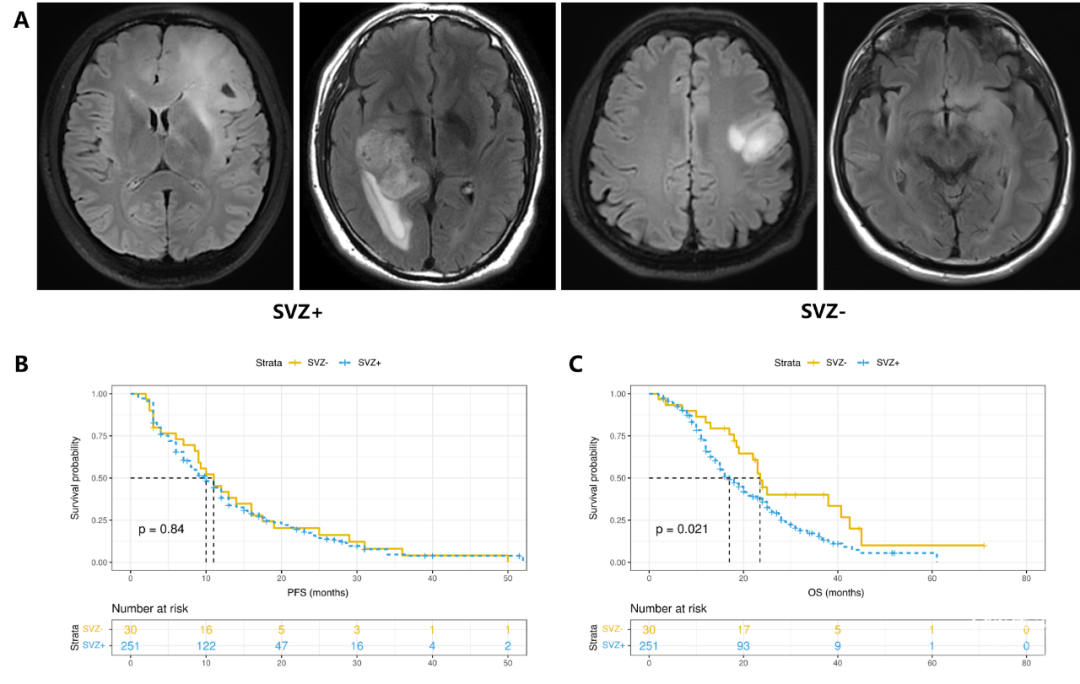
最后,应用基于T2/FLAIR影像的SVZ分型,251名患者(89.3%)被分类为SVZ+,仅有30名患者(10.7%)被分类为SVZ-。与使用T1CE成像的传统SVZ分型相比,基于T2/FLAIR影像的分型有效地对两个队列进行了预后分层,SVZ+队列的中位OS为17.0个月,而SVZ-队列的中位OS为23.5个月(p=0.021)(图4)。此外,该分型在OS风险评估方面优于传统分型(HR 1.71 95% CI 1.07–2.72;p=0.025)。在整合了临床和分子参数如KPS、患者年龄、肿瘤侧别、肿瘤直径和MGMT等后,多因素Cox风险回归分析表明,基于T2/FLAIR影像分型的SVZ+队列与较差的OS显著相关(HR 1.79,95% CI 1.08–2.96;p=0.024),如表2所总结。
讨论
治疗具有侵袭性和异质性的GBM仍然是神经外科医生所面临的巨大挑战。然而,GBM的起源机制仍未被完全揭示。SVZ是一个特殊区域,位于侧脑室、胼胝体和纹状体,内含大量NSC,这些NSC被认为在神经修复和可塑性中起关键作用。肿瘤干细胞(CSC)学说认为,GBM细胞或GBM干细胞可能源于NSC,因为它们具有许多共同的分子特征。有趣的是,在SVZ受累的GBM中发现高含量的CSC相关的基因标志物如CD133。
累及SVZ的GBM代表了具有不同生物行为的亚群,并且先前的一些研究强调了SVZ受累在GBM中的重要性。Lim等人基于MRI上肿瘤与SVZ和皮层的关系提出了四型分类,发现I型肿瘤(SVZ和大脑皮层同时受累)相比于IV型(SVZ和大脑皮层均未受累)具有更高的多发病灶和远处播散复发频率。此外,Jafri等人表明,累及SVZ的GBM与PFS和OS的减少相关。一项荟萃分析还揭示,接触侧脑室对GBM患者的生存结果有负面影响。此外,SVZ中的NSC被认为促进了GBM的发生,并有助于肿瘤复发,即使在远离初始手术和放疗区域的部位也是如此。位于SVZ的GBM还会增加脑积水和肿瘤软脑膜播散的风险。
MRI上增强显示的GBM主要代表血脑屏障被破坏的部分,可能无法代表整个肿瘤。然而,GBM中未增强的肿瘤区域在预后中也起着重要作用。大约7.4%的IDH野生型GBM在术前MRI上缺乏典型的对比增强表现。新的WHO病理分类排除了IDH突变亚型,这些亚型之前占所有GBM的10%,并表现出与野生型肿瘤不同的生物行为。这些因素可能会影响传统基于T1CE影像的SVZ分型在预后评估中的可靠性和适用性。同时,我们的研究结果表明,仅基于T1CE影像的针对IDH野生型肿瘤的SVZ分型无法充分区分SVZ+和SVZ-队列之间的PFS和OS。巧合的是,我们的结果与之前一项研究报道的结果较为一致。
考虑到T2/FLAIR成像能更好地显示GBM中的NEC,我们决定将FLAIR成像纳入基于T1CE成像的SVZ分型中。尽管在组2中,肿瘤的增强部分远离SVZ,但该组的生存结果与组1相似。当比较组2和组3的生存结果时,如果根据传统的T1CE影像的SVZ分型,这些患者都是SVZ-,因此预计预后相当。然而,由于NEC累及了SVZ,组2患者的OS比组3要差。这些结果表明,在评估GBM与SVZ的关系时,NECs的边界比增强边界更具有代表性,进一步强调了NECs在GBM中的重要性。
考虑到T2/FLAIR成像在亚组比较中表现出更好的预后区分,我们随后将其应用于整个队列以进行SVZ相关分型,与仅依靠T1CE成像的分型相比,预后评估性能有所提高。这意味着在T2/FLAIR图像上观察到的异常区域不仅包括水肿,还包括恶性肿瘤细胞,这一观点也有先前研究的证实。此外,RANO工作组也建议使用FLAIR成像评估胶质瘤的NECs。特别注意到T2/FLAIR成像的异常,这一特征还可以用于预测GBM患者的早期复发。超全切除(即超出对比增强肿瘤边界的更大范围切除T2/FLAIR异常信号区域)在神经外科医生中越来越被认可为针对GBM的有效手术治疗策略,并显示出比传统的肿瘤全切除更优越的生存获益。RANO切除工作组的研究结果表明,残留非增强肿瘤体积的患者的生存结果显著下降。然而,在增强区域以外进一步切除非增强肿瘤是否能够为SVZ受累的GBM带来更好的生存获益还有待进一步探索。
Adeberg等人针对GBMs开发了一种称为SVZM的结合DNA甲基化的SVZ分型。其中SVZM+亚组表现出独特的分子特征和不良预后。有趣的是,他们基于T2/FLAIR影像的SVZ+和SVZM+队列之间存在大量重叠。然而,在我们的研究中,无论是使用Kaplan-Meier还是Cox风险模型,PFS都未达到统计显著性。这表明,虽然肿瘤复发模式会受到SVZ受累的影响,但这种受累可能对肿瘤进展或复发时间的影响较小。与早期复发相比,SVZ可能在GBM的晚期中发挥着更大的作用。
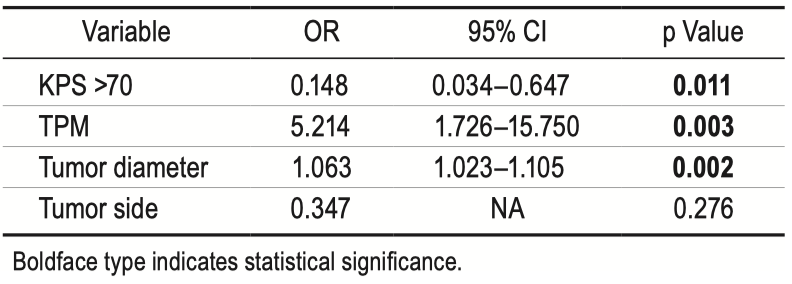
本文的亚组分析突出了组2和组3之间的显著基线特征差异。除了临床参数外,组2的GBMs在分子水平上表现出更高的TPM发生率。组1与组3在TPM方面的比较结果相似,但没有统计学意义。TPM被认为是大多数GBM发生的早期事件,因为它维持了GBM细胞实现复制不朽所需的端粒酶活性。先前的多项研究发现,具有TPM的GBM患者表现出不同的临床特征,并预示着更具侵袭性的生物学行为和更差的预后。
众所周知,SVZ中存在大量具有自我更新和分化为各种神经细胞类型能力的NSCs。Lee等人证明,SVZ中的NSCs是GBM的细胞来源之一。在我们的研究中,我们观察到特定GBMs中TPMs的发生率增加,这些GBMs表现出T2/FLAIR影像上异常信号累及了SVZ区域。作为GBM发生中的早期事件,我们提出TPM可能在NSCs向GBMs转变的过程中发挥作用,从而促进GBM细胞在SVZ微环境中的进展和侵袭。此外,通过调节TERT的表达,TPM可能动态调控GBM的肿瘤生长。这表明TPM可能赋予NSCs恶性转化的选择性优势,导致更具侵袭性的肿瘤表型的发展和对常规治疗的抵抗。然而,必须承认的是,SVZ区域中TPM与GBM进展之间相互作用的具体分子机制仍未完全了解。需要继续进行研究,以阐明在此背景下遗传物质改变与肿瘤细胞行为之间的复杂相互作用。
局限性
本研究的回顾性设计是其主要局限性。此外,在所有GBM患者中,T2/FLAIR成像的SVZ+患者占了较高比例,可能会限制这种分型的临床应用。然而,这也有助于识别预后较好的SVZ-组患者。此外,本研究主要基于东亚患者,对于其他种族人群的适用性尚未证明,今后需要基于更大队列的进一步研究来验证。
考虑到2021年的中枢神经系统肿瘤分类中,将具有特定分子特征的IDH野生型低级别星形细胞瘤分类为WHO 4级GBM(既往称“分子胶质母细胞瘤”),尚不清楚SVZ对这些肿瘤有如何影响。这一方面也应在未来研究中探索。需要承认的是,由于样本量有限,可能存在统计效能不足的情况,这可能会给文章带来一定程度的选择偏差。最后,对于常规成像技术的局限性,如何区分肿瘤是初始起源于SVZ还是后来侵入该区域仍然具有挑战性。由于胶质瘤通常通过白质纤维束扩散,通过扩散张量成像来进一步研究可能会起到帮助作用。
结论
我们的研究结果突显了基于传统T1CE影像的SVZ分型在IDH野生型GBM的预后评估中的局限性,并展现了整合了T2/FLAIR影像进行分型评估的优势。此外,TPM的存在可能在非增强肿瘤浸润SVZ区域的过程中起着关键作用。然而,未来还需要基于大队列的研究来验证这些发现。
通讯作者简介
周大彪 教授
首都医科大学附属北京天坛医院
首都医科大学附属北京天坛医院神经肿瘤外科四病区主任
主任医师、教授、博士生导师
现任中国医师协会和中国抗癌协会脑胶质瘤专业委员会委员
师从赵继宗院士并致力于微创神经外科的发展,开展术中影像引导神经外科手术(IGNS)技术。利用多模态影像融合导航、术中磁共振(iMRI)成像,术中超声和荧光造影技术等精准定位和引导胶质瘤手术,治疗效果优异
开展了多项基于激光间质热疗治疗脑胶质瘤的临床研究
以第一或通讯作者在《Neuro-Oncology》、《Clinical Cancer Research》等国际期刊发表相关研究成果20余篇
先后荣获中华医学科技一等奖和北京市科技进步一等奖等
![]()
声明:脑医汇旗下神外资讯、神介资讯、神内资讯、脑医咨询、Ai Brain 所发表内容之知识产权为脑医汇及主办方、原作者等相关权利人所有。






