VBI-1901是生物制药公司VBI Vaccines开发的一种针对巨细胞病毒(CMV)的肿瘤疫苗,其设计旨在杀死感染CMV的恶性胶质瘤和髓母细胞瘤的肿瘤细胞,增加针对感染细胞的免疫反应。多项研究表明,VBI-1901会触发来自GBM患者和健康志愿者的白细胞的抗肿瘤反应。还有研究发现,小鼠和猴子接种VBI-1901后,均能产生对CMV抗原有特异性反应的白细胞。
目前,VBI Vaccines正在开展关于VBI-1901治疗恶性程度最高的胶质母细胞瘤(GBM)的首项临床试验。这项I/IIa期试验——“评估VBI-1901疫苗用于复发GBM患者的安全性、耐受度和最佳剂量的研究”(Study to Evaluate Safety, Tolerability, and Optimal Dose of Candidate GBM Vaccine VBI-1901 in Recurrent GBM Subjects,NCT03382977),是一项分为三部分的剂量递增研究,接受治疗的入组患者需每4周进行一次VBI-1901接种,直至出现肿瘤进展(根据免疫疗法-神经肿瘤学反应评估[iRANO]/RANO标准)。
在2023年11月17日举行的第28届神经肿瘤学会(SNO)年会及教育日上,VBI-1901 I/IIa期试验的最新阳性生物标志物数据正式公布。
根据最新的机制验证数据,VBI-1901治疗与能够透过血脑屏障进入肿瘤微环境的T细胞激活相关。此外,VBI-1901治疗实现了44%的疾病控制率(7/16),同样数量的患者达到了最低生存期12个月并伴随肿瘤缓解;患者的中位总生存期(OS)为12.9个月,而目前标准单一疗法的中位OS为8个月。


研究者还发现,与疾病稳定或进展的患者相比,在获得部分肿瘤缓解的患者中,其血液/血浆的C4G蛋白(当细胞毒性T细胞或杀伤性T细胞迁移至整个肿瘤微环境时产生的一种蛋白质片段)水平更高;接种VBI-1901后的C4G水平升高与无进展生存期(PFS)延长相关。
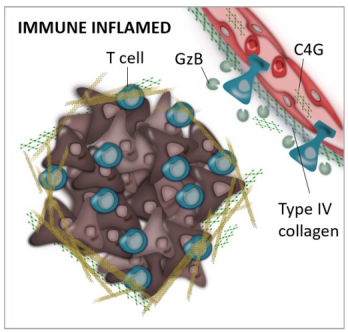
目前,VBI-1901的多中心、随机对照、开放性IIb期研究的入组工作也在持续进行中,旨在进一步评估这种疫苗的安全性和患者耐受度。该研究预计纳入60例复发GBM患者。
VBI Vaccines的首席科学官David E. Anderson博士表示,“GBM肿瘤微环境的免疫抑制性和渗透难度是众所周知的,这就是为什么大多数治疗需要在肿瘤内进行,也解释了为什么目前的有效治疗选择如此之少。我们相信,这些数据将继续提升VBI-1901的潜力,为复发和新发GBM治疗带来有意义的影响。我们期待看到后续开发阶段的各项数据。”
VBI Vaccines(www.vbivaccines.com)是一家以免疫学为驱动的生物制药公司,致力于疾病的有力预防及治疗,针对并克服包括乙肝、冠状病毒和巨细胞病毒等重大传染病,以及GBM等侵袭性癌症。通过针对病毒样颗粒的创新方法(包括包膜病毒样颗粒专利平台技术),VBI Vaccines开发出多种模拟病毒自然表现的候选疫苗,以激发人类免疫系统的固有能力。
声明:脑医汇旗下神外资讯、神介资讯、神内资讯、脑医咨询、AiBrain 所发表内容之知识产权为脑医汇及主办方、原作者等相关权利人所有。




