
【大家说】栏目,关注脑疾病转化医学前沿,综合研究成果概述、研究作者自述和国内权威专家解读。本期栏目,我们特别邀请到中山大学肿瘤防治中心的陈忠平教授和杨群英副主任医师,为我们解读并分享最新发表在《Nature》上关于关联溶瘤免疫激活与胶质母细胞瘤患者生存结局的临床试验的研究成果。
一、研究概述
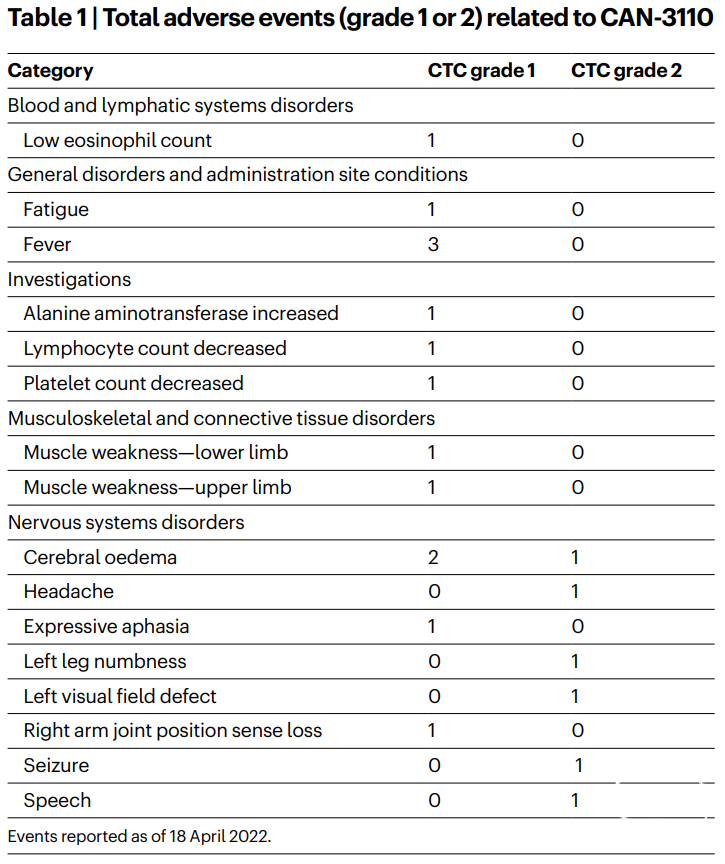
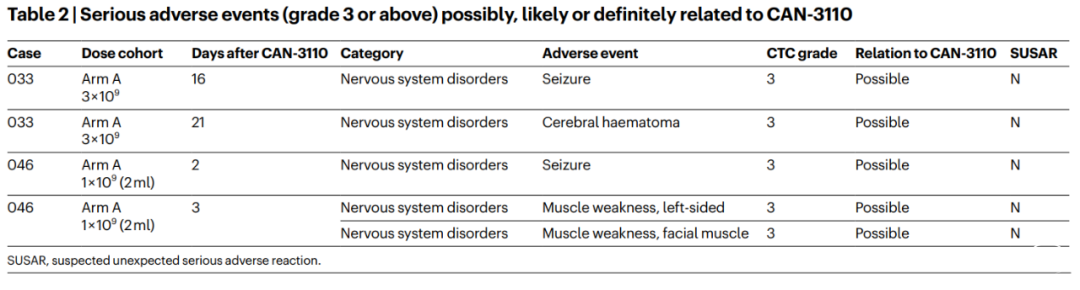
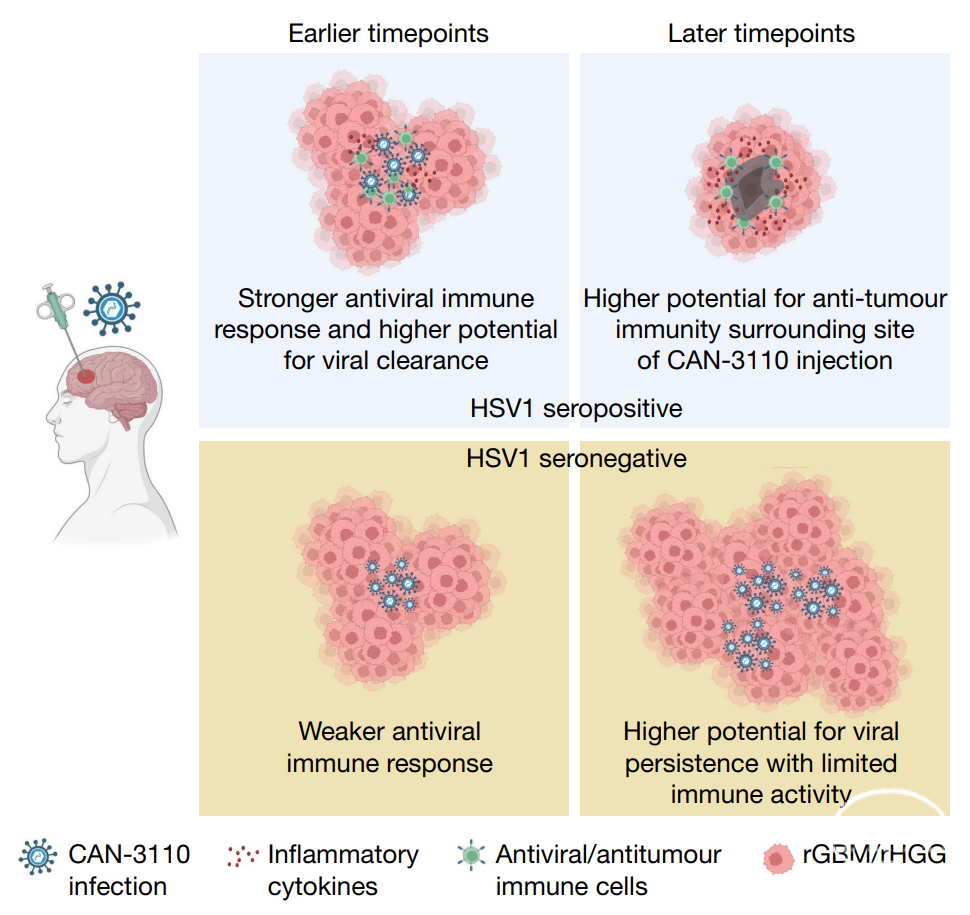
高级别胶质瘤(HGG)是一种起源于神经胶质的中枢神经系统肿瘤,具有高度恶性的形态学和遗传学特征。其中,胶质母细胞瘤(GBM)患者生存结局最差,在神经外科手术切除、放疗和化疗后仍可能迅速复发。包括复发性GBM(rGBM)在内的复发性HGG(rHGG)有着肿瘤进展迅速、生存期不超10个月的特点。虽然目前对HGG/GBM的遗传学、细胞组成和肿瘤进展的信息有很多了解,但这还没有转化为成功的治疗方法。传统的免疫疗法对rHGG/rGBM无效,原因可能是高度免疫抑制的肿瘤微环境导致浸润性抗肿瘤淋巴细胞缺失,因此这类肿瘤也被定义为“淋巴细胞耗竭型”肿瘤。对于rGBM和其他存在高度免疫抑制的实体瘤,我们需要找到使肿瘤微环境更有利于免疫疗法和免疫激活的治疗方案。





+ + + + + + + + + + +
文章来源
Ling AL, Solomon IH, Landivar AM, et al. Clinical trial links oncolytic immunoactivation to survival in glioblastoma. Nature. 2023;623(7985):157-166. doi:10.1038/s41586-023-06623-2
二、作者自述
三、陈忠平教授&杨群英副主任医师的权威解读
专家介绍
陈忠平 教授
中山大学肿瘤防治中心
主任医师、教授、博士生导师
中山大学肿瘤防治中心神经外科创科主任,胶质瘤单病种首席专家
中国名医百强榜“脑胶质瘤手术Top 10医生”
王忠诚神经外科医师奖(2006年学术奖)
中国抗癌协会神经肿瘤专业委员会(第一、二、五届)主任委员
中华医学会神经外科分会神经肿瘤专业委员会第一届委员
中国医师协会神经外科医师分会神经肿瘤专业委员会第一届委员
广东省/广州抗癌协会神经肿瘤专业委员会第一届主任委员
广东省神经外科学会第七、届八副主任委员
《Glioma》主编
杨群英 副主任医师
中山大学肿瘤防治中心
医学博士,副主任医师,硕士生导师
中山大学附属肿瘤医院神经外科/神经肿瘤科主诊教授,胶质瘤单病种专家组核心成员
新疆医科大学附属肿瘤医院神经外科名誉科室主任
声明:脑医汇旗下神外资讯、神介资讯、神内资讯、脑医咨询、AiBrain 所发表内容之知识产权为脑医汇及主办方、原作者等相关权利人所有。








