今天为大家分享的是,由中国人民解放军北部战区总医院曹鹏教授带来的GBM边界处理的思考,欢迎阅读、分享!
![]()
胶质母细胞瘤(GBM)是常见的侵袭性脑肿瘤之一,占48%的恶性原发性脑肿瘤和57%的神经胶质瘤[1,2]。自2005年的Stupp方案确定以来,对GBM的治疗策略主要为最大程度的手术切除,然后进行60Gy传统外照射(EBRT),同时每日服用替莫唑胺(TMZ)至少6个周期[3]。即使经过这种积极的治疗,GBM患者的预后仍然很差,中位无进展生存期(PFS)为6.2-7.5个月,中位总生存期(OS)为14.6-20.5个月[4]。通过增加TMZ剂量升级化疗方案、或添加贝伐单抗、西仑吉肽靶向治疗,将放疗剂量升级2Gy(等效剂量),范围在66至126Gy,PFS和OS的结果相似,反而增加了对脑组织的放射毒性[5-10]。研究发现,85%的肿瘤复发发生在手术切除的边缘附近,常见于首次手术病灶旁2~3cm[11],因脑胶质瘤呈高度浸润性生长,肿瘤组织与正常脑组织边界模糊,传统显微镜模式下难以准确辨别,切除范围多依靠术者的主观判断,手术切缘残留的肿瘤细胞是脑胶质瘤复发的主要原因[12]。因此,脑胶质瘤术中及术后对肿瘤边界的识别及处理至关重要。
![]()
荧光引导技术目前常用显影剂主要包括荧光素钠(fluorescein sodium,FLS)、5-氨基乙酰丙酸(5-aminolevulinic acid,5-ALA)等,其中FLS应用较为广泛(图1、2)。FLS是一种人工合成具有强黄绿色荧光的染料示踪剂,由于GBM呈浸润性生长,可破坏脑血管内皮超微结构,导致血管壁通透性改变及血-脑屏障受损,故静脉注射的FLS可以通过血-脑屏障并在肿瘤组织内蓄积,并通过使用专用的显微镜荧光模式,实现GBM术中可视化,有利于最大程度地切除肿瘤。5-ALA的代谢产物荧光原卟啉Ⅸ能够选择性地在胶质瘤细胞内聚集,激发波长在400~410 nm,在蓝紫光照射下产生红色荧光使肿瘤显影。5-ALA是目前唯一一个通过Ⅲ期临床试验的荧光成像试剂,5-ALA荧光技术已被证明能够提高脑胶质瘤的切除程度[13]。Picart 等应用5-ALA荧光技术辅助手术切除HGG的全切除率为83.3%[14]。5-ALA一般需术前2~3小时口服给药,用药掌控性较差,临床应用风险较高,有低血压、卟啉症、光毒性、光敏反应等副作用,术后需避光24~48h以降低光敏反应的风险,5-ALA目前在国内未获得药品监管部门批准用于临床,价格昂贵。FLS以注射液剂型生产,可在常温下贮存,临床使用安全性高,术中操作简便,只需全身麻醉后外周静脉注射,并且价格低廉,适用于大多数胶质瘤病人。

图1、2
在非显微镜手术阶段,Moore 和Peyton于1947年首次将FLS用于脑肿瘤手术[15]。此后,也有学者将FLS用于脑膜瘤、胶质瘤、脑转移瘤等穿刺活检术。但受当时技术及设备所限,此后几十年中,FLS 在神经外科领域中的应用鲜有报道。2000年前后,开始有学者发现大剂量的FLS(15~20 mg/kg)在普通的显微镜光源下能较清晰地显示黄染的脑胶质瘤[16]。此后,越来越多的学者使用FLS 术中显影辅助切除脑胶质瘤。大量研究已证实FLS荧光模式可增加术中肿瘤可视化程度,肿瘤与正常脑组织可较容易区分,提高肿瘤全切除率,明显提高病人的PFS及OS。Neira等报道应用FLS辅助手术切除32例胶质母细胞瘤(glioblastoma GBM),全切除率为93.1%[17]。Jacquesson等报道应用FLS可将病人PFS从6.7个月延长至 12.9个月,OS从12.3个月延长至20.9个月[18]。Acerbi等报道应用FLS辅助切除高级别胶质瘤,全切除率达82.6%,6、12个月PFS分别为56.6%和15.2%,中位OS为12个月,荧光染色已成为胶质瘤手术切除常用辅助技术[19](图3)。

图3
术中放射治疗系统(IORT)(图4)在很多瘤种当中都已开展,但在胶质瘤的领域开展较少,一方面是设备缘故,另一方面是之前的术中放疗会引起严重的放射性脑坏死,因此很多医生抱有顾虑。但目前的设备较以往有了很大改进,能量为50 keV,且对手术室的防护要求不高。术中放疗通常在手术切除肿瘤或手术暴露不能切除肿瘤的情况下,对瘤床或残存肿瘤区在手术中给予一次大剂量照射。方法采用单次大剂量直射,该照射方法使得肿瘤细胞不易修复,超过了细胞存活曲线的“肩剂量”,显示出明显的生物学效应,并且最大限度地保护了肿瘤附近的正常器官和组织,从而提高了PFS和OS。与传统外照射(EBRT)相比,IORT可以在术中肿瘤切除满意后直视下即刻进行照射,既避免了对周边重要结构的可能损伤,也缩短了放疗与手术治疗之间的时间间隔,因此在理论上有着无法替代的优势。

目前IORT在世界范围内属于较新的技术,在多种肿瘤的临床治疗中均得到广泛应用,并有多个临床试验正在进行,如针对乳腺癌的TARGIT-A、ELIOT及针对GBM的INTRAGO等。2016年德国海德堡大学Giordano教授牵头的INTRAGO phrase I&II 是目前较为著名的研究IORT治疗GBM患者有效性的前瞻性临床试验(NCT02104882)[20],它主要是在不改变标准放化疗治疗STUPP方案的情况下,在手术过程中加入单次20Gy-40Gy的术中放疗治疗,将IORT与标准Stupp方案联合使用的一种治疗模式。主要研究目标是PFS和OS以及局部PFS。INTRAGO 1&2是剂量递增的研究,IORT 在GBM应用的最佳剂量为10-25 Gy,超过25 Gy的IORT剂量可能会导致急性脑肿胀和颅内出血,单次IORT安全剂量最高为40Gy。IORT在治疗肿瘤局部时,可最大限度减少周围正常组织的辐射剂量,但当肿瘤位于无法耐受标准剂量的关键组织附近时,应减少IORT剂量应用,位于颅后窝的肿瘤,因接近脑干不建议行IORT治疗[21]。此外荟萃分析显示IORT能够改善GBM患者的疗效,目前它的OS与Stupp方案的结果类似,但剂量一般在10Gy-20Gy左右,剂量可以进一步提升[22]。目前进行的INTRAGO 3是一项三期多中心的临床RCT研究,即在手术以后加入单次的20Gy-40Gy术中放疗,剂量有所提高,预计入组300多例,该临床试验已在德国波恩大学、美国巴罗神经学研究所、北京天坛医院等国际著名神经外科中心进行,研究结果值得期待[23](图5)。

图5
随着术中放疗、神经电生理、神经导航和荧光引导下肿瘤切除等技术明显进步,部分GBM病人的PFS和OS已有所延长,那么将这些新技术多模态融合治疗GBM,是否会进一步的延长病人的PFS和OS?此项工作在国外部分中心已逐渐开展,例如美国巴洛神经学研究所(Barrow Neurological Institute,BNI),作为INTRAGO II临床研究多中心之一,其目前GBM的治疗策略是,利用双荧光染色技术(FLS+5-ALA)切除GBM,利用“术中共聚焦数字病理系统”(国内未上市并非所有的产品、服务或优惠在每个市场都得到认证或提供)一种可协助医生实时呈现手术标本病理微观结构,利用无限量虚拟病理标本采集,智能云端共享分析数字图像设备,显著提高术中病理诊断协同效率,实现术中快速冰冻“零时差”,详情见视频,(图6、7)。术中行IORT,术后同步放化疗,诠释了在GBM的综合治疗过程中,See(观察)-Check(诊断)-Treat(治疗)的诊疗闭环。

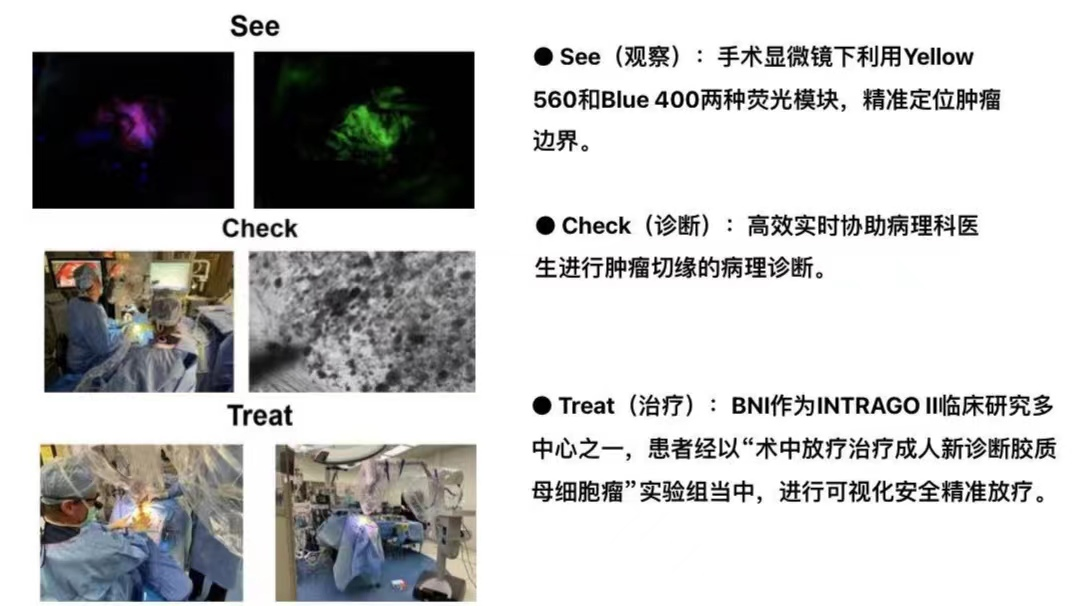
北部战区总医院神经外科近几年在引进蔡司INTRABEAM 600放射外科手术系统、PENTERO 800荧光高端手术显微镜及美敦力s7神经导航系统以来。联合电生理监测等技术尝试进行胶质母细胞瘤多模态综合治疗,并启动相应临床试验(ChiCTR2200063326、ChiCTR2200063348、ChiCTR2200063349),总结出多模态技术具有如下优势:
1. 术中放疗技术所用低能X线与高能电子线相比,更好保护瘤周正常组织,安全性强,作用瘤腔面积大(可调控)、穿透深度高(可达1cm)、安全性较高(毒副作用小),术中10-30min左右的放疗时间,安全可控。
2. 术中荧光素钠黄荧光染色能清晰描绘出病灶边际与形状,更直观地判断肿瘤边界,提高肿瘤的切除程度。
3. 多模态技术在达到最大程度切除肿瘤的同时,有效保护肿瘤周围重要血管及脑组织,并控制局部浸润或残留的肿瘤细胞增殖,防止残余瘤组织在手术和辅助放化疗之间的真空时间增殖复发。
本中心期待通过多模态融合技术治疗更多GBM,为该病的治疗提供新的循证医学证据。通过多模态技术的互补克服传统方案无法解决的难题,利用神经导航、术中电生理监测、荧光染色确定肿瘤边界并尽可能完整切除肿瘤,直视下在容易复发的瘤床精准大剂量IORT,在达到最大程度的切除肿瘤的同时,综合处理肿瘤边界,以期改善患者预后。
专家点评
点击上方二维码观看视频
参考文献
[1] Ostrom QT, Patil N, Cioffi G, Waite K, Kruchko C, Barnholtz-sloan JS. Neuro-Oncology CBTRUS Statistical Report : Primary Brain and Other Central Nervous System Tumors Diagnosed in the. 2020;22:1-96.
[2] Tan AC, Ashley DM, López GY, Malinzak M, Friedman HS, Khasraw M. Management of glioblastoma: State of the art and future directions. CA Cancer J Clin 2020;70(4):299–312.
[3] Stupp R, Mason WP, van den Bent MJ, Weller M, Fisher B, Taphoorn MJ, Belanger K, Brandes AA, Marosi C, Bogdahn U, Curschmann J, Janzer RC, Ludwin SK, Gorlia T, Allgeier A, Lacombe D, Cairncross JG, Eisenhauer E, Mirimanoff RO; European Organisation for Research and Treatment of Cancer Brain Tumor and Radiotherapy Groups; National Cancer Institute of Canada Clinical Trials Group. Radiotherapy plus concomitant and adjuvant temozolomide for glioblastoma. N Engl J Med. 2005 Mar 10;352(10):987-96.
[4] Stupp R, Taillibert S, Kanner AA, Kesari S, Steinberg DM, Toms SA, et al. Maintenance therapy with tumor-treating fields plus temozolomide vs temozolomide alone for glioblastoma. JAMA 2015;314(23):2535.
[5] Massaccesi M, Ferro M, Cilla S, Balducci M, Deodato F, Macchia G, et al. Accelerated intensity-modulated radiotherapy plus temozolomide in patients with glioblastoma: a phase i dose-escalation study (ISIDE-BT-1). Int J Clin Oncol 2013;18(5):784–91.
[6] Reddy K, Damek D, Gaspar LE, Ney D, Waziri A, Lillehei K, et al. Phase II trial of hypofractionated IMRT with temozolomide for patients with newly diagnosed glioblastoma multiforme. Int J Radiat Oncol Biol Phys 2012;84(3):655–60.
[7] Tsien CI, Brown D, Normolle D, Schipper M, Piert M, Junck L, et al. Concurrent temozolomide and dose-escalated intensity-modulated radiation therapy in newly diagnosed glioblastoma. Clin Cancer Res 2012;18(1):273–9.
[8] Yoon SM, Kim JH, Kim SJ, Khang SK, Shin SS, Cho YH, et al. Hypofractionated intensity-modulated radiotherapy using simultaneous integrated boost technique with concurrent and adjuvant temozolomide for glioblastoma. Tumori J 2013;99(4):480–7.
[9] Iuchi T, Hatano K, Kodama T, Sakaida T, Yokoi S, Kawasaki K, et al. Phase 2 trial of hypofractionated high-dose intensity modulated radiation therapy with concurrent and adjuvant temozolomide for newly diagnosed glioblastoma. Int J Radiat Oncol Biol Phys 2014;88(4):793–800.
[10] Badiyan SN, Markovina S, Simpson JR, Robinson CG, DeWees T, Tran DD, et al. Radiation therapy dose escalation for glioblastoma multiforme in the era of temozolomide. Int J Radiat Oncol Biol Phys 2014;90(4):877–85.
[11] Petrecca K, Guiot MC, Panet-Raymond V, Souhami L. Failure pattern following complete resection plus radiotherapy and temozolomide is at the resection margin in patients with glioblastoma. J Neurooncol 2013;111(1):19–23.
[12] Combs SE, Debus J, Schulz-Ertner D. Radiotherapeutic alternatives for previously irradiated recurrent gliomas. BMC Cancer 2007;7:1–11.
[13] Neira JA, Ung TH, Sims JS, Malone HR, Chow DS, Samanamud JL, et al.Aggressive resection at the infiltrative margins of glioblastoma facilitated by intraoperative fluorescein guidance. J Neurosurg. (2016) 127:111–22.
[14] Picart T, Berhouma M, Dumot C, et al. Optimization of highgrade glioma resection using 5- ALA fluorescence- guided surgery: a literature review and practical recommendations from the neuro- oncology club of the French Society of Neurosurgery [J]. Neurochirurgie, 2019, 65(4): 164-177.
[15] Moore MG, Netterville JL, Mendenhall WM, Isaacson B, Nussenbaum B. Head and Neck Paragangliomas: An Update on Evaluation and Management. Otolaryngol Head Neck Surg. 2016 Apr;154(4):597-605.
[16] Shinoda J, Yano H, Yoshimura S, et al. Fluorescenceguided resection of glioblastoma multiforme by using highdose fluorescein sodium: technical note [J]. J Neurosurg,12003, 99(3): 597-603.】
[17] Neira JA, Ung TH, Sims JS, et al. Aggressive resection at the infiltrative margins of glioblastoma facilitated by intraoperative fluorescein guidance [J]. J Neurosurg, 2017, 127(1):111-122.
[18] Jacquesson T, Ducray F, Maucort-Boulch D, et al. Surgeryof high-grade gliomas guided by fluorescence: a retrospective study of 22 patients [J]. Neurochirurgie, 2013, 59(1): 9-16.1
[19] Acerbi F, Broggi M, Schebesch KM, et al. Fluoresceinguided surgery for resection of high- grade gliomas: amulticentric prospective phase II study (FLUOGLIO) [J]. Clin Cancer Res, 2018, 24(1): 52-61.
[20] Giordano FA, Brehmer S, Mürle B, Welzel G, Sperk E, Keller A, Abo-Madyan Y, Scherzinger E, Clausen S, Schneider F, Herskind C, Glas M, Seiz-Rosenhagen M, Groden C, Hänggi D, Schmiedek P, Emami B, Souhami L, Petrecca K, Wenz F. Intraoperative Radiotherapy in Newly Diagnosed Glioblastoma (INTRAGO): An Open-Label, Dose-Escalation Phase I/II Trial. Neurosurgery. 2019 Jan 1;84(1):41-49. doi: 10.1093/neuros/nyy018. PMID: 29528443.
[21] Giordano FA, Brehmer S, Abo-Madyan Y, Welzel G, Sperk E, Keller A, Schneider F, Clausen S, Herskind C, Schmiedek P, Wenz F. INTRAGO: intraoperative radiotherapy in glioblastoma multiforme—a phase I/II dose escalation study. BMC Cancer. 2014 Dec 22;14:992.
[22] Ylanan AMD, Pascual JSG, Cruz-Lim EMD, Ignacio KHD, Cañal JPA, Khu KJO. Intraoperative radiotherapy for glioblastoma: A systematic review of techniques and outcomes. J Clin Neurosci. 2021 Nov;93:36-41. doi: 10.1016/j.jocn.2021.08.022. Epub 2021 Aug 31. PMID: 34656258.
[23] Sarria GR, Sperk E, Han X, Sarria GJ, Wenz F, Brehmer S, Fu B, Min S, Zhang H, Qin S, Qiu X, Hänggi D, Abo-Madyan Y, Martinez D, Cabrera C, Giordano FA. Intraoperative radiotherapy for glioblastoma: an international pooled analysis. Radiother Oncol. 2020 Jan;142:162-167. doi: 10.1016/j.radonc.2019.09.023. Epub 2019 Oct 16. PMID: 31629553.
点评专家简介
梁国标 教授
中国人民解放军北部战区总医院
北部战区总医院神经外科主任、主任医师;全军神经医学研究所所长
中华医学会辽宁省神经外科分会候任主委
辽宁省神经介入学会主任委员
辽宁省神经介入组组长
中国研究型医院学会神经微侵袭专业委员会主任委员
世界华人神经外科协会委员
中国医师协会神经外科医师分会委员
中国医师协会介入医师分会委员
中国医师协会脑血管病专家委员会委员
中华医学会神经外科学分会脑血管病学组副主任委员
全军神经外科学专业委员会常务委员
担任《Neurosurgery》和《Neurology India》审稿专家,《中华神经外科杂志》《中华实验外科杂志》《中国临床神经外科杂志》《创伤外科杂志》《中国微侵袭神经外科杂志》《临床误诊误治》《解放军医药杂志》编委等职
先后荣获辽宁“兴辽英才”计划科技创新领军人才,沈阳市杰出医师奖,沈阳市第七届优秀专家,军区科技发展创新人才等荣誉称号
承担国家十一五、十二五科技支撑计划子课题各1项、国家自然科学基金2项、辽宁省重点项目指导计划1项、辽宁省科技攻关课题1项,辽宁科技创新领军人才项目课题1项,辽宁省博士科研启动基金计划项目课题1项。以第一完成人获军队医疗成果二等奖一项,以第一完成人获辽宁省科技进步一等奖一项,辽宁省科技进步二等奖两项,军队及辽宁省省科技进步三等奖6项,享受军队优秀专业技术人才岗位津贴。发表各类核心期刊200余篇,SCI文章80余篇
作者简介
曹鹏 教授
中国人民解放军北部战区总医院
北部战区总医院神经外科副主任医师、神经外科博士后、硕士研究生导师、芬兰赫尔辛基大学中心医院神经外科访问学者,师从全国著名神经外科专家北部战区总医院神经外科梁国标教授
声明:脑医汇旗下神外资讯、神介资讯、神内资讯、脑医咨询、AiBrain 所发表内容之知识产权为脑医汇及主办方、原作者等相关权利人所有。








