
【大家说】栏目,关注脑疾病转化医学前沿,综合研究成果概述、研究作者自述和国内权威专家解读。本期栏目,我们特别邀请到北京协和医院神经外科的马文斌、王裕教授,为我们解读并分享最新发表在SCIENCE TRANSLATIONAL MEDICINE上的一项在胶质母细胞瘤(GBM)小鼠模型中测试新型肿瘤疫苗的研究成果。
一、研究概述
肿瘤疫苗是当前肿瘤治疗极其重要的一个研究方向,其通过利用肿瘤细胞相关抗原,来唤醒人体针对癌症的免疫系统。肿瘤疫苗技术路径多样,其中灭活肿瘤细胞可诱导有效的抗肿瘤免疫反应,然而,这种方法的有效性受到限制,因为它不能在诱导免疫反应之前杀死肿瘤细胞。与灭活的肿瘤细胞不同,活的肿瘤细胞具有定位和靶向肿瘤的能力。近期,美国布莱根妇女医院的Khalid Shah博士实验室开发了一种基于全癌细胞的双重功能疗法,这意味着,这种新型肿瘤疫苗不仅可以诱导长期免疫、训练免疫系统以防止癌症复发,还可以直接消除已发生的肿瘤。更有意思的是,该团队在患有致命脑癌——胶质母细胞瘤(GBM)的小鼠模型中,测试了这款具有双重作用的肿瘤疫苗。相关研究结果以《基于双功能肿瘤细胞治疗性疫苗展现出直接肿瘤杀伤及抗肿瘤免疫杀伤两种效能》为题,在线发表于2023年1月4日的《SCIENCE TRANSLATIONAL MEDICINE》(IF: 19.319)上。

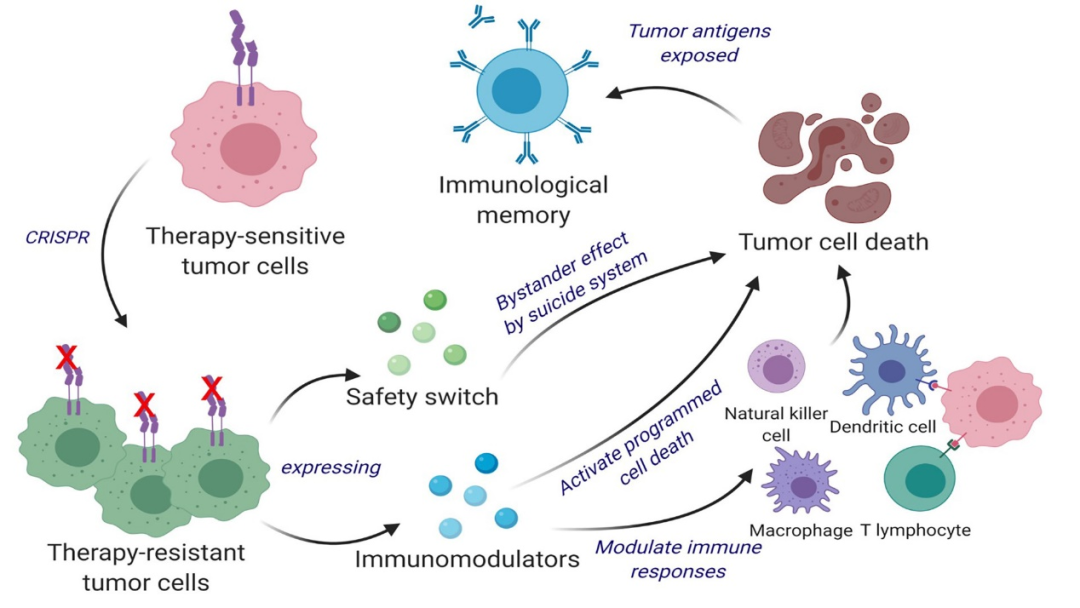
研究团队没有使用灭活的肿瘤细胞,而是重新利用了具有不同特征的活肿瘤细胞。就像信鸽返回栖息地一样,活肿瘤细胞会在大脑中长途跋涉,并回到同伴那里。利用这个特性,研究团队使用CRISPR-Cas9改造了活肿瘤细胞,并重新利用它们释放肿瘤细胞杀伤剂(免疫调节剂IFN-β和粒细胞-巨噬细胞集落刺激因子)。编辑后的肿瘤细胞被设计成表达因子,使其易于被免疫系统发现、标记和记忆,从而为免疫系统的长期抗肿瘤反应做好准备。研究团队在不同的小鼠品系中测试了CRISPR增强和逆向工程治疗性肿瘤细胞(ThTC),包括来自人骨髓、肝脏和胸腺的细胞,旨在模拟人类免疫微环境。他们还在癌细胞中建立了一个两层安全开关,后者被激活后,可以根除ThTC。这种双重功能细胞疗法在这些模型中是安全、适用和有效的,为治疗提供了路线图。
+ + + + + + + + + + +
文章来源
二、作者自述
通讯作者、布里格姆妇女医院神经外科研究部副主任兼哈佛医学院教授Khalid Shah介绍说:“活肿瘤细胞拥有一个不同寻常的特征,就是可以回到它们的肿瘤细胞同伴那里。我们一直想利用这一特质实现一个简单的想法:将癌细胞转化为癌症杀手和疫苗。我们使用基因编辑工具CRISPR-Cas9对活肿瘤细胞进行了改造,使其释放肿瘤细胞杀伤剂和免疫调节剂,从而让免疫系统为长期的抗肿瘤反应做好准备。”
Shah教授接着表示:“我们所做的全部工作,即使是高度技术性的工作,也从未忽视病人。我们的目标是采取一种创新但可转化的方法,这样就可以开发出一种治疗性的抗癌疫苗,最终对医学产生持久影响。”
关于下一步,Shah教授表示:“我们正在开发下一代基于改造自体和异体肿瘤细胞的疫苗,有望通过我们的治疗策略来防止肿瘤进展、复发和转移,对患者产生影响。”Shah教授补充道,“如果团队的研究能取得持续成果,那么这一肿瘤疫苗将在三到五年内进入临床试验阶段。”
最后,Shah教授及其同事还在文章中指出,“这种治疗策略适用于更广泛的实体肿瘤,并有必要对其应用展开进行进一步的研究。”
三、马文斌、王裕教授的权威解读
导致胶母细胞瘤(GBM)标准治疗疗效不佳的主要原因有:颅内胶质瘤呈侵袭性生长,限制了局部治疗的有效性;血脑屏障的存在使得抗肿瘤药物难以达到颅内病灶处;胶母细胞瘤的异质性导致耐药复发;胶质瘤也有其特殊的微环境使其对免疫应答的反应减弱,同时下调了肿瘤对外界凋亡信号的应答等。最新的研究已经证实颅内存在脑膜淋巴管,大脑可通过脑膜淋巴管与外界免疫系统相通,此为脑肿瘤的免疫治疗提供了基础。
肿瘤疫苗属于主动免疫范畴,分为预防性及治疗性疫苗。其原理是将肿瘤抗原以多种形式导入患者体内,增强免疫原性,激活患者自身的细胞免疫和体液免疫应答,从而达到预防/控制/清除肿瘤的目的。最早应用于GBM的疫苗治疗则见于1980年的病例报道。按照肿瘤治疗性疫苗分类,涉及到GBM的疫苗治疗的方式多种:
1
基于多肽的肿瘤治疗疫苗(代表为靶向EGFR-vIII抗原肽疫苗Rindopepimut、靶向Survivin抗原肽疫苗、个体化的抗原肽疫苗-GAPVAC等);
2
基于细胞的肿瘤治疗疫苗(代表为自体特异性DC疫苗-DCVax-L、靶向Cytomegalovirus pp65 DC疫苗——以上均属于树突状细胞DCs疫苗,另外还有自体肿瘤疫苗IGV-001);
3
其他疫苗(如卡介苗、基于细菌/病毒治疗性疫苗、独特性疫苗等),该类恶性胶质瘤治疗性疫苗中以病毒载体的肿瘤治疗性疫苗进展较快,如溶瘤病毒DNX-2401等;
4
基于核酸的肿瘤治疗性疫苗,该领域GBM核酸疫苗刚起步,代表有INO-5401。
上述四类治疗中以基于细胞的肿瘤治疗疫苗研发最受神经肿瘤领域学者关注;该类治疗性疫苗在GBM免疫治疗III期临床试验获得成功(推荐阅读:《【大家说】毛颖教授为你导读“DC疫苗治疗胶质母细胞瘤(GBM)的一项III期临床试验结果”》),另外该类治疗性疫苗的多个II期临床试验亦获得成功。鉴于此,该类疫苗的临床前研究不断加速及涌现。新近在Sci Transl Med杂志刊登美国布莱根妇女医院的Khalid Shah博士实验室临床前研究《Bifunctional cancer cell-based vaccine concomitantly drives direct tumor killing and antitumor immunity》,在基于肿瘤细胞的GBM治疗性疫苗——一种基于全肿瘤细胞的双重功能疗法开发上,取得了亮眼的进展。

Khalid Shah博士基于全肿瘤细胞的双重功能疗法与以往自体肿瘤疫苗 IGV-001治疗复发GBM不同;IGV-001制备过程首先将切除的GBM肿瘤细胞经过IMV-001处理,诱导GBM肿瘤细胞凋亡。将处理过的细胞再次混合过量IMV-001(作为佐剂)并加入IGF-1R反义寡核苷酸(IGF-1R/AS ODN置于单向渗透室,然后在GBM术后的24小时内植入患者腹部皮下。凋亡的肿瘤细胞、佐剂及IGF-1R反义寡核苷酸三者共同发挥疫苗作用,并使得试验组患者mOS延长7个月;此为灭活胶母细胞瘤发挥免疫治疗作用的模式。
Khalid Shah博士另辟蹊径开发出基因工程治疗性肿瘤细胞(Therapeutic Tumor Cell, ThTC)治疗GBM。该创新疗法原理较为复杂,集成如下:
1
利用肿瘤细胞具有归巢特性,在进行基因工程改造后的小鼠胶母细胞瘤仍有寻靶功能,自动找向体内病灶;
2
干扰素β(IFN-β)在肿瘤治疗中可以直接抑制肿瘤增殖及抗肿瘤血管形成,加速肿瘤凋亡,此为直接杀伤效应,另外INF-β且能下调PDGFRB的mRNA及蛋白水平,而PDGFRB能够促进胶质瘤干细胞生长/存活/侵袭;
3
IFN-β及粒细胞巨噬细胞刺激生长因子(GM-CSF)在抗肿瘤免疫反应的作用在于促进DC细胞的分化、增殖及招募,抗原呈递,共刺激分子表达及促炎细胞因子的产生;同时被INF-β杀伤的小鼠胶母细胞瘤细胞向肿瘤微环境释放出新抗原,又在IFN-β及GM-CSF帮助下以更高效率呈递及交叉呈递给DCs细胞,有利于抗肿瘤免疫的启动,此为间接的肿瘤细胞杀伤效应;
4
利用CRISPR-Cas9基因敲除技术将小鼠胶母细胞瘤的IFN-β受体敲除,使之由IFN-β敏感表型变为IFN-β耐受表型;这样大大降低了基因工程ThTC被小鼠免疫系统杀灭的可能;
5
经基因敲除IFN-β的基因工程改造小鼠胶母细胞瘤再进行改造,使其高表达并分泌IFN-β及GM-CSF;
6
具有活性的治疗性肿瘤细胞ThTC由于其增殖能力强,又有归巢能力,因此在试验动物荷瘤部位的肿瘤微环境中大量分泌IFN-β及GM-CSF(较自体干细胞及髓系来源细胞分泌能力均强);
7
为了防止新的胶母细胞瘤产生,该基因工程ThTC导入自杀基因系统,即利用慢病毒转导单纯疱疹病毒I型胸苷激酶基因(HSV-1 tk基因)及雷帕霉素激活的半胱氨酸天冬氨酸蛋白水解酶9基因,形成双重安全锁,在使用更昔洛韦/雷帕霉素后即可以造成该基因工程ThTC细胞死亡,免除新肿瘤产生之忧。
综上,该研究中Khalid Shah团队应用上述复杂的机理(至少7个)完成对整个试验研究的设计。研究的结果展示了基因工程治疗性肿瘤细胞ThTC作为肿瘤治疗性疫苗发挥了直接杀伤小鼠胶母细胞瘤及激活抗肿瘤免疫系统发挥了间接杀伤小鼠胶母细胞瘤的双重治疗效应。另外本研究对小鼠胶母细胞瘤免疫治疗机理的阐述亦有新意,包括CD8+、CD4+淋巴细胞在小鼠胶母细胞瘤免疫治疗中是功能独立的。在本试验中,经基因工程ThTC治疗后肿瘤微环境中细胞毒性CD4+ T细胞标签量及细胞表面标志物升高,这说明ThTC治疗后可以激活CD4+ T细胞的细胞毒功能,由此可以引申出具有记忆功能的CD4+ T细胞在防止肿瘤生长及进展过程中具备维持免疫监视的功能。
该项试验研究给神经肿瘤研究者以深刻的启迪,选择合适治疗途径,“智慧型”的载体,结合无差别肿瘤杀伤及靶向肿瘤杀伤,充分启动抗肿瘤免疫环的多个环节,治疗中引入安全锁机制等,必将促进胶母细胞瘤治疗性疫苗的研发高质量快速发展。
专家介绍
马文斌 主任医师
北京协和医院
北京协和医院神经外科主任,主任医师,教授,博士研究生导师
中国抗癌协会脑胶质瘤专业委员会主任委员
中国药促会脑神经临床药物研究专委会副主任委员
北京医学奖励基金会脑转移瘤专业委员会主任委员
中国脑转移瘤协作组副组长
中国脑胶质瘤协作组第三任组长
临床开展恶性胶质瘤的综合治疗,对恶性胶质瘤/转移瘤的化疗、分子靶向治疗、耐药复发及基因治疗研究有较深入研究;在微创神经外科领域,开展影像引导下-术中电生理检测下-唤醒麻醉下重要皮层及白质纤维束功能区病变切除,并对多模式影像学融合(如PET/CT、fMRI、MRI、CT)神经导航有所心得
主持并结题多项国家自然科学基金课题。参与发表SCI文章百余篇。作为编者参与编写《脑肿瘤的化学治疗》《神经外科诊疗常规》《临床内分泌外科学》等,作为副主译参与翻译《神经外科手术学》,作为译者翻译《神经外科学》《威廉姆斯内分泌学》等
王裕 副主任医师
北京协和医院
北京协和医院神经外科副主任医师,副教授,医学博士,硕士研究生导师
中国医师协会脑胶质瘤专业委员会全国委员
中国医师协会脑胶质瘤专委会分子诊疗专业委员会委员
中国胶质瘤协作组成员
北京医学奖励基金会脑转移瘤专家委员会秘书长
北京医学会神经外科转化医学学组委员
世界华人医师协会智慧医疗委员会委员
北京抗癌协会神经肿瘤青委会委员
主要致力于脑胶质瘤、脑转移瘤等颅内恶性肿瘤的多模态影像引导的精确神经外科手术切除,以及放、化疗、靶向及免疫、生物治疗在内的综合治疗。与此同时还擅长于影像引导下综合应用立体定向技术、神经导航技术、神外机器人辅助技术进行颅内病变精确活检手术,以期最小的代价获取病理诊断,指导患者下一步治疗
声明:脑医汇旗下神外资讯、神介资讯、神内资讯、脑医咨询、AiBrain 所发表内容之知识产权为脑医汇及主办方、原作者等相关权利人所有。








