近期,河南-麦考瑞大学生命学院生物医学创新联合中心的Muhammad Ismail等构建ApoE-ARTPC@TMZ脂质体纳米材料,应用透射电镜、流式细胞术、蛋白印记法和免疫荧光染色等手段,通过体外GBM细胞培养、正常小鼠模型和PDX模型研究,明确其生物安全性、靶向性、高效性及显著的抗胶质瘤活性的治疗效果,结果发表于2022年6月的《Biomaterials》在线。
——摘自文章章节
【Ref: Ismail M, et al. Biomaterials. 2022 Jun 1;287:121608. doi:10.1016/j.biomaterials.2022.121608. [Epub ahead of print]】
胶质母细胞瘤(GBM)是最常见的恶性脑肿瘤,致死率和致残率均很高。替莫唑胺(TMZ)是当前临床上治疗胶质瘤的一线化疗药物,但因血脑屏障(BBB)和TMZ耐药性,对GBM的治疗难度很大。近期,河南-麦考瑞大学生命学院生物医学创新联合中心的Muhammad Ismail等构建ApoE-ARTPC@TMZ脂质体纳米材料,应用透射电镜、流式细胞术、蛋白印记法和免疫荧光染色等手段,通过体外GBM细胞培养、正常小鼠模型和PDX模型研究,明确其生物安全性、靶向性、高效性及显著的抗胶质瘤活性的治疗效果,结果发表于2022年6月的《Biomaterials》在线。
作者以封装替莫唑胺和青蒿琥酯磷脂酰胆碱(ARTPC)为基础,联合ApoE功能化脂质体纳米平台构建脂质体纳米材料ApoE-ARTPC@TMZ,利用其高BBB渗透性和靶向性,作用于肿瘤,提高GBM对TMZ的敏感性,增强协同DNA损伤和诱导凋亡。研究者通过体内外实验及PDX模型,进一步验证该ApoE-ARTPC@TMZ脂质体在治疗GBM方面的临床潜力。
1. ApoE-ARTPC@TMZ脂质体的构建及表征作者构建具备靶向性的ApoE-ARTPC@TMZ纳米脂质体。与非ApoE修饰的ARTPC@TMZ相比,二者粒径大小接近,ApoE-ARTPC@TMZ具有更好的靶向性和特异性、更高的血液稳定性、更高的细胞摄取效率。在酸性或富含的环境中,该脂质体能够分解并释放TMZ及ARTPC代谢物,协同诱导胶质瘤细胞死亡(图1、2)。
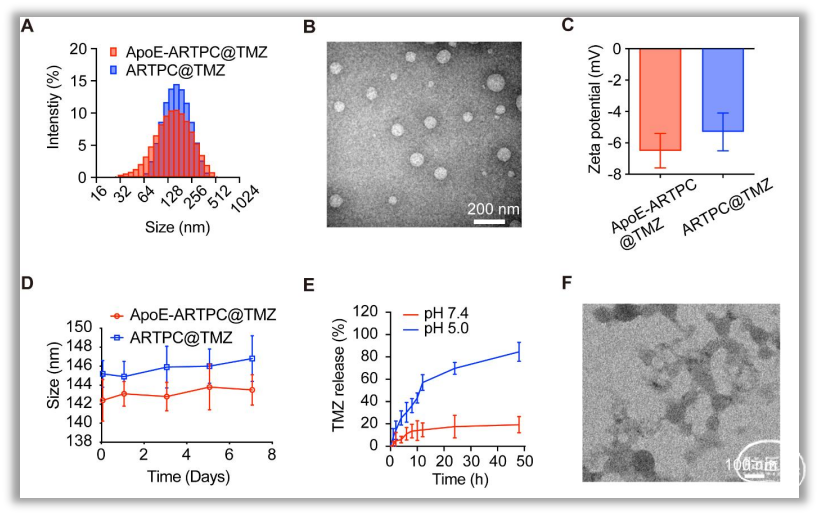
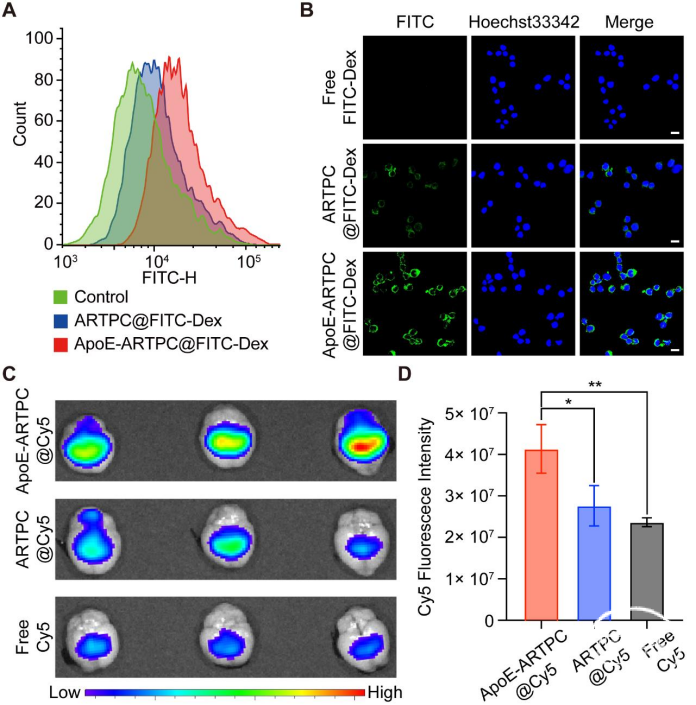
图2. ApoE功能化ARTPC脂质体的体外靶向研究2. ApoE-ARTPC@TMZ纳米脂质体介导体外协同效应在U251-TR细胞中,作者证实脂质体对其良好的协同细胞毒作用,之后利用流式细胞术、共聚焦显微镜、Western Blot等方法明确该脂质体可通过诱导DNA损伤,介导DNA修复抑制,引导ROS生成并导致细胞凋亡,干扰Wnt/β-catenin抑制MGMT蛋白表达;通过p38/ERK信号传导调节铁死亡等机制提高胶质瘤对TMZ敏感性并抑制肿瘤细胞增殖,促进其凋亡(图3)。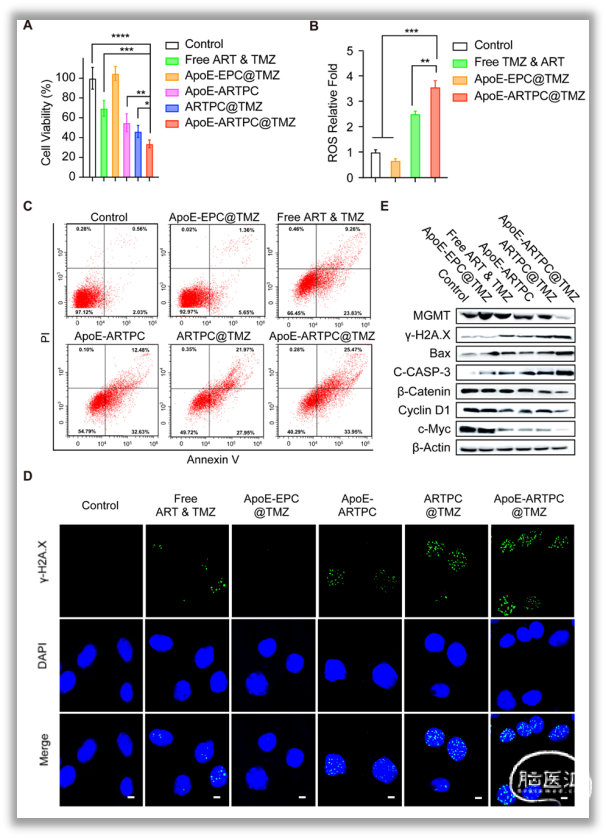
图3. ApoE-ARTPC@TMZ脂质体介导抗TMZU251-TR GBM细胞的协同作用3. ApoE-ARTPC@TMZ纳米脂质体参与GBM治疗静脉注射有染料标记的脂质体(ApoE-ARTPC@DIR),并活体成像,发现 ApoE-ARTPC@DIR处理的小鼠颅内肿瘤荧光最强,验证该脂质体的BBB穿透能力和肿瘤靶向能力(图4)。在小鼠PDX模型中,研究发现ApoE-ARTPC@TMZ脂质体可以抑制肿瘤生长,并显著延长荷瘤小鼠的生存期。通过免疫组化(IHC)染色,观察不同治疗组中增殖、DNA损伤、凋亡和β-连环蛋白信号干扰的标记物水平,明确该ApoE-ARTPC@TMZ纳米脂质体在抗肿瘤过程中介导的DNA修复抑制是通过Wnt/β-连环蛋白信号级联的衰减,从而增强肿瘤细胞对TMZ的化学敏感性,导致体内肿瘤细胞凋亡(图5)。此外,血常规、H&E染色、免疫荧光染色结果显示,ApoE-ARTPC@TMZ未造成明显不良反应和药物相关毒性。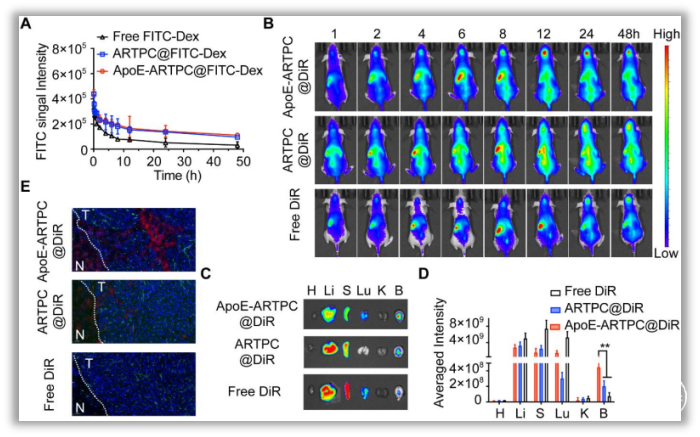
图4. ApoE-ARTPC@TMZ脂质体在小鼠PDX模型中的循环稳定性及靶向、渗透能力

图5. APOE-ARTPC@TMZ脂质体对小鼠PDX模型、治疗效果
综上所述,该研究构建的ApoE-ARTPC@TMZ脂质体能有效地穿过BBB,利用青蒿琥酯介导Wnt/β-Catenin通路抑制DNA修复,从而增强肿瘤对TMZ敏感性,强化药物协同治疗效应;同时降低TMZ有效剂量,减少其相关毒性,提高安全性,有效延长小鼠生存周期,凸显该纳米平台在胶质瘤治疗中的极大临床潜力。

声明:脑医汇旗下神外资讯、神介资讯、脑医咨询、AiBrain所发表内容之知识产权为脑医汇及主办方、原作者等相关权利人所有。未经许可,禁止进行转载、摘编、复制、裁切、录制等。经许可授权使用,亦须注明来源。欢迎转发、分享。











