美国哈佛医学院神经研究中心的Thomas S. van Solinge综述GBM局部治疗最新进展。文章发表在2022年4月的《Nat Rev Neurol》杂志。
——摘自文章章节
【Ref: van Solinge TS, et al. Nat Rev Neurol. 2022 Apr;18(4):221-236. doi: 10.1038/s41582-022-00621-0. Epub 2022 Mar 11.】
胶质母细胞瘤(Glioblastoma,GBM)是致命的神经系统恶性肿瘤之一,因其肿瘤异质性、肿瘤微环境特性、低免疫原性、肿瘤干细胞浸润以及血脑屏障特性,治疗尤为困难。大约80%的GBM患者在术后残腔内或边缘很快复发,这种局部复发与无进展生存期(progression-free survival,PFS)显著缩短相关。美国哈佛医学院神经研究中心的Thomas S. van Solinge综述GBM局部治疗最新进展。文章发表在2022年4月的《Nat Rev Neurol》杂志。
局部热疗法:不仅诱导肿瘤细胞凋亡和坏死,还能使胶质瘤细胞对放疗和化疗敏感,激发免疫反应,并造成短暂的血脑屏障破坏。该疗法包括激光间质热疗(laser interstitial thermal therapy,LITT)、磁场热疗和聚焦超声(focused ultrasound,FUS)等。
LITT疗法,通过立体定向将激光探针插入肿瘤内部(图1)。然后用波长为1064nm或980nm的激光将周围组织加热到42.5-45.5℃并持续几分钟,同时使用MRI实时监测病灶区温度。在LITT治疗中,最大的挑战是平衡治疗效果和不良反应。消融程度是疗效的一个重要决定因素。有研究表明,最大程度消融与改善无进展生存期(PFS)和总体生存期(overall survival,OS)相关。但一篇综述提及,越激进的治疗可能会增加不良反应的风险,并发症发生率高达33%。目前研究表明,对于位置深在或神经功能状态差而无法手术的GBM患者,LITT疗法具有成本-效果优势,但需要精心设计的临床试验评估LITT疗法单独或联合其它治疗的真正疗效。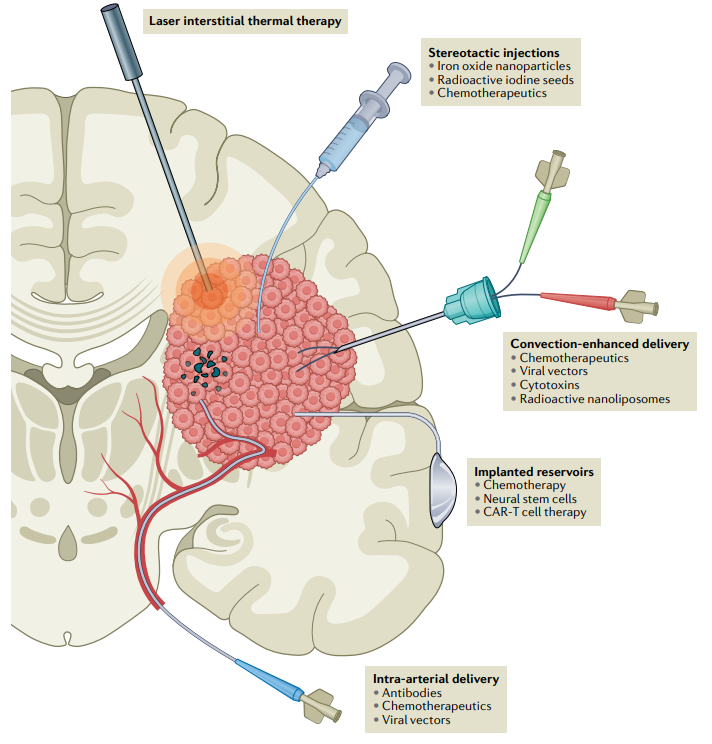
图1. 在激光间质热疗法中,MRI监测下,用激光探针加热肿瘤组织,使组织坏死同时破坏血脑屏障(BBB)。在立体定向神经导航的帮助下,各种治疗化合物可以直接注射到肿瘤中。对流增强给药包括使用压力梯度持续注入治疗化合物从而改善分布。植入Ommaya或Rickham储液囊可以在较长的时间内进行间歇药物注射。微导管可以直接插入供血动脉,局部输送高剂量的治疗药物。这种技术可以与破坏BBB相结合。CAR:嵌合抗原受体。磁场热疗,是通过外部交变磁场刺激肿瘤内部或切除肿瘤后残腔内置入的磁性纳米颗粒,以破坏癌细胞有丝分裂的技术。6例复发GBM患者的I期试验中,在术后残腔置入磁性纳米颗粒,结合60Gy放疗。6轮治疗后均未观察到明显不良反应,但治疗2-5个月后,所有患者均出现肿瘤耀斑反应,纳米颗粒周围出现明显水肿。6例患者都需要使用高剂量的皮质类固醇。其中4例患者接受开颅手术取出纳米颗粒。取出纳米颗粒时获得的组织进行分析,显示CD8+T细胞、CD4+T细胞和CD63+巨噬细胞浸润增加,表明已触发免疫反应。残腔内磁热疗法诱导强烈的炎症反应,有助于提高GBM患者免疫反应或免疫疗法的疗效。但作用机制和最佳治疗策略仍有待进一步研究。引导聚焦超声术(FUS)治疗GBM患者可暂时破坏血脑屏障,从而可使化疗药物进入脑内。现代FUS技术的发展,可能为提高胶质母细胞瘤的药物治疗的精确性带来新的希望。光动力疗法(Photodynamic therapy,PDT):光敏剂经特定波长的激光激活后,产生活性氧(reactive oxygen species,ROS)。ROS与DNA、蛋白质、脂质和其它大分子相互作用,破坏细胞代谢途径,导致细胞凋亡。光敏剂还可损伤肿瘤血管内皮细胞,局部血管内形成血栓和血管收缩,造成肿瘤缺血缺氧,从而间接杀死肿瘤细胞。在小鼠模型中,活性氧的产生和肿瘤血管内皮细胞损伤引起强烈的抗肿瘤免疫反应。目前应用于胶质母细胞瘤研究的光敏剂主要是Photofrin和5-ALA。值得注意的是,在PDT治疗中,激光必须照射到含有增敏剂的细胞。而常用激光波长范围为630-690纳米,在大多数组织中穿透力几乎不超过5毫米。因此PDT对位置深在的GBM疗效欠佳。有研究表明,75%的肿瘤患者在PDT治疗区内复发,因此对光敏剂在切除腔内的长期影响产生怀疑。然而,鉴于5-ALA的临床适用性以及低风险性,有必要进一步研究其对GBM的疗效。对流增强给药(Convection-enhanced delivery,CED)是一种给药方法,不是治疗本身。直接注射到脑实质或肿瘤组织的化疗药物的弥漫性差;药物滞留可在肿瘤区维持较恒定的浓度,从而提高治疗效果。化疗的CED在实验室中已经完成,但转化到临床却很困难。注射套管准确放置和提高抗肿瘤药物在肿瘤中的分布是亟需解决的难题。由于GBM具高度浸润性,化疗药物不仅需要渗透到组织深部,还必须渗透到恶性组织,避免发生严重的不良反应。药物晶片和储液囊植入能够向肿瘤长期输送药物。目前文献报道对可植入的卡莫司汀晶片持批评态度,需通过调整药物剂量、植入技术提高其疗效和安全性。CED有利于化疗药物直接扩散到肿瘤组织。在GBM患者化疗中,置入储液囊的作用尚未确定。动脉导管给药,随着血管内介入技术的进步,大剂量药物可经过动脉导管直接到达肿瘤内;结合血脑屏障的破坏,药物可以最大限度地通过血脑屏障。这种方法无论是作为不能手术的患者的挽救性治疗,还是与当前的标准治疗相结合,均有相当好的前景。
免疫疗法,GBM低免疫原性和肿瘤微环境免疫抑制作用导致肿瘤产生抵抗免疫反应。许多新的系统或局部疗法通过增强免疫系统对抗GBM的抗免疫反应(图2)。腺病毒/单纯疱疹病毒-胸苷激酶(AdvHSV-tk)系统、Gd-RTS-hIL-12腺病毒载体、Toca 511以及基因重组脊髓灰质炎病毒载体(PVSRIPO)均可诱发强烈免疫反应。然而,并不是所有的患者都能从中获益;只有肿瘤较小、年轻、异柠檬酸脱氢酶-1(isocitrate dehydrogenase 1,IDH1)和IDH2突变、O6-甲基鸟嘌呤-DNA甲基转移酶(O6-methylguanine DNA methyltransferase,MGMT)启动子甲基化和神经功能状态较好的患者可能获得良好的预后因素。目前关于GBM免疫疗法的研究处于I期和II期试验,必须经过III期试验才能确定该疗法的真正价值。
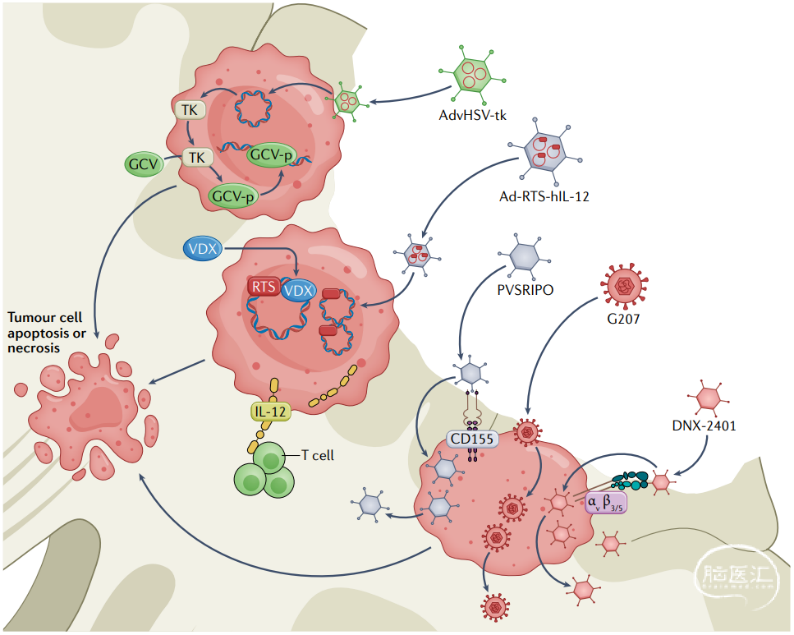
图2. AdvHSV-tk作为腺病毒载体,可传递单纯疱疹病毒1型(HSV-1)胸苷激酶(TK)。将其导入肿瘤细胞后,产生TK。TK磷酸化更昔洛韦(GCV)形成GCV-p,从而干扰DNA修复和复制,最终导致肿瘤细胞凋亡或坏死。Ad-RTS-hIL-12作为腺病毒载体,通过单次瘤内注射并工程化以表达hIL-12,hIL-12表达受RheoSwitch治疗系统(RheoSwitch Therapeutic System,RTS)控制。当口服VDX时,IL-12产生。IL-12激活T细胞并形成抗肿瘤微环境。PVSRIPO是一种具有复制能力的溶瘤性脊髓灰质炎鼻病毒嵌合体。PVSRIPO通过GBM中大量表达的CD155进入细胞。然后病毒在肿瘤细胞中复制,致使细胞凋亡和病毒的扩散。G207是一种毒性低的HSV-1变体,可在肿瘤细胞中选择性复制,导致细胞凋亡。DNX-2401可通过表达胶质瘤干细胞上的αvβ3和αvβ5整合素进入肿瘤细胞,从而肿瘤细胞凋亡或坏死。研究表明全身使用细胞因子类药物可诱导对抗肿瘤的免疫反应,但也存在很大的毒性和不良反应的风险。因此,采取局部释放细胞因子药物以规避全身反应。局部注射细胞因子类药物(IL13-PE38QQR)和寡核苷酸(CpG-ODN)可增强抗肿瘤免疫反应。
为了增加肿瘤放射剂量,同时尽量减少对周围组织的损害,近距离放射治疗、肿瘤内植入辐射源或对肿瘤附近组织的放射疗法也取得不同程度的成绩。
用于治疗GBM的间充质干细胞(MSCs)和神经干细胞(neural stem cells,NSCs)的主要功能是向肿瘤细胞深处递送化疗药物。有研究表明,NSCs可输送溶瘤腺病毒。NSCs的动力学和生命周期需要进一步的研究。GBM的异质性以及治疗后其表达谱发生变化,可影响嵌合抗原受体T细胞(chimeric antigen receptor T-cell immunotherapy,CAR-T)的免疫疗法疗效。
胶质母细胞瘤的治疗仍具有很大的挑战性,许多局部治疗方法正在研发中。未来治疗GBM可能不是采取单一的方法,必须为患者设计量身定制的、个体化的、局部与全身相结合的治疗策略。

声明:脑医汇旗下神外资讯、神介资讯、脑医咨询、AiBrain所发表内容之知识产权为脑医汇及主办方、原作者等相关权利人所有。未经许可,禁止进行转载、摘编、复制、裁切、录制等。经许可授权使用,亦须注明来源。欢迎转发、分享。








