美国佛罗里达大学医学院神经肿瘤科的Dongjiang Chen等应用GBM细胞系和同基因鼠GBM模型,通过免疫荧光染色、免疫印迹、单细胞测序、RNA测序等方法,明确了TTFields介导cGAS/STING通路并激活AIM2炎症小体,发挥GBM免疫治疗作用,结果发表于2022年4月的《The Journal of Clinical Investigation》在线。
——摘自文章章节
【Ref: Chen D, et al. J Clin Invest. 2022 Apr 15;132(8):e149258. doi: 10.1172/JCI149258.】
胶质母细胞瘤(GBM)是成人常见的、恶性程度最高的颅内肿瘤,而且具有免疫高度抑制的肿瘤微环境(TME)。肿瘤电场治疗(TTFields)是采用低强度、中频、交变电场破坏有丝分裂纺锤体,进而导致染色体错误分离和细胞凋亡的物理疗法。在TTF治疗GBM过程的影像学观察到短暂的肿瘤强化和水肿,提示TTF治疗除抗有丝分裂效应外,可能有炎症反应机制存在。动物实验发现TTFields可以刺激免疫原性细胞死亡、促进免疫细胞募集并诱导炎症反应。然而,TTFields逆转GBM患者的全身免疫抑制及相关分子机制尚不明确。美国佛罗里达大学医学院神经肿瘤科的Dongjiang Chen等应用GBM细胞系和同基因鼠GBM模型,通过免疫荧光染色、免疫印迹、单细胞测序、RNA测序等方法,明确了TTFields介导cGAS/STING通路并激活AIM2炎症小体,发挥GBM免疫治疗作用,结果发表于2022年4月的《The Journal of Clinical Investigation》在线。
作者在共聚焦显微镜下观察4个GBM癌症干细胞(GSC)系和3个GBM细胞系在TTFields作用下的核膜完整性,并通过免疫印迹等方法验证其与cGAS/STING通路及AIM2炎症小体的相关性。随后,作者应用同基因鼠GBM模型,使用单细胞及RNA测序等方法,探索TTFields对机体适应性免疫的激活作用。
研究结果发现,在4个GSC细胞系和3个GBM细胞系中,TTFields引起核包膜的局部破裂和穿孔,进而产生细胞大胞质微核簇(图1)。一方面,胞质微核簇能够募集cGAS,介导STING通路,导致PICs、T1IFNs和T1IRGs的上调,激活树突状细胞(DCs)和淋巴细胞,发挥抗GBM免疫作用(图2-3)。另一方面,胞质微核簇能够激活AIM2/Caspase-1炎性小体,诱导GSC中膜损伤的细胞死亡(图4-5)。
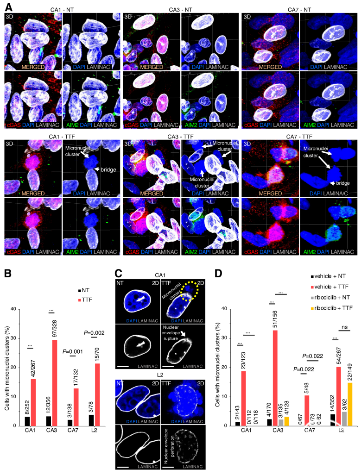
图1. TTFields诱导的胞质微核簇在GSC中募集cGAS和AIM2。
图2. TTFields激活GSC中的cGAS/STING通路。

图3. TTFields在GSC中激活cGAS/STING诱导PIC、T1IFN和T1IRG。
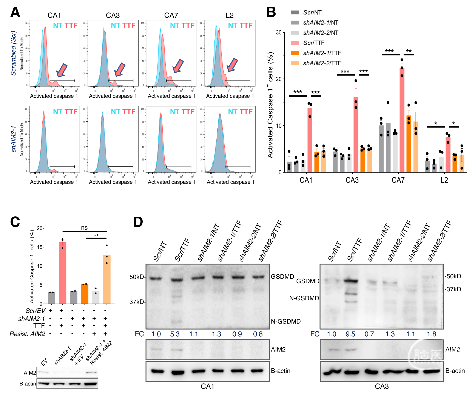
图4. TTFields激活GSC中的AIM2/Caspase-1炎性小体。
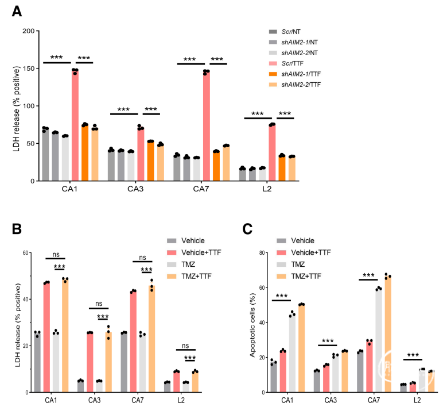
图5. TTFields激活的AIM2/Caspase-1炎性小体诱导GSC中膜损伤的细胞死亡。
在C57BL/6J同系原位GBM模型(KR158和GL261)中,作者发现,TTFields诱导的PIC和T1IFNs以STING或AIM2依赖性方式激活适应性免疫(图6-8)。进一步分析其免疫表型,发现活化的DCs和CD69+CD8+T细胞显著增加(图9-10)。结合T1IRG的生物学轨迹,验证其对于TTFields诱导的免疫激活的重要性(图11-12)。
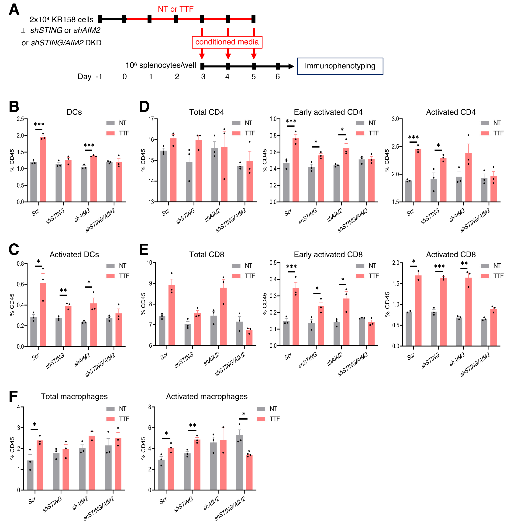
图6. TTFields诱导的PIC和T1IFN刺激DCs和淋巴细胞。
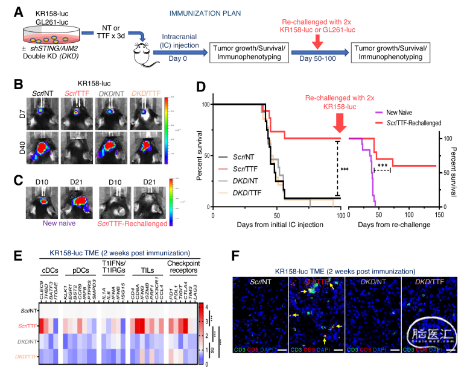
图7. TTFields在KR158同基因GBM模型中诱导抗肿瘤免疫依赖STING和AIM2。
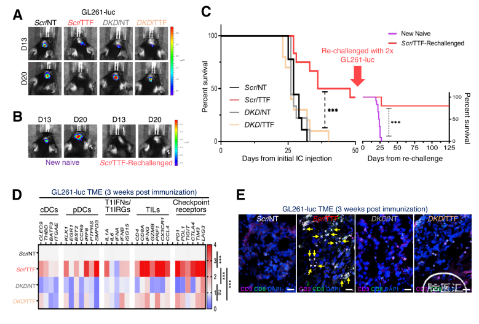
图8. TTFields在GL261同基因GBM模型中诱导抗肿瘤免疫依赖STING和AIM2。
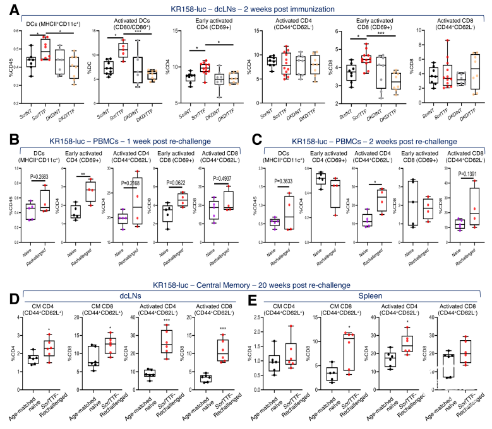
图9. KR158GBM模型中TTFields诱导的抗肿瘤免疫的免疫表型分析。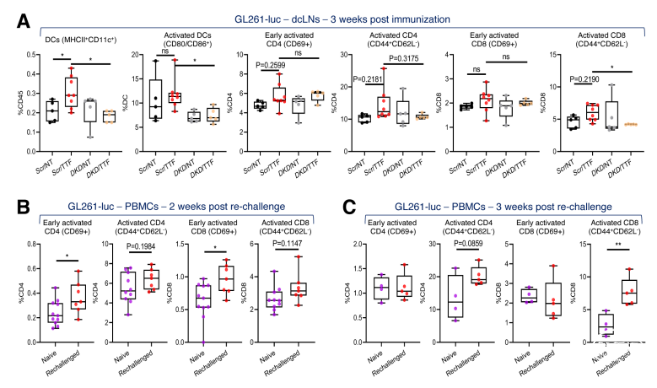
图10. 在GL261GBM模型中TTFields诱导的抗肿瘤免疫的免疫表型分析。

图11. TTFields治疗的新诊断GBM患者PBMC的单细胞测序和RNA-seq。
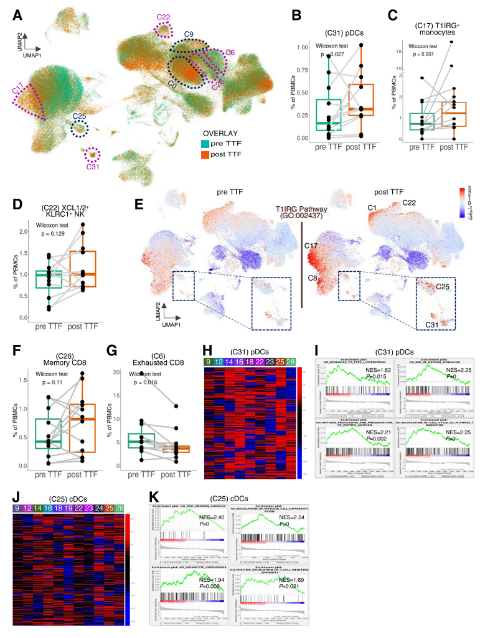
图12. 在GBM患者中,TTFields治疗通过基于T1IRG的轨迹与免疫激活相关。
作者认为,TTFields能够诱导GBM核包膜的局灶性破坏,导致含大微核簇的细胞溶质释放,介导募集和激活cGAS/STING及AIM2/Caspase-1炎性小体,进而诱导TCRb克隆扩增和pDC激活,发挥抗GBM的免疫作用。该研究展现TTFields对GBM及其它实体肿瘤的免疫治疗潜力,为TTFields肿瘤免疫治疗提供理论依据。

声明:脑医汇旗下神外资讯、神介资讯、脑医咨询、AiBrain所发表内容之知识产权为脑医汇及主办方、原作者等相关权利人所有。未经许可,禁止进行转载、摘编、复制、裁切、录制等。经许可授权使用,亦须注明来源。欢迎转发、分享。



















