美国俄亥俄州克利夫兰诊所勒纳研究所癌症生物学系的Weiwei Tao等发现,Wnt/β-catenin通路下游的分泌蛋白WISP1有维持GSC和TAM存活的双重作用,并揭示其作用机制及以此作为靶点对GBM治疗的潜在意义;结果发表在2020年6月的《Nature Communications》杂志。
——摘自文章章节
【Ref: Tao W, et al. Nat Commun. 2020 Jun 15;11(1):3015. doi: 10.1038/s41467-020-16827-z.】
胶质母细胞瘤(GBM)是成人常见的原发性恶性脑肿瘤,平均生存期少于16个月。GBM存在复杂的异质性,具有特征性胶质瘤干细胞(GSC)亚群、非干细胞肿瘤亚群及肿瘤微环境。在肿瘤微环境中,浸润的免疫细胞,尤其是巨噬细胞(TAM)参与GBM的发生发展及免疫逃避等功能,并与胶质瘤的分级、复发及预后密切相关。美国俄亥俄州克利夫兰诊所勒纳研究所癌症生物学系的Weiwei Tao等发现,Wnt/β-catenin通路下游的分泌蛋白WISP1有维持GSC和TAM存活的双重作用,并揭示其作用机制及以此作为靶点对GBM治疗的潜在意义;结果发表在2020年6月的《Nature Communications》杂志。
作者通过分析TCGA和Gravendeel数据库资料,确认GBM中Wnt/β-catenin通路下游的靶基因WISP1高表达与患者的预后不良明显相关。体外实验发现,WISP1主要在GSC中表达,并分泌到细胞外,维持GSC的干性;敲低WISP1的表达则可以抑制GSC驱动的肿瘤生长。
进一步研究发现,WISP1通过激活Akt信号通路促进GSC的增殖和存活。机制研究结果展示,GSC通过自分泌方式,使WISP1结合到自身表面的Integrin α6β1受体上, 进而激活下游的Akt信号通路。此外,WISP1促进具有肿瘤支持作用的M2型肿瘤相关巨噬细胞(M2 TAMs)的存活;具体过程是GSC分泌WISP1到细胞外,再通过旁分泌的方式与M2 TAMs表面的α6β1受体结合,激活Akt信号通路,促进M2 TAMs对肿瘤的支持,而阻断α6或β1受体减弱WISP1诱导的Akt通路激活和M2 TAMs的存活(图1)。
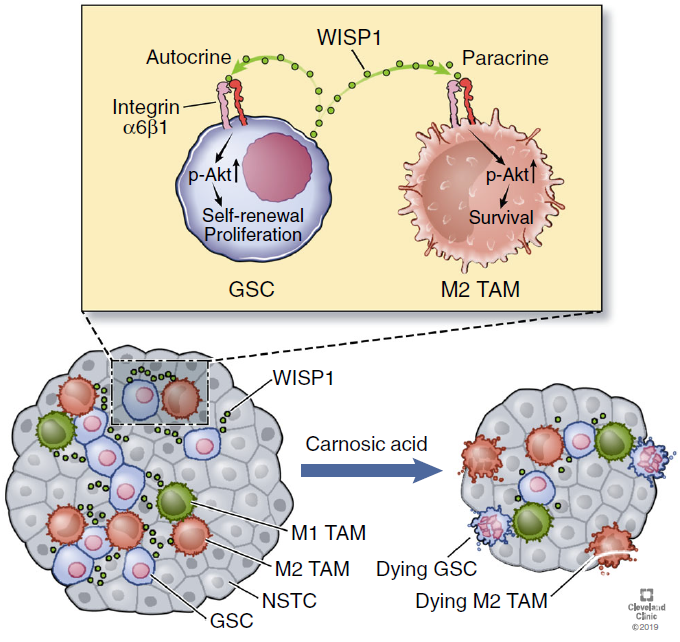
图1. WISP1由GSCs表达和分泌,通过自分泌促进GSC维持,从而激活α6β1-Akt信号传导。GSC分泌的WISP1,以旁分泌方式通过α6β1介导的Akt活化促进M2 TAMs存活。WISP1的双重作用增强GBM的生长和进展。
最后,研究者使用β-catenin特异性抑制剂carnosic acid(CA)抑制Wnt/β-catenin/WISP1信号,可以显著抑制GBM肿瘤的生长并提高小鼠异种移植模型的存活率。
该研究首次证实,WISP1作为关键因子以自分泌和旁分泌的方式在维持GSC和M2 TAM的存活中发挥作用。破坏WISP1或其上游调节靶点可以有效抑制GBM的生长,这为治疗GBM和其它恶性肿瘤提供有效的方法。此外,由于WISP1是一种由GBM肿瘤高度表达的分泌蛋白,因此血清或脑脊液中的WISP1可以作为诊断标志物。
声明:脑医汇旗下神外资讯、神介资讯、脑医咨询所发表内容之知识产权为脑医汇及主办方、原作者等相关权利人所有。未经许可,禁止进行转载、摘编、复制、裁切、录制等。经许可授权使用,亦须注明来源。欢迎转发、分享。







