美国马萨诸塞州波士顿总医院和哈佛医学院放射肿瘤科的Christine E. Eyler等通过GBM细胞系条形码结合单细胞转录组学追踪使用RTK抑制剂时,GBM干细胞耐药的发生状况。文章发表在2020年7月的《Genome Biology》在线。
——摘自文章章节
【Ref: Eyler CE, et al. Genome Biol. 2020 Jul 15;21(1):174. doi: 10.1186/s13059-020-02085-1.】
肿瘤通过短暂或持续的遗传和表观遗传改变适应药物治疗。要准确了解短暂或持续的遗传和表观遗传如何影响肿瘤异质性、动态亚群和整体肿瘤的适应性,需要通过在单细胞水平上的前瞻性实验研究,标记、跟踪和描述耐药或其它适应性的变化。在胶质母细胞瘤(GBM)中,受体酪氨酸激酶(receptor tyrosine kinase,RTK)治疗的效果不佳是遗传异质性或信号传导阻滞的表观遗传变化所造成。美国马萨诸塞州波士顿总医院和哈佛医学院放射肿瘤科的Christine E. Eyler等通过GBM细胞系条形码结合单细胞转录组学追踪使用RTK抑制剂时,GBM干细胞耐药的发生状况。文章发表在2020年7月的《Genome Biology》在线。为追踪克隆谱系的生长和表型,作者将慢病毒转基因条形码系统结合单细胞RNA测序(scRNA-seq),通过高度多样的条形码检测恶性肿瘤细胞群中的罕见亚克隆。研究者针对由血小板衍生生长因子受体(PDGFRA)增强的、来源于患者胶质瘤的细胞球模型(GSC8)保持条形码多样性;将GSC8细胞置于不同的培养基,并连续用达沙替尼(dasatinib)治疗70天。通过t-SNE可视化分析单个细胞的转录程序,探索胶质母细胞瘤对达沙替尼耐药的过程。
虽然大量条形码谱系采用依赖于分级的持久性表型,肿瘤早期药物治疗时罕见的亚克隆获得遗传基因改变,使它们能够随着时间的推移迅速增长。单细胞分析显示,这些遗传亚克隆的胰岛素受体底物1和底物2(IRS1或IRS2)位点拷贝数扩增,激活胰岛素和AKT信号通路。IRS1和IRS2都是高度调节的衔接蛋白,将胰岛素受体(IR)或胰岛素样生长因子(IGF-1R)信号传递到下游效应器通路。在原发性胶质母细胞瘤中,持续性细胞(persister-like cells)、IRS1和和IRS2等基因组明显扩增,可能是GBM对靶向药物治疗耐药的基础(图1-5)。
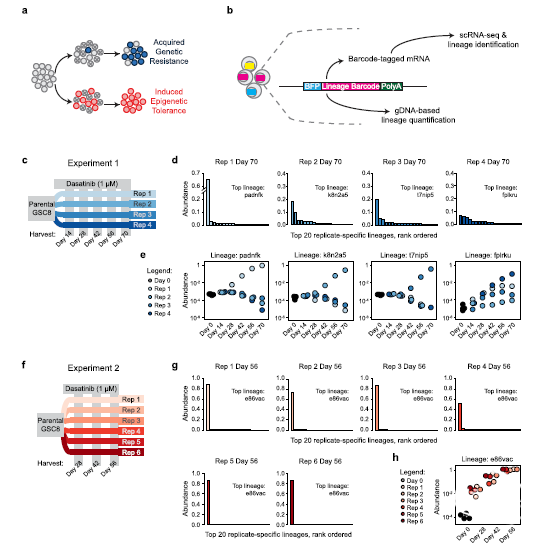
图1. 条形码谱系追踪识别患者胶质瘤细胞中的耐药模式。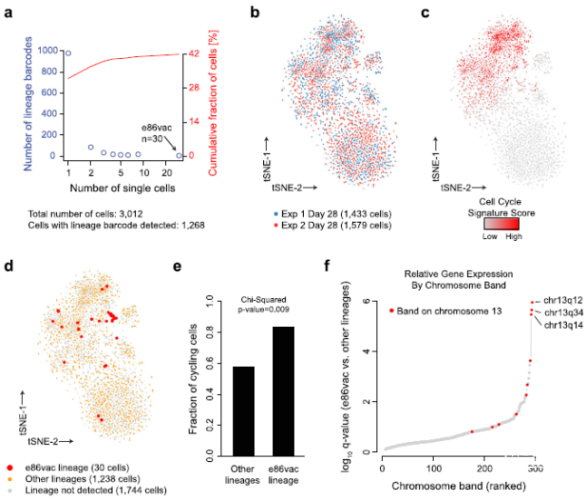
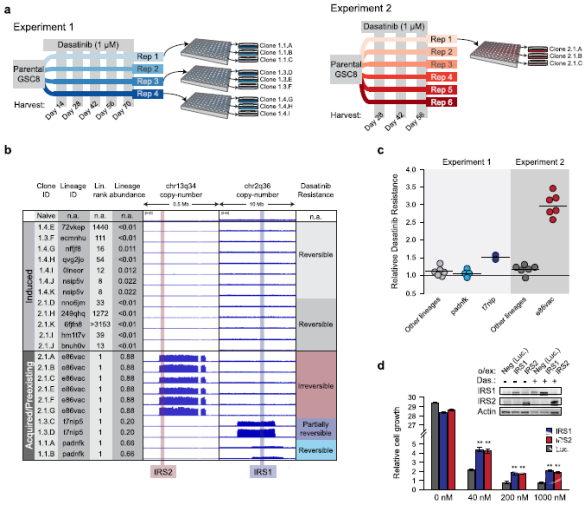
图3. 克隆培养分析确定耐药谱系中独特的、功能上平行的染色体扩增。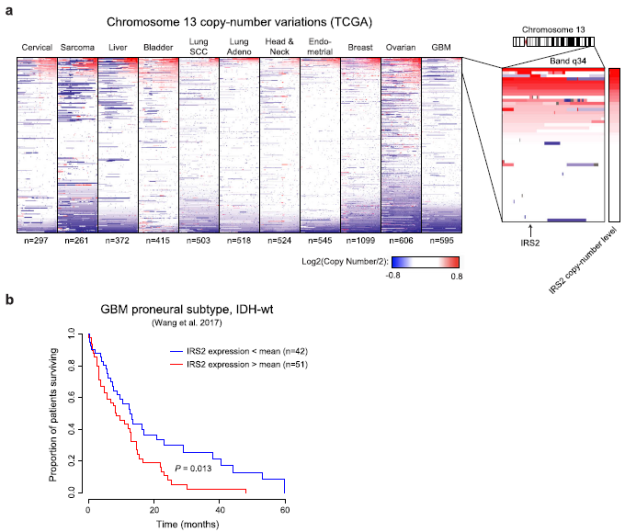
图4. chr13q34/IRS2的局部扩增存在于多种肿瘤类型。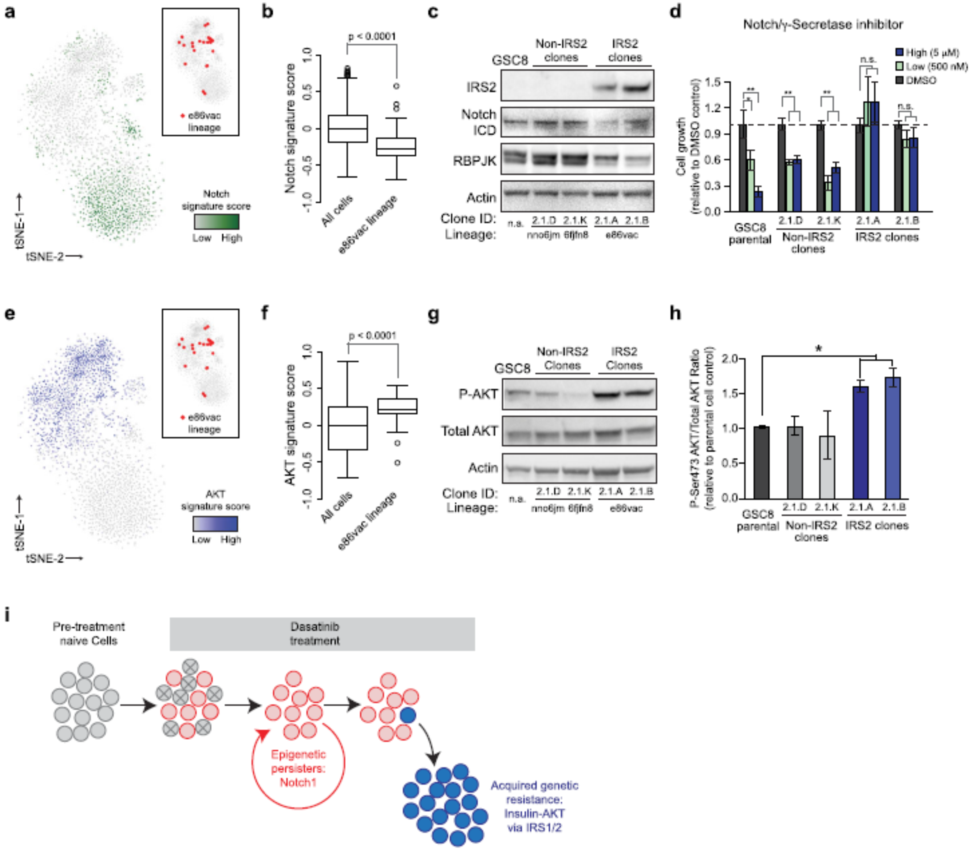
研究者使用细胞系条形码追踪结合单细胞RNA-seq的方法,揭示PDGFRA扩增的胶质母细胞瘤模型中,胰岛素受体IRS1和IRS2拷贝数扩增是肿瘤对达沙替尼耐药的遗传媒介。作者认为,该研究的结论是对胶质母细胞瘤对各种药物抵抗和耐受、导致肿瘤复发的新见解。

声明:脑医汇旗下神外资讯、神介资讯、脑医咨询所发表内容之知识产权为脑医汇及主办方、原作者等相关权利人所有。未经许可,禁止进行转载、摘编、复制、裁切、录制等。经许可授权使用,亦须注明来源。欢迎转发、分享。












