美国德克萨斯州休斯顿贝勒医学院发育生物学科的Jeff C. Carlson等建立小鼠GBM模型研究肿瘤相关血管和肿瘤性血管内皮细胞的分子和形态学,结果发表于2021年6月的《Neuro-Oncology》杂志。
——摘自文章章节
【Ref: Carlson JC, et al. Neuro Oncol. 2021 Jun 1;23(6):932-944. doi: 10.1093/neuonc/noaa297.】
胶质母细胞瘤(GBM)是最常见的原发性恶性脑肿瘤,多数患者在确诊后生存期不到两年。目前,对胶质瘤中的血管生成机制尚存争议,其中血管内皮细胞的分子和细胞动力学特征尚未明确。美国德克萨斯州休斯顿贝勒医学院发育生物学科的Jeff C. Carlson等建立小鼠GBM模型研究肿瘤相关血管(TAVs)和肿瘤性血管内皮细胞(TDECs)的分子和形态学,结果发表于2021年6月的《Neuro-Oncology》杂志。
该研究采用宫内电穿孔技术和CRISPR/Cas9基因工程技术构建具有正常免疫功能的基因工程小鼠胶质瘤模型;基于三维结构从肿瘤发生发展过程中描述血管-肿瘤之间的动力学特征,采用单细胞RNA测序技术阐明TAVs和TDECs之间的关系。并在患者来源的原位异种移植瘤(PDX)模型中验证。在基因工程小鼠胶质瘤(NF1、TP53和PTEN缺失)模型中,发现肿瘤源性内皮细胞TDECs是一个罕见的亚群,可在肿瘤内生成血管。转录谱分析显示,肿瘤相关血管细胞TAVs和肿瘤源性血管内皮细胞TDECs在分子特征上的不同,两者之间存在广泛的异质性。这些标记在临床上人脑胶质瘤样本中得到验证。基因工程小鼠出生后第65天(P65)和第80天(P80),在显微镜下通过荧光观察到小鼠脑TAVs的形态变化。定量分析显示,与对侧大脑相比,P65和P80之间的TAVs密度无明显变化。但是,P80的TAVs分支指数和分支点连接数显著减少,表明随着时间推移,无法建立有效的血管网络(图1)。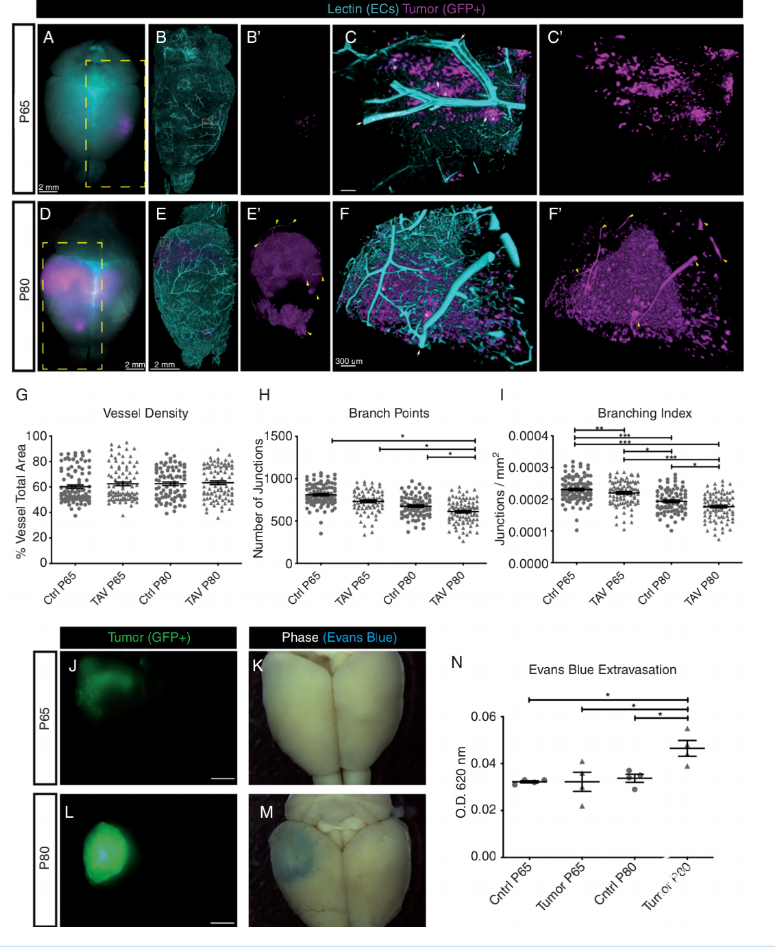
三维重建鼠脑显示,GFP+的肿瘤来源细胞参与血管生成。P80脑冰冻切片进行免疫组化,共聚焦成像确定血管GFP+表达内皮特异性标记CD31(图2),意味着这些血管细胞的来源与肿瘤细胞一致。为量化TDECs,研究者分离P65和P80荷瘤脑,并进行流式分析以分离肿瘤源性血管内皮细胞(GFP+,CD31+/TDECs)和正常血管内皮细胞(GFP−,CD31+/TAVs)。定量分析显示,在P65和P80时TDECs的平均占比分别为所有肿瘤细胞数量的0.36%和0.52%(图2)。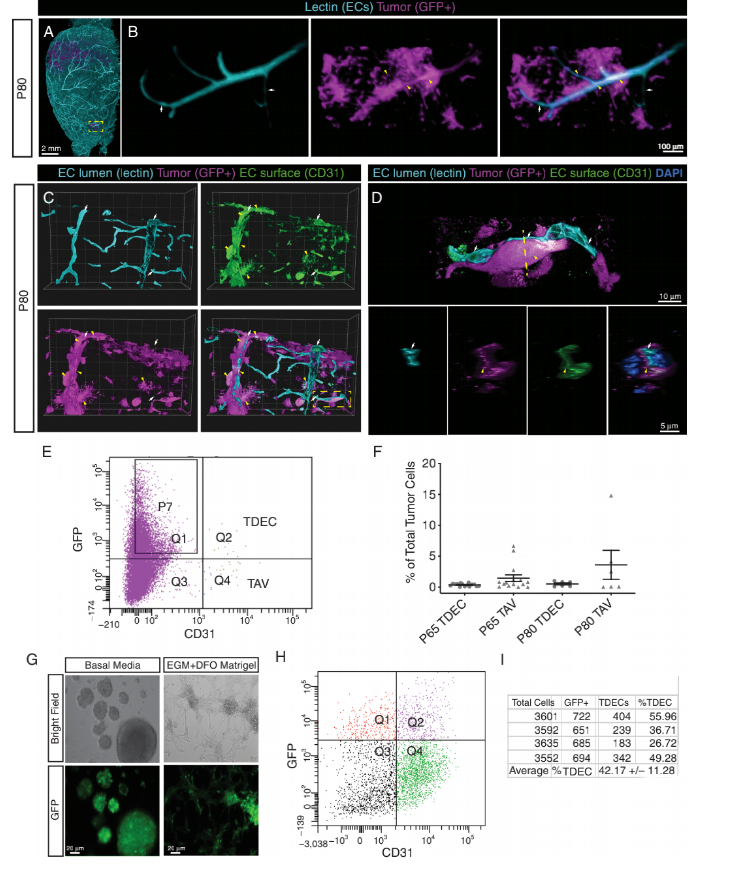
图2. 小鼠胶质瘤模型中存在肿瘤源性血管内皮细胞。对比肿瘤与TAVs、TDECs测序,生物信息学分析鉴定2700多个差异基因。GO分析证实,TAVs和TDECs基因在血管和血管生成相关通路中富集,而肿瘤显示出神经系统特征。对这两个神经系统发育与血管生成具代表性类别的单基因进行分析,证实TDECs和TAVs群体有血管内皮细胞特性(图3)。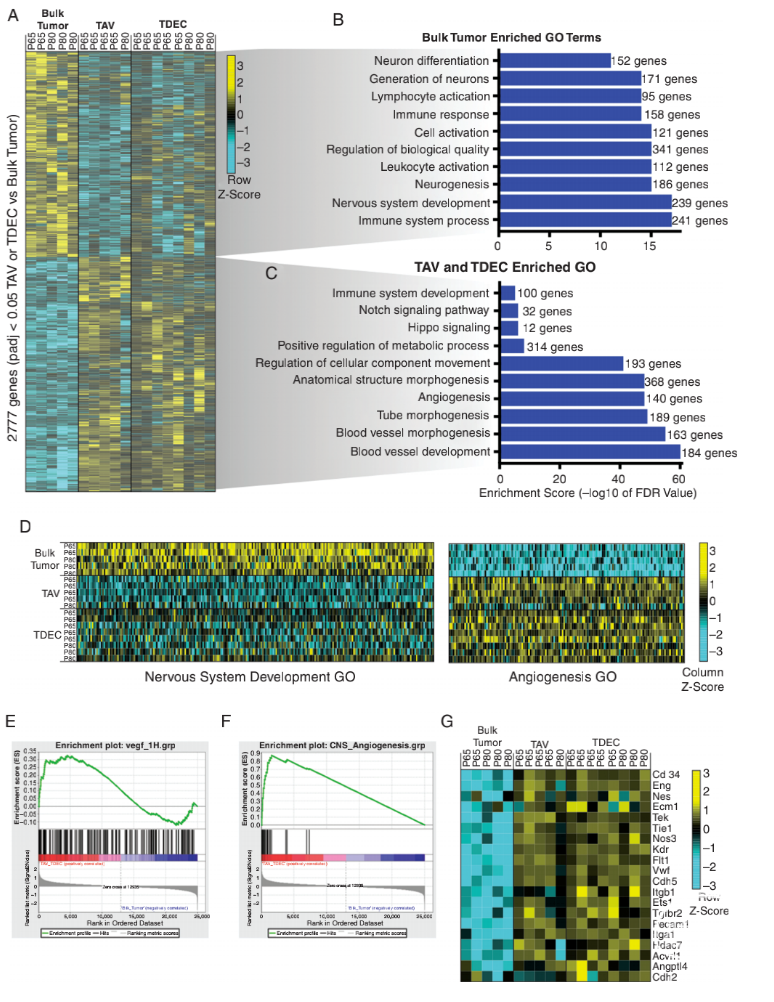
图3. 肿瘤相关的血管系统与肿瘤来源的血管内皮有分子差异。研究者用Seurat分析细胞转录组和血管内皮细胞数据集,鉴定10种不同的细胞类型,从壁细胞到EGFP+谱系的肿瘤细胞,通过表达GFP报告基因确定。接着对内皮细胞进行再分析,确定3个独立的簇,每个簇都有不同的分子特征(图4)。鉴于TAVs的异质性,研究者试图进一步从分子上区分TAVs和TDECs。比较TAVs和TDECs转录组发现,两者之间有400多个差异表达基因。对这些差异基因的GO分析发现,与血管生成的三个特征基因,即细胞增殖、细胞粘附和细胞运动,在TDECs中显著富集。这意味着TDECs细胞的迁移能力更强,比TAVs更具侵袭性,血管生成能力更强。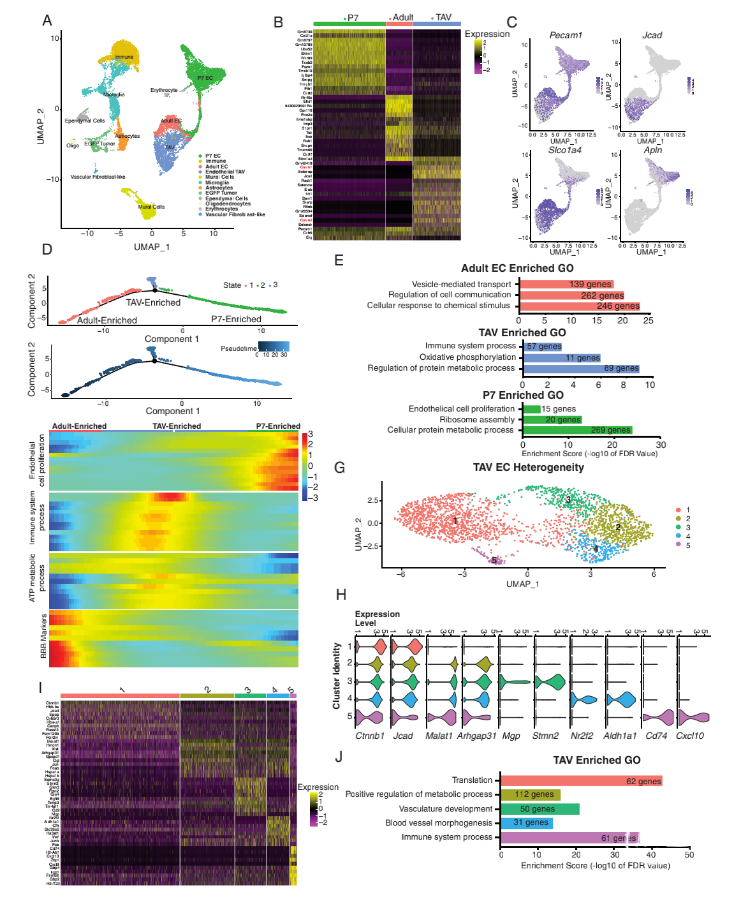
图4. TAVs表现出广泛的细胞异质性,并不仅是血管生成的成人内皮细胞。PDX来源的GBM中发现TDBECs和TDLECs为确定人胶质瘤中是否存在TDBECs和TDLECs群体,研究者将患者来源的胶质瘤细胞系注射到SCID小鼠(即PDX模型)中。在肿瘤生成过程中,通过人类白细胞抗原、CD31、PDPN和FLT4等标志物流式分离TDBECs和TDLECs;结果证实,胶质瘤PDX模型中同样存在上述TDECs的各种亚群。RNA测序获得1200多个差异表达基因,对人类PDX的TDBECs和TDLECs基因GO分析显示,这些差异基因表达与小鼠模型中的结果相似,如在循环系统发育和细胞迁移相关通路中显著富集(图5)。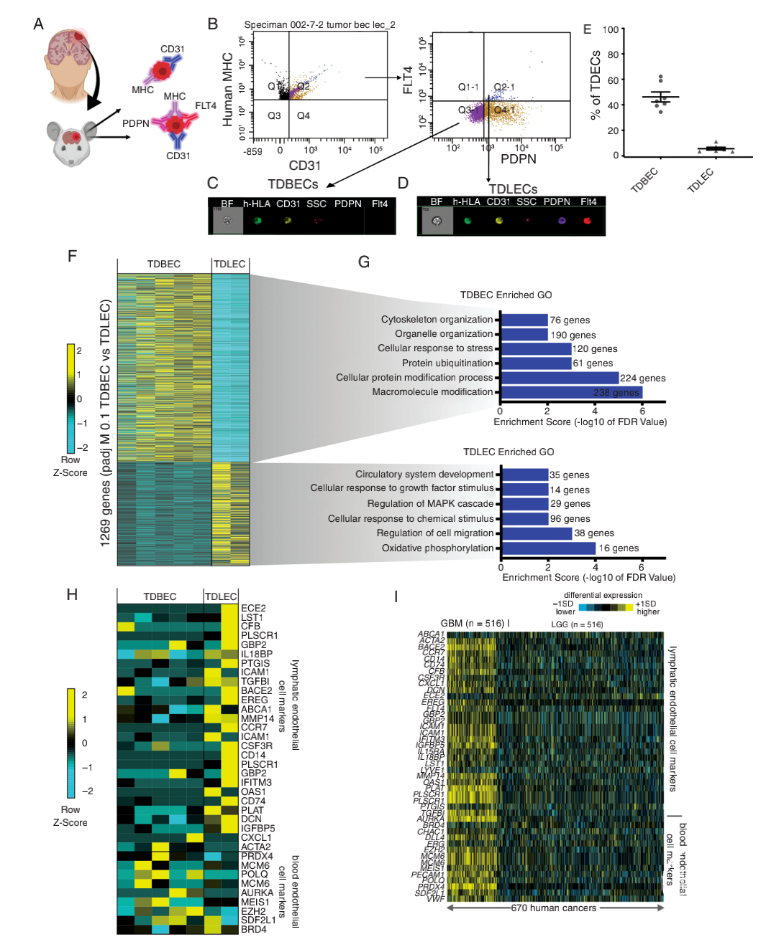
图5. TDECs异质性在人脑胶质瘤异种移植模型中具有保守性。
该研究结果表明,在肿瘤和肿瘤微环境中,存在广泛的血管内皮细胞异质性。该研究提示肿瘤血管内皮细胞来源多样,为胶质瘤发生过程中驱动肿瘤血管化和血管生成的分子机制提供新的见解。

声明:脑医汇旗下神外资讯、神介资讯、脑医咨询所发表内容之知识产权为脑医汇及主办方、原作者等相关权利人所有。未经许可,禁止进行转载、摘编、复制、裁切、录制等。经许可授权使用,亦须注明来源。欢迎转发、分享。












