加拿大麦吉尔大学肿瘤放射科的Paul Daniel等对替莫唑胺诱导胶质瘤超突变的机制和治疗进行综述;文章发表于2019年2月的《Frontiers in Oncology》杂志。
——摘自文章章节
【Ref: Daniel P, et al. Front Oncol. 2019 Feb 4;9:41. doi: 10.3389/fonc.2019.00041. eCollection 2019.】
研究背景
瘤放射科的Paul Daniel等对替莫唑胺(TMZ)诱导胶质瘤超突变(hypermutation)的机制和治疗进行综述;文章发表于2019年2月的《Frontiers in Oncology》杂志。
研究方法
研究结果
手术联合放化疗是治疗胶质母细胞瘤(GBM)的主要手段,但GBM抵抗放化疗,复发率很高。化疗耐药是影响GBM疗效的重要问题。加拿大麦吉尔大学肿复发胶质瘤基因组一般存在两种情况,即超突变以及非超突变。超突变指全基因组突变增加,C:G富集程度大于T:A,多数是由于修复碱基错配(MMR)相关基因失活导致。非超突变复发胶质瘤则不具有这些特征,与原发性肿瘤突变负荷几乎持平。低级别与高级别胶质瘤出现超突变的情况和能力各不相同,具体机制尚不明确。
TMZ能使DNA O6位点的鸟嘌呤发生甲基化,甲基化的鸟嘌呤与胸腺嘧啶发生碱基错配,引起基因组不稳定及细胞凋亡。而MGMT能有效修复碱基错配,因此,MGMT启动子甲基化状态是肿瘤细胞对TMZ是否耐药的预测指标,也是预测复发GBM超突变的方法之一。
MGMT缺乏表达,MMR系统则被激活。MMR蛋白同样能够识别并修复错配碱基,但这种修复往往导致DNA双链断裂、细胞周期阻滞以及凋亡。复发GBM中,MMR表达下调,提示MMR低表达是胶质瘤化疗抵抗的可能机制之一。MMR信号通路突变在复发的超突变胶质瘤中尤为常见。MMR蛋白功能缺失,减弱DNA损伤修复能力,导致超突变。
超突变胶质瘤的治疗手段与非超突变胶质瘤不同,探索复发GBM的分子特征能为患者提供更精准的治疗。检测肿瘤基因突变负荷(TMB)可预测对免疫检查点抑制剂治疗的反应。最近批准的PD-1抑制剂派姆单抗(pembrolizumab)应用于所有MMR缺失或微卫星高度不稳定(MSI)的肿瘤患者,但MSI似乎与TMZ诱导的超突变无关。个案报道也推荐将免疫检查点抑制剂用于超突变复发GBM的治疗,限制胶质瘤免疫治疗的另一个因素是胶质瘤免疫微环境的“冷肿瘤”特征。目前已有研究表明,GBM患者血脑屏障遭到破坏,免疫细胞可以进入肿瘤,因此免疫疗法对胶质瘤无效可能不在于血脑屏障的限制,而是在于其免疫微环境。
在TMZ诱导的超突变胶质瘤中,MMR基因突变可能为探索新疗法提供思路(图1)。突变的增加在一定程度上对治疗是有利的;在超突变时,肿瘤细胞侵袭性下降,对后续治疗更为敏感,但进一步累积就会产生不利影响。
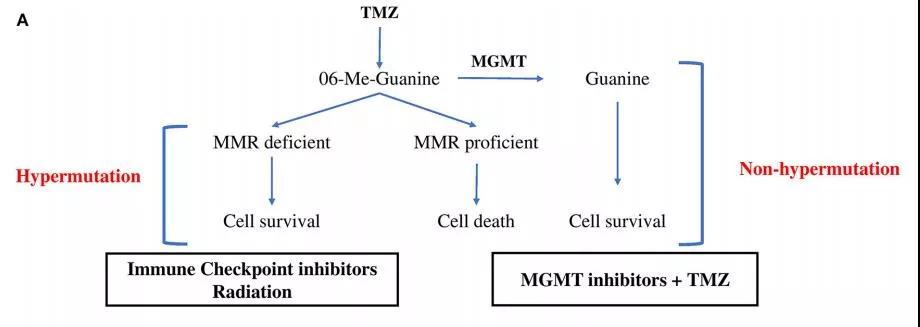
图1. 超突变型与非超突变型肿瘤的特点以及治疗策略;非超突变型:在MGMT表达正常时,甲基化鸟嘌呤被MGMT修复,肿瘤细胞生存;相应的治疗是应用MGMT抑制剂+TMZ。超突变型:在MGMT缺失,MMR基因表达正常时,肿瘤细胞死亡;当MMR突变缺失时,肿瘤细胞存活;相应的治疗是免疫检查点抑制剂+放疗。
结论
作者指出,超突变型复发胶质瘤具有独立的分子亚型,仍有许多问题需明确。探索超突变型以及非超突变型复发胶质瘤潜在的分子特征能够为复发GBM的治疗开拓新的方法。






