作者:杨凯元(第一作者),满韦韬,荆林凯,孙振兴,梁平,王劲,王贵怀
通信作者:王贵怀
作者单位:清华大学附属北京清华长庚医院神经外科
译者:杨凯元
原文刊发于World Neurosurg 2020.11
[REF: Yang K, Man W, Jing L, et al. Clinical Features and Outcomes of Primary Spinal Cord Glioblastoma: A Single-Center Experience and Literature Review. World Neurosurg. 2020;143:e157-e165. doi:10.1016/j.wneu.2020.07.066] PMID: 32688042
摘要
目的
探讨原发性脊髓胶质母细胞瘤的临床特征、治疗方案及预后因素。
方法
回顾性分析2014年12月至2019年7月于清华大学附属北京清华长庚医院神经外科接受手术治疗的11例原发性脊髓胶质母细胞瘤患者的临床资料,总结其临床特征并利用单因素Log-rank分析预后因素。应用SPSS 23.0软件进行数据录入及相关统计分析。
结果
本研究纳入的 11名患者中包括5名男性(45.5%)和6名女性(54.5%),诊断时的中位年龄为26岁。患者术前症状的中位持续时间为4个月。手术次全切除8例(72.7%),大部切除3例(27.3%)。2名患者(18.2%)术后接受辅助放、化疗,3名患者(27.3%)仅行化疗,6名患者(54.5%)未接受放化疗。此外,2名患者在肿瘤复发后接受贝伐珠单抗挽救性治疗。平均随访时间12.4个月,中位无进展生存期(PFS)为6个月 (95% CI, 1.58-10.42月),中位总生存期(OS)为12个月 (95% CI, 8.33-15.67月), 1年生存率为31.8%;截止2020年4月,2名患者(18.2%)仍存活。单因素Log-rank分析显示,患者年龄和术前症状持续时间均为PFS和OS的预后影响因素(P<0.05),年轻患者(<30岁)和急性病程患者(<6个月)预后较差。然而,未发现手术切除程度及接受术后辅助治疗(放疗/化疗/贝伐珠单抗)对患者预后的明显改善作用。
结论
原发性脊髓胶质母细胞瘤较为罕见,恶性程度高,预后极差,并常导致严重的神经功能障碍,极大影响患者的生存质量。患者年龄和术前症状持续时间是影响预后的因素,然而肿瘤切除程度及术后辅助放化疗对患者预后的影响仍需进一步研究。
关键词
胶质母细胞瘤;脊髓;预后;手术;放疗;化疗
前言
与颅内肿瘤相比,脊髓肿瘤较为罕见,约占全部中枢神经系统肿瘤的10%。而原发性脊髓胶质母细胞瘤(primary spinal cord glioblastoma,PSC GBM)则更为罕见,仅占所有脊髓肿瘤的1.5%。近年来,外科手术技术和术后辅助治疗如放化疗等取得了进展,但PSC GBM患者的预后仍不佳,其总生存期仅约10-14个月。此外,PSC GBM还常常导致患者严重的神经功能障碍,严重影响生活质量。
迄今为止关于PSC GBM最大的单中心研究包括15例PSC GBM患者,由Yi S等人于2019年报道。然而,由于本病的罕见性,大多数先前的研究仅为病例报告或一些小样本量临床研究。因此,对于PSC GBM患者的临床特征、最佳治疗方案和预后因素等仍存在争议。在此,我们在本研究中报告了11例经组织学证实的PSC GBM患者。根据我们单中心的诊疗经验并结合文献回顾,分析这些患者的临床、放射学、手术和分子病理信息。此外,我们在本研究中首次发现术前症状的持续时间是PSC GBM的预后因素。我们希望本研究可以为这种极其罕见的恶性疾病提供一些新的临床证据。
方法
患者基本信息
本研究纳入2015年5月至2019年7月期间北京清华长庚医院神经外科收治的14例根据2016年WHO中枢神经系统肿瘤分类病理诊断为PSC GBM的患者。,由于1例患者出院后失访,2例患者曾接受脊髓低级别弥漫性星形细胞瘤切除术,最终11例(78.6%)PSC GBM患者被纳入本研究。这项研究得到了我们机构伦理审查委员会的批准。术前对所有患者进行脑和全脊髓磁共振成像(MRI),目的是排除原发性脑GBM引起的脊髓转移性病变,术后同样进行全中枢神经系统的MRI复查。所有患者均在术中神经生理监测下接受了安全的手术切除。次全切除术(STR)被定义为术后MRI证实手术切除超过肿瘤体积的80%,而部分切除(PR)被定义为切除的肿瘤体积小于80%。对所有患者进行详细的神经查体,改良McCormick评分用于评估患者的神经功能状态,ASIA分级用于评估患者脊髓损伤程度, KPS评分用于评估患者功能状态。在术前、术后1周、术后3个月、术后6个月和术后1年分别对患者进行评分。术后辅助治疗包括放疗、化疗和贝伐单抗治疗。记录所有患者的临床、放射学、手术和病理信息。
分子病理信息
通过免疫组织化学染色检测患者IDH-1、Ki-67、P53和H3K27M的表达情况。基于免疫组织化学染色阳性细胞的百分比,将Ki-67指数分为高表达(>40%)或低表达(≤40%)。
患者随访及统计分析
患者每3个月定期进行门诊复查或接受电话随访调查,必要时每1个月进行一次随访。无进展生存期(PFS)定义为手术日期至术后MRI证实复发日期之间的持续时间。总生存期(OS)定义为手术日期至患者死亡或最后一次随访日期之间的持续时间。所有数据均使用SPSS 25.0和R 3.5.0进行分析。使用K-M法计算患者的PFS、OS和存活率。此外,K-M分析还用于评估各种临床预后因素对患者PFS和OS的影响。利用最大选择检验法寻找Ki-67的cut-off值。P值小于0.05被认为具有统计学意义。
文献回顾
在本研究中我们检索了PubMed数据库中2015年~2020年这5年间发表的所有关于PSC GBM的49篇文献,检索关键词包括“spinal cord GBM multiforme”、“spinal cord glioblastoma”和“spinal cord malignant glioma”。所有49篇文章均由2位作者(K.Y .和W.M .)共同仔细审阅,并检查了文献中报告的每个患者的文献来源和日期以避免重复。纳入标准如下:1)经手术和病理证实的PSC GBM患者;2)术后随访> 3个月的患者,除非达到生存终点;3)英语文献中报道的病例。排除标准如下:1) PSC GBM并发其他恶性或良性肿瘤;2)继发性脊髓GBM患者(有以前曾接受过脊髓低级胶质瘤切除术或诊断为原发性脑GBM有继发性转移的证据)。最终,共有26项研究(共涉及57名患者)的结果数据符合我们的要求,并被纳入分析。
结果
患者基本信息及临床特征
在本回顾性研究中,共有11名PSC GBM患者符合我们的纳入标准。其中男性5例(45.5%),女性6例(54.5%)。他们诊断时的平均年龄为26岁(年龄范围为9-69岁)。术前KPS中位数为40分(范围20-90分)。术前症状的中位持续时间为4.0个月(范围为0.5-120个月)。最常见的术前表现包括背痛(7例,63.6%)、运动障碍(10例,90.9%)、感觉障碍(11例,100%)和括约肌功能障碍(6例,54.5%)。术前神经功能检查显示,根据改良McCormick评分,II级患者4例,III级2例,IV级5例。术前ASIA分级显示,2名患者为B级, 3名C级,6名D级。
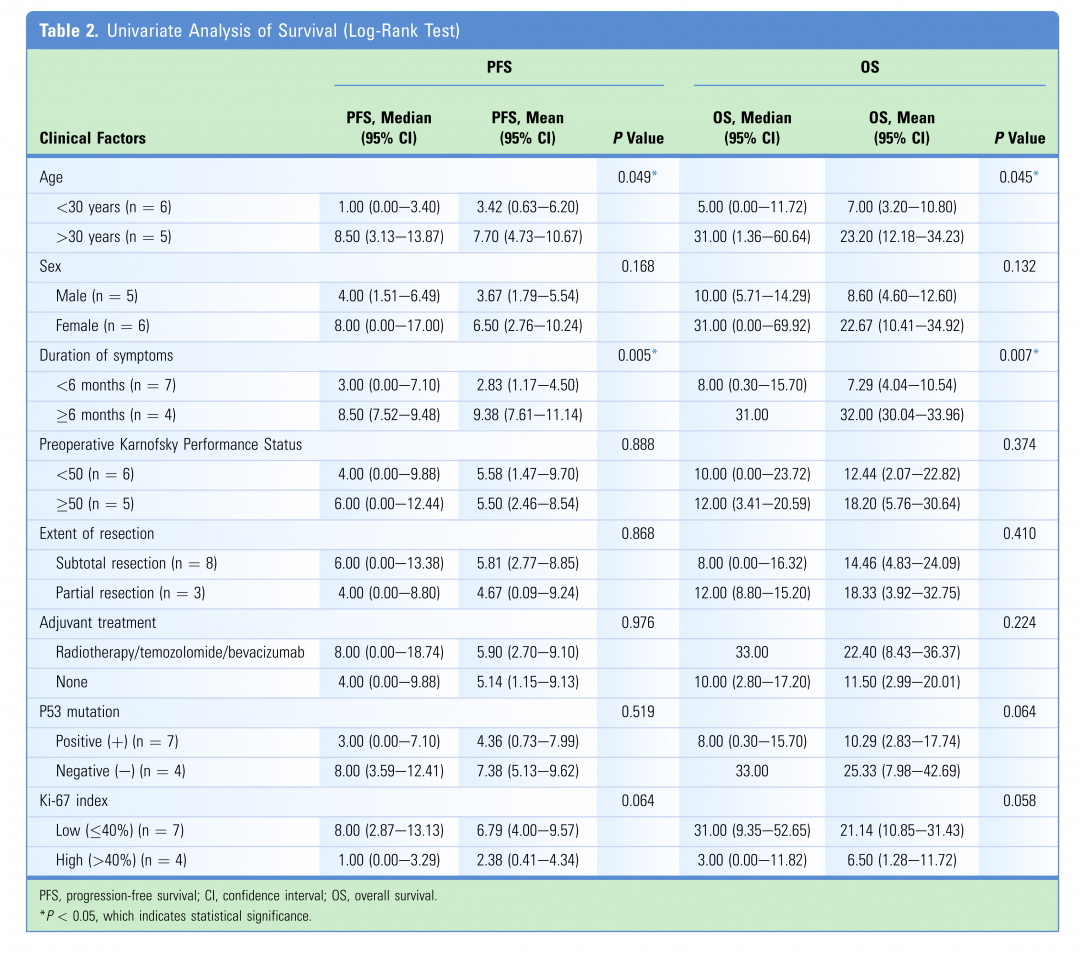
患者影像学特征
肿瘤部位包括颈段脊髓(5例,45.5%)、颈胸段(3例,27.3%)、胸段(1例,9.1%)和胸腰段(2例,18.2%)。根据T1加权磁共振成像,肿瘤信号为等信号5例,低信号4例,等-低信号2例。T2加权磁共振成像显示所有肿瘤均为高信号。增强T1加权成像显示9例患者肿瘤呈现不均匀强化,2例患者肿瘤均匀强化。此外,所有患者的MRI均可见瘤周脊髓水肿,其中4名患者肿瘤出现囊性改变;然而,仅有1例患者伴发脊髓空洞症。此外,2例患者的肿瘤呈外生性生长。
患者接受治疗情况及病理学特征
所有患者均经后正中入路行显微镜下肿瘤切除术。6名患者接受了椎板切除术,另外5名患者接受了椎板成形术。8例患者(72.7%)行肿瘤次全切除术(STR),另外3例患者(27.3%)行部分切除(PR)。2例患者接受术后替莫唑胺(TMZ)化疗联合剂量分割调强放疗(45 Gy/25)。3名患者仅接受了TMZ化疗,6名患者由于各种原因未接受放化疗。此外,2名患者在肿瘤复发后接受了额外的贝伐珠单抗挽救性治疗。
组织病理学分析显示所有肿瘤都具有典型的胶质母细胞瘤的组织学指征。IDH-1、Ki-67、P53和H3K27M的免疫组化结果分别在6例(54.5%)、11例(100%)、11例(100%)和5例(45.5%)患者中可用。在所有检测到的病例中,没有患者存在IDH-1突变,P53突变7例(54.5%),H3K27M突变2例(18.2%)。此外,Ki-67指数中位数为30%(范围为10%-60%),其中4名患者(36.4%) Ki-67指数较高(>40%)。

患者预后及相关预后因素分析
8名患者(72.7%)术后有稳定或改善的McCormick评分,随访3个月后6例(54.5%)患者评分结果保持稳定;然而,只有1名患者(9.1%)在1年后的随访评估中保持了稳定的评分。6名患者(54.5%)术后ASIA评分稳定或改善,3个月随访时3名患者(27.3%)的ASIA评分下降,只有1名患者(9.1%)在1年的随访评估中保持了稳定的ASIA评分。此外,6名患者(54.5%)术后KPS评分稳定或改善,4名患者(36.4%)随访3个月时KPS评分稳定,仅1名患者(9.1%)在随访一年时保持稳定的KPS评分。然而,术后McCormick评分、ASIA评分或KPS评分的恶化与较短的PFS或OS之间没有显著的统计学相关性(P>0.05)。
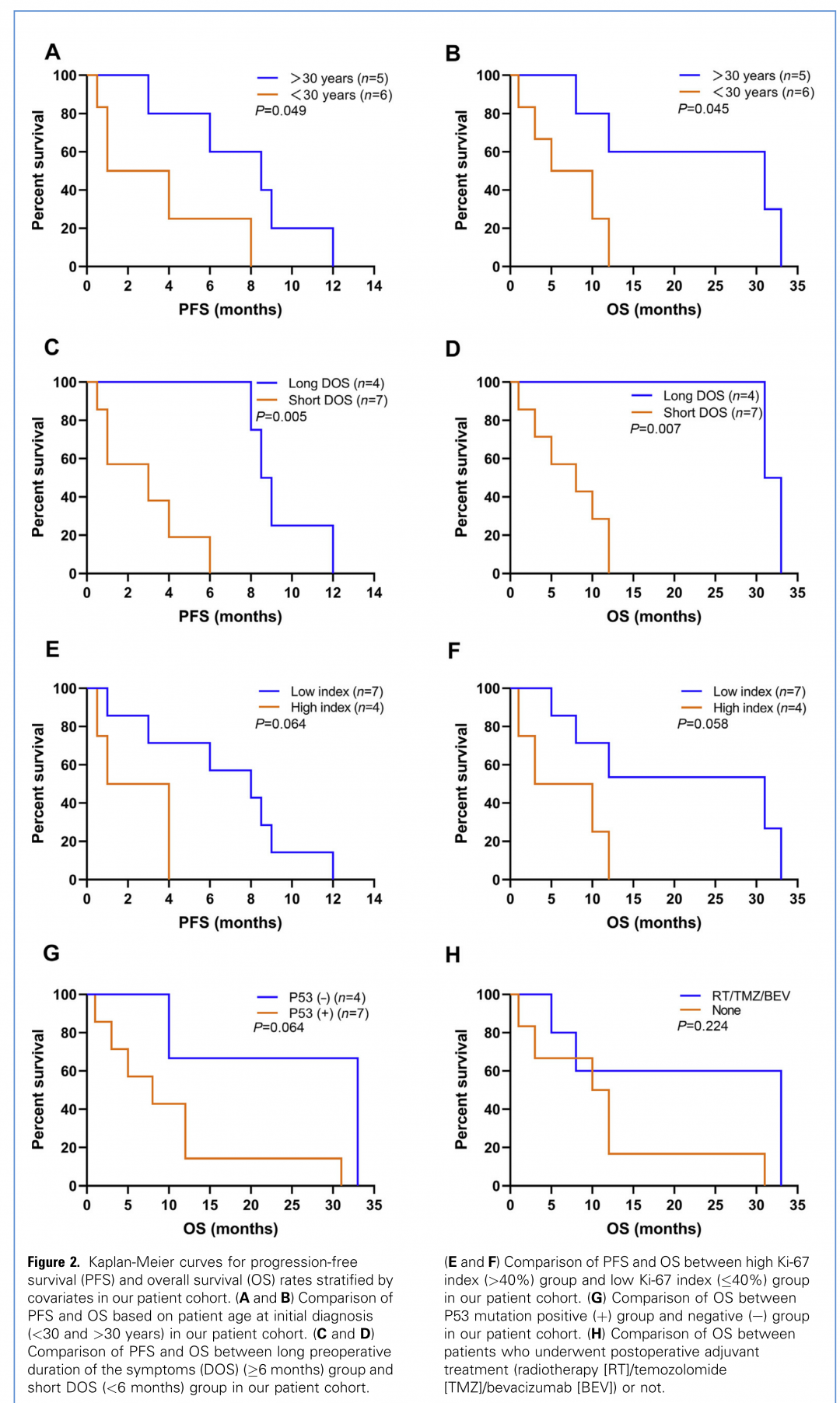
我们的患者随访时间为1-33个月(平均12.4个月)。其中10名患者肿瘤复发,1名患者围手术期死亡,6名患者(54.5%)肿瘤播散转移至中枢神经系统不同部位。截至最后一次随访,9名患者死亡,2名患者仍存活。全部11名患者的中位PFS为6个月(95%CI,1.58-10.42个月),中位OS为12个月(95%CI,8.33-15.67个月),1年生存率为31.8%。在单因素分析中,患者初次诊断时的年龄和术前症状的持续时间被确认为预后相关因素(P<0.05)。年轻(<30岁)患者组的PFS和OS均较短(中位PFS,1.0 vs.8.5个月,P=0.049;中位OS,5.0 vs.31.0个月,P=0.045)。此外,术前症状持续时间长的患者组(≥6个月)的存活时间明显更长(中位PFS,8.5 vs.3.0个月,P=0.005;中位OS,31.0 vs.8.0个月,P=0.007)。高Ki-67指数(>40%)组的患者预后不佳(中位PFS,1 vs.8个月,P=0.064;中位OS,3 vs.31个月,P=0.058);此外,P53突变组OS较短 (中位OS,8 vs.33个月,P=0.064),但P值没有达到统计学意义(0.05) 。然而,我们发现手术切除程度和术后辅助治疗并没有为患者带来生存益处。
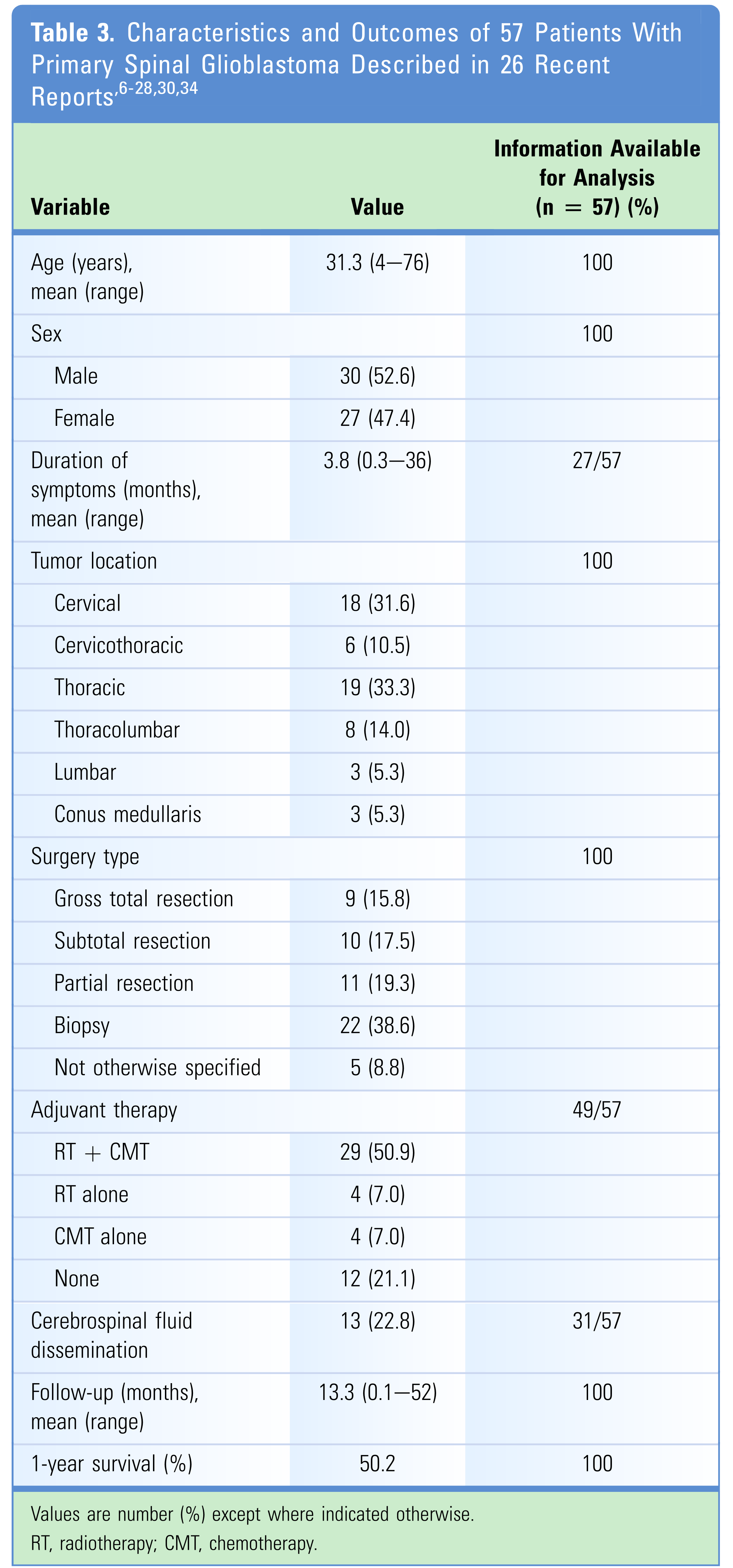
文献回顾
表3总结了符合我们要求的26篇文章中共57名患者的相关临床特征和预后结果。57例患者的平均年龄为31.3岁,大多数(30例,52.6%)为男性。平均术前症状持续时间为3.8个月。大多数肿瘤位于颈段脊髓(18例,31.6%)和胸段脊髓(19例,33.3%)。最常见的手术类型是活检,共有22例(38.6%)患者接受了活检手术。有13例(22.8%)患者发生了脑脊液播散。29例患者(50.9%)接受术后辅助放疗联合化疗。57名患者的平均随访时间为13.3个月,1年存活率为50.2%。
讨论
在这项研究中,我们发现患者在初次诊断时的年龄和术前症状的持续时间是影响预后的因素。PSC GBM可以发生在任何年龄,但多发于年轻患者。在本研究中,最年轻的患者为9岁,而最年长的患者为69岁。他们诊断时的中位年龄为26岁,这与以前的研究结果相似。此外,我们还发现,与年轻(<30岁)患者组相比,年长(>30岁)患者组的中位PFS和OS更长。这些结果与Moinuddin等人和Konar等人的发现类似,他们都发现年长患者组(18-65岁)比年轻患者组(<18岁)的OS更长。然而,根据Cheng等人的研究,与年轻患者相比,40岁以上的患者PFS和OS更短。术前症状的持续时间是我们研究中发现的另一个预后因素,术前症状持续时间较长的患者(≥6个月)有PFS和OS较长。本研究中患者术前症状的中位持续时间为4.0个月,比其他常见脊柱肿瘤的中位时间短,这体现了PSC GBM的高度侵袭性生长模式和恶性特征。
现如今,胶质瘤的诊疗已进入分子病理时代,组织病理结合分子标志物如Ki-67、P53、IDH和H3K27M等可能比单独的组织病理学更具有参考意义。Ki-67代表肿瘤细胞的增殖能力,可用于预测GBM的早期播散。Ki-67在肿瘤细胞中的高表达意味着它们的增殖和侵袭能力更强,代表着恶性特征和预后不良。在我们的患者队列中,11名患者中有4名(36.4%)患者的Ki-67指数较高(>40%),PFS和OS较短(P=0.064和P=0.058)。P53突变也被认为是恶性星形细胞肿瘤的早期事件。与脑胶质瘤不同,脊髓胶质瘤通常存在肿瘤蛋白P53突变而没有IDH-1/2突变。在我们的患者队列中,没有患者发生IDH-1突变;然而,在11名患者中有7名(54.5%)患者具有P53突变,且其OS更短(P=0.064)。这些结果与前人的研究结果相似。然而,Ki-67指数和P53突变对PFS和OS的影响未达到统计学意义(0.05),这可能是因为病例数量较少。
H3K27M突变在弥漫性中线胶质瘤(DMG)中的预后意义在以前的研究中已被广泛探讨,其中大部分研究表明具有H3K27M突变的DMG患者预后较差。然而,由于研究数量有限,H3K27M突变在PSC GBM中的预后意义仍不清楚且存有争议。Yi等人发现,5例H3K27M突变的PSC GBM患者显示出比H3K27M野生型患者更长的OS和DFS。而且在全部25例IV级脊髓胶质瘤患者(胶质母细胞瘤和DMG伴有H3K27M突变)中,H3K27M突变患者仍显示出比无突变患者更长的OS和DFS,这意味着与脑胶质瘤不同的是,PSC GBM和DMG患者的H3K27M突变可能不是独立的不良预后因素。相比之下,其他一些研究表明脊髓恶性胶质瘤中H3K27M突变代表着不良预后。Karremann等人的一项回顾性研究表明,H3K27M突变型DMG在所有脊髓中线部位肿瘤中预后最差;Uppar等人报告了一名H3K27M突变的PSC GBM患者,在术后第23天死亡,预后极差。我们在2名患者(18.2%)中发现H3K27M突变,他们在我们的患者队列中分别具有最短和最长的生存期(1 vs. 33个月)。
尽管接受了积极的治疗,本研究中的PSC GBM患者预后仍较差,中位OS仅为12个月,与前人的研究结果相似。而且在单变量分析中,PFS和OS都未能从切除程度和术后辅助治疗(包括放疗、化疗和贝伐单抗)中获益。
手术全切除(GTR)能显著提高脑GBM患者的生存率;然而,积极的外科干预在PSC GBM中的作用仍不清楚。此前几项研究发现,GTR并没有令PSC GBM患者获得生存受益,甚至可能加剧术后神功能状态的恶化,这与我们的发现一致。因此,在PSC GBM的外科治疗中,也许没有必要追求GTR。凭借技术的优势(如术中神经生理监测和5-ALA荧光引导切除),我们可以对患者进行安全范围内的最大切除,以获得组织病理学诊断并对脊髓进行减压,尽最大努力避免造成患者术后神经功能障碍。
同样,脊髓GBM术后放疗的有效性在既往研究中受到质疑。Cheng等对14例PSC GBM患者的研究表明,术后放疗可延长患者术后生存时间;Liu等人也发现术后放疗可延长脊髓高级别胶质瘤患者的生存时间。然而,一些研究发现放疗并无对脊髓GBM患者的益处,甚至显示出对患者生存的负面影响。另一方面,由于术后放疗存在相关的脊髓毒性和诱发继发性肿瘤的风险,因此对于儿童的术后放疗可能需要更慎重的考虑。
目前尚无大型临床试验评估TMZ在PSC GBM化疗中的作用。一些研究发现,TMZ并不能提升PSC GBM患者的存活率。然而,术后放疗和TMZ化疗的结合可能有助于PSC GBM患者延长生存期。此外,贝伐珠单抗在PSC GBM的治疗中也具有一定价值,因为其可缓解瘤周水肿,进而可以短暂的缓解症状,减少激素类药物的使用。Chamberlain和Kaley等人研究发现贝伐单抗可作为挽救性疗法显示出一定的症状缓解作用。在我们的研究中发现,尽管术后辅助治疗(放化疗及贝伐单抗)对患者生存期的延长无统计学意义上的益处,但患者的PFS及OS均有所延长。因此,对于PSC GBM患者的术后多模态辅助治疗可能非常必要的。
本研究尚存在局限性。首先,由于PSC GBM罕见,本研究是一项仅包括11名患者的小型回顾性单中心研究。因此,我们的统计数据无法进行多因素分析。其次,由于肿瘤组织样本有限,一些患者缺乏分子病理标志物信息。第三,在我们的患者队列中尚有两名患者未达到生存终点,我们会继续跟进随访。
结论
本研究表明,PSC GBM是一种极其罕见的恶性肿瘤。由于缺乏有效的治疗方案,PSC GBM患者预后不佳,并常常导致严重的神经功能缺损。我们的研究结果显示,患者诊断时的年龄和术前症状的持续时间是预后相关因素。然而,肿瘤切除程度及术后辅助放化疗对患者预后的影响仍不清楚,需要在具有较大样本量的前瞻性队列中进一步研究。
原文通讯作者简介
王贵怀 教授
清华大学附属北京清华长庚医院神经外科主任
王贵怀,医学博士,主任医师,清华大学教授、博士生导师。王贵怀教授从事神经外科工作30余年,致力于神经外科脊柱脊髓疾病的临床与基础研究,在脊髓胶质瘤的精准治疗、脊髓损伤修复、神经调控以及神外手术机器人等方面做了深入的研究,承担过多项国家级及省部级科研项目,研究结果发表在《Biomaterials》、《Theranostics》和《JNS-Spine》等权威期刊上。目前担任中国医师协会神经外科医师分会脊髓脊柱专业组主任委员、世界华人神经外科协会脊柱脊髓专业委员会主任委员、中国抗癌协会神经肿瘤学委员会第一届脊髓脊柱肿瘤学组组长、北京医学会神经外科学分会脊髓脊柱学组组长。










