患者李某某,男性,67岁,从事中医诊疗工作,既往体健。
主诉:
记忆力下降6个月,头部胀痛1个月。
现病史:
患者6个月前自觉记忆力明显下降,无意识不清,无肢体无力或肢体抽搐发作,未予特殊重视,后自觉症状逐渐加重,并伴有头部胀痛,遂至当地医院就诊后查头颅MRI提示左侧大脑半球多发性病灶,为求进一步手术治疗来北京天坛医院神经外科就诊。
入院查体:
神清可语,一般情况良好,对答基本切题,反应力稍迟缓,右利手,四肢肌力V级,余神经系统查体未见异常。术前KPS评分90。
头颅MRI检查(2020年3月31日):
♢ 报告描述:
左侧颞枕叶及丘脑受累可见不规则形团块长T2、长T1异常信号影,边界清楚,内部信号不均匀,大小约40*42*51mm,DWI\ADC未见弥散受限信号影,注药后呈不均匀明显强化,中线结构居中,左侧脑室局部受压变形,双侧脑室不对称。脑沟池内未见明显异常信号影。双侧鼻窦内粘膜增厚。双侧眼眶内未见明显异常信号影。
♢ 报告诊断:
左侧颞枕叶及丘脑受累占位病变:胶质母细胞瘤可能性大;左侧小脑幕切迹下疝;双侧鼻窦内炎症性改变。
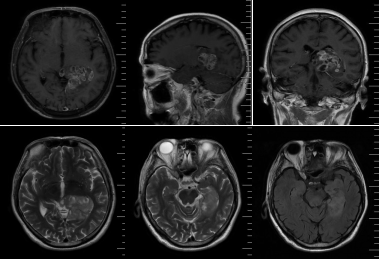
图1. 术前MRI检查提示左侧颞枕叶、丘脑、颞叶内侧及海马钩回多发性占位
MRI T1增强序列提示左侧颞枕叶及丘脑病变不均匀明显强化,T2/FLAIR序列提示病变累及左侧颞叶内侧及海马钩回,未见明显强化,考虑多灶性高级别胶质瘤可能。
患者入院诊断为左颞枕及丘脑多发性占位,病变侵袭范围较广,累及左侧颞叶内侧及海马钩回,左侧小脑幕切迹下疝,考虑多灶性高级别胶质瘤可能性大。
因单次手术难以全切肿瘤,计划采取分期手术策略,第一次手术行左侧颞枕开颅切除左颞枕叶MRI增强部分肿瘤,择期第二次手术行左额颞开颅切除左侧颞叶内侧及海马MRI非强化部分肿瘤,力争最终近全切除全部肿瘤病变。
手术方案:
左颞枕开颅肿瘤切除术。
手术过程:
患者插管全麻成功后,病人取右侧俯卧位,头架固定。
常规碘酒(4%)和酒精(75%)消毒后铺巾,神经导航确定病变位置,头皮浸润麻醉,沿左颞枕马蹄形切口逐层切开,颅骨钻2孔,骨瓣铣下保留。
硬膜四周严密悬吊,硬膜张力略高,250ml甘露醇快速静点静点颅内压,“+”字状剪开脑膜,神经导航再次确定病变位置,自枕叶皮层造瘘,皮层下约3.5cm即可见实性病变,呈灰红色,质地软,血供丰富,与周围脑组织边界不清。
肿瘤主体位于左侧颞枕叶三角区并向深部丘脑及海马方向生长,部分肿瘤突入三室后部并经大脑镰下向对侧生长,显微镜下自肿瘤大致边界逐步分离并分块切除,保护深部大脑大静脉等重要引流静脉,最终镜下近全切除左侧颞枕及丘脑病变,大小约5.5×6.0×5.0cm,左侧海马方向病变位置深在难以完整切除,左侧脑室枕角开放。
术腔严密止血,创面速即纱帖敷,术腔反复冲洗清亮,脑组织搏动好,减张修补缝合硬脑膜,还纳固定骨瓣,逐层缝合肌肉、皮下及皮肤。
手术顺利,术中出血约150ml,未输血,术后回ICU病房监护。
术后查体:
患者一般情况良好,神清可语,对答基本切题,四肢遵嘱活动,肌力V级。术后KPS评分80。
术后MRI检查:
♢ 报告描述:
左顶枕骨质连续性中断,骨瓣下、左顶枕至丘脑可见大片状混杂密度信号,与左侧脑室枕角分界不清,增强后术区局部小条片模糊强化。左侧海马肿胀,未见强化。脑室扩大,左侧脑室受压变形,右侧枕角内见低信号液平,中线结构基本居中,脑沟裂变浅。
♢ 报告诊断:
左顶枕占位开颅术后改变;脑室扩大少量积血。
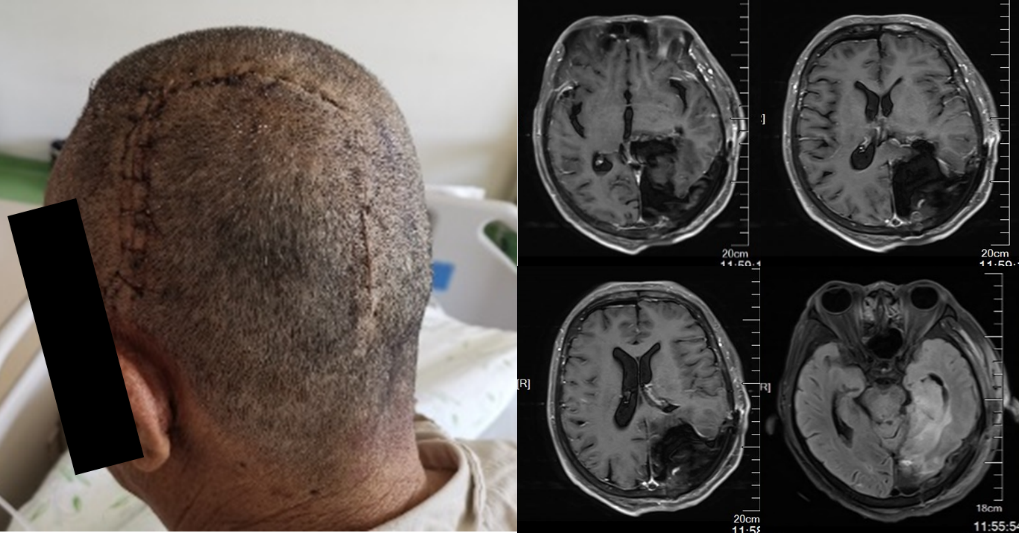
图2. 第一次手术后MRI检查提示左侧颞枕开颅术后改变,左侧颞枕叶增强部分肿瘤病灶切除满意
手术方案:
左额颞开颅肿瘤切除术。
手术过程:
患者气管插管全麻成功后,仰卧头右偏,头架固定,导航注册肿瘤体表投影。
常规碘酒(4%)和酒精(75%)消毒后铺巾,头皮浸润麻醉,取前次手术颞枕切口前缘并分别向额颞部延伸,逐层切开,皮瓣翻向前方,颞肌翻向下方。充分暴露骨质,颅骨钻孔骨瓣铣下保留。
硬膜止血后四周严密悬吊,见硬膜张力略高250ml甘露醇快速静点降低颅内压,“弧形+放射”状剪开硬脑膜,缓慢释放侧裂池脑脊液后脑压下降满意,仔细分离外侧裂,软膜下切除部分颞极组织,显露侧脑室颞角,颞角底部可见肿胀海马组织,灰红色,质软,与周围组织边界不清,血供丰富,未见钙化、坏死及囊变,显微镜下分块近全切除肿瘤,达到前次手术颞枕叶术腔,导航再次确定肿瘤切除范围。
术腔严密止血,反复冲洗清亮,脑组织搏动好,减张修补缝合硬脑膜,还纳固定骨瓣,逐层缝合肌肉、皮下及皮肤。
手术顺利,麻醉满意,术中出血约200ml,未输血,术后回ICU病房监护。
术后查体:
患者一般情况良好,神清可语,对答基本切题,四肢遵嘱活动,肌力V级,言语功能及肢体肌力情况基本同术前。术后KPS评分80。
术后MRI检查:
♢ 报告描述:
左侧颞枕部可见术后痕迹,左侧颞顶部骨板下、左侧枕叶区域见条片状T2WI高、T1WI混杂信号影,DWI像上可见上述区域内线条状高信号;左侧颞叶可见斑片状混杂信号影;双侧脑室后旁、胼胝体压部见FLAIR高信号影;增强扫描后术区脑膜可见线样强化。
左侧脑室较窄、右侧脑室较宽,中线结构向右侧移位。左侧额部骨板下见新月形脑脊液样信号影。
♢ 报告诊断:
左侧颞部及左侧颞枕部开颅术后改变;左侧额部硬膜下积液。
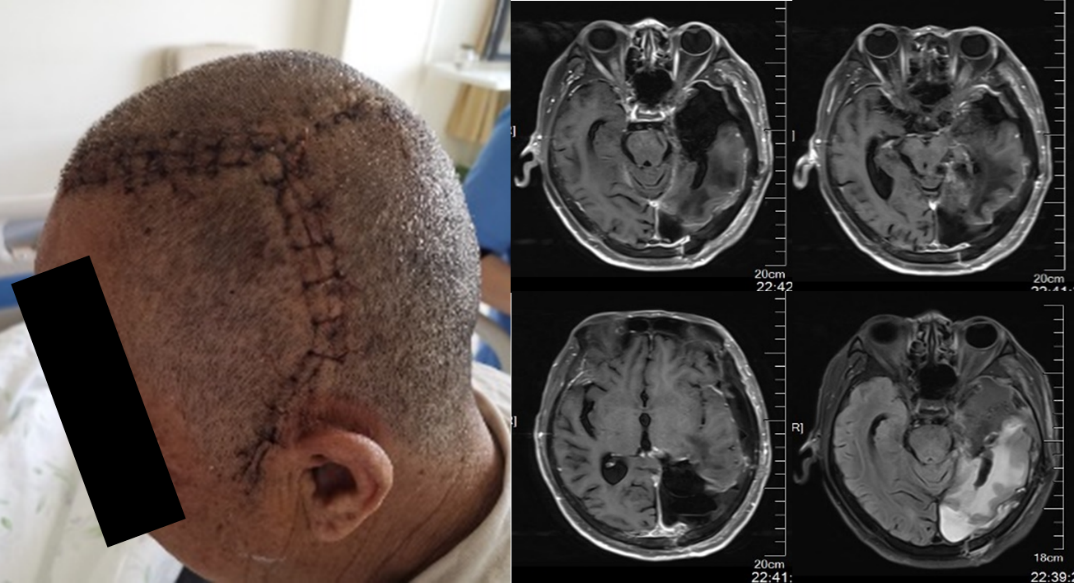
图3. 第二次手术后MRI检查提示左侧额颞开颅术后改变,左侧颞叶内侧及海马钩回非增强部分肿瘤病灶切除满意,整体肿瘤病变达到近全切除目标
♢ 第一次:胶质母细胞瘤(WHO IV级),浸润蛛网膜下腔和软膜下;
♢ 第二次:间变性星形细胞瘤(WHO III级);
♢ IDH野生型。
免疫组化染色:
ATRX(部分+);P53(+);Ki-67(约20-40%);IDH1(-);H3K27M(-)。
分子检测结果:
IDH1基因R132突变(-);IDH2基因R172突变(-);MGMT基因启动子甲基化(-);TERT启动子C228T突变(+);TERT启动子C250T突变(-);染色体1p/19q不存在杂合性缺失。
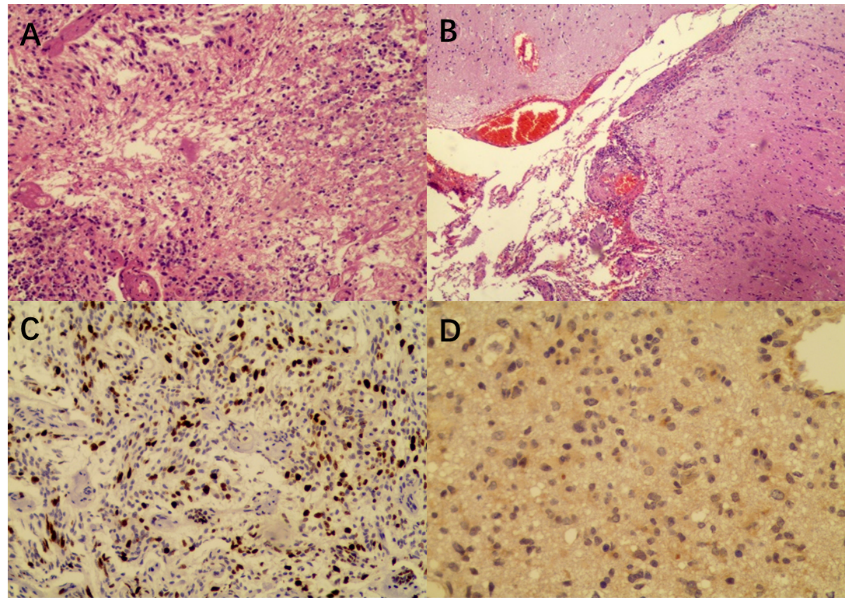
图4. 常规病理H-E染色(A/B)与Ki-67(C)、IDH1(D)免疫组化染色结果,病理诊断考虑胶质母细胞瘤(WHO IV级)
术后给予积极对症支持治疗,术后无癫痫发作,常规口服左乙拉西坦0.5g Bid。
患者恢复顺利,生命体征平稳,神清可语,四肢肌力V级,出院KPS=80分。
后续治疗建议行多病灶放射治疗,参照Stupp方案口服替莫唑胺同步及辅助化疗。
术后3月复查MRI:
♢ 报告描述:
左颞顶枕部骨质呈术后改变,左顶枕叶可见斑片状混杂信号,DWI示其内可见散在斑片状略高信号,左顶、左颞可见斑片状长T1长T2混杂信号影;双侧脑室后旁、胼胝体压部可见FLAIR高信号影;增强扫描后术区脑膜可见线样强化。
幕上脑室略大,左侧脑室枕角变形,中线结构居中,局部脑沟裂欠规则。
♢ 报告诊断:
左侧颞部及左侧颞枕部开颅胶质母细胞瘤术后改变。
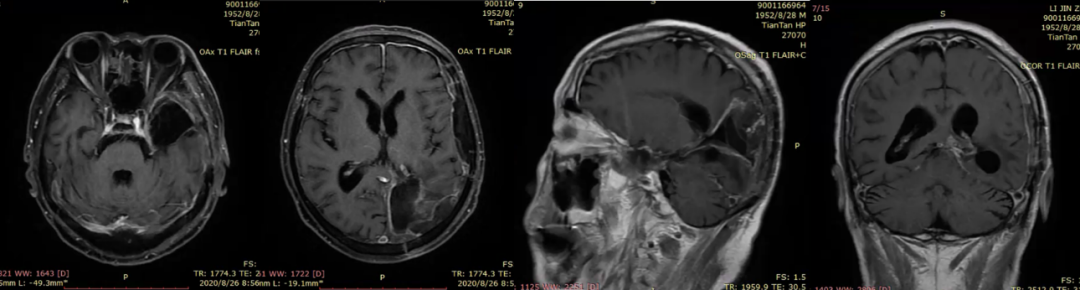
图5. 术后3个月MRI检查提示颅内肿瘤病变控制良好,未见明显肿瘤复发或进展迹象
经验分享
1.颅内多发性胶质瘤最早由Bradely等进行报道,约占全部胶质瘤患者数的2~20%,病理类型大多为胶质母细胞瘤(GBM),多发性GBM约占GBM患者总数的20%。
1963年,Batzdorf和Malamud依据病理与影像学特点将多发性胶质瘤分为两类:多灶性胶质瘤(multifocal glioma)和多中心性胶质瘤(multicentric glioma)。
多灶性胶质瘤是指肿瘤通过已知存在的通路而生长和扩散的多发性肿瘤,病灶之间有明确的传播、转移路线,这些通路包括白质纤维束(如联系纤维,投射纤维和联合纤维)、脑脊液循环通路以及邻近脑组织的扩散等。通常MRI T2和FLAIR序列上可观察到相应的转移途径。
多中心性胶质瘤是指在发生时间和空间上相分隔的肿瘤病灶,往往分布于1-3个不同脑叶或不同半球,无法用上述传播转移途径解释。
2.现有研究发现多发性胶质瘤的临床预后较单病灶胶质瘤更差,可能因为多发性胶质瘤具有显著不同的分子遗传学背景,既往研究也报道多发性胶质母细胞瘤往往是间质亚型,并且不伴有IDH1、ATRX或PDGFRA基因突变。
另外,多灶性胶质瘤和多中心性胶质瘤可能具有不同的肿瘤克隆起源特征,但并无确切证据表明二者生存期存在明显差异。
相信随着高通量组学测序技术的逐渐普及,采用多病灶取材及单细胞测序技术,有望进一步阐明多发性胶质瘤的分子演进过程。
3.多发性胶质瘤的治疗目前尚无推荐治疗方案,临床上争议较大。
许多学者认为广泛切除肿瘤会增加出血和神经功能障碍的风险,故手术策略相对保守。但手术切除程度仍是多发性胶质瘤临床预后的主要影响因素,因此治疗原则应该是最大范围安全切除肿瘤组织,同时尽可能的确证多个病灶的病理组织类型与分子病理特征,而对于不能切除的病灶,采用立体定向活检明确病理诊断是非常必要的,继而指导下一步综合治疗,总体治疗策略可参照新诊断胶质母细胞瘤的推荐治疗方案。
4.在我们本次介绍的病例中,患者肿瘤位于左侧优势半球,呈多灶性浸润性生长,累及多个脑叶深部组织,难以单次手术完全切除,根据最大范围安全切除原则,采取分期手术切除策略,第一次切除强化部分肿瘤,第二次切除残余非强化部分肿瘤,总体达到肿瘤近全切除,有效降低术后再出血风险。患者术后恢复顺利,取得了较为满意的临床疗效。
5.运用术前多模态影像、术中导航、术中肿瘤显像及术中MRI等技术,了解重要脑功能区位置、肿瘤浸润范围、与周围组织解剖关系,可大大提高手术效率及安全性,最大程度避免术中损伤重要脑功能区和重要血管结构,降低术后严重脑水肿或神经功能障碍的发生率,为后续综合治疗创造条件,最终改善患者的生活质量并延长存活时间。
参考文献
1. Batzdorf U, Malamud N. The Problem of Multicentric Gliomas. J Neurosurg. 1963;20:122-36.
2. Patil CG, Eboli P, Hu J. Management of multifocal and multicentric gliomas. Neurosurg Clin N Am. 2012;23(2):343-50.
3. Patil CG, Yi A, Elramsisy A, Hu J, Mukherjee D, Irvin DK, Yu JS, Bannykh SI, Black KL, Nuño M. Prognosis of patients with multifocal glioblastoma: a case-control study. J Neurosurg. 2012;117(4):705-11.
4. Hassaneen W, Levine NB, Suki D, Salaskar AL, de Moura Lima A, McCutcheon IE, Prabhu SS, Lang FF, DeMonte F, Rao G, Weinberg JS, Wildrick DM, Aldape KD, Sawaya R. Multiple craniotomies in the management of multifocal and multicentric glioblastoma. Clinical article. J Neurosurg. 2011;114(3):576-84.
5. Liu Q, Liu Y, Li W, Wang X, Sawaya R, Lang FF, Yung WK, Chen K, Fuller GN, Zhang W. Genetic, epigenetic, and molecular landscapes of multifocal and multicentric glioblastoma. Acta Neuropathol. 2015;130(4):587-97.
6. Di Carlo DT, Cagnazzo F, Benedetto N, Morganti R, Perrini P. Multiple high-grade gliomas: epidemiology, management, and outcome. A systematic review and meta-analysis. Neurosurg Rev. 2019;42(2):263-275.
7. Dono A, Wang E, Lopez-Rivera V, Ramesh AV, Tandon N, Ballester LY, Esquenazi Y. Molecular characteristics and clinical features of multifocal glioblastoma. J Neurooncol. 2020;148(2):389-397.
8. Georgescu MM, Olar A. Genetic and histologic spatiotemporal evolution of recurrent, multifocal, multicentric and metastatic glioblastoma. Acta Neuropathol Commun. 2020;8(1):10.
作者简介

张伟
副主任医师,副教授,硕士生导师
北京天坛医院神经外科肿瘤五病区副主任
美国MD安德森癌症中心博士后

王地
硕士研究生,首都医科大学附属北京天坛医院

江涛
主任医师,教授,博士生导师
北京天坛医院神经外科肿瘤五病区主任
北京天坛医院神经外科副主任
北京市神经外科研究所副所长






