平均随访时间为17.1个月
中位OS达到19个月(95% CI:14.9, 未达到)
中位PFS达到10.6个月(95% CI:8.2~16.7)
行路难,行路难,GBM患者路在何方?
170万年前的一块南非远古趾骨上的骨肉瘤,拉开了人类发现癌症的序幕,而世界上关于癌症病例的最早记录可以追溯到公元前1600年的古埃及时期。经过几百年不懈的探索,人类正在逐渐揭开癌症神秘的面纱。根据日本国立癌症研究中心的报告,超过80%的甲状腺癌和乳腺癌患者能够继续存活10年,但很不幸的,人类对于某些癌症目前仍然束手无策,比如胶质母细胞瘤(GBM)。
GBM是中枢神经系统中恶性程度最高的肿瘤,占所有脑恶性肿瘤的16%,死亡率极高。由于肿瘤生长迅速,并具有高度侵袭性,肿瘤细胞常常浸润到正常脑组织,很难实现完整的手术切除,且术后易复发。可以说,GBM是一个“致命杀手”,患者一旦确诊,平均生存期仅有14-15个月,5年生存率更是只有5%[1,2]。从上世纪60年代以单纯手术治疗为主,发展至目前以术后放疗联合替莫唑胺(TMZ)同步并辅助化疗(Stupp方案)[3]为新诊断GBM患者的标准治疗方案。近期研究除了电场治疗可以适度提高患者的生存率,GBM的治疗陷入瓶颈——如何才能提高患者总生存时间,或许将会成为未来一段时间研究者要面临的难题。
那么,GBM患者是否能迎来黎明的曙光呢?
山穷水复疑无路,柳暗花明又一村
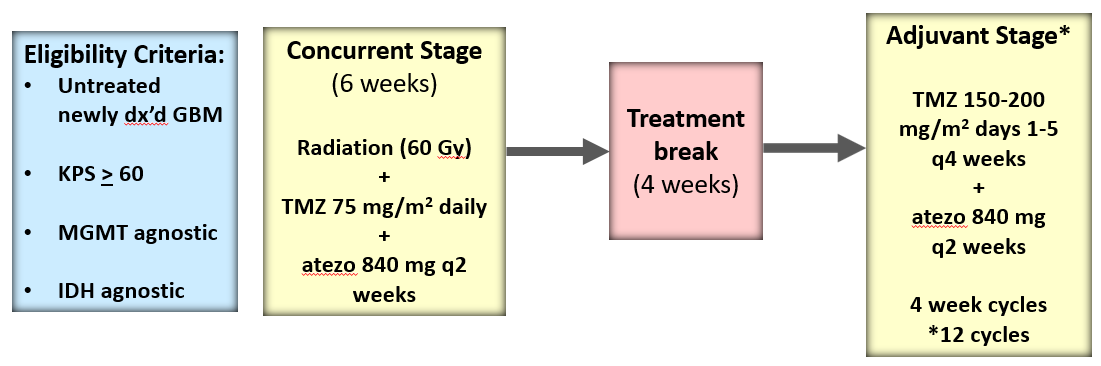
![]()
试验结果
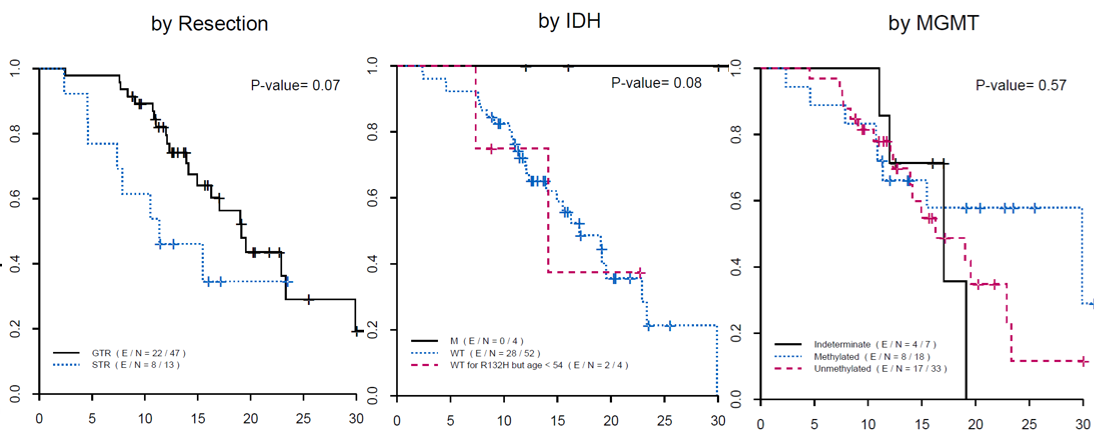
![]()
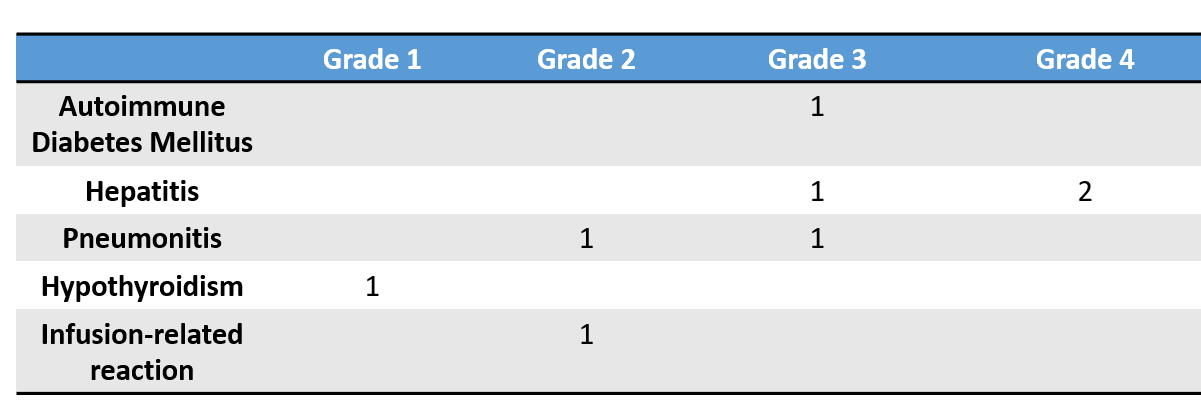
安全性数据
展 望
此外,PD-1/PD-L1免疫抑制剂与抗血管生成通路的协同机制也已经在多个瘤种中得到了疗效的验证。PD-L1免疫抑制剂阿替利珠单抗联合贝伐珠单抗已被证实在晚期肝癌、非小细胞肺癌和小细胞肺癌、特定类型转移性尿路上皮癌和PD-L1高表达的转移性三阴性乳腺癌等多种类型癌症中的疗效。贝伐珠单抗作为复发GBM患者的标准治疗手段之一,我们也很期待阿替利珠单抗与贝伐珠单抗联合应用在GBM中的疗效获益。
改善GBM患者生存预后的道路虽然布满荆棘,但免疫疗法从基础向临床的转化以及创新药物的研发让患者重燃希望,GBM的免疫治疗未来可期!
[1] Hanif F, Muzaffar K, Perveen K, et al. Glioblastoma multiforme: A review of its epidemiology and pathogenesis through clinical presentation and treatment[J]. Asian Pacific journal of cancer prevention: APJCP, 2017, 18(1): 3.
[2] Stupp R, Hegi M E, Mason W P, et al. Effects of radiotherapy with concomitant and adjuvant temozolomide versus radiotherapy alone on survival in glioblastoma in a randomised phase III study: 5-year analysis of the EORTC-NCIC trial[J]. The lancet oncology, 2009, 10(5): 459-466.
[3] Stupp R, Mason W P, Van Den Bent M J, et al. Radiotherapy plus concomitant and adjuvant temozolomide for glioblastoma[J]. New England Journal of Medicine, 2005, 352(10): 987-996.
[4] Reardon, D. A. et al. Randomized phase 3study evaluating the efficacy and safety of nivolumab versus bevacizumab in patientswith recurrent glioblastoma: CheckMate 143. Neuro Oncol. 2017, 19, p iii21
[5] Wang X, Guo G, Guan H, Yu Y, Lu J, Yu J. Challenges and potential of PD-1/PD-L1 checkpoint blockade immunotherapy for glioblastoma. J Exp Clin Cancer Res. 2019; 38(1):87
[6] Sangeeta Goswami, et al.Immune profiling of human tumors identifies CD73 as a combinatorial target in glioblastoma.Nature Medicine (2019).