TTFields 联合同步放化疗治疗新诊断GBM的试点研究结果解读
肿瘤电场治疗(TTFields)是利用中等频率(100-300kHz)、低强度(1-3V/cm)交变电场治疗肿瘤的一种物理治疗方法,已在多种肿瘤类型的相关研究中被证实可起到破坏肿瘤细胞有丝分裂、致使细胞周期停滞和诱导细胞凋亡的作用。其使用方法为将两对传感阵列(每块分布9个绝缘电极片)紧密帖服于头皮上,通过便携式电场发生器产生中频低强度交变电场对患者进行治疗。具有非侵袭性、局部施放、持续性治疗等特点。美国食品药品管理局(FDA)分别于2011年4月8日、2015年10月5日批准200kHz的TTFields 用于治疗复发和新诊断的胶质母细胞瘤(GBM),随后于2019年5月批准 150kHz的TTFields用于治疗恶性胸膜间皮瘤(MPM)。EF-14的III期临床研究已证实,TTFields在同步放化疗后联合替莫唑胺(TMZ)治疗新诊断的GBM患者与TMZ单用相比,可显著延长新诊断GBM 患者的中位OS(20.9m VS 16.0m)。且在联合治疗中,TTFields没有增加全身系统性不良事件发生率,唯一的不良反应为轻到中度的皮肤毒性。尽管TTFields的机制和疗效已得到大规模临床研究和临床实践的初步证明,但是否存在更多其他作用机制?如何发挥其最大肿瘤细胞杀伤作用?等问题仍吸引着众多学者进行探索。
Moshe Giladi等发现在放疗后立即使用TTFields可以抑制DNA的同源重组修复,提示TTFields可以起到放疗增敏作用。Eun Ho Kim等在物理体模测量和动物模型上均发现,佩戴电极贴片进行放疗可能不会增加局部皮肤的毒性。这使得将放疗后立即使用TTFields作为增强放疗效果的方案成为可能。在以上基础研究的数据支持下,Rachel Grossman等开展了一项前瞻性、单臂、开放性试点研究:评估TTFields与TMZ同步放化疗同期使用治疗新诊断 GBM的有效性和安全性,其最终结果在2019年11月20-24日的SNO年会上公布。
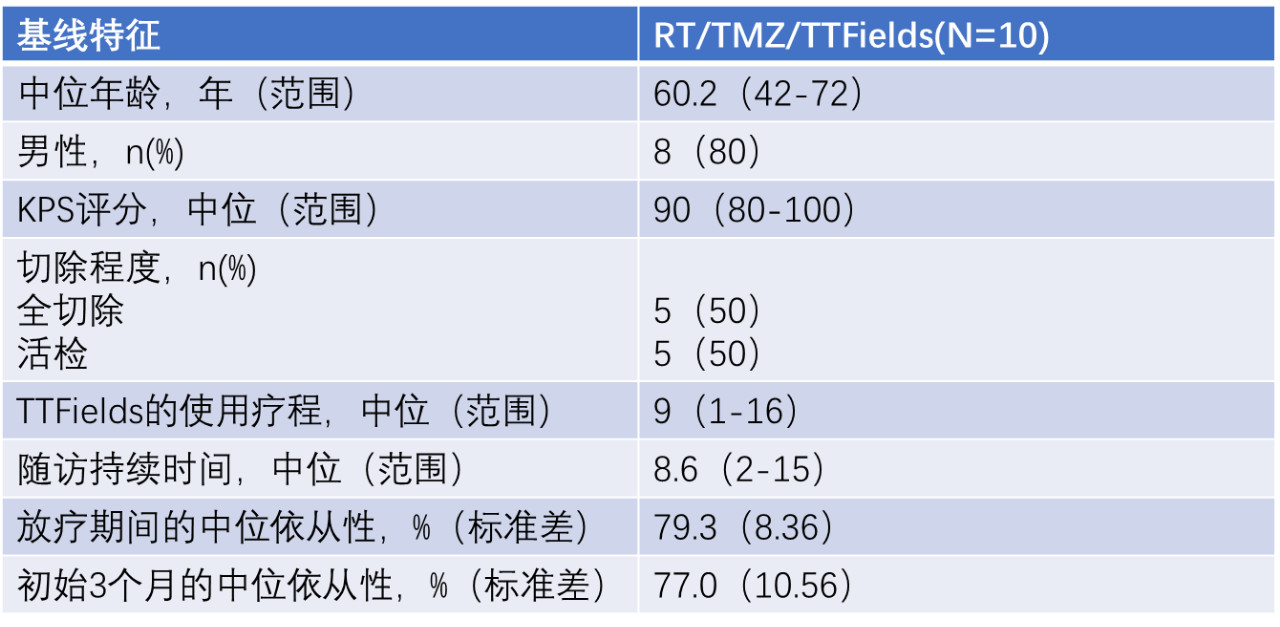
入组患者:经组织学确诊的新诊断成年幕上GBM患者10例。
治疗方案:进行肿瘤减积手术或活检后,开展放疗+TMZ+TTFields同步治疗6周,随后继续TTFields(x24m)+TMZ(x6个周期)维持治疗。
主要终点:在同步放化疗阶段同时使用TTFields的安全性,包括放疗延迟
次要终点:PFS、OS。
入组基线特征:2017年4月-12月期间入组10例患者,来自于以色列的特拉维夫医学单中心。
主要终点:
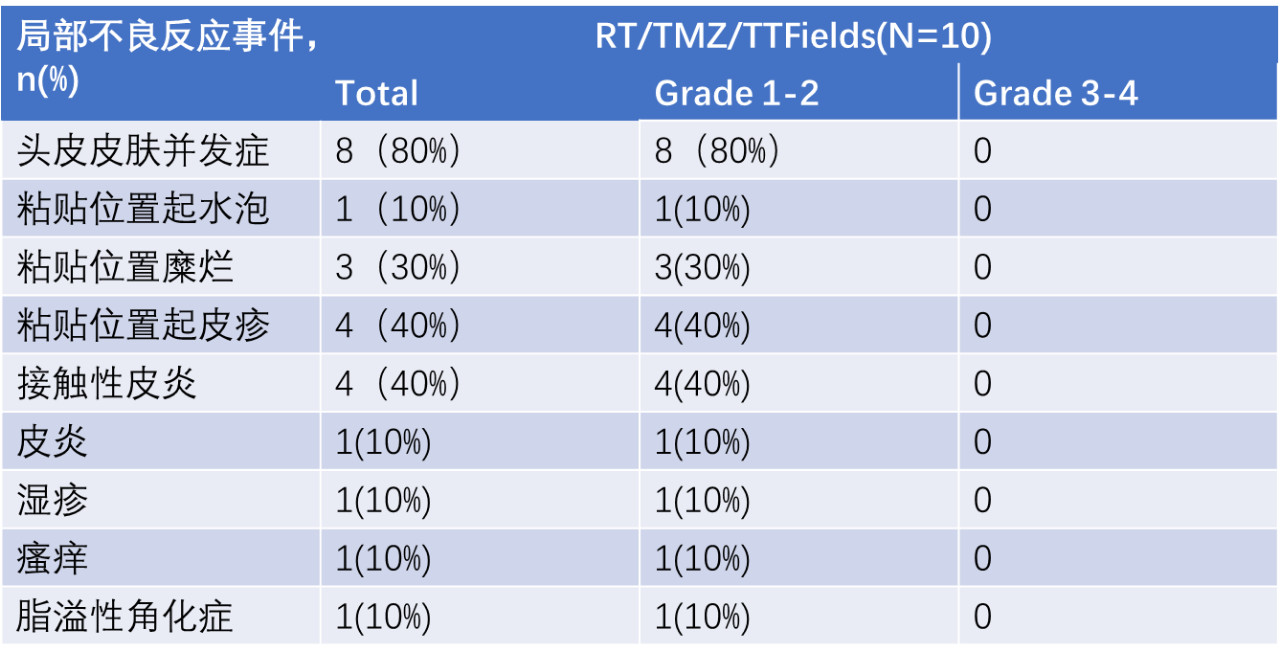
1.所有患者均上报≥1个不良事件,其中8个患者(80%)报告的皮肤毒性(1-2级被认为与TTFields相关)。
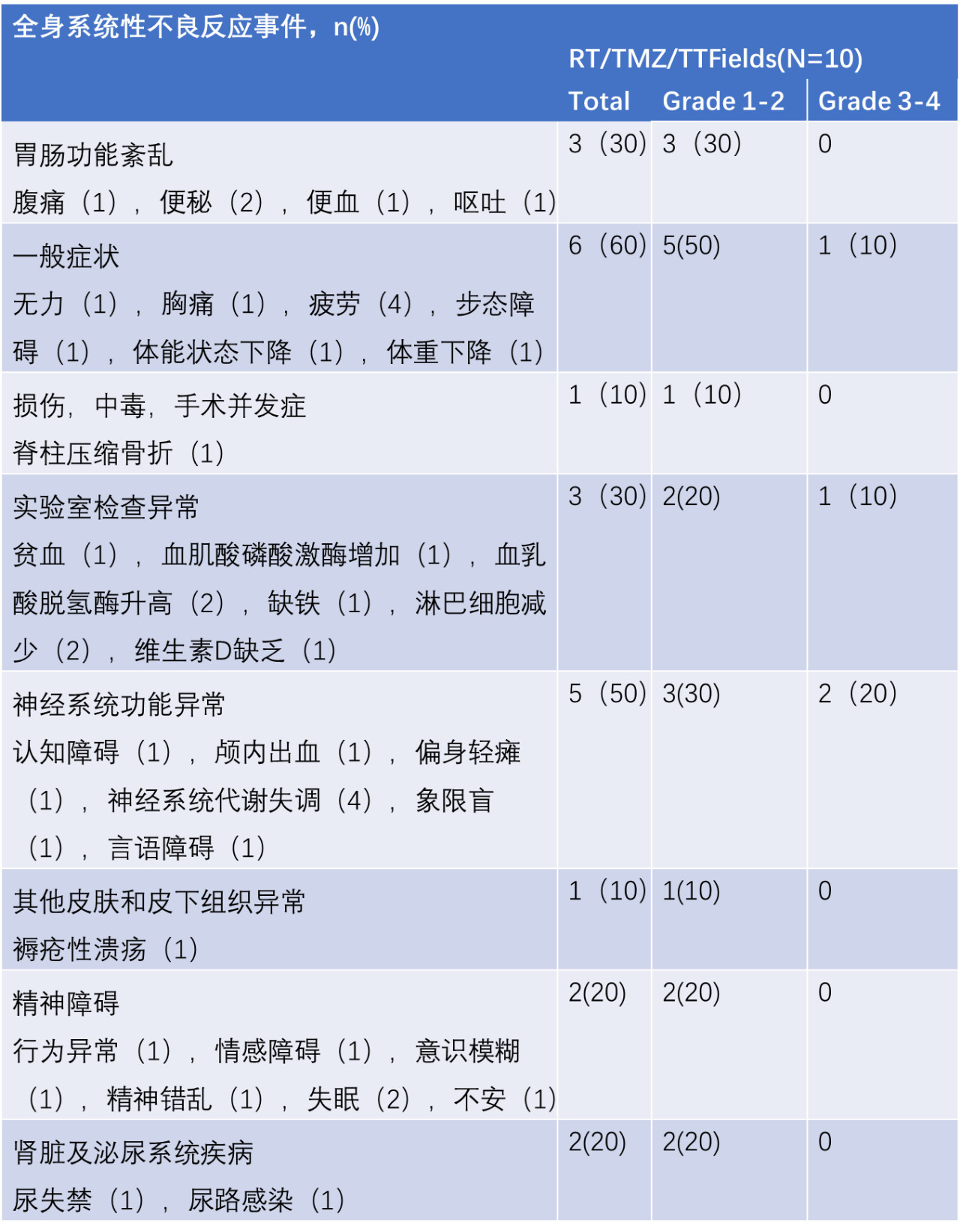
2.与TTFields不相关的全身系统性不良反应事件如下:
3.有8名患者存在放射治疗延迟,但均与TFields的皮肤毒性无关。
次要终点:
1.接受RT+TMZ+TTFields同步治疗且随后TMZ+TTFields维持治疗新诊断GBM患者的应答情况如下,其中7名患者仍然存活,且3名没有肿瘤进展的提示。
2.接受RT+TMZ+TTFields同步治疗且随后TMZ+TTFields 维持治疗新诊断GBM患者的KM无进展生存曲线如下,其中中位PFS为8.9个月(95% CI 2.1-12.9),3个月的PFS为70.0%,6个月的PFS为58.3%,中位OS尚未达到。
在同步放化疗时期加入TTFields进行联合治疗,没有增加单独放疗、单独 TMZ化疗相关的毒性反应。与EF-14[4]研究相似,本试验唯一与TTFields相关的不良事件为皮毒性。本试验中有8名患者经历放疗延迟,但均与皮肤毒性无关。此外,经观察放疗+TMZ+TTFields同步治疗的初步疗效良好。基于以上试验的安全性和初步疗效,Rachel Grossman启动了一项在60名新诊断GBM患者上探索RT/TMZ/TTFields同步治疗有效性的II期临床研究。而 Novocure也将开展一项随机分组(1:1)、开放性、双臂、多中心的关键性III临床试验EF-32,采用TTFields(200kHz)联合放疗、TMZ同步治疗新诊断的GBM患者,结果值得期待。
EORTC Ⅲ期临床试验CATNON第二次中期结果
CATNON是由EORTC发起的大型III期临床试验,自2007年起至2015年共纳入无1p/19q联合缺失的WHO III级间变性星形细胞瘤(AA)751例。该临床实验的第一次中期结果已在2016年的ASCO会议上公布,在本次SNO会议上,试验主要负责人Martin J.Van den Bent教授进行了第二次中期结果汇报。同第一次中期结果相比,本次汇报主要展示了放疗同步TMZ化疗的治疗作用以及不同分子特征肿瘤的预后特点。
首先,在所有患者中放疗同步TMZ化疗未能显著延长患者生存时间(HR0.968,p=0.763),但在IDH突变的患者中有延长生存时间的趋势(HR0.72,p=0.051)。其次,IDH突变AA可以从TMZ辅助化疗中获益(HR0.46,p<0.001),但IDH野生AA在放疗同步TMZ化疗以及辅助TMZ化疗中均未能获益。Martin教授指出未来的工作重点是补充完善入组患者的分子标志物数据。
随着分子病理的发展我们发现存在不同分子特征的胶质瘤具有显著不同的生物学特性,近期国际病理学组织cIMPACT-NOW提出将EGFR扩增、染色体+7/-10、TERTp突变以及CDKN2A/B缺失等纳入新的病理分类标准。EORTC也正在着力补充CATNON实验患者的分子特征数据。相信随着分子分层的细分以及随访时间的延长我们可以更加明确TMZ化疗在AA中的作用。
IDH野生型/TERT启动子突变型较低级别脑胶质瘤术后同步放化疗的前瞻性研究结果解读
江涛教授团队开展的一项前瞻性随机对照研究,旨在研究术后放疗结合TMZ同步和辅助化疗治疗WHO II/III级脑胶质瘤IDH-wt和TERTp-mut亚群的疗效和安全性,其中期结果在本次会议上公布。
入组患者:经组织学确诊的新诊断WHO II/III级脑胶质瘤IDH-wt和TERTp-mut亚群30例。
治疗方案:进行肿瘤最大限度安全切除或活检后,随机分入单纯放疗组或术后放疗同步及辅助TMZ化疗(6-12周期)。放疗剂量两组均为60Gy/30次。
主要终点:OS。
次要终点:PFS,同步放化疗和辅助化疗的安全性。
主要终点:1年OS在二个治疗组间有显著差异,单因素分析及多因素分析均显示同步放化疗与全切除是预后良好因素。

次要终点:中位无进展生存时间无显著差异。

毒性反应:全组都很好地耐受治疗,没有因毒性中断治疗。
这是第一个基于IDH和TERT启动子突变状态分类来探讨WHO II/III级脑胶质瘤治疗策略的前瞻性研究。该研究的结果发现术后放疗结合TMZ同步和辅助化疗与单纯放疗相比显著提高了WHO II/III级脑胶质瘤IDHwt/TERTp-mut亚群的总生存。由于该亚群仅占较低级别脑胶质瘤的7-10%,且为单中心研究,难以入组足够的病例,因此需要一个大的多中心前瞻性随机研究来证实该研究的结果。
底节区生殖细胞肿瘤单中心回顾性研究
首都医科大学附属北京天坛医院,从上世纪90年代末,在罗世祺教授、邱晓光教授的带领下,开展生殖细胞肿瘤的临床治疗和研究,在该领域积累了丰富的临床经验。在本届SNO会议上,李博医师介绍了过去20年天坛医院经治的211例底节区生殖细胞肿瘤的临床数据,这是迄今为止最大一组的单中心报道。
结果显示,底节区生殖细胞肿瘤患者中,大约95%为男性,80%在起病时伴有一侧肢体轻瘫,18%伴有性早熟,2.8%的患者伴有转移。就治疗而言,无论是在生殖细胞瘤还是非生殖细胞瘤性生殖细胞肿瘤患者中均发现,局部放疗有更高的复发风险,而全脑放疗和全脑全脊髓放疗复发风险相似。
生殖细胞肿瘤患者以儿童和青少年多见,远期发育和生活质量成为关注的重点。本研究利用PedsQL 4.0生活质量调查问卷和世界卫生组织发布的用于评价5-19岁人群生长发育的WHO AnthroPlus软件,对上述两个问题进行了研究。结果显示,从整体上看,这部分人群治疗后的发育仍处于正常人群水平,但生活质量明显低于正常人群,也低于罹患其它肿瘤、慢性疾病、其它脑肿瘤的患者。
鉴于大范围照射的潜在远期毒副作用,对于不伴有转移的患者,可以考虑缩小照射范围,选择诸如全脑,全脑室在内的照射方式,局部放疗因复发风险高应该弃用,同时,照射剂量也严重与毒副作用相关,近来研究重点是:放化疗联合治疗以减低放疗剂量和缩小照射体积。
首都医科大学北京天坛医院邱晓光教授点评
2019年SNO会议发言内容主要涉及神经肿瘤继续教育,病理及分子病理,影像,多方向基础研究,临床治疗(手术,放化疗,靶向和免疫治疗)和康复等诸多领域,遗憾的是没有新的神经肿瘤三期临床结果公布,我们选取了四个与临床治疗相关的发言摘要,这些数据都还没有正式发表,仅供国内同行参考,其中,TTF联合TMZ放化疗治疗GBM作为1类推荐已经分别写入2018年NCCN指南和国家卫健委《脑胶质瘤诊疗规范》,EORTC Ⅲ期临床试验CATNON的最终结果很可能改变无1p/19q联合缺失的WHO III级间变性胶质瘤的治疗模式。




