
Neuro-Oncology
Volume 21, Issue 6, June2019
本期编译:
王 樑、翟玉龙
西安唐都医院神经外科
周 杰
西南医科大学附属医院
万大海、杨远达、孙毓奇、杨钰桢
山西医科大学第一医院
潘 灏
东部战区总医院
组稿、审校
王 樑
西安唐都医院神经外科
Neuro-Oncology
2019年6月速览
EDITORIALS
1.NG2/CSPG4与胶质母细胞瘤
NG2/CSPG4 in glioblastoma: about flexibility
Gaetano Finocchiaro; Serena Pellegatta
Neuro-Oncology, Volume 21, Issue 6, June 2019, Pages 697–698, https://doi.org/10.1093/neuonc/noz055
【王樑】
2.如何将免疫治疗纳入胶质母细胞瘤的治疗标准
How to integrate immunotherapy into standard of care in glioblastoma
Michael Platten
Neuro-Oncology, Volume 21, Issue 6, June 2019, Pages 699–700, https://doi.org/10.1093/neuonc/noz043
检查点抑制剂,如pd-1拮抗剂nivolumab和pembrolizumab,目前在全球50多个胶质母细胞瘤的临床试验中进行了测试。其中,20多个临床试验是对新诊断的胶质母细胞瘤进行的。虽然该领域热切期待着CheckMate548 Ⅲ期临床试验的结果,但在MGMT甲基化的新诊断的胶质母细胞瘤患者(基于CheckMate143临床试验)中,测试添加nivolumab与替莫唑胺(TMZ)的标准放化疗的疗效是公平的,提示大多数患者将不会受益,相关反应将局限于具有高突变表型的患者。虽然对免疫检查点抑制剂的抵抗可能是由淋巴细胞减少表型和低突变负荷导致的免疫识别不良所致,但同时进行烷基化治疗作为混杂因素的相关性尚不清楚。实用的方法是简单地将免疫检查点抑制剂与新诊断的MGMT甲基化胶质母细胞瘤的临床试验中的免疫检查点抑制剂结合到辅助TMZ化疗中,在5/28方案内给予标准剂量(SD)方案200mg/m2,与任何其他非免疫干预一样,旨在改善MGMT甲基化胶质母细胞瘤患者的治疗结果。有趣的是,这种实用的方法在许多疫苗试验中也被采用,目的是诱发肿瘤特异性T细胞反应,即使是在高度复杂的个性化方法中。普遍的观点是,TMZ诱导淋巴细胞减少,从而允许肿瘤反应性T细胞在外周循环的扩展,正如在疫苗或过继T细胞移植前使用低剂量环磷酰胺进行预处理。相反的观点是,循环中的肿瘤反应性T细胞在反复暴露于高剂量的TMZ时被简单地杀死。虽然这两种观点在生物学上都是合理的,但令人惊讶的是,关于标准TMZ给药方案的实际免疫效果的数据却很少。当EGFRvIII疫苗被开发成标准治疗时,与SD-TMZ相比,100mg/m2的强化21/28治疗方案会导致更明显的淋巴细胞减少和疫苗反应,尽管调节性(免疫抑制性)T细胞(T-reg细胞)的外周频率增加。这说明TMZ化疗的剂量和时间对抗肿瘤免疫反应至关重要,标准的评估参数(如T细胞亚群的频率)不足以描述TMZ化疗的详细免疫结果。
在本期神经肿瘤学中,Karachi等人在两个实验性同基因胶质瘤模型中,使用SD-TMZ与计量给药(MD)同时给予抗PD-1抗体时,比较TMZ对抗原特异性T细胞反应的影响。重要的是,与DI-TMZ相比,两种方案之间的累积剂量是相同的,并且MD方案仅给药10天。在这项临床前研究中最令人瞩目的发现是,SD-TMZ抑制了抗PD-1治疗的抗肿瘤作用,而抗PD-1疗效在MD-TMZ治疗的动物中正常。虽然在这项研究中,没有机械地将SD-TMZ抑制抗PD-1治疗效果归结于肿瘤浸润淋巴细胞上的衰竭标记物上调,从而将变阻器转移到炎症反应较低的肿瘤微环境中,实际上这是一种在实体肿瘤中对检查点抑制反应的重要预后参数。这与之前GL261模型的研究一致,该模型证明,在启动检查点阻断前5天,PD-1阻断TMZ可增强PD-1阻断的抗肿瘤效果,但会损害长期免疫记忆。
对患者和临床试验设计有什么影响?在考虑免疫治疗时,患者应首先停用地塞米松,因为有足够的数据表明地塞米松肯定比烷基化化疗更有害于抗肿瘤免疫治疗。Karachi及其同事的简练的临床前研究说明了临床前模型解决重要临床问题的价值,但由于大多数临床前模型的已知局限性,需要进行全面设计的临床研究。随着越来越复杂的免疫疗法的检验,现在是时候进行对照临床试验,确定胶质母细胞瘤的标准治疗(包括SD和MD或DI TMZ方案)对免疫检查点抑制剂和疫苗(不仅在外周循环中,而且在治疗后的肿瘤组织中)诱导的抗肿瘤免疫的影响。由于TMZ的潜在有害或可能有益作用,只能在肿瘤微环境中,而不能在外周循环中如实评估。在这方面,该领域需要更多的临床试验,如目前招募的vxm01-ave-04-int或noa-21 11个试验中所示,实验性免疫治疗开始后肿瘤组织切除是方案的组成部分。也就是说,这一领域进一步发展的先决条件是一项对照临床试验的概念证明,免疫疗法对胶质母细胞瘤患者有效。
【翟玉龙、王樑】
3.新诊断胶质母细胞瘤治疗剂量的多样性
Dose diversification in newly diagnosed glioblastoma
Elizabeth R Gerstner
Neuro-Oncology, Volume 21, Issue 6, June 2019, Pages 701–702, https://doi.org/10.1093/neuonc/noz063
对于新诊断的胶质母细胞瘤(nGBM)患者化疗选择十分有限,替莫唑胺仍然是化疗的主要手段。考虑到其较低的药物毒性,为了克服患者耐药性和改善患者预后,目前已经开展了多种评估强化替莫唑胺剂量的替代剂量方案的研究。遗憾的是,这些研究没有得出足够的增强替莫唑胺成效的结论。最近,在非甲基化MGMT胶质母细胞瘤患者中降低替莫唑胺药量同时使用基于亚组分析的新药物的临床试验已经开展,这表明替莫唑胺在特定的nGBM患者中益处有限。甚至有人担心替莫唑胺可能导致过度突变的肿瘤表型和更具侵袭性的疾病,因此谁应该接受替莫唑胺以及如何优化其使用仍是一个重要的临床问题。
最近,Herrlinger等人发表了一项针对具有MGMT启动子甲基化的nGBM患者的III期随机对照试验结果,该试验的策略是化疗剂量多样化而非剂量强化。根据UKT03试验的乐观结果,nGBM患者被随机分为标准放疗/替莫唑胺(stupp方案,n=69)或在第1天给予洛莫司汀,在每6周周期的第2-6天给予替莫唑胺6个周期(n=72)。在改良意向治疗(ITT)分析中,洛莫司汀/替莫唑胺组(48.1个月vs31.4个月,P=0.0492)的总生存率有显著改善,这在ITT人群中得到证实(46.9 months vs30.4months)。两组间无进展生存率无显著差异,作者假设这是由于洛莫司汀/替莫唑胺组假性进展增加所致。尽管患者人数较少,但在洛莫司汀/替莫唑胺组中,活检证实的假性进展病例多于替莫唑胺组。去除IDH突变肿瘤的事后分析并没有实质性改变结果。洛莫司汀和替莫唑胺联合使用会适度增加毒性,完成所有计划化疗周期的患者较少。
总体而言,这些结果对于MGMT甲基化的nGBM患者是有希望的。两种烷基化剂(替莫唑胺和洛莫司汀)都会干扰不同的细胞复制途径,这突显出阻断多种途径的治疗可能对患者最有效。然而,正确的患者选择对不同的联合化疗方案成功至关重要。在这项研究中,作者集中在MGMT甲基化人群中,这些人群预计化疗的益处最大,并且更可能反映出其他化学敏感疾病的结果,如少突胶质瘤,其中三药丙卡巴嗪、洛莫司汀和长春新碱(PCV)的治疗显示生存率或原发中枢神经系统的生存率有所提高。以多药化疗为主要治疗手段的淋巴瘤。在分子医学的这个时代,重点是针对性治疗(例如针对性EGFR)的精细治疗,但这些努力在GBM中并不总是成功,或者反应持续时间有限。鉴于GBM的异质性,剂量多样化可能比单药更有益。然而,剂量多样化是否会有益于其他GBM亚型,如MGMT非甲基化人群,这些人群对化疗的反应可能有所不同,这一点仍有待观察——再次强调需要进行适当的患者选择。
本研究存在一些局限性,包括样本量小。此外,由于药物的给药时间表不同,患者和医生对治疗没有盲目性。随着毒性的增加,增加了将该方案扩大到老年或更虚弱的非临床试验人群的担忧。尽管存在这些局限性,但成功完成了一项研究,使用了2种已经存在了很多年的药物,并且提高了生存率,这为我们提供了希望,使我们可以手头上有工具来帮助至少一部分nGBM患者。
【翟玉龙、王樑】
REVIEW
1.硬脊膜内脊髓肿瘤治疗进展:以肿瘤放疗为焦点
Updates in the management of intradural spinal cord tumors: a radiation oncology focus
Rupesh Kotecha; Minesh P Mehta; Eric L Chang; Paul D Brown; John H Suh ...
Neuro-Oncology, Volume 21, Issue 6, June 2019, Pages 707–718, https://doi.org/10.1093/neuonc/noz014
原发性脊髓肿瘤是一类异质性较强的中枢神经系统恶性肿瘤。由于该类肿瘤病理亚型较多、发病率较低、神经功能缺失症状高发等特点,导致该类肿瘤治疗较为复杂。随着神经影像学的进步,整合诊断、预后、分子检测的应用以及神经外科手术技术的发展,放射治疗在原发性脊髓肿瘤多模态治疗中的角色得到重新认识,也更需要前瞻性、多中心、多学科对脊髓肿瘤放疗策略进一步探讨。当然,放射治疗技术的进步也极大地提高了脊髓肿瘤治疗的延续性。同时,立体定向放射外科和质子放射治疗为病人提供了新的放疗选择。本文就目前放疗在原发性脊髓肿瘤治疗中的最新进展进行了总结。
脊髓内肿瘤
星形细胞胶质瘤
作者指出,颅内胶质瘤常见的PTEN、BRAF、p53等基因突变在髓内胶质瘤中仍然适用,但IDH、H3K27等突变情况在髓内胶质瘤中情况略有不同。通过整合分子表型和全基因组测序有利于我们找到特有的靶向治疗靶点。针对全切除的WHO I级的毛细胞型星形细胞胶质瘤和WHO II级星形细胞瘤,暂不推荐进行放化疗等辅助治疗。而未全切除的低级别胶质瘤(WHO I-II级)推荐后续进行辅助治疗。WHO III-IV级胶质瘤在最大范围安全切除的前提下,推荐按照颅内胶质瘤治疗指南进行放化疗改善预后。放疗推荐在术后4-6周进行,照射范围一般包括残留肿瘤、术腔、肿瘤可能侵袭区域(但不包括相关脊髓空洞),根据肿瘤病理级别和组织亚型、部位和残留程度可以使用调强放疗(IMRT)、容积旋转调强放疗(VMAT)或质子束治疗(PBT)(45-54Gy,1.8–2 Gy/次)等放疗技术减少周边重要结构放疗剂量,降低并发症发生率。
室管膜肿瘤
作者首先总结了脊髓室管膜肿瘤的流行病学和分子病理特点,提出全中枢筛查扩散病灶对脊髓室管膜肿瘤治疗极其重要,而最大安全范围切除仍然是脊髓室管膜肿瘤的手术策略。肿瘤全切是该类患者预后最重要的预后相关因素。术后应根据肿瘤切除程度、患者功能情况、患者年龄和肿瘤WHO病理分级进行辅助放疗。对于CSF细胞学阴性患者可以推荐局部照射,而CSF细胞学阳性或脑脊髓多发病灶患者推荐全中枢照射。
随后,作者分别总结了WHO I级黏液乳头状室管膜瘤、WHO II级室管膜瘤的临床特点、手术策略和放疗最新进展,并着重介绍了放疗方式的改进,最大限度地减少了临近组织器官的放射暴露,提高术后辅助治疗效果。
血管母细胞瘤
作者对脊髓血管母细胞瘤的临床特点和治疗策略进行了概述,并结合文献就其放疗相关进展进行了详细阐述。临床研究发现50Gy或更高剂量放疗可以为患者带来生存获益,对于播散性生长的脊髓母细胞瘤患者,放疗具有重要的作用,同时强调立体定向放射治疗(SRS)对于该类疾病的应用。
髓外硬膜下脊髓肿瘤
最后,作者以脊膜瘤为例,阐述了目前髓外硬膜下脊髓肿瘤的放疗进展。首先,作者对脊膜瘤的临床特点、分子背景和治疗策略进行了概述,全切除肿瘤(Simpson grades I–II)仍然是影响其预后的最重要因素。放射治疗适用于无法接受手术、肿瘤残留(Simpson grades III–IV)、WHO II-III级的脊膜瘤。肿瘤的部位、大小、病理、波及范围、临近重要结构、再次手术、年龄和患者功能情况是影响神经外科医生是否采用放射治疗的重要因素。最后,作者进一步通过实例讲解了脊膜瘤个体化的放疗策略。
本文是一篇很详尽的关于脊髓肿瘤放射治疗的综述,对临床放疗选择和应用具有很好的参考价值。
【周杰】
BASIC AND TRANSLATIONAL INVESTIGATIONS
1.一种EGFR推动的非固定模式转化的NG2胶质母细胞瘤细胞
A non-hierarchical organization of tumorigenic NG2 cells in glioblastoma promoted by EGFR
Talal F Al-Mayhani; Richard M Heywood; Vamsidhara Vemireddy; Justin D Lathia; Sara G M Piccirillo...
Neuro-Oncology, Volume 21, Issue 6, June 2019, Pages 719–729, https://doi.org/10.1093/neuonc/noy204
神经元-胶质细胞抗原2(NG2)是一种与人发育密切相关的跨膜蛋白多糖,在人脑组织NG2+祖细胞表面广泛表达。研究表明,NG2+祖细胞增殖,然后NG2表达降低,向NG-细胞分化,表达成熟的少突胶质细胞标记物,而低级别的少突神经胶质瘤就起源于该类细胞。NG2+肿瘤细胞较NG2-肿瘤细胞具有更强的增殖能力,而降低NG2表达可以抑制肿瘤生长。同时,正常脑组织和胶质瘤中EGFR信号通路均被证实与NG2表达密切相关,也被证实参与胶质母细胞瘤(GBM)发生发展,但在GBM中与NG2相互作用关系尚不明确。因此,作者通过一系列实验研究GBM原代细胞模型中研究NG2+与NG2-细胞中的具体转化关系,通过体内外实验研究NG2对于GBM细胞EGFR信号通路及GBM增殖的影响。
首先,作者发现随着培养时间的延长,GBM细胞中NG2+与NG2-细胞数量可以互相转化,保持动态平衡。NG2+的GBM细胞较NG2-的GBM细胞增殖能力更强,但随着培养时间延长(30 days),两种细胞比例相当时,两者增殖能力比较无统计学差异。作者进一步通过shRNA降低GBM细胞NG2蛋白表达,NG2敲除组GBM细胞(NG2-KD)增殖、克隆形成能力均降低,而原位成瘤模型中尽管NG2-KD成瘤率(19/21)与对照组(NG2-WT, 20/21)没有差异,但NG2-KD组荷瘤小鼠生存时间更长。
随后,作者研究NG2/EGFR相互作用对GBM生长的影响。体内外实验结果发现,EGFR表达在NG2+细胞和NG2-细胞中没有区别,但pEGFR(Tyr1068)在NG2+细胞中表达较NG2-细胞明显增加;降低NG2蛋白表达可以使GBM细胞中pEGFR蛋白表达降低,但不影响EGFR蛋白表达。进一步功能实验亦发现EGFR+/NG2+的GBM细胞EGFR+/NG2-的GBM细胞增殖能力显著增强。
进一步机制研究发现NG2+的GBM细胞较NG2-的GBM细胞EGFR通路下游蛋白(AKT 和ERK1/2)磷酸化表达增高,降低GBM细胞NG2蛋白表达后其磷酸化水平降低。以上结果均提示NG2可能参与EGFR信号通路调控。最后,作者分别提取Oncomine数据库中GBM临床样本信息和该研究团队收集的临床标本再次证实GBM中EGFR与NG2表达具有正相关关系。
通过以上实验结果,作者首次揭示了GBM中存在一种双向随机的NG2蛋白转化机制。NG2可能通过促进EGFR通路相关蛋白磷酸化,进而推动GBM细胞生长。NG2/EGFR相关作用机制的揭示,有可能提升GBM患者抗EGFR治疗效果,为将来GBM治疗提供新的干预靶点,具有重要的临床意义。
【周杰】
2.不同剂量替莫唑胺治疗影响T细胞对免疫检查点抑制的反应
Modulation of temozolomide dose differentially affects T-cell response to immune checkpoint inhibition
Aida Karachi; Changlin Yang; Farhad Dastmalchi; Elias J Sayour; Jianping Huang ...
免疫检查点抑制剂可以阻断肿瘤细胞对T细胞的抑制作用,重新激活针对肿瘤抗原的T细胞,适用于包括胶质母细胞瘤(GBM)在内的实体性恶性肿瘤的辅助治疗。PD-1被证实是GBM中最重要的免疫检查点之一,目前已在黑色素瘤、非小细胞肺癌、GBM免疫治疗中应用,但最近的一个III期临床实验结果显示PD-1单药治疗并未使复发GBM患者生存获益。因此,目前众多研究者试图采用联合用药的策略提高新发GBM患者预后。
替莫唑胺是目前最常用的GBM术后化疗的标准方案之一,研究表明替莫唑胺治疗GBM可以导致引起患者淋巴细胞减少和肿瘤微环境变化,与用药剂量和用药方案密切相关。本研究作者假设替莫唑胺用药剂量的变化可以降低免疫抑制细胞数量、导致淋巴细胞衰竭,从而影响免疫检查点抑制效率。因此,作者拟探究不同剂量替莫唑胺是否能够影响受试者免疫情况和肿瘤微环境,进而影响PD-1抑制剂对GBM的治疗效果。
首先,作者研究替莫唑胺给药剂量对荷瘤小鼠外周免疫细胞表型的影响,其结果提示替莫唑胺持续剂量方案(MD, 25mg/kg x 10 days)和标准剂量方案(SD, 50 mg/kg x 5 days)均可以降低荷瘤小鼠外周血淋巴细胞数量,SD组荷瘤小鼠较MD组荷瘤小鼠CD4和CD8 T细胞数量下降更明显。替莫唑胺治疗可以使正常小鼠脾细胞和荷瘤小鼠循环CD4/CD8 T细胞中PD-1和PD-L1表达增高。替莫唑胺SD方案导致T细胞耗竭标记物:LAG-3和TIM-3表达明显增高,而MD方案并未引起LAG-3和TIM-3表达变化。两种替莫唑胺方案均可以导致荷瘤小鼠的调节性T细胞(Treg)数量增加,SD组Treg细胞数量增加更明显。同时,SD方案还可以引起Treg细胞中PD-L1表达,血中CD11b+、Ly6G/6C+ 细胞数量增高,但MD方案未引起相应变化,说明MD方案较SD方案更具有降低外周血细胞免疫抑制细胞数量的优势。
该团队进一步研究发现替莫唑胺治疗可以降低IFN-g阳性表达的CD3 T细胞比例,但SD方案导致该细胞比例降低更明显。而MD方案较SD方案更具有降低PD-1/TIM-3/LAG-3表达均阳性的肿瘤浸润T细胞(TILs)数量的趋势(p=0.2512)。SD方案可以减少荷瘤小鼠T细胞IFN-g分泌并降低抗原特异性T细胞功能,而MD方案并未出现上述反应。综合以上结果,作者提出:对比MD方案,SD方案可以减弱外周和肿瘤浸润T细胞的功能,促使TILs耗竭表型增加。
接着,作者研究PD-1单药或联合替莫唑胺对宿主免疫的影响。结果提示,单独PD-1抗体治疗可以分别提高CD4、CD8、Treg细胞中PD-L1表达。PD-1抗体/SD方案治疗可以在部分荷瘤小鼠(GL261)中逆转替莫唑胺单药导致的外周血T细胞耗竭标记物表达增加。同时,PD-1抗体/MD方案可以增加CD4/CD8细胞中PD-1表达,其结果与单用MD方案类似。而PD-1单药或联合替莫唑胺可以增加外周血T细胞中PD-L1表达,并且逆转替莫唑胺SD方案引起的外周T细胞耗损标记物表达增加。同时,PD-1抗体/MD方案较PD-1抗体/SD方案更能增加荷瘤小鼠脾脏和血液中抗原特异性T细胞,以及抗原特异性TILs数量。
随后,作者研究PD-1联合替莫唑胺治疗对GBM中TILs的影响,发现两种联合方案对CD3+TILs数量改变不存在统计学差异,但PD-1抗体/MD方案较PD-1抗体/SD方案更能降低TILs中LAG-3(p=0.018)和TIM-3(p=0.4)表达。对比PD-1/SD方案,PD-1抗体/MD方案更能促进部分肿瘤活化T细胞数量增加(YFP+ /CD3+TILs: 14-fold, YFP+ /CD4+TILs: 12-fold, p<0.05; YFP+/CD8+TILs: P=0.8949)。两种剂量方案联合PD-1抗体治疗后,其髓系抑制性细胞(MDSCs)和巨噬细胞(CD11b+/Ly6G/6c+) 数量相当,MD/PD-1抗体组较SD/PD-1抗体组巨噬细胞(CD11b+/F480+) 数量增加,但不具有统计学意义。
作者还对替莫唑胺对肿瘤微环境的影响进行了研究。替莫唑胺单药组与PD-1抗体单药组或联合治疗组免疫基因表达具有差异,而PD-1联合替莫唑胺SD方案治疗可以促使GBM免疫耗损相关基因表达增高,也能使免疫检查点相关基因(CTLA-4,LAG-3和TIGIT)表达增高,并与功能实验结果一致。最后在小鼠颅内GBM模型中,使用SD剂量替莫唑胺治疗会削弱PD-1抗体治疗带来的生存获益。MD方案可以保留PD-1单药治疗带来的小鼠生存获益。
本研究结果提示,替莫唑胺SD方案可以促进T细胞耗竭标记物表达增加,而MD方案并不引起相关耗损标记物表达增加;而PD-1抗体治疗可以逆转SD方案导致的外周T细胞耗损,但不会影响TILs数量。根据以上结果,作者认为不同剂量替莫唑胺方案可以显著影响外周和肿瘤内免疫微环境,持续剂量替莫唑胺方案可能是更好的GBM免疫治疗联合选择。
【周杰】
3.SND1——促进胶质瘤增殖并预测患者预后的新型染色体结构修饰物
The novel chromatin architectural regulator SND1 promotes glioma proliferation and invasion and predicts the prognosis of patients
Lin Yu; Jinling Xu; Jing Liu; Huibian Zhang; Cuiyun Sun ...
Neuro-Oncology, Volume 21, Issue 6, June 2019, Pages 742–754, https://doi.org/10.1093/neuonc/noz038
在多种常见的恶性肿瘤中,SND1表达增加提示可能与肿瘤的发生关系密切。但是目前对于SND1影响胶质瘤细胞增殖和侵袭的具体机制研究报道较少。
本研究通过transwell,MTT,集落形成和原位肿瘤植入实验发现SND1是一个促进细胞增殖和侵袭的神经胶质瘤启动子。据报道SND1可以与组蛋白乙酰转移酶GCN5结合。有研究表明CCND1/CDK4和CCNE1/CDK2复合物是细胞G1/S相变和增殖的关键驱动因子,而CDKN1B是这两种复合物的抑制剂。实验通过敲除U118MG和患者来源的原代GBM细胞中的SND1,可显著降低RHOA,CCND1,CCNE1和CDK4的表达并增加CDKN1B的表达。然后使用cDNA微阵列筛选下游基因转录谱发现RHOA是和SND1关系最紧密的直接下游靶基因。证实了SND1通过促进GCN5与R1、R2位点结合,使RHOA上的组蛋白H3K9乙酰化和染色体空间构象发生改变从而促进RHOA转录,进而提高CCND1、CCNE1、CDK4的表达、降低CDKN1B的表达,进一步加速胶质瘤细胞从细胞周期的G1期向S期过渡,促进胶质瘤细胞增殖。
作者通过诱导组蛋白H3K9乙酰化和重组RHOA启动子的染色质构象,直接激活RHOA转录,揭示了SND1促进胶质瘤恶性进展的新机制。这为靶向治疗恶性胶质瘤提供了强有力的理论依据,并对胶质瘤的分类和治疗提供了良好的预测价值。

图1.SND1可促进神经胶质瘤中的RH0A和其他间接靶基因的表达
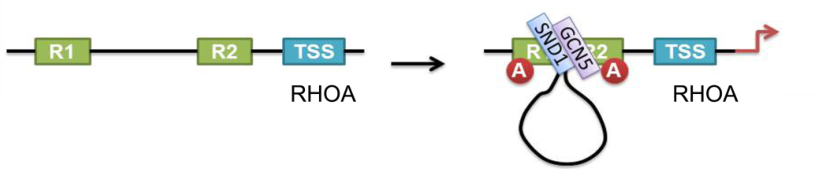
【杨远达、万大海】
4.TSPO-PET 和弥散加权MRI对浸润性人脑胶质瘤小鼠模型的成像研究
TSPO-PET and diffusion-weighted MRI for imaging a mouse model of infiltrative human glioma
Hayet Pigeon; Elodie A Pérès; Charles Truillet; Benoit Jego; Fawzi Boumezbeur ...
Neuro-Oncology, Volume 21, Issue 6, June 2019, Pages 755–764, https://doi.org/10.1093/neuonc/noz029
胶质母细胞瘤是最具破坏性的肿瘤,尽管使用多模式治疗,但大多数患者仍会复发,这通常是由于胶质瘤的高度侵袭性造成的。然而,胶质瘤浸润程度的检测仍然具有较高的挑战性。这项研究的目的是评估应用正电子发射断层扫描(PET)和磁共振成像(MRI)技术从而实现可视化肿瘤的生物活动和浸润程度。作者使用多模态成像研究了[18F] DPA-714(一种针对该模型的靶向转位蛋白18kDa(TSPO)的放射性示踪剂)、[18F] FET-PET、非高斯扩散MRI(ADC0,Kurtosis),以及S指数(一种复合扩散度量),用于检测人类侵袭性胶质瘤模型中的肿瘤浸润情况。活体实验成像结果通过放射自显影和免疫荧光证实。
结果发现,在胶质瘤细胞植入后7周开始,肿瘤对侧大脑半球[18F] DPA-714摄取比率增加(1.49±0.11),TSPO-PET观察到胶质瘤浸润到对侧半球的时间要比[18F] FET-PET提前两周。弥散加权成像(DWI)检测5周时带有胶质瘤半球和对侧半球之间的差异比标准T2WI更敏感,特别是峰度值方面。免疫荧光数据反应了活体实验成像结果。有趣的是,肿瘤和基质TSPO的标记表明肿瘤细胞主要表达TSPO。
这些结果表明,先进的PET和MRI成像方法,如[18F] DPA-714和DWI,在早期可视化胶质瘤生长和浸润可能优于标准成像方法。

图1:TSPO-PET信号与解剖T2WI的共同配准。A:在肿瘤发展第 5,7,9周时,(左)总和[18F] DPA-714 PET图像(30-60分钟 p.i.);(中)解剖TWI图像,白色箭头表示肿瘤细胞植入的针道;(右)融合[18F] DPA-714 PET/T2WI图像。B:对侧和同侧感兴趣体积的标准化摄取值的量化不同的成像点。

图2:携带浸润性神经胶质瘤的小鼠脑中的纵向DWI。A:ADC0、峰度和相对强度指标由非高斯扩散模型确定在不同的回波平面显象点。B:5周、7周和9周时同侧与对侧ADC0、峰度和相对强度指标的比较。
【孙毓奇、万大海】
5.胱硫醚:1p/19q共缺失胶质瘤MRS标记物
Cystathionine as a marker for 1p/19q codeleted gliomas by in vivo magnetic resonance spectroscopy
Francesca Branzoli; Clément Pontoizeau; Lucien Tchara; Anna Luisa Di Stefano; Aurélie Kamoun ...
Neuro-Oncology, Volume 21, Issue 6, June 2019, Pages 765–774, https://doi.org/10.1093/neuonc/noz031
选择合适的个体化的治疗方案对于胶质瘤患者预后至关重要,因胶质瘤的诊断及预后受益于分子标志物的诊断,目前染色体1p/19q共缺失被认为是有效的预测因子。
基于染色体1p/19q共缺失的胶质瘤患者有更好预后的背景,该实验研究1p/19q共缺失对于肿瘤细胞代谢的影响,并进一步评估个体化治疗代谢靶点的可能性。实验共纳入65例低级别胶质瘤患者,31例接受磁共振波普(MRS)检查,47例脑胶质瘤标本接受液相色谱-质谱(LC-MS)分析一系列氨基酸表达结果,33例采用定量聚合酶链反应分析基因表型,此外还在1p缺失的细胞模型中进行代谢失踪实验。实验证实,在IDH突变且1p/19q共缺失的胶质瘤患者体内检测到胱硫醚水平较非共缺失的患者及健康组织显著升高;定量聚合酶链反应分析显示,同IDH突变非1p/19q共缺失的胶质瘤相比,IDH突变1p/19q共缺失的胶质瘤中磷酸甘油酸脱氢酶(PHGDH)和胱硫醚γ裂解酶(CTH)表达均降低40-50%,因此其易受丝氨酸及谷胱甘肽耗竭的影响。
实验通过MRS检测到胱硫醚存在于1p/19q胶质瘤患者体内及脑组织样本中,且存在选择性积累现象,其被肿瘤标本体外代谢组学分析所证实。本研究开辟了无创研究癌症特征性代谢的可能性,使胱硫醚可作为1p/19q共缺失患者个体化治疗的候选标志物。

图1.胱硫醚的体内检测

图2.参与谷胱甘肽合成的胱硫醚及其代谢物
【杨钰桢、万大海】
REST-DRD2 mechanism impacts glioblastoma stem cell–mediated tumorigenesis
Anantha L Marisetty; Li Lu; Bethany L Veo; Bin Liu; Cristian Coarfa ...
Neuro-Oncology, Volume 21, Issue 6, June 2019, Pages 775–785, https://doi.org/10.1093/neuonc/noz030
GBM是颅内常见高恶性异质性肿瘤,其内在机制仍未完全明确。既往研究已经发现转录抑制子REST(抑制元件1-沉默转录因子,repressor element-1 silencing transcription factor)的表达水平可以调节GBM干细胞(GSCs)的致癌潜能。但是REST如何实现这一调控仍未可知。Anantha L. Marisetty等确定两株独立的高REST表达GSC细胞株(HR),全基因组转录组分析及DNA结合分析提示神经递质信号的主要调节基因,多巴胺受体D2(dopamine receptor D2, DRD2)基因是REST的直接靶基因。分子生物学分析及鼠颅内原位移植瘤实验结果证实,DRD2是REST调节肿瘤发生的一个直接下游靶基因,其作用至少部分是通过调节凋亡和侵袭实现的。此外,分析TCGA的GBM数据库,提取154例GBM患者的RNA序列进行分析,笔者认为可根据REST、DRD2水平将GBM进行分层,存在高REST/低DRD2(HRLD)和低REST/高DRD2(LRHD)这两种亚型分类,这种分类与既往TCGA的GBM亚型分类(神经元型、前神经元型、间质型、经典型)截然不同。利用DESeq2软件包进行两组之间的差异分析,得到5731个差异表达基因,对差异表达基因进行富集分析,发现两组间存在差异化的分子亚型。GSEA分析提示两亚型间存在显著区别的特异性基因富集和生物学通路。TCGA数据库分析发现两亚型之间的OS、PFS没有差异,但是年龄分布存在显著差异,HRLD61.6岁vs LRHD54.6岁(P=0.033)。这些结果提示REST通过DRD2调节HR-GSCs内的神经递质信号通路,从而影响GSCs的肿瘤发生过程。GBM可能存在REST-DRD2分类模式,分出HRLD和LRHD两种亚型。
【潘灏】
PEDIATRIC NEURO-ONCOLOGY
1.在DIPG中抑制PPM1D突变,可增强放疗诱导的DNA损伤反应和增殖抑制作用
Inhibition of mutant PPM1D enhances DNA damage response and growth suppressive effects of ionizing radiation in diffuse intrinsic pontine glioma
Mwangala Precious Akamandisa; Kai Nie; Rita Nahta; Dolores Hambardzumyan; Robert Craig Castellino
Neuro-Oncology, Volume 21, Issue 6, June 2019, Pages 786–799, https://doi.org/10.1093/neuonc/noz053
【潘灏】
2.透明隔胚胎发育不良性神经上皮瘤(DNET):临床、影像、病理及分子分型分析
Neuro-Oncology, Volume 21, Issue 6, June 2019, Pages 800–808, https://doi.org/10.1093/neuonc/noz037
Prospective, longitudinal comparison of neurocognitive change in pediatric brain tumor patients treated with proton radiotherapy versus surgery only
Lisa S Kahalley; M Douglas Ris; Anita Mahajan; M Fatih Okcu; Murali Chintagumpala...
Neuro-Oncology, Volume 21, Issue 6, June 2019, Pages 809–818, https://doi.org/10.1093/neuonc/noz041
Targeted copy number analysis outperforms histologic grading in predicting patient survival for WHO grades II/III IDH-mutant astrocytomas
Patrick J Cimino; Eric C Holland
Neuro-Oncology, Volume 21, Issue 6, June 2019, Pages 819–821, https://doi.org/10.1093/neuonc/noz052
自实施世界卫生组织(WHO)通过异柠檬酸脱氢酶(IDH)突变类型划分II/III级星形细胞瘤以来,原有的组织学分级方案无法为IDH突变的星形细胞瘤提供预后信息,而IDH突变的星形细胞瘤是星形细胞瘤的主要组成部分。作为组织学分级的替代选择,我们及他人团队已证明全染色体和全基因组水平相结合的体细胞拷贝数变化(SCNAs)可预测生存。我们团队利用TCGA数据库数据分析发现IDH突变星形细胞瘤可以分为三个不同的SCNA亚型(由CDKN2A缺失,CDK4扩增,和14或14q染色体缺失决定),这是独立于WHO(II-IV)的分级:M1(最差生存),M2(较差生存)和M3(良好生存)。虽然这些SCNA亚型在德国胶质瘤网络(GGN)中的一大批胶质瘤患者中得到了验证,但在较低级别的WHO II/III级IDH突变型的星形细胞瘤中尚未得到验证。考虑到组织学分级在IDH突变的星形细胞瘤类型划分中缺乏说服力,我们在WHO II/III级IDH突变星形细胞瘤的机构队列中确认了SCNAs分级方法的有效性。
研究性文件回顾记录了2000年至2010年间切除的一组新诊断的WHO II/III级弥漫性胶质瘤患者(n=178)(人类受试者的使用经由华盛顿大学机构审查委员会批准)。纳入标准要求患者至少在5年的临床随访中没有复发或早期死亡(n=109)。对提取的DNA样本使用InfiniumR EPIC甲基化检测方法进行全基因组甲基化分析(n=66)。通过对IDAT文件进行分析(https://www.molcularneuropathology.org),将弥漫性胶质瘤分为以下三个类别之一:星形细胞瘤IDH-野生型, WHO II/III级(n=7);星形细胞瘤IDH突变体,WHO II/III级(n=34); 以及少突胶质细胞瘤IDH突变体和1p19q共缺失,WHO II/III级(n=25)。IDH突变的星形细胞瘤进一步通过WHO组织学分级分析,并提议划分SCNA分子亚型。在本队列中,,组织学分级与以往报道一致,无法对患者无进展生存期(P=0.349)或总体生存期(P=0.139)进行预测。然而,对SCNA M1-M3亚型的评估与TCGA数据库类似,可为该研究队列的无复发(P=0.0044)和总体生存率(P<0.0001)提供了预测信息。SCNA亚型依据其组成成分被进一步细分。CDKN2A缺失与较差的总体生存率相关(P=0.0136),但与无进展生存无关(P=0.146)。CDK4扩增与无进展生存(P=0.722)及总体生存(P=0.587)均无相关性。14号染色体缺失提示无进展生存期较差(P=0.0044),但与总体生存期无明显相关性(P=0.237)。总体而言,CDKN2A缺失、CDK4扩增和染色体14缺失的组合为世卫组织II/III级IDH突变的星形细胞瘤提供了实用的预后预测信息,而组织学分级不能在此充分预测预后。
在分子诊断时代,随着弥漫性胶质瘤分类的完善,分级可能包含除IDH突变状态以外的分子特征。通过SCNAs(如cdkn2a缺失)对IDH突变的星形细胞瘤进行分层,无论是否有额外的遗传/染色体标记都可以作为分子分级的基础。在识别侵袭性IDH突变星形细胞瘤时,测定SCNAs可能比通过有丝分裂活性分级更具有一致性和可重复性,从而降低观察者间神经病理诊断和临床风险分层的变异性。IDH突变的星形细胞瘤的SCNAs亚型对临床试验的注册也有重要意义。我们的研究小组之前已经表明,相对于大量的普通人群,IDH野生型胶质母细胞瘤的SCNAs亚型在医学和外科试验群体中分布不均匀,这对试验的注册具有一定的影响。因此,有必要将SCNAs分析纳入IDH突变的星形细胞瘤的临床试验中,以确保分子亚型在治疗组间的均匀分布,从而使临床试验结果具有普遍性,并确定亚型特异性治疗策略。
Sustained imaging response and hearing preservation with low-dose bevacizumab in sporadic vestibular schwannoma
Matthias A Karajannis; Mari Hagiwara; Mark Schreyer; Sofia Haque
Neuro-Oncology, Volume 21, Issue 6, June 2019, Pages 822–824, https://doi.org/10.1093/neuonc/noz051
贝伐珠单抗对2型神经纤维瘤病(NF2)相关前庭神经鞘瘤(VS)的亚群患者具有缩小肿瘤体积和改善听力的作用。近期前瞻性临床试验数据显示,NF2-VS患者的影像学和听力反应应答率分别为57%和36%,且停药后治疗效果无法维持。目前尚不清楚是否散发VS也可能对贝伐珠单抗有反应。
我们报道了一位进展期散发VS的成年女性对低剂量贝伐珠单抗的持续治疗反应。她在47岁时因跌倒后进行了脑部核磁共振成像检查,结果显示为右侧桥小脑角占位,考虑诊断为VS。她的既往病史与儿童早期的左耳失聪,这可能与腮腺炎或使用耳毒性抗生素有关。初期影像学检查显示VS进展缓慢,随后发展为进行性脑积水,需要行脑室-腹腔分流术。考虑到存在完全失聪的风险,她拒绝接受手术或放疗来治疗她的进行性VS。在充分知情同意后,她开始每2周接受一次10mg/kg剂量的贝伐珠单抗治疗。
治疗评估包括先前描述的使用MRI进行脑肿瘤体积测量,以及听力图。在治疗前,肿瘤大小为8.56ml,右耳听力基本正常。她对治疗有很好的影像学应答,随后逐步将BEV降低至2.5mg/kg每4周一次的低剂量来限制毒性风险并维持治疗效果。她对治疗耐受性良好,无高血压或蛋白尿等贝伐珠单抗相关毒性。最近一次测量的肿瘤体积测量为2.76ml,比前期基线数据缩小67.8%。目前,她已接受33个月以上的治疗,没有任何贝伐珠单抗相关毒性的证据,并保持右耳听力正常。
弥散加权成像计算的平均表观扩散系数(ADC)显示在基线时为1267 mm2/s,治疗2个月后降至1050mm2/s,较基线数据降低了17.1%。在基线时升高的ADC值在治疗过程中下降已经被证明与NF2-VS对贝伐单抗的影像学应答和听力反应相关。
根据我们的观察得出以下结论:偶发的VS可能对贝伐珠单抗治疗有高度的反应。因此,在权衡相关的短期和长期风险以及成本后,贝伐珠单抗可以作为一种新的、有效的治疗方案来作为部分不适合接受手术或放疗在内的标准治疗的偶发VS患者的一种选择。此外,对这一患者群体的前瞻性临床研究是必要的。






