今天为大家带来的是,由空军军医大学唐都医院王樑副教授、复旦大学附属华山医院陈灵朝博士整理汇编的“《神外资讯》2018年鉴(IV):脑胶质瘤相关研究最新进展(下)”,承接上篇脑胶质瘤相关研究最新进展(上)欢迎观看、阅读!
四、胶质瘤治疗新技术
01
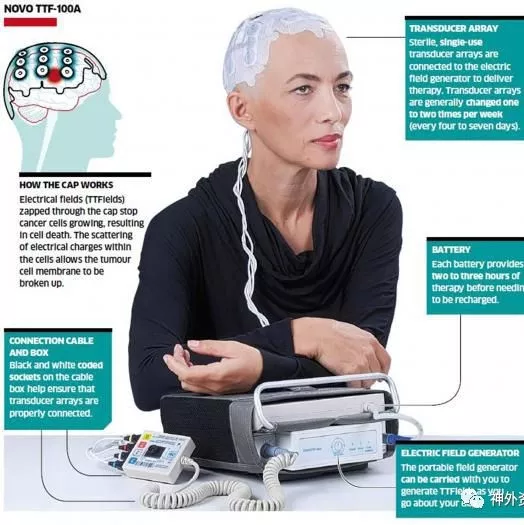
肿瘤治疗电场联合替莫唑胺治疗胶质母细胞瘤
编译 | makaay
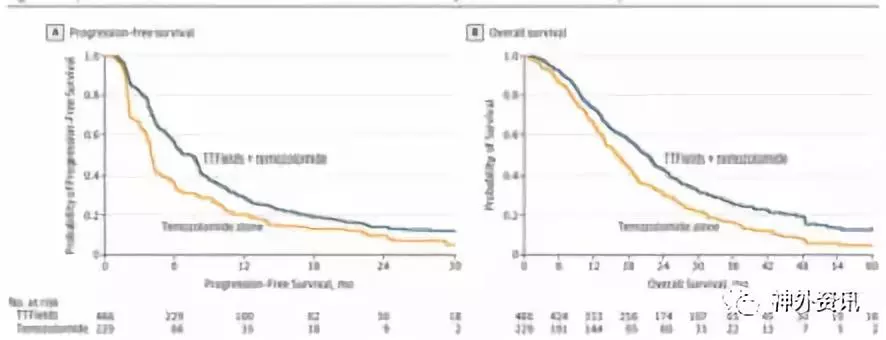
肿瘤治疗电场(tumor-treating fields,TTFields)是一种抗肿瘤细胞有丝分裂的治疗仪,通过置于头皮的换能器芯片提供低强度的中频(200kHz)交变电场,从而选择性影响分化的胶质母细胞瘤(GBM)细胞,导致肿瘤细胞有丝分裂停滞,促使快速分裂的细胞凋亡。美国西北大学Robert H. Lurie综合癌症中心Lou和Jean Malnati脑肿瘤研究所的Roger Stupp等开展一项多中心研究,评估TTFields联合替莫唑胺化疗疗效。该研究包括TTFields联合替莫唑胺化疗组(联合组)466例和单一替莫唑胺化疗组(单药组)229例。随访后联合组PFS中位数6.7个月,单药组4.0个月(HR=0.63;95% CI,0.52-0.76;P<0.001)。联合组OS中位数20.9个月,单药组16.0个月(HR=0.63;95% CI,0.53-0.76;P<0.001)。对年龄、性别、Karnofsky表现评分、MGMT启动子甲基化状态、肿瘤位置或切除范围等进行亚组分析,TTFields联合替莫唑胺化疗提升各亚组患者的PFS和OS。联合组患者的全身不良并发症发生率为48%,单药组为44%。联合组患者52%发生轻度至中度的皮肤毒性反应,而单药组患者无1例出现皮肤毒性反应(图2、表1)。
因此作者指出,在术后标准化放化疗的胶质母细胞瘤患者随机临床试验的最后阶段,采用TTFields联合替莫唑胺化疗,与单一替莫唑胺化疗相比,前者的无进展生存期和总生存期获得显著改善。
02
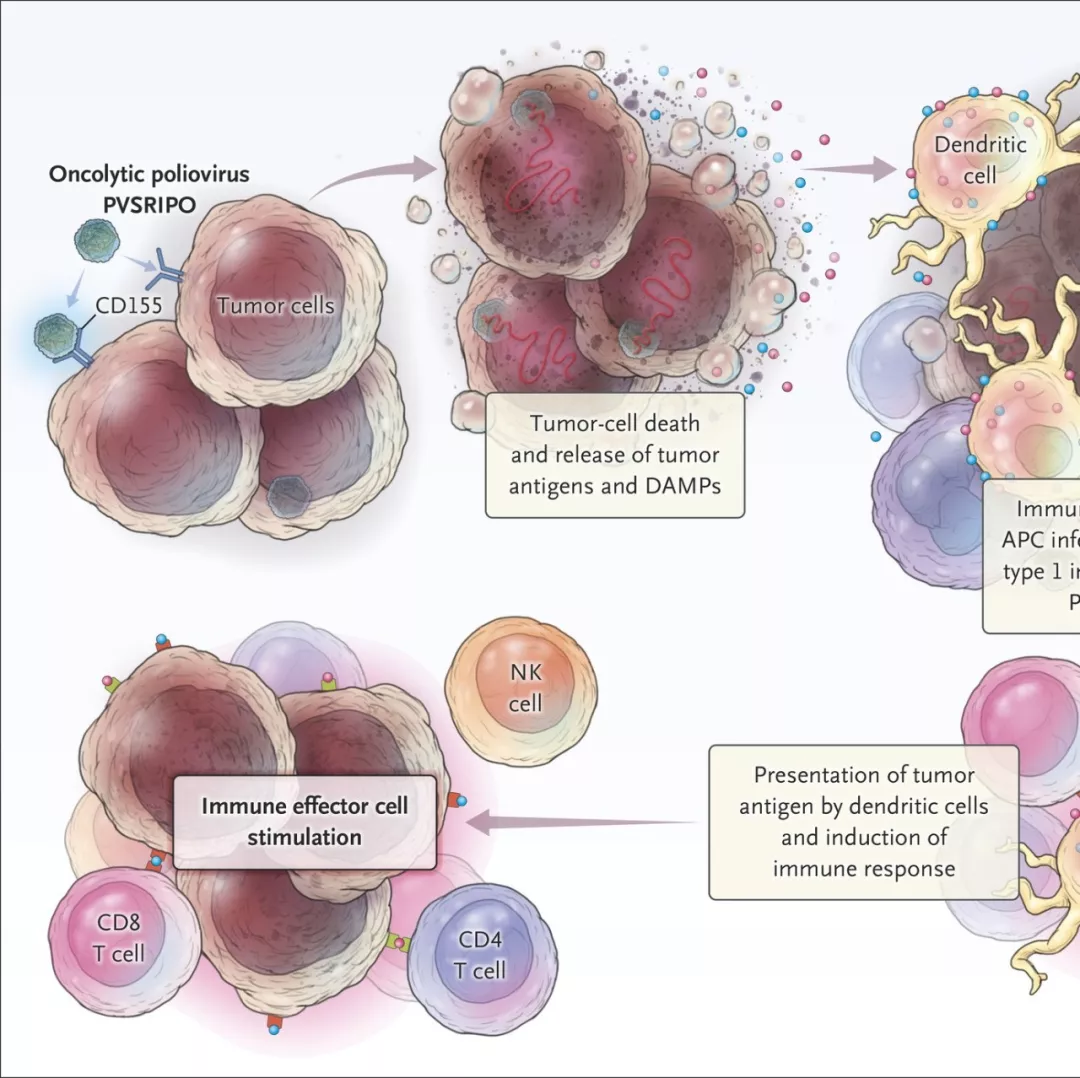
重组脊髓灰质炎病毒治疗复发胶质母细胞瘤
编译 | makaay
脊髓灰质炎病毒是单链含RNA的小核糖核酸病毒,没有包膜,可在被感染的细胞中复制,并能破坏被感染的细胞。该病毒具有嗜神经性,能通过在胶质母细胞瘤上表达增加的受体-CD155进入细胞。美国杜克大学医学中心神经外科的Annick Desjardins等采用基因编组技术开发靶向胶质细胞瘤的脊髓灰质炎病毒PVSRIPO治疗幕上复发胶质母细胞瘤。该研究纳入经组织病理学检查诊断为有可测量病灶、肿瘤增强部分≥1cm、最大维度≤5.5cm的61例成人幕上复发GBM患者。
作者将剂量-1(5.0×107TCID 50)定为剂量递增阶段的初始剂量。在此阶段,研究者观察到剂量限制性毒性作用,即给药剂量为5(1010TCID50)的患者在给药导管拔除后立即出现4级颅内出血。在剂量扩张阶段,19%患者有3级或以上与PVSRIPO相关的不良并发症。接受PVSRIPO治疗的患者在36个月时总体生存期达到21%(95% CI,11~33个月),对照组仅为4%。93%以上的毒性属于1级或2级。在10%以下患者中观察到偏瘫、头痛和癫痫发作等的3级毒性反应。
通过该项研究作者证实在WHO IV级的复发恶性胶质瘤患者中,PVSRIPO的瘤内输注治疗不会造成神经毒性。接受PVSRIPO免疫治疗患者在24和36个月时的生存率显著高于对照组。溶瘤病毒在初步的临床试验中显示良好的疗效,但方法上仍然存在某些问题,但是这种方法展现出的效果是值得进行深入研究的。
03
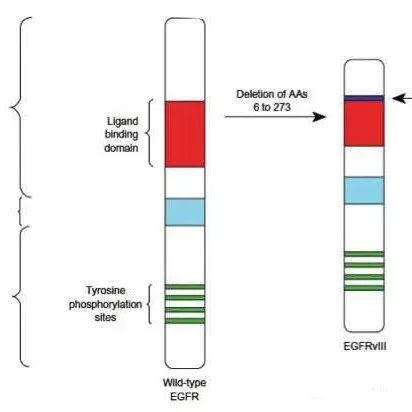
肽类肿瘤疫苗Rindopepimut治疗GBM无效
编译 | Neuroscience
胶质母细胞瘤(GBM)恶性程度高,20%-30%胶质母细胞瘤伴发EGFRvIII突变,其独特的免疫原性促使Rindopepimut(又名CDX-110,肽类肿瘤疫苗)的产生。瑞士苏黎世大学神经和肿瘤学系的Michael Weller等开展随机、双盲的Ⅲ期ACT IV试验,试验入选745例新诊断的表达EGFRvIII的胶质母细胞瘤患者,接受最大限度手术切除和放化疗。其中405例为微小残留病灶(minimal residual disease,MRD),即经放化疗肿瘤强化灶<2cm2;338例为显著残留病灶(significan residual disease,SRD),即经放化疗肿瘤强化灶≥2cm2。MRD组中,195例患者接受Rindopepimut+替莫唑胺治疗,另外210例接受对照剂+替莫唑胺治疗;总生存期为20.1个月比20个月(p=0.93),无进展生存期为8个月比7.4个月(p=0.91)。SRD组中,175例患者接受Rindopepimut+替莫唑胺治疗,另外163例接受对照剂+替莫唑胺治疗;总生存期为14.8个月比14.1个月(p=0.066),无进展生存期为3.7个月比3.7个月(p=0.28)。意向性治疗人群中,371例患者接受Rindopepimut+替莫唑胺治疗,374例患者接受对照剂+替莫唑胺治疗;总生存期为17.4个月比17.4个月(p=0.22),无进展生存期为7.1个月比5.6个月(p=0.51)。
该研究表明在目前的标准化疗方案上,增加Rindopepimut不能延长新发的EGFRvIII型胶质母细胞瘤患者的生存时间。
04
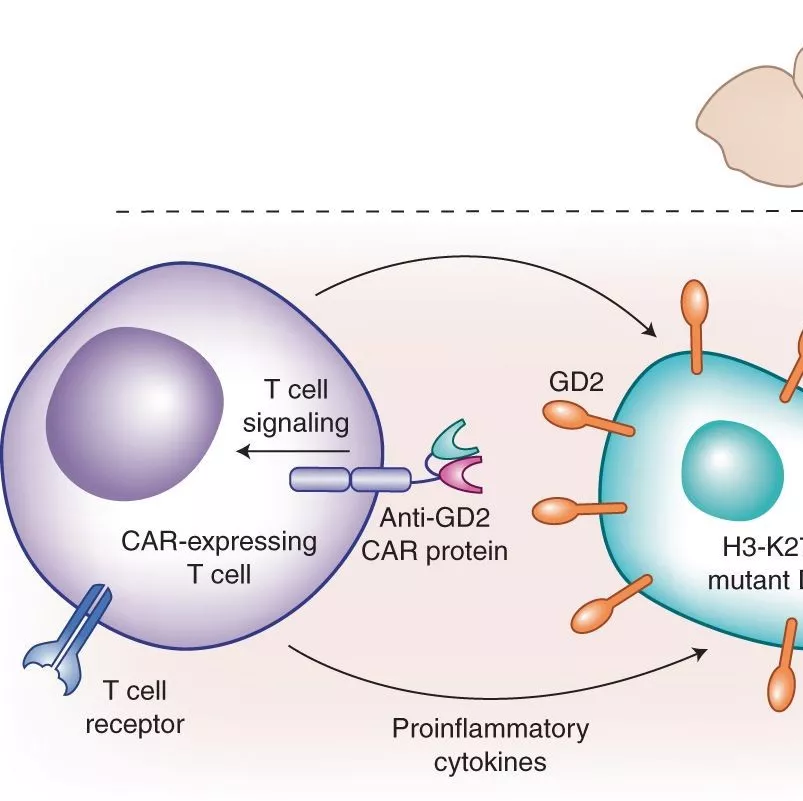
抗GD2-CAR-T细胞治疗H3-K27M阳性的弥漫中线胶质瘤
编译 | makaay
弥漫性原发性桥脑胶质瘤(diffuse intrinsic pontine glioma,DIPG)和其它弥漫性中线胶质瘤(diffuse midline gliomas,DMGs)是致命的儿童中枢神经系统恶性肿瘤。几乎所有DMG内存在的组蛋白H3.1和H3.3的N-末端尾部残基27(K27M)赖氨酸被甲硫氨酸取代。美国斯坦福大学医学院神经科的Christopher W. Mount等筛查携带H3-K27M突变体的6例患者的异种移植模型(PDX)和无突变模型的细胞表面抗原,发现H3-K27M突变体模型中二唾液酸神经节苷脂GD2高表达。并制作抗GD2-CAR-T细胞评估GD2在H3-K27M突变体DMG中的作用。这些细胞表现为含有H3-K27M突变体细胞肿瘤的显著活性。然后在体内用抗GD2 CAR-T细胞治疗H3-K27M突变体异种移植模型;发现在这些模型中用抗GD2-CAR-T细胞治疗后的肿瘤体积显著缩小,但用CD19-CAR-T细胞治疗的对照组小鼠无反应。此外,使用CAR-T细胞治疗后7天,在小鼠软脑膜中有CAR-T细胞浸润,显示其可以通过血脑屏障。
因此,该研究发现在PDX模型中,使用抗GD2-CAR-T细胞后肿瘤体积显著缩小;在免疫缺陷小鼠中,几乎可以根除所有H3-K27M突变体肿瘤细胞和延长小鼠存活时间。该研究实验结果,非常值得在人类实体肿瘤中进行相应的临床研究,以进一步得到验证。
05
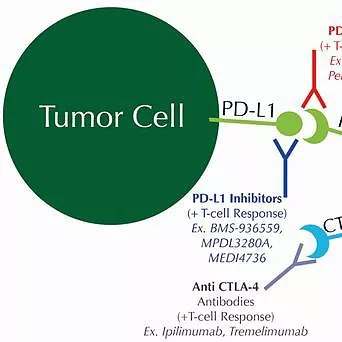
抗PD-1结合贝伐单抗治疗HGGs患者的预后
编译 | 王承斌
美国纽约大学朗格尼医学中心劳拉和艾萨克珀尔穆特癌症中心的Sylvia C. Kurz等开展应用程序性细胞死亡蛋白1(programmed cell death protein1,PD-1)--抑制抗体nivolumab或pembrolizumab联合或不联合贝伐单抗(bevacizumab),进行复发性高级别胶质瘤(recurrent high-grade gliomas,HGGs)挽救性治疗的单中心回顾性研究。
研究人员对31例HGGs成年患者实施PD-1抑制抗体nivolumab或pembrolizumab联合或不联合贝伐单抗的治疗方案,其中部分患者先前接受过贝伐单抗治疗。具体用药为:nivolumab,每三周2mg/kg或pembrolizumab,每两周3mg/kg联合贝伐单抗,每两周10mg/kg或不联合。分别对nivolumab±贝伐单抗和pembrolizumab±贝伐单抗的临床疗效和影像学表现进行评估。
结果显示,应用首次抗PD-1剂量(first anti–PD-1 dose)治疗,患者总体的中位无进展生存期(mPFS)3.2个月(95% CI,2.2-4.2);其中,nivolumab治疗的mPFS为3.8个月(95% CI,1.7-5.8),pembrolizumab治疗的mPFS为2.3个月(95% CI,1.7-2.8),二者相比,mPFS无显著性差异(P=0.08)。入组前经贝伐单抗治疗的mPFS为3.2个月(95% CI,2-4.3)与未接受过贝伐单抗治疗的mPFS为3.7个月(95% CI,0-7.9),mPFS也无有显著性差异(P=0.3)。应用首次抗PD-1剂量的患者中位生存期为6.6个月(95% CI,4.2-9.1)。
作者认为,应用nivolumab或pembrolizumab联合或不联合贝伐单抗的挽救治疗复发性HGGs患者,未能获得改善生存率的疗效。
06
联用贝伐珠单抗未改善复发胶质瘤的预后
编译 | 王承斌
荷兰鹿特丹Erasmus MC癌症研究所脑肿瘤中心的Martin J van den Bent等对贝伐珠单抗治疗首次复发的WHOⅡ级和Ⅲ级胶质瘤的随机、开放标签的Ⅱ期临床试验(TAVAREC)的数据整合分析。TAVAREC临床试验由欧洲癌症研究和治疗协作组于2011年2月发起,在欧洲32个医疗中心开展,主要研究对象是诊断为无1p/19q共缺失的复发WHOⅡ级和Ⅲ级胶质瘤患者,其中包括首次复发、放化疗后经MRI增强明确的复发病例。研究中心网站将患者随机分为两组,并根据肿瘤组织学分级、患者身体状态以及之前所接受的治疗类型进行分层。其中1组患者在疾病没有进展及未发生不可接受的毒副作用的情况下,每一周的前1-5天口服替莫唑胺,28天为一个周期,重复12个周期。2组患者替莫唑胺的用法用量和1组相同,只在每个周期的第1和15天附加静滴超过90min的贝伐珠单抗。研究发现1组77例替莫唑胺单药治疗,总生存人数为72例,其中完成整个治疗过程44例。2组78例替莫唑胺和贝伐珠单抗联用治疗。1年总生存人数为69例,完成整个治疗过程38例。
治疗过程中出现的主要毒副作用,如血液系统毒性、神经系统毒性、乏力、恶心和感染等发病率2组高于1组。2组中1例患者出现严重的血小板减少症死于感染后的瘤内出血。Kaplan-Meier生存分析发现加用贝伐珠单抗对患者生存率和生存质量无改善作用,而且产生毒副作用的风险更高。
07
贝伐单抗治疗初发儿童高级别胶质瘤无效
编译 | Neuroscience
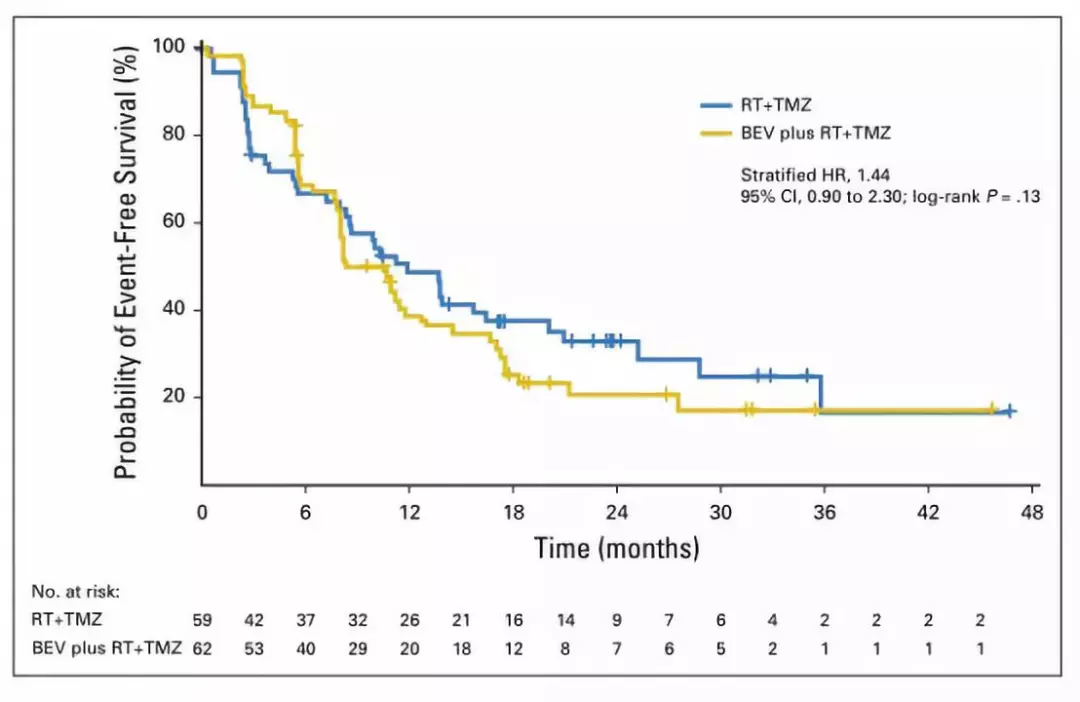
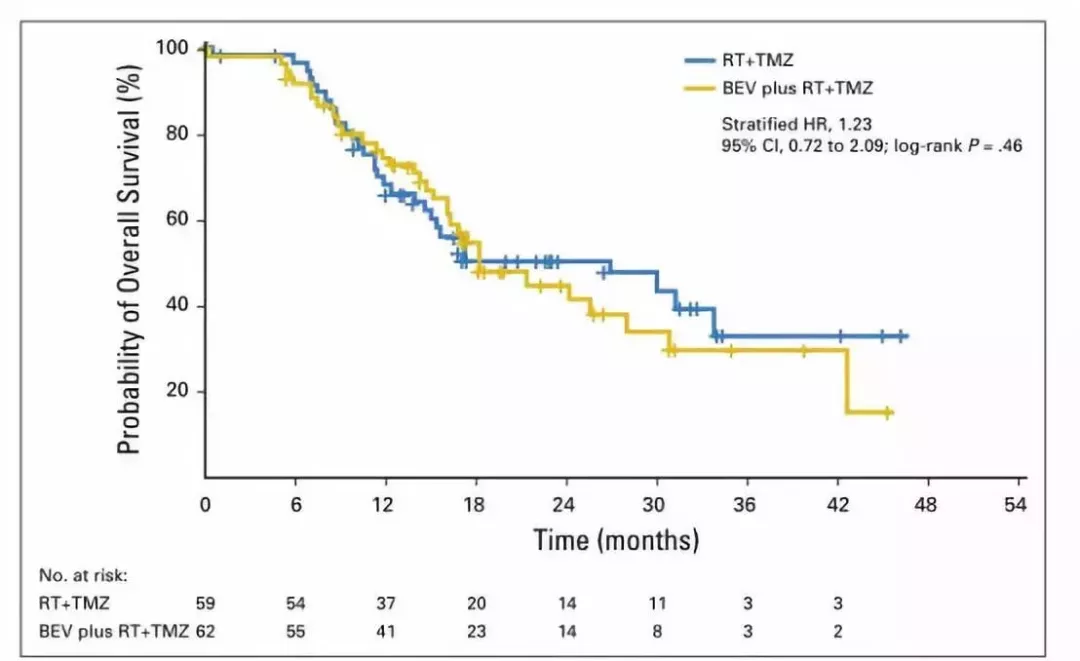
高级别胶质瘤(high-grade gliomas,HGG)是儿童中枢神经系统恶性肿瘤中最常见的一类。尽管手术切除后辅助放化疗,儿童HGG预后仍然很差。法国古斯塔夫·鲁西研究所 的Jacques Grill 等观察儿童HGG患者术后辅助放化疗的同时给予BEV治疗的疗效。该研究纳入121例儿童HGG患者,术后59例分入放疗加替莫唑胺(RT+TMZ)组,62例至RT+TMZ+BEV组。临床治疗最终结果为无事件生存(event-free survival,EFS),通过影像学科医生双盲判定。结果显示,RT+TMZ组的EFS为11.8个月,RT+TMZ+BEV组的EFS为8.2个月,两组间无统计学差异(p=0.13)(图1);同时,两组间总生存期亦无统计学差异(p=0.46)(图2)。但是,不良事件发生率RT+TMZ+BEV组高于RT+TMZ组。
作者认为,对于初发儿童高级别胶质瘤患者,RT+TMZ治疗方案中增加BEV并不能改善EFS。
五、胶质瘤发生发展机制及分型治疗
01
GBM起源于室管膜下区的基因突变细胞
编译 | Neuroscience
胶质母细胞瘤(GBM)是侵袭性极强和无法治愈的恶性脑肿瘤,总体生存期中位数15个月。驱动GBM发生的突变起源细胞可能是疾病进展的基础,也是开发治疗新手段的方向。韩国首尔科学技术研究院医学工程学院的Joo Ho Lee等通过基因工程GBM小鼠模型和单细胞测序等方法,在体外和体内实验研究带有GBM特征的突变起源细胞。发现56.3%IDH野生型GBM患者,其远离肿瘤的正常SVZ组织含有低水平的GBM驱动突变基因,低于突变负荷的1%,包括EGFR突变和TERT启动子突变基因等;该驱动突变基因在相应匹配的GBM中高水平表达。随后,研究者对SVZ中神经干细胞的p53、PTEN和EGFR等基因通过基因编辑手段使其突变,模拟人体低水平驱动突变的情况,亦得出同样结果。此外,通过对GBM患者以及小鼠模型的研究,发现SVZ中携带驱动突变基因的神经干细胞,从SVZ迁移至大脑远隔区域,并导致恶性胶质瘤在远隔区域发生,67%的神经胶质瘤发生在远离突变SVZ的大脑区域。研究者进一步通过单细胞测序分析,确定SVZ中具有驱动GBM发生的突变基因细胞的类型,大部分是GFAP阳性的星形胶质细胞样神经干细胞。
02
以基因分型为靶向的胶质瘤局部治疗
编译 | 王承斌
为提高对IDH突变型胶质瘤的局部控制,同时避免代谢治疗相关的全身毒性,美国哈佛大学麻省总院的Ganesh M. Shankar等研究一种术中快速检测基因分型结合应用IDH靶向的烟酰胺磷酸核糖转移酶(NAMPT)抑制剂(GMX-1778)缓释微粒(MP),借助基因特异性精准地控制胶质瘤,并降低GMX-1778 MP全身毒性的新治疗方法。作者一方面采取局部注入药物避免全身系统用药所引起的全身毒性,又解决血脑屏障拦截药物渗入的问题。另一方面开发一种基于q-PCR和利用Taqman标记的探针对突变位点进行荧光检测的快速分子诊断技术。最后在荷瘤小鼠实验模型中,应用携带靶向药物的缓释微粒注入脑内肿瘤中,经生物素荧光成像系统检测,与注入无靶向药物微粒的对照组相比,发现实验组小鼠脑内胶质瘤体积明显缩小,生存期显著延长。作者指出,胶质瘤手术过程中快速基因分型诊断结合针对IDH突变基因的靶向治疗具有临床应用前景,但还需在大型动物体内的实验验证,才能保证其安全有效地造福患者。
03
儿童低级别胶质瘤分子病理学分级
编译 | 张振宇
香港中文大学威尔士亲王医院解剖和细胞病理学科的Rui Ryan Yang等该研究纳入289例18岁以下的低级别胶质瘤患者,分别对肿瘤标本进行TERT启动子、H3F3A、BRAF V600E突变、MYB扩增、KIAA1549-BRAF融合、CDKN2A缺失和ATRX丢失的检测,并进行单因素和多因素生存分析。研究发现,有TERT启动子突变、H3F3A突变和ATRX丢失的患儿预后最差。相反,有BRAF融合和MYB扩增的患儿预后明显较好。
研究者对有完整的分子病理学数据的263例患儿进行综合分级,分为低危组(n=114)、Ⅰ度中危组(n=35)、Ⅱ度中危组(n=78)和高危组(n=36)。低危组包含BRAF融合MYB扩增;Ⅰ度中危组包含BRAF V600E或CDKN2A缺失;Ⅱ度中危组不包括上述分子病理学改变;高危组包括TERT启动子突变或H3F3A突变或ATRX丢失(图1)。通过单因素生存分析发现,不同风险等级组患儿预后有明显差异;通过多因素生存分析确认,该分子病理学分型系统是PLGG的一个独立预后因素。
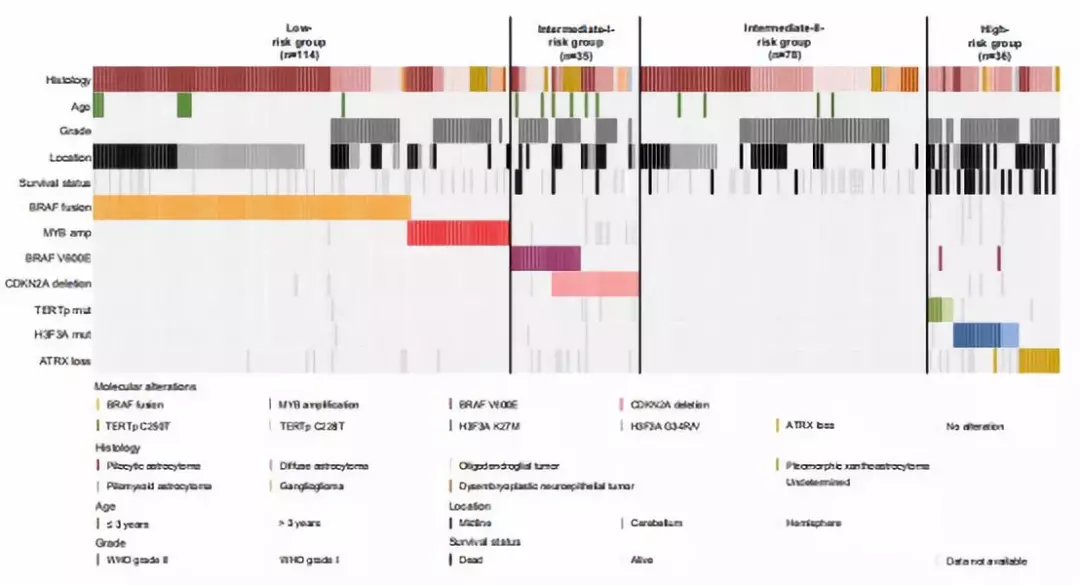
图1. 四种危险程度分级的PLGG患儿年龄、肿瘤部位及分子病理学情况。
该研究首次根据最新分子病理学进展,通过分子标志物对大样本PLGG进行分级(图2);该风险分层,在临床上对确定PLGG的诊疗策略具有重要意义。
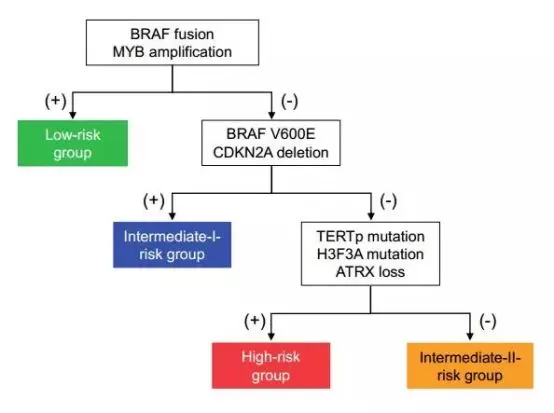
图2. 儿童低级别胶质瘤临床诊疗风险分级模型。
04
IDH1突变诱导星形细胞恶变及胶质瘤发生
编译 | Neuroscience
约70%-80%的弥漫性星形细胞瘤存在IDH1突变,而其中90%患者为IDH1R132H突变。美国盐湖城犹他大学健康科学中心亨茨曼癌症研究所的Beatrice Philip等发现,单纯IDH1R132H本身并不足以诱导星形细胞恶变及胶质瘤发生,但当细胞处于PDGFA扩增及Cdkn2a、ATRX和PTEN敲除环境时,IDH1R132H可以促成神经胶质瘤的生成和缩短实验动物生存期。这些肿瘤在表观遗传学上类似人类IDH1突变型胶质瘤,表现为2-HG含量升高,5hmc含量降低,全基因组高甲基化改变。此外,这些肿瘤也符合人类胶质瘤的IDH1突变与分子分型(即原神经型)的关系。
该研究结果支持IDH1突变促成神经胶质瘤发生的假说,阐述IDH1突变驱动神经胶质瘤发生发展的生物学机制,有助于探讨针对致命的神经胶质瘤的治疗策略。
05
对家族性胶质瘤基因和发病机制的研究进展
编译 |王承斌
散发性胶质瘤有特征性基因组表现,通过分子学和临床特点可进一步细分成独特的亚型。仅5%-10%原发性胶质瘤具有家族性,对于家族性胶质瘤的分子学特征还知之甚少。美国休斯顿贝勒医学院和安德森癌症研究中心的Daniel I. Jacobs等对具有胶质瘤家族史的163例肿瘤标本进行分子分型;同时整合生殖细胞和体细胞的基因组数据,对其中20例胶质瘤患者的发病机制作详细的描述。与散发胶质瘤相比,分析所得的特征突变都与调节端粒长度的基因相关,所有突变都涉及shelterin复合体基因POT1或TERF2,TERT基因启动子中的活化突变(TERTp),或ATRX中功能突变的丧失。
该研究表明,家族性胶质瘤的分子特征在很大程度上覆盖散发性胶质瘤,而且生殖细胞和体细胞分子特征都涉及胶质瘤形成的核心途径。通过该项样本量小的研究,依然可以对一系列病例整合多个生殖细胞和体细胞的分子遗传学数据,为胶质瘤的发病机制提供独特的视角。根据核心通路的基因富集程度,指导未来的测序工作,可集中信号通路,确定与胶质瘤具有相关性的生殖细胞中的突变频率。明确胶质瘤发病的遗传因素,有助于开辟新的靶向治疗途径。
六、胶质瘤基础研究与转化
01
单细胞测序分析GBM的侵袭性特征
编译 | mackaay
胶质母细胞瘤(GBM)是成人最常见的原发性恶性脑肿瘤,由于肿瘤核心外的侵袭性细胞通常不受局部治疗的影响,其弥漫性生长而难以治愈。以往研究表明,GBM存在异质性。目前仍缺乏GBM单细胞水平的研究,缺乏肿瘤微环境中神经元、小胶质细胞、免疫细胞和血管细胞之间的相互作用的研究。美国斯坦福大学生物工程学和应用物理学的Spyros Darmanis等对4例IDH1阴性的原发性GBM进行单细胞RNA测序(RNA-seq),作者使用DESeq2算法得出了22种在侵袭性肿瘤细胞的高表达基因。作者对肿瘤中浸润的免疫淋巴细胞进行分析发现,巨噬细胞或小胶质细胞可分布在瘤周也可在肿瘤核心,提示髓系来源的细胞亚群在肿瘤核心区内外的存在差异。炎症相关标志物在瘤周表达更多,而血管形成相关因子在肿瘤核心区表达更多。该研究揭示GBM单细胞的转录组表达情况,提供肿瘤发生、肿瘤侵袭以及肿瘤细胞与免疫系统之间相互作用的大量信息。
02
供脑肿瘤研究的3D类器官培养技术
编译 |王承斌
恶性脑肿瘤的研究受制于基因组的变异和遗传异质性,同时也受到实验模型欠缺的影响。3D类器官培养技术为建立脑肿瘤模型开拓新方向。
最近,奥地利维也纳科学研究院分子生物技术研究所(IMBA)的Shan Bian等报道,该研究所Jürgen A. Knoblich教授领衔的团队创建肿瘤性大脑类器官(neoplastic cerebral organoid,neoCOR)的3D体外实验模型,通过转位因子系统(transposable element system)和CRISPR-Cas9(Clustered Regularly Interspaced Short Palindromic Repeats-Cas9)系统在类脑器官中引发致癌突变,演绎由驱动突变介导的脑肿瘤发生过程。研究人员筛选癌症基因组中与临床恶性脑肿瘤相关的突变基因,获得胶质母细胞瘤(GBM)样和中枢神经系统原始神经外胚层肿瘤(CNE-PNET)样的突变基因组合。将NeoCORs移植到免疫缺陷小鼠的肾脏被膜下,结果显示肿瘤类器官可在体内环境下存活并增殖,并表现出不同的生长特性,形象地模拟CNS-PNET和GBM两类肿瘤,表现出多种与原发肿瘤类似的特征,如自我增殖、永生性和浸润生长等。而且GBM样NeoCORs中,如果存在EGFROE/EGFRvIIIOE则对TKI类药物敏感,提示携带不同驱动突变的NeoCORs为抗肿瘤药物的筛选提供新策略。
该研究结果表明,NeoCOR适用于脑肿瘤生物学的研究以及在特定DNA畸变背景下药物效应的评估。
03
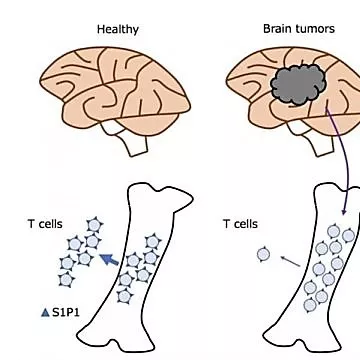
GBM等颅内恶性肿瘤导致T淋巴细胞减少症的机制
编译 |王承斌
癌症引起的T淋巴细胞功能障碍,有助于肿瘤的免疫逃逸。该现象在胶质母细胞瘤(GBM)患者中尤其严重。GBM基本上局限于颅内,但常常引起机体免疫系统T细胞数量减少和功能障碍。目前,还未充分认识这类特征性的T淋巴细胞减少症的病理机制。美国杜克大学医学中心Preston Robert Tisch脑肿瘤中心的研究者发现,未接受治疗的GBM患者和GBM荷瘤小鼠模型均存在与艾滋病患者相同的CD4+T细胞计数减少和淋巴器官萎缩的现象;在外周血中消失的大量幼稚T细胞被隔离在骨髓内。该现象并非GBM所特有,其它肿瘤颅内转移时也会发生。T细胞被隔离伴随T细胞表面1-磷酸鞘氨醇受体1(S1P1)的丧失;排除S1P1内化(internalization)后,这一过程可逆转。在GBM的荷瘤小鼠模型中,发现排除S1P1内化和T细胞的隔离逆转之前,T细胞激活疗法不起作用。因此,将T细胞隔离于骨髓中,是导致T细胞功能障碍的肿瘤适应模式。
04
缺氧环境下分泌因子促进胶质瘤干细胞自我更新
编译 | 董思远
胶质瘤干细胞(GSCs)的自我更新是胶质瘤对放疗或化疗产生耐受和复发的重要因素。缺氧是高级别胶质瘤微环境的标志性特点,已证明与GSCs的自我更新有关。美国达特茅斯盖泽尔医学院分子和系统生物学的DA Almiron Bonnin等研究发现,缺氧环境内的胶质瘤细胞表达的缺氧诱导因子(HIF-1α)能够提高信号传导与转录激活因子3(STAT3)的活性,分泌VEGF增多,加强GSCs的自我更新。选择性抑制VEGF的分泌,可见STAT3活化程度降低,同时GSCs的自我更新下降。动物模型分别使用蛋白转运抑制剂BFA和Ras相关C3肉毒素基质1(RAC1)抑制剂EHT-1864,VEGF表达量显著减少,肿瘤生长速度减慢,小鼠存活时间延长。最后,作者比较在分泌因子抑制剂作用下的缺氧环境与正常环境中的胶质瘤基因表达,进一步验证抑制分泌因子对缓解缺氧的重要作用。同时筛选出19个胶质瘤缺氧基因标志物,建立缺氧标志物评分方式;并利用TCGA数据库选取580例GBM患者数据,评估缺氧程度与GBM预后的密切相关。
综上所述,缺氧环境能够诱导VEGF等因子的分泌,激活STAT3,从而促进GSCs的自我更新。
05
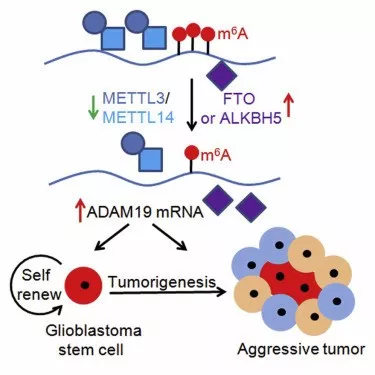
m6A的mRNA甲基化调控胶质瘤干细胞的形成
编译 | mackaay
DNA甲基化是表观遗传学调控的重要方式。其中N6-甲基腺嘌呤(m6A)是真核生物最常见的mRNA修饰,占mRNA碱基甲基化修饰的80%,主要分布在mRNA中。美国杜瓦迪市希望城Berman研究所生物科学研究生院的Qi Cui等通过对胶质瘤干细胞的m6A的研究,发现GSCs中的m6A水平随着诱导分化而提升。mRNA的m6A修饰关键是甲基转移酶METTL3或METTL14对GSCs的生长和自我更新的重要作用。m6A的mRNA甲基化小分子化合物FTO抑制剂在动物体内能抑制胶质瘤生长。RNA测序(RNA-seq)检测结合生物信息学分析发现,m6A-甲基化的mRNA参与多个关键的细胞过程,例如细胞生长、细胞分化、DNA损伤应答和细胞应激等。研究结果表明,mRNA甲基化修饰影响GSCs的生长、自我更新和肿瘤发生。
06
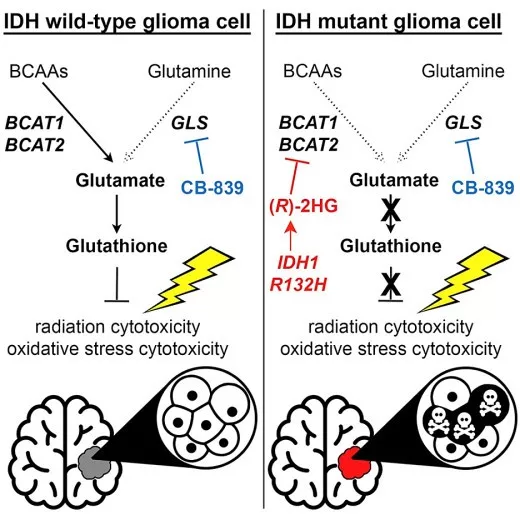
IDH突变型胶质瘤中(R)-2HG可抑制转氨酶BCAT的活性
编译 |王承斌