今天为大家带来的是,由空军军医大学唐都医院王樑副教授、复旦大学附属华山医院陈灵朝博士整理汇编的“《神外资讯》2018年鉴(Ⅲ):脑胶质瘤相关研究最新进展(上)”,欢迎观看、阅读!
卷首语
从基础研究到临床实践,胶质瘤总是神经系统肿瘤中最受关注的一个。尤其是随着影像技术进步、靶向和免疫治疗进展、分子病理推广和单细胞测序等多种新研究方法的涌现,脑胶质瘤相关研究也取得很多新进展。回顾2018年,神外资讯共推送了五十余篇与胶质瘤相关的临床和基础研究,我们将这些文献分为影像学评价和诊断、手术相关进展、预后相关因素、治疗新技术、发生发展机制及分型治疗和基础研究六个部分进行归纳,集中向读者推荐,希望能对您新一年的工作和研究提供帮助,欢迎各位同道品鉴。
王樑、陈灵朝


专家简介
一、胶质瘤影像学评价与影像学诊断
01
精确计算低级别胶质瘤术后早期残余肿瘤的方法
编译 | 杨佳
德国海德堡大学医院神经外科的Moritz Scherer等通过术后早期MRI评估LGG术后的残余肿瘤预测患者的生存预后。
该研究共纳入43例WHO Ⅱ级的LGG患者,分别在术前、术后早期72h之内以及术后3-4个月随访期时进行MRI扫描,获取FLAIR序列和ADC图像。以三个时间点的FLAIR序列图像高信号区计算肿瘤体积。在术后epMRI中,将FLAIR序列与ADC图像进行配准,FLAIR序列所描绘的高信号区肿瘤范围自动与ADC图像对应。作者使用最大化期望值(EM)计算法,对ADC图像中相对应的区域进行概率性分割,分成为残余肿瘤、缺血灶和正常脑白质三部分。将epMRI图像中由概率性分割得到的残余肿瘤体积与fuMRI图像中通过FLAIR序列高信号区得到的残余肿瘤体积进行相关性分析。
结果显示,依据FLAIR序列高信号区测算肿瘤范围,术前LGG平均体积是32.8±27.0ml、epMRI图像是19.4±16.5ml和fuMRI图像是8.4±10.2ml。epMRI与fuMRI的FLAIR序列高信号区的肿瘤体积平均差值11.0±10.6ml(p<0.0001)。epMRI图像根据ADC值进行概率性分割后,肿瘤体积7.6±10.2ml,占32%;缺血灶体积8.1±5.9ml,占48%;正常脑组织体积3.7±4.9ml,占20%。通过概率性分割后得到epMRI图像肿瘤体积与fuMRI的FLAIR序列高信号区的肿瘤体积差值变小,平均0.8±3.7ml,(p=0.16)。计算epMRI图像中在分割后的三部分平均ADC值,并结合肿瘤对侧正常额叶区域的平均ADC值得到ADC比例。三部分的ADC比例分别为,残余肿瘤1.48±0.46,正常脑组织1.11±0.31,缺血灶0.76±0.23,三者有显著性差异(p<0.0001)。
该研究发现,对无强化的LGG切除后早期,通过FLAIR序列的高信号评估残余肿瘤的体积会产生过量估计,而利用EM计算法根据ADC值对FLAIR高信号区进行概率性分割,可以减少术后缺血灶的干扰,获得较准确的残余肿瘤范围,为患者的生存预测、术后放疗以及评估LGG的进展提供依据。
02
GBM形态不规则,即使“全切除”预后仍差
编译 | penny
西班牙拉曼恰大学Beteta等研究MRI-T1增强中GBM边缘形态特征与GBM预后的预测价值。
研究共纳入216例GBM患者,其中165例为试验组, 51例为验证组。肿瘤MRI成像在Matlab中分割和三维重建等处理后,评价肿瘤边缘的不规则性。所谓不规则性指边缘与相同体积的球面的不同程度。结果显示,肿瘤边缘不规则是试验组(HR=1.61;P=0.005)和验证组(HR=1.84; P=0.05)生存期预测的重要影响因素。多因素分析仍具有统计学意义(HR=3.05;P<0.001)。肿瘤边缘不规则患者的生存期,次全切除肿瘤与全切除肿瘤之间并没有明显差异(HR=1.17;P=0.57);而肿瘤边缘规则患者可以从肿瘤全切除术中获益(HR=2.07;P=0.004)。
作者指出,胶质母细胞瘤患者的MRI-T1加权增强成像中,肿瘤边缘不规则是预测GBM患者生存期的重要因素,有助于手术预后的判断。
03
DTI的联合直方图揭示GBM浸润的异质性
编译 | 王承斌
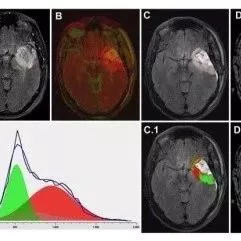
英国剑桥大学剑桥脑肿瘤影像学研究中心的Chao Li等利用DTI联合直方图分析方法,讨论GBM的浸润模式与临床预后的相关性。
该研究共纳入115例原发性胶质母细胞瘤患者,均于术前进行MRI成像检查和手术治疗。在肿瘤增强和非增强区域中,构建DTI联合直方图(图1)。结果发现,联合直方图特征与患者存活率显著相关。肿瘤非增强区DTI-p减少和DTI-q增加的比例与肿瘤进展相关(r=0.35,P=0.010);对患者的无进展生存期(HR=1.08,P<0.001)和总生存期(HR=1.36,P<0.001)有显著的影响。
作者指出,该检查方法有助于了解肿瘤浸润生长的不同特点,也有助于判断临床预后。非增强区域DTI-p减少和DTI-q增加可以认为与肿瘤浸润生长和肿瘤进展直接相关,对指导手术切除和放疗提供新的依据。
04
利用改良MRS在体识别脑胶质瘤IDH突变
编译 | Serena
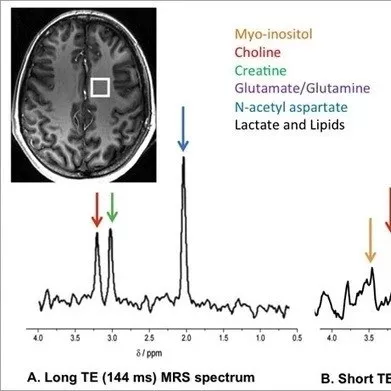
法国巴黎神经影像中心的Branzoli等利用磁共振波谱(MRS)成像,检测代谢物2-羟基戊二酸(2HG)来确定脑胶质瘤患者的IDH突变状况。
该前瞻性研究纳入24例拟诊为低级别胶质瘤患者。应用2种MRS成像方法在3T MRI设备上获得MRS数据,通过Mescher-Garwood分辨光谱(MEGA-PRESS)序列实施改良MRS检测,并使用>6mL的感兴趣体积优化PRESS序列检测2HG。确定IDH突变状态及2HG水平后与MRS检查结果进行比较。结果发现,改良MRS序列在检测2HG时的特异度和灵敏度均达到100%。该技术评估的2HG水平与从组织样品中测得的2HG水平一致。而优化PRESS序列检测2HG的性能较低。
作者认为,改良MRS是无创性检测IDH突变的可靠手段,显示出对2HG检测的高灵敏度和特异度。将改良MRS整合到临床实践中,有益于神经胶质瘤的无创诊断、预后评估和制定治疗计划。
05
rCBV和ADC鉴别WHO Ⅱ-Ⅲ级胶质瘤的组织学亚型和基因亚型x
编译 | 陈鹏
美国洛杉矶加洲大学脑肿瘤影像学实验室的Kevin Leu等回顾性分析65例WHO Ⅱ-Ⅲ级成人胶质瘤患者的临床资料。
作者收集231例WHO Ⅱ-Ⅲ级成人胶质瘤患者数据。最终选取65例患者,其中 WHO Ⅱ级31例和WHO Ⅲ级34例。发现rCBV和ADC值在星形细胞瘤与少突胶质细胞瘤之间无显著差异;ADC在基因亚型间的差异具有统计学意义(p=0.0016),尤其在IDHWT与IDHMUT/1p19q+之间的显著性差异更突出(p=0.0013)。IDHMUT/1p19q+的Ⅲ级胶质瘤中,中位ADC数值较高;IDHWT的Ⅲ级胶质瘤中,rCBV较高而ADC较低;IDHMUT/1p19q−的Ⅲ级胶质瘤中,rCBV和ADC值居中,与Ⅱ级胶质瘤相似。多因素分析显示,IDHWT和IDHMUT的Ⅱ和Ⅲ级胶质瘤的AUC值为0.84(p<0.0001)。研究表明,rCBV、ADC、MRI-T2序列高信号肿瘤体积和增强表现相结合,是非侵袭性鉴别胶质瘤分子遗传基因亚型的有效手段。
作者指出,该研究表明,ADC与2016年版WHO分级胶质瘤的基因亚型分类密切相关,而在2007年版组织学分类的胶质瘤中的特征性变化较小。ADC结合rCBV、MRI-T2序列高信号肿瘤体积和增强表现,有助于区分IDHWT和IDHMUT胶质瘤以及IDHMUT/1p19q+和IDHMUT/1p19q−胶质瘤。
二、胶质瘤手术治疗相关技术进展
01
有必要继续研究扩大胶质瘤切除范围的证据
编译 | 王承斌
美国俄亥俄州克利夫兰凯斯西储大学医学院的Leeuw等对有关扩大胶质瘤切除范围的文献进行系统回顾。
作者在数据库中检索后,最终纳入符合要求的7项研究报告论文,含492例胶质瘤患者;其中,男性214例和女性278例,年龄18至82岁。在492例中,88例接受扩大范围的肿瘤切除术;高级别胶质瘤51例、低级别胶质瘤37例。
作者发现,无论低级别或高级别胶质瘤,扩大范围的手术切除可延长患者的总体生存期和无进展生存期,但目前支持胶质瘤扩大切除范围的应用证据仍不充分;特别对低级别胶质瘤患者,因手术导致的神经功能缺损和长期残疾显著地提高死亡率。作者建议开展更大样本数的前瞻性研究,减少潜在的偏倚,提升证据效应。
02
“iST”是保护非优势额叶胶质瘤手术患者执行功能的有益工具
编译 | 王承斌
意大利米兰大学神经外科肿瘤学科的Guglielmo Puglisi等采用斯特鲁普任务的术中版本(intraoperative version of the Stroop task,iST)在术中探测与EF相关的脑区,对高级脑功能起保护作用。
45例非优势额叶胶质瘤患者行清醒手术,通过脑定位系统确定精确的切除边界。其中,对照组的18例患者在术中接受皮质-皮质下水平的脑功能定位。其余27例患者为Stroop task组,除接受语言、练习和运动功能定位外,还通过iST在皮质-皮质下水平对其执行功能进行定位。评估两组患者术前、术后7天和3个月的执行功能状况。
研究中,iST在Stroop task组均得到成功地应用。通过精确地刺激额中回下部、岛叶前部和壳核上方的白质,患者在颜色的识别速度和读取字义方面的结果都受到干扰;对照组和Stroop task组在肿瘤切除范围相似的前提下,术中使用iST可显著降低患者术后3个月随访时的执行功能障碍发生率。
作者指出,使用iST进行脑功能定位可以在术中识别和保护与自主反应有关的额叶结构,减少术后执行功能缺失发生率。因此,iST术中识别可保护神经功能网络,预防非优势额叶肿瘤大范围切除后患者高级认知功能障碍的发生,提高术后生活质量。
03
高级别胶质瘤术中脑室开放后可能发生的后果
编译 | 晓鑫
在高级别神经胶质瘤(HGG)的切除过程中,有时会打开脑室,其后果还不确定。美国田纳西州纳什维尔范德比尔特大学医学中心的Mistry等对成人HGG切除术中切开脑室对发生肿瘤播散、脑积水和死亡率的影响进行meta分析。
作者检索数据库发表的文献。比较HGG切除术中脑室开放与脑室未开放时发生软脑膜播散和脑积的机率,评估有或无脑室开放的HGG患者总生存率。
共检索得6910篇论文,纳入20项研究,含2251例HGG患者。在9项研究中,进入脑室患者软脑膜播散发生率为86/410例,高于未进入脑室患者的软脑膜播散发生率57/847例(P=0.0002)。在11项研究中,HGG切除时进入脑室患者脑积水发生率8/431例,而未进入脑室患者脑积水发生率11/565例(P<0.00001)。在10项研究中,对患者进行生存期比较,413例进入脑室患者的平均存活时间16.8月,而322例未进入脑室患者平均存活时间19.1月(P=0.01)。
meta分析显示,高级别胶质瘤患者肿瘤切除术中进入脑室与肿瘤播散和脑积水发生、存活率下降之间存在一定的相关性,建议进一步开展这方面的研究。该研究结论不足以阻碍手术医生追求最大程度安全切除肿瘤时进入脑室,但神经外科医生和神经肿瘤学家有必要意识到脑室开放可能产生的后果。
04
5-ALA诱导的荧光可作为LGG预后的独立标志物
编译 | Fu
应用5-氨基乙酰丙酸(5-ALA),能使20%低级别胶质瘤(LGG)在手术中呈现可见的原卟啉荧光。德国明斯特大学医学院神经外科的Mohammed Jaber等对5-ALA诱导荧光是否可作为LGG的预后标记物进行研究。
在74例LGG患者中,16例(21.6%)呈现荧光。呈现荧光和非荧光肿瘤患者在年龄、性别、肿瘤大小和肿瘤切除范围方面均无显著差异。呈现荧光的肿瘤部分与MRI成像弱强化和PET-FET摄取增加有关,但与年龄、Karnofsky表现评分、肿瘤大小无关。只有EGFR在荧光与非荧光肿瘤的表达上略有差异,19%比5%(P=0.057)。荧光与非荧光肿瘤的PFS中位数9.8月vs 45.8月、MTFS的中位数43.0月vs 64.6月(P=0.015)、OS的中位数51.6vs 68.2(P=0.002)。多变量分析显示,IDH状态和荧光可分别独立预测MTFS和OS。但荧光不能独立预测PFS。
荧光是低级别胶质瘤所固有的恶性转化和OS预测标志物。在决策LGG患者辅助治疗时,肿瘤中的荧光具有参考效应。
05
WHO Ⅲ级胶质瘤切除程度与患者生存期的关系
编译 | jiy
WHO Ⅲ级胶质瘤在临床上比较少见。日本东京女子医科大学医学研究院神经外科的Yu Fujii等研究WHO Ⅲ级胶质瘤切除程度(EOR)对患者生存期的影响。
该项回顾性研究纳入2000年3月至2011年12月,术中MRI辅助下切除的122例WHO Ⅲ级胶质瘤患者。根据组织学分型将患者分为两组:I组,81例间变性星形细胞瘤(AA)或间变性少突星形细胞瘤(AOA);Ⅱ组:41例间变性少突胶质细胞瘤(AO)。术前以及术后均作MRI-T2加权成像以及MRI-T1加权增强成像,计算肿瘤切除程度。结果显示,患者总体术后5年、8年和10年生存率分别为74.28%、70.59%和65.88%。I组患者5年和8年生存率分别为72.2%和67.2%,10年生存率为62.0%。Ⅱ组患者5年和8年生存率均为79.0%,10年生存率的数据缺失。在I组患者中,肿瘤切除达53%或以上可获得较长的生存期,但Ⅱ组患者则无此结果。单因素分析显示,术前的KPS分数、IDH1突变、MRI-T2加权成像高信号病灶的EOR是AA与AOA组患者生存的预测因素。多因素分析证实,MRI-T2加权成像高信号病灶的EOR和IDH1突变是AA与AOA组患者的生存预测因素。
作者指出,MRI-T2加权成像的高信号病灶切除程度是预测间变性星形细胞瘤与间变性少突星形细胞瘤患者预后的重要因素,肿瘤切除程度达到术前MRI-T2加权成像高信号病灶的53%或以上可获得较长的生存时间。
06
复发性岛叶胶质瘤再手术有益于患者
编译 | 王承斌
低级别和高级别胶质瘤的较大限度地切除(EOR)有益于改善患者的总生存期和无进展生存期。前美国旧金山加利福尼亚大学神经外科的Ramin A. Morshed等对复发性岛叶胶质瘤再次EOR术后患者的预后进行分析。
该研究纳入44例岛叶胶质瘤(WHO Ⅱ-Ⅳ)术后复发和进行再手术的患者。术前和术后肿瘤体积通过增强的MRI-T1序列和T2-FlAIR序列计算所得。49次复发性岛叶胶质瘤再次切除术。WHO-Ⅱ级、Ⅲ级和Ⅳ级胶质瘤分别占46.9%、28.6%和24.5%。Berger-Sanai分区系统和肿瘤毗邻区域不会对EOR造成影响。95.9%患者涉及语言功能区或运动功能投射网络。再次手术后发现,44.9%肿瘤病理学性质发生转化。术后随访90天的评估显示,91.5%患者未发生新的神经功能障碍;出现新发神经功能障碍患者中,3例(6.4%)视野缺损,1例(2.1%)轻度偏瘫;而新出现的神经功能症状与肿瘤EOR无关。
复发性岛叶胶质瘤涉及复杂的脑结构解剖和功能区;在可接受的切除程度和安全性的前提下,再次手术不受肿瘤所在部位和病理学分级的影响。患者可通过手术再次获益。
三、胶质瘤预后相关因素分析
01
BMI是GBM患者预后的预测指标
编译 | Fu
体质指数(body mass index,BMI)是评估人体肥胖程度的简捷指标。印度钦奈阿波罗专科医院肿瘤放射科的Mahadev Potharaju等分析GBM患者的BMI与总体生存期(OS)的关系。
392例经组织病理学确诊为GBM患者,均接受Stupp标准治疗方案。记录患者首次入院时身高和体重测量值,计算BMI。患者BMI为18.5-43.5,中位数24.3;53.3%患者体重正常,36.5%超重,10.2%肥胖。正常体重组的OS中位数为13.5个月,超重组为15.4个月,肥胖组为15.1个月。
单因素分析显示,年龄、Karnofsky评分、肿瘤切除程度、脑肿瘤独立递归分级指数和BMI等是预后的独立影响因子。调整年龄、Karnofsky评分、和肿瘤切除程度后,超重和肥胖者相应的HR值分别为0.70(P=0.009)和0.66(P=0.04)。性别、糖尿病和高血压三个变量间没有显著的交互作用。
作者指出,BMI高的GBM患者预后明显好。该结论需要进一步验证,并探索其机制。
02
低级别胶质瘤恶性转化的危险因素
编译 | 丁陈禹
既往研究报道低级别胶质瘤发生恶性转化(MT)成高级别胶质瘤(WHO 3-4级)的发生率为23%-72%。美国俄亥俄州克利夫兰诊所放射肿瘤学科的Erin S. Murphy等对胶质瘤恶性转化的危险因素进行研究。
研究共纳入599例低级别胶质瘤(WHO 2级)患者,平均随访88.3个月。根据是否发生MT,124例分入MT组,475例分入非MT组。对比两组患者的一般资料、肿瘤特征、手术切除程度、治疗方案、MT情况和预后。
599例低级别胶质瘤患者的MT发生率为21%。MT组124例中,76例经活检证实恶性转化。MT组5年和10年无进展生存率分别为30.6%±4.2%和4.8%±1.9%,5年和10年总体生存率分别为75%±4.0%和46%±5.0%;非MT组5年和10年无进展生存率分别为60%±2.4%和38%±2.7%,5年和10年总体生存率分别为87%±1.7%和78%±2.3%。MT显著影响胶质瘤患者的生存期,其危险因素包括高龄、男性、多发肿瘤、单纯化疗以及手术未完全切除肿瘤。但此结论有待开展前瞻性研究验证。
03
丘脑胶质母细胞瘤预后分析
编译 | Serena
美国德克萨斯大学健康科学中心神经外科的Yoshua Esquenazi等研究丘脑胶质母细胞瘤患者的自然史和与生存相关的因素。
作者10年内共57例丘脑GBM患者纳入研究;中位年龄53岁,中位KPS评分80。最常见的症状是疲劳、意识模糊和头痛。47%患者术前有脑积水。47例进行立体定向活检,10例接受开颅手术。中位总体生存期为12.2个月。KPS较高、年龄较小和脑脊液(CSF)分流术与总体生存期延长具相关性;以语言障碍起病与生存期较短相关。多变量分析指出,KPS是影响总体生存期的独立预测因素。
作者认为,丘脑GBM患者的总体存活期与未能全切除的幕上GBM相仿。年轻和具有良好的功能状态的患者存活率较高。肿瘤累及中脑并不是预后不良的危险因素。
(未完待续......)