研究背景
在药物难治性癫痫患者中,一部分在经过规范的术前评估后,可以接受外科切除性手术治疗;而另一部分则因致痫灶无法定位、手术可能造成严重的脑功能损伤、患方无手术意愿等诸多原因难以接受有效的切除性手术。对于这些患者,也可以选择神经调控手术如反应性神经刺激术(RNS)、迷走神经刺激术(VNS)、深部脑刺激术(DBS)等治疗,它们均有可能在一定程度上缓解癫痫发作,但均为有创的手术治疗,具有一些外科并发症,且费用常常十分昂贵。因此,如果能够通过非药物的、低成本的无创手段对癫痫进行调控,那将是十分理想的。
目前公认的对难治性癫痫有调控作用的无创工具主要包括经颅直流电刺激(transcranial direct current stimulation, tDCS)和经颅磁刺激(TMS),本临床研究所涉及的经颅微电流神经调控技术(geodesic transcranial electrical neuromodulation,GTEN)即为基于256导联高密度脑电系统(Electrical Geodesics, Inc., US)的高精度个体化的tDCS技术(区别于传统根据头表解剖定位的tDCS技术)。传统tDCS技术的实施已有约50年历史,近10余年来的发展尤为迅速。在现有的众多研究中,所报道的不良反应均非常轻微,且基于大量研究的系统综述显示治疗组和空白对照组的不良反应发生率无显著差异,文献中可见多个关于tDCS应用的指南性论文。低电压、微电流的阴极(cathodal)直流电刺激已被许多研究证实对癫痫样放电可有明确的抑制作用。
研究介绍
本临床研究全程在复旦大学附属华山医院神经外科进行,与美国多个中心采用相同研究方案,同时合作进行数据分析、计划制定等。目前在美国已有的四个中心(Electrical Geodesics Inc., Eugene;Harborview medical center, Seattle;Beth Israel Deaconess Medical center of Harvard University Medical School, Boston;Stanford University Hospital, Stanford)计划(或正在)进行此项临床研究。
研究目标
评价应用GTEN技术对难治性癫痫进行神经调控的可行性及通过随访来探讨其对癫痫样放电的抑制作用,评价这种无创神经调控手段对难治性癫痫的治疗作用。
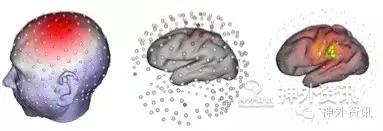
图1. GTEN微电流刺激前致痫灶精确定位。
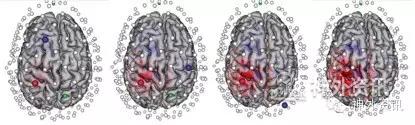
图2. GTEN微电流刺激方案的制定。

备注:长按上方二维码或点击左下角阅读原文均可填写表单报名,但是否能参加临床试验,需至以上专家门诊待教授评估后方可确定。
研究受试者招募条件
入选标准
1. 难治性癫痫患者,14—60周岁,性别不限;
2. 部分性发作,服用两种达到有效剂量的抗癫痫药物仍控制不佳;
3. 具有可经高密度脑电源定位辨别和定位的癫痫样放电灶,单灶或多灶;
4. 在过去的1月内,曾有2次及以上的部分性癫痫发作,可继发强直阵挛发作(GTCS),但每日癫痫发作需少于10次;
5. 在过去的1月内,用药方案没有改变;
6. 癫痫发作史至少2年;
7. 能够理解和签署知情同意书(限成人,儿科患者由监护人签署)。
排除标准
1. 在研究进行期间有备孕意向;
2. 怀孕;
3. 有恶性神经系统肿瘤、神经系统变性疾病、严重系统疾病、症状性脑血管病、心脏疾病或酒精药物滥用病史、血压血糖控制不良、心肺功能不全、肝肾功能不全、急性感染证据以及不明确经颅电刺激技术是否会对被试者病情产生不良影响的情况;
4. 有癫痫持续状态病史,或心因性“癫痫” 病史;
5. 装有心脏起搏器、迷走神经刺激器,体内金属植入物(除假牙)如神经刺激器、植入耳蜗、植入药物泵等;
6. 曾有开颅手术史;
7. 对利多卡因过敏或有相关禁用此药的医学情况;
8. 不能表达疼痛或不适;
9. 对银过敏;
10. 对GTEN技术有禁忌症;
11. 近3月参与其它临床研究。
安全性和伦理学
本研究已得到华山医院伦理委员会批准可以在我院进行。该研究所涉及的基础设备GES 256导联高密度脑电系统已获得美国食品药品监督管理局(FDA)和中国FDA的批准用于临床,至今未见严重不良反应报告,在本院对该套设备进行的操作中亦无任何不良反应记录。经颅电刺激所需的设备(GTEN 100)是对本套设备所进行的升级,由本系统的生产和研发厂家美国Electrical Geodesics, Inc.公司进行操作。本设备相关研究已获得美国FDA签发的研究性医疗器械豁免(Investigational Device Exemption,IDE)许可,即该设备的安全性已得到FDA的研究和认可,批准可以进行以收集安全性和可行性数据为主要目的的临床研究(“Safety and Feasibility Trial”)。
作者:复旦大学附属华山医院神经外科冯睿、胡杰、吴劲松、马成鑫、年玉平、郎黎琴、潘力(PI)、陈亮、周良辅
相关医院门诊时间
胡杰教授
复旦大学附属华山医院
周二上午专家门诊,周四下午特需门诊
华山医院静安分院(静安区中心医院)
周三上午专家门诊
好大夫个人网站:
http://jiehu68.haodf.com/
潘力教授
复旦大学附属华山医院
周二上午特需门诊
好大夫个人网站:
http://panlihuashan.haodf.com/
吴劲松教授
复旦大学附属华山医院
周五下午专家门诊
好大夫个人网站:
http://wjsongc.haodf.com/
更多资讯请关注神外资讯微信公众号:neurosurgerynews






