原作出处:
Gersey, Z.C., Abou-Al-Shaar, H., Cabral, D.T.F. et al. A refined treatment strategy for skull base chordoma: A protocol and management algorithm. Neurosurg Rev 48, 729 (2025). https://doi.org/10.1007/s10143-025-03869-4
颅底脊索瘤(Skull Base Chordomas, SBCs)作为一种罕见的骨性恶性肿瘤,仅占骨性恶性肿瘤的1%~4%,却因起源于颅底中线区域、毗邻复杂神经血管结构且具有强侵袭性的生物学特性,成为神经外科、放疗科等多学科领域极具挑战性的疾病。其治疗长期面临核心困境:病变位置深在、手术显露难度大,且对传统化疗不敏感,单一治疗手段难以兼顾肿瘤切除率与神经功能保护,而既往研究多聚焦于手术入路改良、放疗疗效分析等单一环节,缺乏覆盖“诊断-手术-辅助治疗-监测-复发处理”全病程的统一、实用管理框架,导致临床决策存在较大异质性。在此背景下,Zachary C. Gersey等学者基于美国匹兹堡大学医学中心(UPMC)2001-2020年197例患者307次手术的丰富临床经验,系统整合了内镜经鼻入路(EEA)等现代手术技术、基因型指导的个体化放疗方案及新兴靶向/免疫治疗进展,提出了一套可操作的全流程治疗算法,为颅底脊索瘤的首刀、补刀、复发刀以及放疗、临床试验入口提供了可借鉴的决策框架。可以说,该研究填补了当前颅底脊索瘤缺乏整合性管理范式的空白,为多学科团队优化患者预后提供了关键参考,其核心观点与实践策略对神经外科、颅底外科及放疗科临床医生具有重要指导价值。以下为AI解读,仅供参考。

1. 临床症状:核心表现为头痛(枕部多见,28%-64%患者)、颈痛(骨质侵蚀+硬膜扩张所致)、复视(多因第Ⅵ颅神经麻痹),均与肿瘤对邻近神经血管结构的占位效应相关。
2. 影像学特征:
● MRI:T1加权呈低-中等信号,T2加权高信号(高液含量),增强模式多样;
● CT:边界清晰的膨胀性软组织肿块,伴明显骨质破坏,轻-中度强化;
● 鉴别要点:SBCs多为中线病变,与偏心性的软骨肉瘤可区分,常沿颅底静脉解剖蔓延。
3. 基础检查:初诊需常规行全脑脊髓MRI,排除远处转移。
1. 手术目标与原则
● 核心目标:最大安全切除(优先保护神经血管功能),切除程度与无进展生存期(PFS)、总生存期(OS)直接相关;
● 术后评估:常规即刻行MRI检测残留病灶,若安全可行,可在同一住院周期内再次切除(优先于重建完全愈合前,限同一入路、同一团队且无需额外开颅);若需更换入路,待初始手术恢复后再行二次切除。
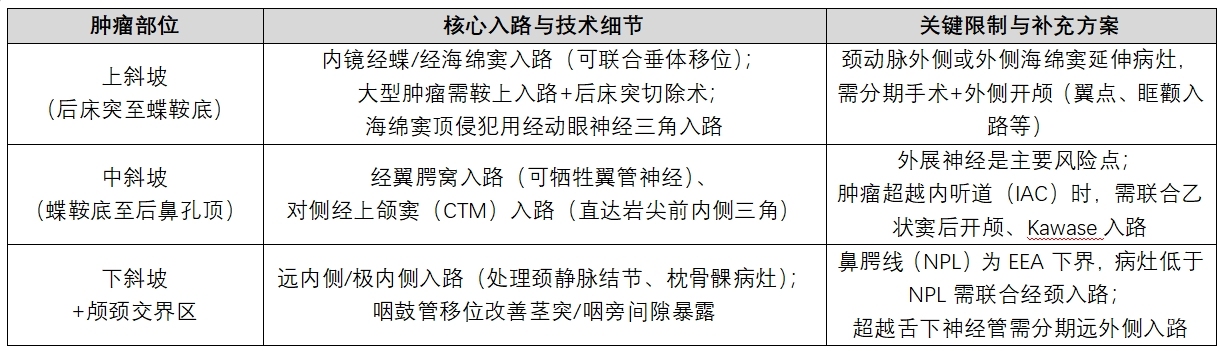
2. 关键手术入路选择(按肿瘤部位分类)
● 内镜经鼻入路(EEA)——首选核心入路
√ 优势:微创、视野清晰,结合鼻中隔皮瓣(NSF)、垂体移位、远内侧技术等改良,显著提升斜坡病灶切除率,并发症发生率不高于开放入路;
√ 技术辅助:术中需用外展神经肌电图监测,NSF活力常规通过吲哚菁绿(ICG)血管造影验证。
● 分部位手术策略
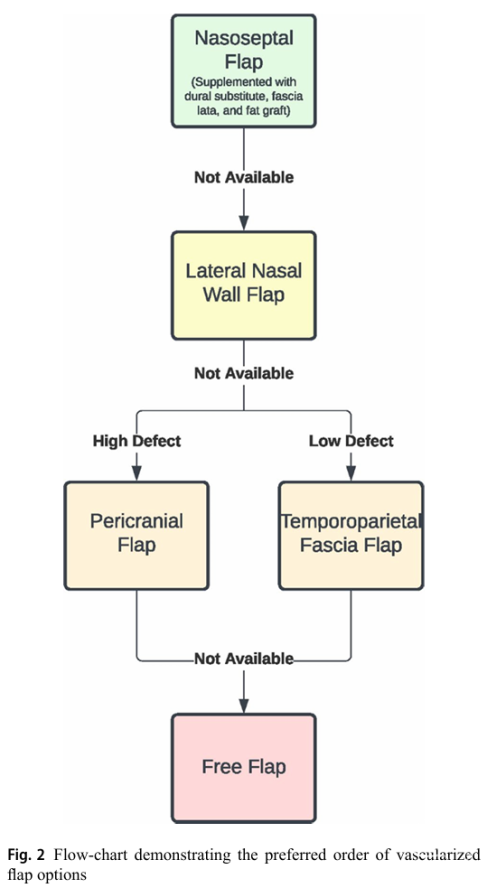
● 重建方案(按脑脊液漏风险分级)
√ 无硬脑膜破损:仅用带血管蒂NSF;
√ 后颅窝缺损+脑脊液漏:脑脊液分流+多层重建(硬脑膜替代物+阔筋膜移植物+斜坡隐窝脂肪移植+延伸NSF);
√ 下斜坡/颅颈交界区:加用鼻咽瓣(贴合NSF上缘);
√ 皮瓣选择顺序:NSF→鼻腔外侧壁皮瓣→高缺损用颅外颅骨膜瓣/低缺损用颞顶筋膜瓣→最后选择游离皮瓣(前臂/股外侧肌)。
3. 切除范围与分期手术
● 硬膜骨膜层需广泛切除(利于术后影像学评估和放疗规划),内层硬膜仅在小型无病灶肿瘤中保留;
● 常见残留部位处理:岩尖/Meckel囊后部(经岩尖前入路)、舌下神经管/颈静脉孔外侧(远外侧入路)、C2以下Batson静脉丛侵犯(后路/经颈入路);
● 禁忌:绝不以牺牲关键功能(如椎动脉、可恢复的外展神经)为代价追求全切除(GTR)。
1. 核心地位:SBCs对传统化疗耐药,术后放疗为关键辅助治疗,需结合手术切除程度和肿瘤基因型制定方案。
2. 放疗选择:
● 首选:质子束放疗(PBRT)——剂量分布更优,减少对周围神经血管的损伤;
● 替代方案:外照射放疗(EBRT,历史剂量可达75Gy)、立体定向放射外科(SRS)——适用于不可手术的局限性复发灶;
3. 基因型指导分层:
● Group A(低1p36缺失+纯合子9p21缺失):预后较好,全切除(GTR)后可降低放疗强度——基于作者团队2018年发表的前瞻性单臂研究
● Group B/C(非全切除):PFS较差,需强化放疗。
1. 常规监测
● 术后即刻、3个月、9个月各行1次MRI;无进展者后续每年1次MRI;
● 低分化/去分化肿瘤:需缩短监测间隔,加强随访。
2. 复发处理策略

1. 化疗:无FDA批准的专属药物,目前仍处于研究阶段。
2. 免疫治疗:
● 潜力依据:SBCs高表达PD-L1;
● 现状:纳武利尤单抗(Nivolumab)、帕博利珠单抗(Pembrolizumab)等PD-1抑制剂临床试验结果混杂,暂无明确推荐方案;
3. 靶向治疗:
● 核心靶点:转录因子brachyury(SBCs关键驱动因子);
● 现状:针对brachyury的小分子抑制剂和疫苗临床试验(如NCT03083678)尚未显示显著疗效;
4. 特殊类型:活检证实的低分化/去分化SBCs,需多学科团队评估,可考虑化疗或靶向治疗作为新辅助方案。
1. 入路限制:EEA下界为鼻腭线(NPL,从鼻前骨至硬腭后部),超越该线需联合其他入路;
2. 神经保护:中斜坡手术中外展神经为主要风险点,必须行术中肌电图监测;
3. 多学科协作:需联合耳鼻喉科、放疗科、肿瘤科,全程制定个体化方案(从诊断到复发管理)。
推荐阅读:
声明:脑医汇旗下神外资讯、神介资讯、神内资讯、脑医咨询、Ai Brain 所发表内容之知识产权为脑医汇及主办方、原作者等相关权利人所有。





