维持充足的脑氧输送是预防急性脑损伤(ABI)患者继发性缺血损伤的基础。动脉血二氧化碳分压(PaCO₂)的调节在这一过程中起关键作用,因为PaCO₂是脑血流量(CBF)的有效调节因子。在无颅内压(ICP)升高的情况下,将PaCO₂控制在适宜临床范围内可促进脑氧充分输送并最大程度减少缺血损伤。本文简要阐述PaCO₂与CBF的生理学关联,并总结常见ABI病症中基于证据的PaCO₂管理策略(图1)。
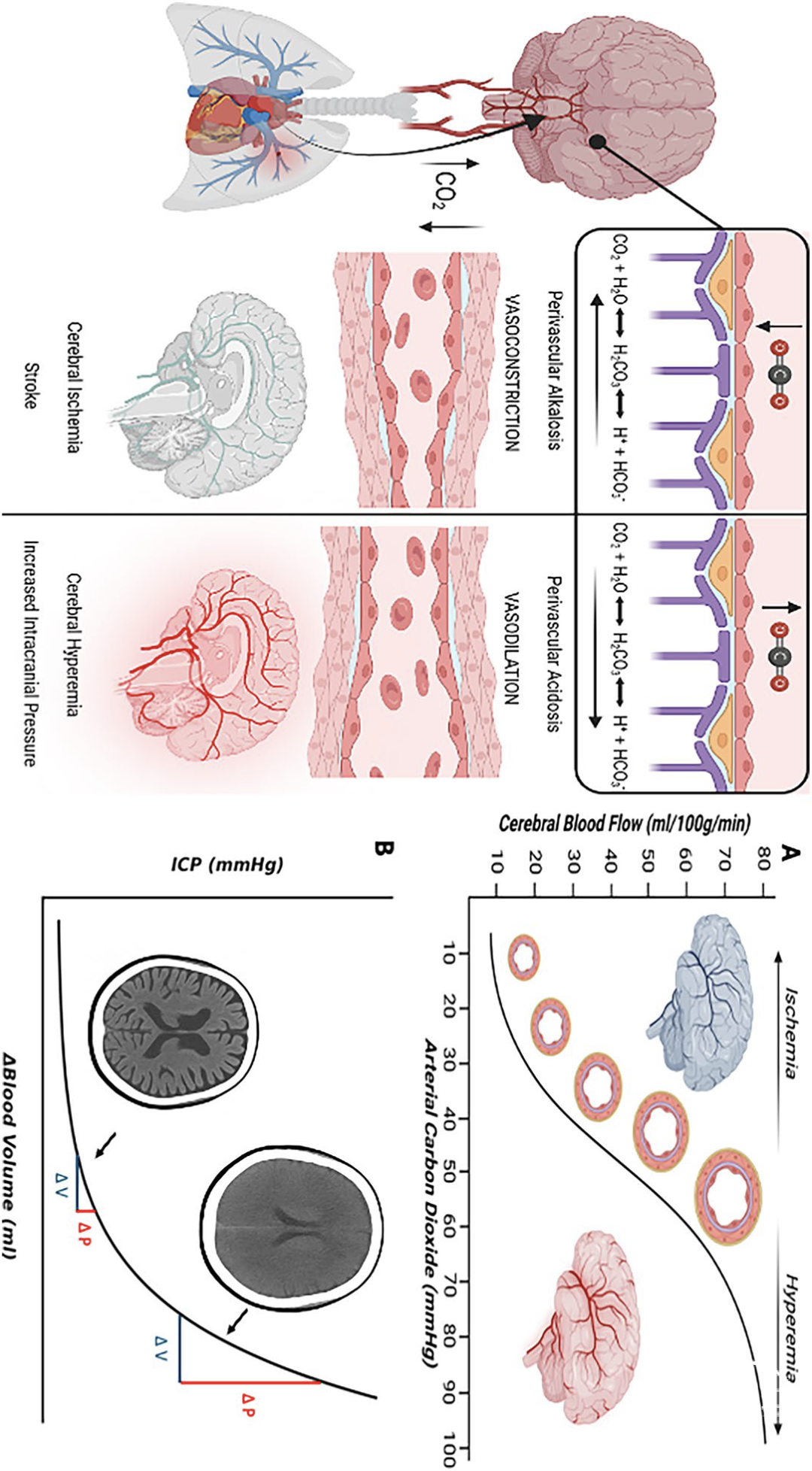
图1 二氧化碳对脑血流量(CBF)和颅内压(ICP)的影响。本图阐释了血管收缩与舒张的相关风险,以及二氧化碳与大脑反应性的基本病理生理机制。A PaCO₂与CBF在20-80 mmHg范围内呈近似线性关系。在此区间内,PaCO₂升高会导致血管周酸中毒、脑小动脉扩张及CBF增加;而PaCO₂降低则引起血管周碱中毒、脑小动脉收缩及CBF减少。该关系的临床意义在于:较低PaCO₂水平可能引发脑缺血,较高水平则可能导致充血(伴潜在ICP升高)。B 脑血容量变化与ICP的关系取决于基础脑弹性。在脑弹性较低的患者中,特定幅度的PaCO₂升高所致血容量增加仅会引起轻微且临床意义不显著的ICP升高;反之,在脑弹性增高的患者中,同等程度的PaCO₂和血容量增加可能导致显著且具有潜在危险性的ICP上升。缩写:CBF脑血流量,ICP颅内压,PaCO₂动脉血二氧化碳分压:
CO₂与脑生理机制
PaCO₂与CBF在20-80 mmHg范围内呈近线性关系。PaCO₂每升高1 mmHg,CBF增加约3-6%;每降低1 mmHg,CBF则减少1-3%(图1A)[1]。PaCO₂调节CBF的程度(即CO₂反应性)在老年人群或严重ABI患者中会减弱[2]。此外,这种效应存在区域异质性,灰质的CO₂反应性比白质高2-3倍[3]。
CBF对CO₂的反应通过脑脊液pH值变化介导。CO₂对CBF的影响比全身动脉pH更强烈且即时,因其可自由穿过血脑屏障并直接改变血管周pH值。高碳酸血症导致脑脊液酸化和软脑膜阻力小动脉扩张,增加CBF及血容量,在代偿储备有限的患者中可能升高ICP(图1B)。相反,低碳酸血症引起脑脊液碱中毒、软脑膜小动脉收缩及CBF降低[1]。伴随的血容量减少可降低ICP,这解释了过度通气用于控制ICP升高的临床原理。
然而持续深度过度通气可能通过减少CBF导致脑缺血。ABI后24-36小时内维持PaCO₂为25 mmHg会显著增加脑脊液中代谢应激标志物(如谷氨酸和乳酸)[4],影像学研究证实当PaCO₂从36 mmHg降至29 mmHg时CBF显著减弱[5]。除短暂用于难治性颅内高压或脑疝前兆外,不推荐深度过度通气[6,7]。虽缺乏强效数据,轻度低碳酸血症(PaCO₂ 32-35 mmHg)的风险可能较低[8],支持在ICP升高时短暂谨慎地采用过度通气。
ABI中的CO₂目标值
总体建议
临床指南推荐对无ICP升高的ABI患者将PaCO₂维持在35-45 mmHg,允许ICP升高者适当降低[6,9]。ENIO观察性研究(1476例患者)的亚组分析发现PaCO₂与预后呈U型关联:相较于正常碳酸血症(35-45 mmHg),PaCO₂<32 mmHg或>45 mmHg时院内死亡率显著上升,其中PaCO₂<26 mmHg时死亡率最高[10]。
创伤性脑损伤
西雅图国际脑损伤共识联盟建议对重型创伤性脑损伤(TBI)患者管理颅内压(ICP)时采用分层设定PaCO₂目标值的策略(第一层:正常低值碳酸血症,35-38 mmHg;第二层:轻度低碳酸血症,32-35 mmHg)[6]。脑创伤基金会指南反对常规将PaCO₂降至30 mmHg以下[7],其部分依据源于30多年前一项涉及113例患者的随机试验——该研究证实与正常碳酸血症组(PaCO₂ 35±2 mmHg)相比,长期预防性过度通气(PaCO₂ 25±2 mmHg)会导致更差的长期预后[11]。尽管如此,不同医院的平均PaCO₂水平仍存在显著差异[12]。在具备监测条件时,推荐采用脑氧监测技术(如颈静脉血氧测定或脑组织探针)来指导治疗性过度通气的深度与持续时间,以规避CBF减少及继发缺氧风险[6]。正在进行的BONANZA与BOOST-III试验(ACTRN12619001328167和NCT03754114)中,轻度高碳酸血症(45-50 mmHg)被纳入标准化方案,用于在ICP正常时通过增加CBF改善脑组织低氧状态。该策略目前仍属研究范畴,若无有创颅内监测支持则不推荐应用。
缺血性与出血性脑卒中
现行指南未明确针对缺血性或出血性卒中患者的PaCO₂目标值,临床通常参考TBI文献的原则进行推导[13]。虽然ABI机械通气指南推荐将PaCO₂维持在35-45 mmHg(包括卒中患者)[9],但需考虑若干疾病特异性因素。缺血性卒中后半暗带区域CBF常显著降低。动物模型中过度通气可能诱发"盗血"现象,使血液从邻近脑组织分流至半暗带[14]。然而这种方案并非常规推荐,且持续过度通气可能扩大缺血区域,其风险超过潜在获益。
蛛网膜下腔出血患者常出现自发性过度通气与低碳酸血症。低碳酸血症介导的CBF减少值得关注(尤其在血管痉挛或迟发性脑缺血患者中),但通过镇静、肌松等方式"规范化"调整PaCO₂可能因影响神经功能评估而不适用于所有患者。个体化管理常属必要。另一方面,一项针对6例重症蛛网膜下腔出血患者的研究显示,控制性高碳酸血症(最高60 mmHg)可改善CBF与脑氧合,且未增加ICP[15]。ENIO亚组分析发现,SAH后即使轻度低碳酸血症也与院内死亡率独立相关,而高碳酸血症无此关联[10]。因此控制性高碳酸血症或成为管理特定患者迟发性脑缺血的有前景的治疗选择,但需进一步研究验证。
颅内出血患者的PaCO₂管理遵循前述通用原则。对血肿占位效应显著者,避免高碳酸血症尤为重要——因颅内顺应性下降时,CBF与血容量的轻微增加即可引发ICP升高(图1B)。
心脏骤停后脑损伤
现行指南推荐该人群应将PaCO₂维持在35-45 mmHg[16]。针对1700例院外心脏骤停患者的TAME试验显示,与正常碳酸血症组(35-45 mmHg)相比,目标PaCO₂设为50-55 mmHg未能改善6个月神经功能或降低死亡率[17]。该中性结果可能与心脏骤停后脑损伤患者普遍存在的CO₂反应性受损有关[2]。自主循环恢复后,CBF通常经历短暂高灌注期(10-30分钟),继而进入 prolonged 低灌注期。低碳酸血症相关缺血风险在低灌注期尤为突出,这强调了循环恢复后严格避免PaCO₂<35 mmHg的重要性。
结论
多数ABI患者(尤其在急性期)推荐维持正常碳酸血症,因此时PaCO₂介导的CBF变化可能显著影响ICP及继发性脑损伤风险。采用过度通气实现轻度低碳酸血症(PaCO₂ 32-35 mmHg)可作为管理ICP升高及急性ICP危象的有效手段,但需谨慎使用以避免缺血并发症。控制性高碳酸血症仍是持续研究领域。未来研究应探索个体化的PaCO₂管理策略。
Intensive Care Med
. 2025 Jul;51(7):1256-1259. doi: 10.1007/s00134-025-07913-1. Epub 2025 May 5.
Carbon dioxide pathophysiology and targets following acute brain injury
*本文转载自微信公众号“脑血管病及重症文献导读”,脑医汇获授权转载
![]()
声明:脑医汇旗下神外资讯、神介资讯、脑医咨询、Ai Brain 所发表内容之知识产权为脑医汇及主办方、原作者等相关权利人所有。
投稿邮箱:NAOYIHUI@163.com
未经许可,禁止进行转载、摘编、复制、裁切、录制等。经许可授权使用,亦须注明来源。欢迎转发、分享。
投稿/会议发布,请联系400-888-2526转3。




