尽管重症监护病房管理取得进展,且新诊断技术与监测模式得以应用,创伤性脑损伤(TBI)患者不良神经功能结局发生率仍居高不下。专科神经重症监护单元已被证实可改善预后。现行指南虽已制定,但多数推荐基于低等级证据,导致TBI管理在多模态神经监测指征、颅内外并发症处理及预后工具应用等方面存在显著临床实践差异。生物标志物与人工智能等新工具虽已涌现,仍需进一步研究确立其临床应用价值。本叙述性综述旨在阐述ICU中TBI管理的实践标准,厘清现有证据与知识缺口,为临床医师提供实用诊疗框架。
创伤性脑损伤(TBI)是全球致残致死的主要病因之一,构成重大公共卫生负担[1]。其流行病学特征存在地域差异:中低收入国家(LMICs)因交通事故高发导致疾病负担更重[2];而高收入国家(HICs)老年人群跌倒(常合并多种基础疾病)已成为首要致伤原因。
ICU中的TBI管理具有高度复杂性,核心在于预防或减轻继发性脑损伤,同时需应对疾病的临床与病理生理异质性,并管理可能加剧损伤的脑-体交互作用。本综述系统阐述成人重症TBI的ICU标准管理策略,涵盖指南导向的初始复苏、继发性损伤防治策略、神经监测技术新进展,以及常规ICU管理、颅外并发症识别处理、长期预后评估工具应用等内容。
TBI的病理生理进程始于急性生物力学损伤,继而演变为影响长期预后的继发性级联反应。鉴于初始损伤机制(包括加速度、作用部位、损伤类型等)存在异质性,TBI更宜视为疾病谱而非单一实体[2]。年龄、性别、遗传背景和合并症等个体因素可调节损伤进展,但针对这些变量制定个体化治疗策略的证据仍有限。
原发性损伤多表现为局灶性与弥漫性病变共存,单纯局灶性损伤罕见[3]。剪切力导致的轴索损伤可引发细胞骨架破坏、运输功能障碍及白质进行性退化,即使早期影像学未见异常。生物力学损伤触发兴奋性毒性、细胞内钙超载及以细胞因子释放、内皮/小胶质/星形细胞激活为特征的炎症级联反应[4,5]。脂代谢紊乱[6]与微生物组改变[7]可能加速损伤进展。持续血脑屏障破坏、神经炎症及蛋白质错误折叠(如β淀粉样蛋白沉积、tau蛋白病变)最终导致慢性神经元丢失与神经退行性变[8]。
虽然损伤可激活神经发生、轴突发芽等内源性修复机制,但这些过程通常短暂且不足以抵消损伤进展。这提示临床需同步开发早期神经保护干预与后期抗炎/促修复治疗策略。通过整合神经影像、血液生物标志物与基因组学特征,将TBI重新划分为具有特定分子特征的亚型,有望推动ICU中的精准医疗决策[9]。
在创伤性脑损伤(TBI)早期阶段,低氧血症、低血压及代谢紊乱(单独或协同作用)是关键的继发性损伤因素,可促进脑水肿形成并影响脑灌注与氧输送[10-12]。
指南推荐对存在以下情况的TBI患者行早期气管插管机械通气:意识障碍(格拉斯哥昏迷评分[GCS]<9分)、严重躁动、气道保护反射消失,或合并胸腹部损伤的GCS>8分患者。应维持外周血氧饱和度>94%或氧分压80-120 mmHg,但需注意新证据表明高氧血症可能有害[13,14]。必须避免高碳酸血症导致的脑血管扩张(增加脑血容量引发颅内高压)与低碳酸血症引起的脑血流减少(可能导致缺血)。推荐维持二氧化碳分压(PaCO2)于35-45 mmHg区间,支持持续呼气末CO2监测的应用。
低血压(操作上常定义为<90 mmHg)与不良神经预后显著相关[15]。最新《脑创伤基金会指南》(BTF)建议维持脑灌注压(CPP=平均动脉压-颅内压)在60-70 mmHg[16],但基于患者自身调节状态的个体化方案可能更具优势。虽然CPP最优化(CPPopt)概念备受关注,即根据脑自动调节功能确定理想CPP值,但其有效性尚缺确凿证据[17]。推荐采用年龄分层血压目标:收缩压≥100 mmHg或平均动脉压>80 mmHg,老年患者可能受益于收缩压≥110 mmHg[18]。液体治疗应以优化复苏为目标,同时避免容量过负荷,必要时可联用血管活性药物。等渗晶体液应作为首选,因高渗盐水未显示预后获益,而低渗溶液可能加重脑水肿[19-21]。
血糖异常与体温波动是继发性损伤的重要促进因素,需在早期密切监测。孤立性TBI患者使用氨甲环酸未显示临床获益[22]。
尽管缺乏随机对照试验证据,但初期复苏阶段对氧合、通气、血流动力学等生理参数的标准化调控,已被一致证实与生存率改善相关[23]。
创伤性脑损伤的基础与高级神经影像学检查
计算机断层扫描(CT)对识别具有临床意义的颅内损伤及颅面骨折具有高敏感性和特异性。相较于磁共振成像(MRI),CT的优势包括成像时间短、潜在风险和禁忌症较少。因此,CT是创伤性脑损伤急性期和亚急性期初步诊断及间隔期影像学检查的主要方式。
对于外伤患者可考虑行CT血管造影以评估钝性脑血管损伤(BCVI,包括颈动脉和椎动脉损伤),此类损伤可能增加卒中风险(https://www.facs.org/media/vgfgjpfk/best-practices-guidelines-traumatic-brain-injury.pdf)。多项研究目前推荐对所有严重创伤患者进行普遍性BCVI筛查,采用全身CT检查,在合并颅骨或脊柱骨折、伴有胸部损伤的TBI患者,或神经影像学无法解释的神经系统检查异常患者中检出率最高(https://www.facs.org/media/vgfgjpfk/best-practices-guidelines-traumatic-brain-injury.pdf)。
与传统CT相比,常规MRI能更精确地描述损伤的分布范围和程度,无论是在特定神经解剖位置(如脑干损伤)还是对特定类型病变(如脑微出血)的检测方面[24]。目前,MRI最常用于评估特定的临床问题,例如无法解释的局灶性神经功能缺损和长期意识障碍(昏迷)患者,以发现CT未检出的病变并协助预后判断(图1)。
图1 展示MRI在TBI急性期潜在价值的影像。患者1在遭受TBI后第2天和第5天接受成像检查。平均扩散图示如何区分不同类型的水肿:蓝色箭头指向挫伤周围血管源性水肿(扩散不受限),红色箭头指向细胞毒性水肿小边缘带(扩散受限)。至第5天时,细胞毒性区域已不可见。超急性期挫伤周围这些低信号区可能代表微血管衰竭区域。患者2存在弥漫性轴索损伤,于伤后第3天接受MRI检查。磁敏感加权成像(SWI)显示左侧中脑背侧及双侧颞叶存在点状出血灶,这些病变在FLAIR序列和CT扫描中均不可见。Newcombe等[27]。FLAIR=液体衰减反转恢复序列,MRI=磁共振成像,TBI=创伤性脑损伤,MD=平均扩散系数:
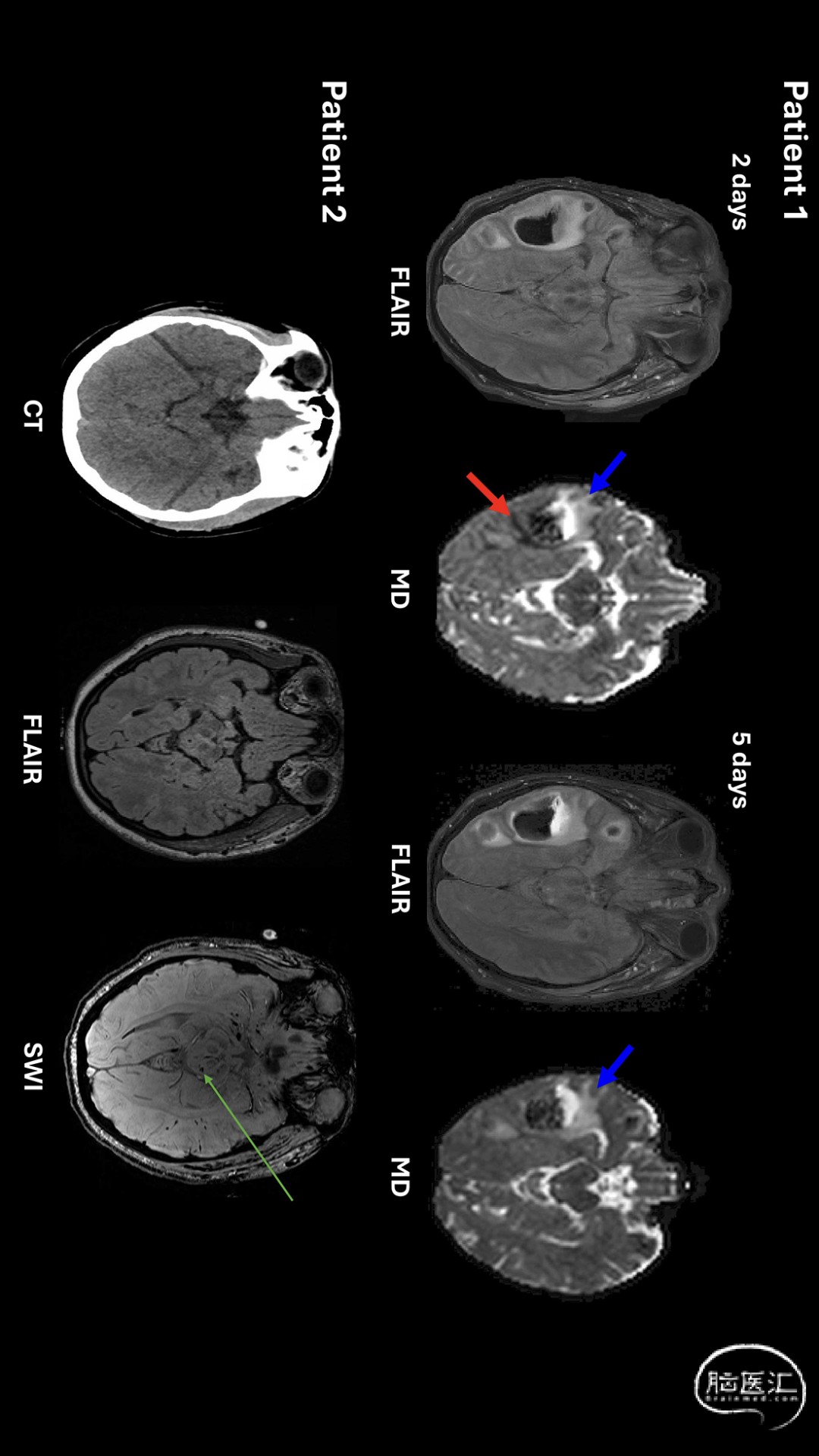
定量MRI技术可检测其他方法不可见的损伤,并提供独特的病理生理学见解。这些技术包括容积分析、多种扩散MRI(dMRI,最常见的是扩散张量成像)、定量磁敏感图、MRI灌注成像(如动态对比增强MR灌注)和静息态功能MRI[24-26]。其中,急性期研究最多的是dMRI,该技术通过表征水分子扩散特性来反映损伤后发生变化的组织微观结构,从而提供病理学信息。例如,在超急性期,脑挫伤可能同时存在血管源性水肿(扩散不受限)和细胞毒性水肿(扩散受限)区域[25]。细胞毒性水肿可能代表微血管损伤,这可为未来治疗试验提供靶点[27](图1)。扩散张量成像(DTI)指标具有特殊重要性,因其可指导昏迷苏醒预测,并在神经预后评估方面具有潜力[28,29]。但在广泛临床应用前,仍需改进序列标准化、脑损伤自动量化技术,并加强对个体结果的理解。
颅内压监测指征与管理
创伤性脑损伤后颅内压(ICP)及其衍生参数的测量仍是重点关注和研究领域[30]。尽管目前缺乏明确证据支持基于ICP监测的治疗方案具有确切获益,但此类监测仍被视为现代脑损伤治疗的基础[16]。事实上,美国外科医师学会要求美国创伤中心必须开展ICP监测以获得认证资格。
ICP测量不仅为通过治疗调整维持阈值提供依据,还能检测不断扩大的颅内占位性病变,并为ICP剂量、脑灌注压、最佳脑灌注压、自动调节状态及顺应性/代偿储备提供信息[31]。
《脑创伤基金会指南》推荐在以下情况下使用ICP监测:(1)昏迷伴头部CT异常[16,32,33];(2)昏迷患者头部CT检查正常但具备以下两个或以上特征:年龄超过40岁、低血压或神经系统检查出现去皮质/去大脑强直[34]。这些指征的证据支持力度未达到纳入最新第四版BTF成人指南的标准[16]。但编委会选择在指南中重申这些建议,以保持对颅内压升高风险患者特征的充分认识。
2013年米兰共识会议得出结论,需要对ICP监测采取更保守的态度[35],建议在以下情况对昏迷TBI患者进行监测:存在脑挫伤且认为中断镇静以检查神经状态具有危险性,或临床检查不可靠时;或在二次去骨瓣减压术后评估ICP控制效果并指导进一步治疗时。共识小组不建议对头部CT扫描正常的昏迷TBI患者进行ICP监测。西雅图国际严重创伤性脑损伤共识会议(SIBICC)采用严谨的德尔菲共识流程重新评估了ICP监测指征[36]。结果显示,作者团队对ICP监测的使用比BTF或米兰建议更为宽松,并且他们重视ICP数据在检测和监测严重颅内高压之外的更多价值。鉴于此,近期在预测颅内压升高方面的进展[37]可能不足以制定未来关于ICP监测指征的建议。尽管已有相当充分的描述,但颅脑影像学正常时的ICP升高现象[34]仍值得进一步研究。
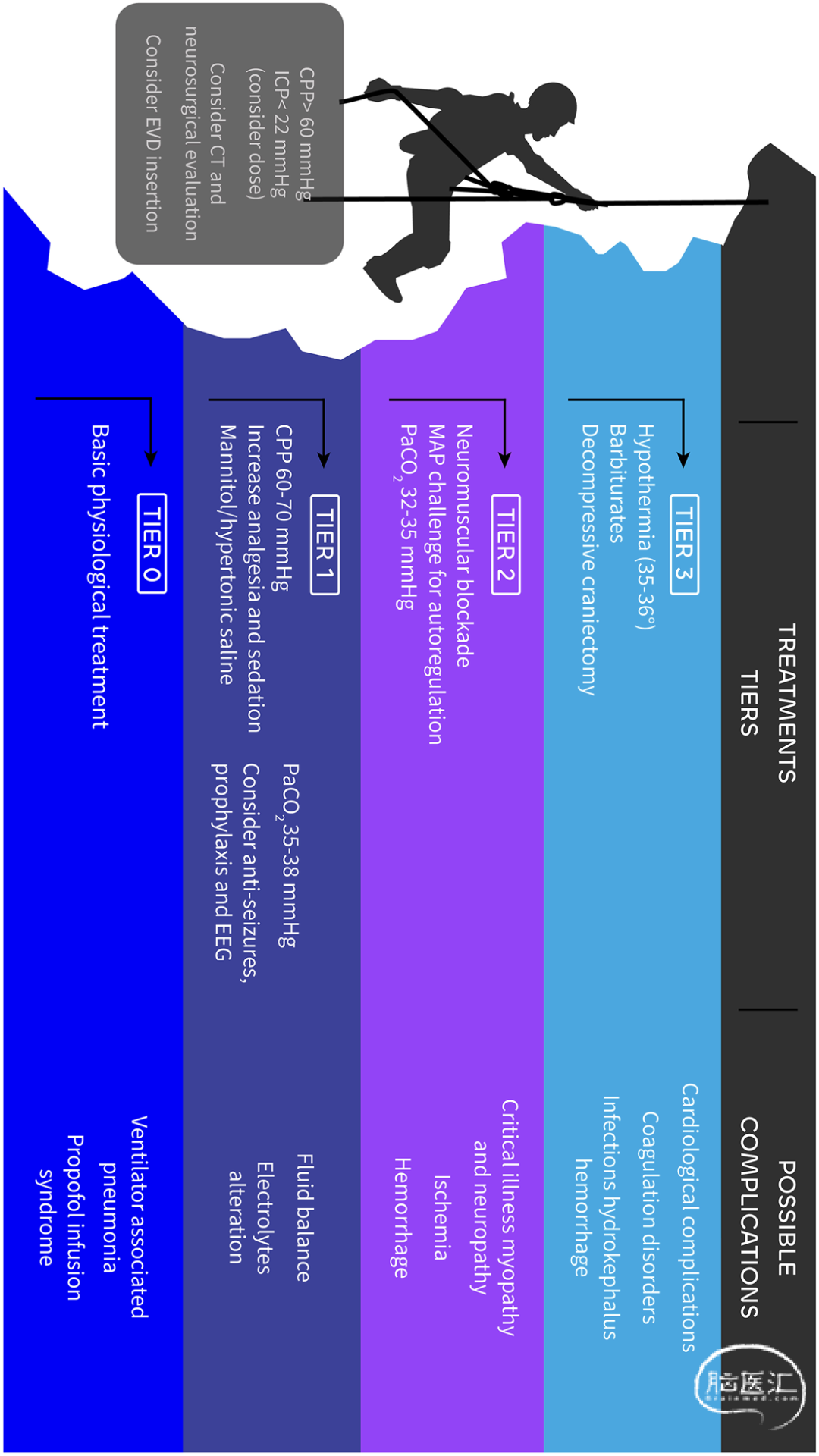
针对颅内压升高已发展出多种治疗手段[38]。现行治疗方案主张优先采用低风险治疗措施,并逐步升级至高风险干预。现代治疗策略基于风险-获益比将这些措施划分为三个层级[39,40],区别于既往"阶梯式"方案中规定的特定治疗顺序——后者仅对难治性颅内高压病例保留激进治疗措施(去骨瓣减压术、低温疗法、巴比妥类药物)(图2)。
图2 颅内压管理的阶梯式方案。CPP,脑灌注压;ICP,颅内高压;VAP,呼吸机相关肺炎;PRIS,丙泊酚输注相关综合征;PaCO2,二氧化碳分压;EEG,脑电图;MAP,平均动脉压;DC,去骨瓣减压术;EVD,脑室外引流:
高级有创神经监测技术
除颅内压监测外,多项有创技术可用于评估脑氧合与代谢状态,包括脑组织氧分压监测(PbtO₂)和脑微透析技术。PbtO₂监测在严重TBI中日益普及,用于检测脑缺氧状态[41]——低PbtO₂水平已被证实与不良神经预后独立相关[42],且这种关联性不受颅内压/脑灌注压测量值影响[43](图3)。BOOST II期前瞻性随机对照试验比较了单纯基于颅内压监测的治疗方案与联合PbtO₂指导的治疗策略对严重TBI的管理效果[44]。研究显示联合监测组在脑缺氧持续时间和严重程度方面具有统计学意义的改善。虽然该试验主要验证可行性而未设定足够效能检测总体预后差异,但确实观察到6个月死亡率降低和神经功能改善的趋势。Oxy-TC随机试验则发现,钝性TBI患者接受联合监测与单纯颅内压监测在功能预后方面无显著差异[45],尽管在颅内压升高亚组中观察到获益信号。目前正在进行更大规模的III期临床试验(BONANZA:ACTRN12619001328167;BOOST III:NCT03754114),旨在比较单纯颅内压管理与联合PbtO₂指导治疗的预后差异[46]。
图3 创伤性脑损伤患者的有创与无创多模态神经监测。EEG,脑电图;SSEP,体感诱发电位;EMS/NCV,肌电图/神经传导速度;TCD,经颅多普勒;ICP,颅内压;PbtO2,脑组织氧分压;CT,计算机断层扫描;MRI,磁共振成像;fMRI,功能磁共振成像;ONSD,视神经鞘直径;GFAP,胶质纤维酸性蛋白;UCH-L1,泛素羧基末端水解酶L1:
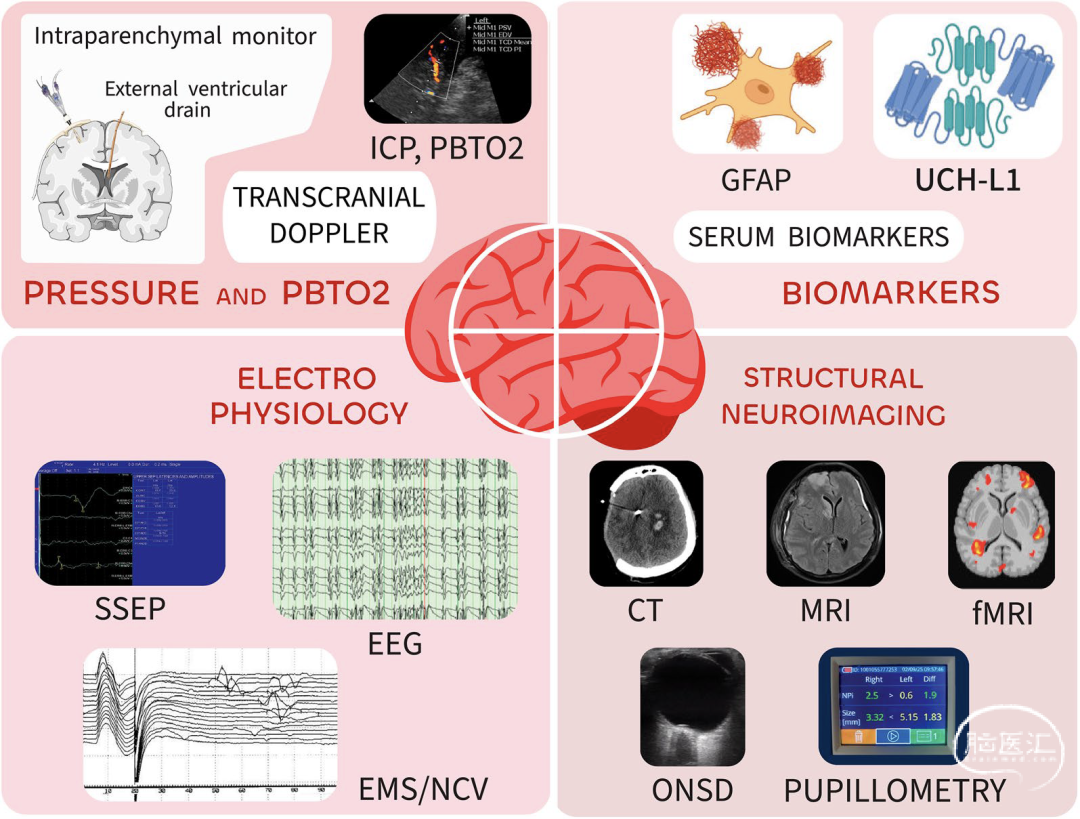
脑微透析技术深化了我们对TBI后急性脑功能障碍的认识,可作为床旁神经监测的补充工具[47]。乳酸/丙酮酸比值>25即提示不良预后,当>40时表明细胞能量危机。临床实践中,该比值超过35-40常触发治疗干预[48]。然而由于资源消耗大且缺乏确凿临床疗效证据,该技术尚未在全球神经重症监护病房普及。
目前临床上可用的无创神经监测工具包括瞳孔测量仪、脑部超声和脑电图[49]。
当前瞳孔测量技术使用专用设备定量评估瞳孔对光反射,相比传统主观评估能更精确分析瞳孔功能[50,51]。所有设备均通过评估瞳孔对光反应来测量一致的潜伏期、收缩与扩张幅度及速度参数。部分设备特有的预测指标可预警神经功能恶化并判断预后[52],但瞳孔测量在评估颅内压方面的作用仍存争议[49]。
基于超声的脑灌注评估作为无创神经监测手段已有数十年应用历史。经颅多普勒(TCD)测得的脑血流速度可用于计算颅内压,IMPRESSIT-2试验证实其具有排除高颅压的价值[53]。通过TCD计算的脑血管阻力指数(即搏动指数)及其衍生参数,也适用于创伤性脑损伤等非分隔型脑水肿的评估[54]。视神经鞘直径(ONSD)测量作为便捷的床旁无创颅内压替代指标,近年获得广泛研究。
近期发布的B-ICONIC专家共识指南为资源有限地区提供了无创多模态监测方案框架(包括瞳孔测量、ONSD、TCD搏动指数及TCD计算的无创颅内压)[49]。虽然这些工具不能完全替代有创颅内压监测,但在无法实施或有创监测禁忌时具有特殊价值,亦可作为有创监测的补充以深化对脑生理状态的理解。
脑电图(EEG)技术已广泛应用于TBI重症监护[55,56],包括癫痫发作的波形定性分析、定量EEG参数(振幅整合脑电图、相对频带功率、相对α变异性、频谱熵)及EEG反应性评估。其应用不仅限于癫痫检测,新证据表明人工智能辅助的EEG模型对预后判断具有价值[57]。现有证据尚不足以推荐持续或间断EEG监测的优选方案,决策应基于当地条件与临床情况。
近期出现的基于颅骨弹性测量技术(brain4care公司)评估颅内压与顺应性的方法展现出应用前景[58,59],但需进一步验证方可投入临床使用。
通气管理
在管理需要机械通气的创伤性脑损伤(TBI)患者时,存在若干特殊的临床考量[12,60]。实验与临床研究已描述了脑与肺病理生理学之间复杂且紧密交织的双向相互作用("脑-肺交互作用")。
历史上,急性脑损伤患者在机械通气实践研究中代表性不足。主要担忧在于低潮气量通气、较高呼气末正压[61]或俯卧位通气[62]可能导致颅内压升高,这使TBI合并急性呼吸窘迫综合征(ARDS)的管理存在潜在矛盾[63,64]。
虽然急性脑损伤的最佳通气目标尚未充分探索[65],但近期证据逐渐积累。高潮气量与脑损伤患者不良预后相关[66]。近期PROLABI随机对照试验在非ARDS脑损伤人群中比较肺保护性策略与传统通气方式,未显示死亡率、呼吸机依赖或ARDS发生率的差异[67]。但该试验因样本量不足提前终止,且未考虑镇静或神经肌肉阻滞对维持低潮气量通气的影响,故结论尚不明确。其他与预后相关的通气参数包括机械功率、驱动压、峰压和平台压[60,68,69]。VENTIBRAIN观察性研究表明,该人群普遍采用肺保护性通气策略且与死亡率改善相关[60]。
2020年欧洲重症监护医学会(ESICM)关于急性脑损伤机械通气的共识指南建议将氧分压维持在80-120 mmHg,显著高于普通重症患者推荐值(≥55 mmHg)。虽然低氧血症与高氧血症均与TBI不良预后相关[70,71],但U型曲线的确切临界值仍有待确定,且目标值可能需要个体化调整。
作为脑血管张力的重要调节因素,二氧化碳分压(PaCO₂)可影响颅内压和脑灌注。过度通气与通气不足均与脑损伤患者不良预后相关[72,73]。推荐维持PaCO₂于生理范围。深度过度通气风险较高,仅应作为脑疝发生时的短期措施[12]。略低的PaCO₂范围(32-35 mmHg)是TBI颅内压管理分层的一部分,联合PbtO₂监测时似乎安全可行。
预测气道保护反射受损患者的成功拔管仍是重大挑战[74-77]。迄今最大规模前瞻性研究ENIO(纳入48%TBI患者)显示,TBI患者拔管失败率低于其他脑损伤。需综合考虑的拔管成功预测因素包括生命体征、咽反射、吸痰频率、吞咽尝试、视觉追踪、GCS评分及预防性物理治疗[78]。最新指南建议在拔管前评估:GCS运动评分>6分、正常呼吸驱动、稳定的颅内状态、完整的气道保护反射(有效咳嗽、咽反射和吞咽尝试)及每小时气管内吸痰≤2次[79]。
脑损伤患者的气管切开实践差异显著。CENTER-TBI前瞻性研究报道气管切开率为8-50%,时机选择也存在差异[80]。延迟气管切开与不良神经预后相关。SETPOINT-2随机对照试验未显示早期气管切开对混合卒中人群的获益[81]。但2024年美国外科医师学会最新指南仍建议对重症TBI患者考虑早期(<7天)气管切开。
抗血栓药物管理与血栓预防
随着TBI患者老龄化趋势,因合并症使用抗血栓药物的情况日益普遍[82]。TBI后需立即逆转药物性治疗性凝血功能障碍。2024年美国外科医师学会(ACS)《创伤性脑损伤管理最佳实践指南》针对抗血栓逆转、重启时机及最佳血栓预防启动时间提出了最新建议(https://www.facs.org/media/vgfgjpfk/best-practices-guidelines-traumatic-brain-injury.pdf)。
抗凝剂(维生素K拮抗剂、直接口服抗凝药)的急性逆转临床实践已较成熟,但ACS指南建议"考虑抗凝逆转"而非强制要求所有TBI患者执行。对于出血高风险患者(如需紧急手术、脑室外引流置入、血肿扩大高风险或危及生命的出血)推荐急性逆转。入院CT显示的出血性病灶在创伤后24小时内进展风险最高[83],尤其伤后数分钟至数小时风险急剧升高,且血肿扩大与不良预后强烈相关,这支持急性抗凝逆转的合理性。
血小板输注逆转抗血小板治疗的效果较不确定。虽然脑出血患者理论上适用,但自发性脑出血研究显示其潜在危害。因此不建议对病情稳定(无活动性出血)且无需(神经)手术的TBI患者输注血小板来逆转抗血小板药物效果[84]。最新指南建议临床判断决定:对于接受手术/有创操作且血小板低下的抗血小板治疗TBI患者,是否需输注血小板以达到止血[79]。
重启抗凝治疗需基于风险-效益评估及间隔CT显示的出血进展情况。通常建议先使用低分子肝素或普通肝素,再过渡至口服抗凝药。房颤患者可延迟数周重启抗凝[85],但具体时机应个体化评估血栓栓塞绝对风险。
目前共识认为若无禁忌证,应在TBI后72小时内启动药物性静脉血栓栓塞预防。但缺乏强证据指导该时间窗内的个体化启动时机,故各指南推荐存在差异[85]。对中高风险非手术TBI患者,若随访头颅CT显示颅内损伤无进展,建议伤后24-48小时内开始预防。开颅或去骨瓣术后患者,若术后CT显示颅内出血稳定,同样建议24-48小时内启动预防。
关于维生素K拮抗剂逆转,尚不明确4因子凝血酶原复合物应采用固定剂量还是体重调整剂量。直接口服抗凝药的实验室检测方法定义不清,阻碍了精准的药物逆转剂量确定。
TBI后重启治疗性抗凝和抗血小板治疗的时机需要随机试验证据来制定更个体化的建议。72小时内启动药物预防的具体时机,以及机械预防与药物预防的相对效果也需进一步评估[86-90]。电子补充材料表S1总结了最新指南对TBI患者抗血栓逆转、重启及血栓预防的建议。
液体管理、输血与血流动力学调控
TBI患者的血流动力学管理因合并出血/脊髓休克、需优化脑灌注或处理脓毒症/消化道出血等继发并发症而具有挑战性[91,92]。晶体液仍是ICU一线液体选择,但平衡液与90天死亡率升高相关(尤其GCS<6患者)[93]。大型随机试验的二次分析校正多种混杂因素后得出相似结论[94]。
虽然避免低血容量对维持全身及脑灌注至关重要,但也不应低估液体过负荷风险。TBI患者液体管理实践差异显著,正平衡程度与不良预后相关[95]。但目前对目标零平衡的可行性及临床获益仍存在科学争议。核心目标是优化容量状态及脑灌注氧合,同时最小化液体过负荷风险。目前尚不确定心输出量或神经监测指导的个体化血流动力学管理策略是否更具优势。
广泛采用血管加压药维持CPP在60-70 mmHg可预防低血压,部分代偿低血容量并避免液体过负荷。虽然目前对高级血流动力学监测的类型和作用无特定指征,但对血流动力学不稳定或需大剂量血管活性药物的患者应考虑使用。
两项近期随机对照试验评估了TBI患者自由(<9-10 g/dL)与限制性(<7 g/dL)血红蛋白输血阈值策略。一项研究显示自由策略使6个月不良神经功能结局绝对降低6%(无统计学意义)[96]。另一试验在急性脑损伤混合人群中发现较高血红蛋白目标使不良结局绝对降低10%,TBI亚组获益一致[97]。这些发现提示该人群可能需要更高的红细胞输注血红蛋白阈值。
其他并发症管理(急性肾损伤、电解质紊乱、营养支持)
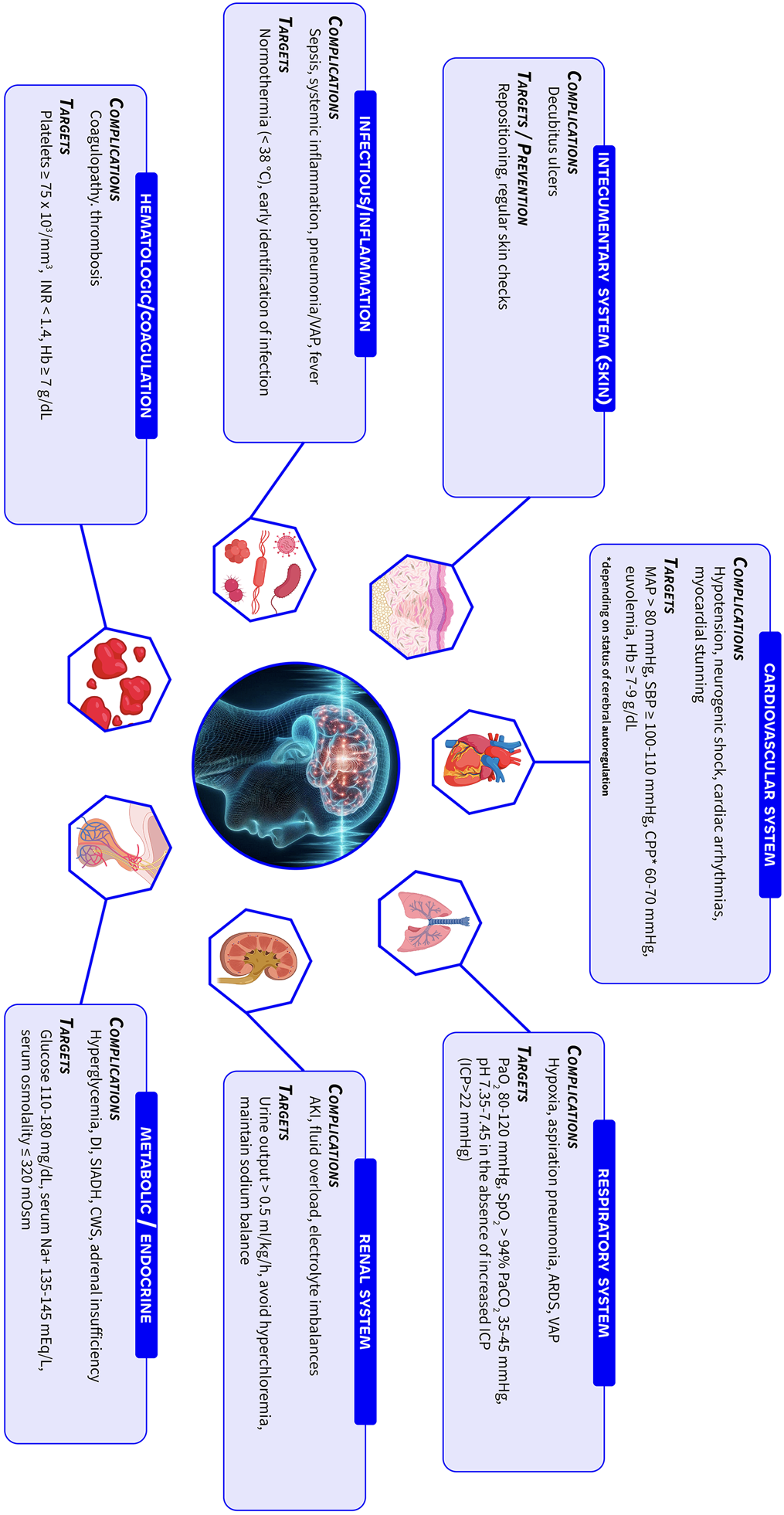
在创伤性脑损伤(TBI)及其急性期管理相关并发症中,癫痫发作、急性肾损伤和电解质紊乱尤为突出(图4)。
图4 创伤性脑损伤患者的常见全身并发症(由Jeanette Tas使用BioRender.com制作)。AKI,急性肾损伤;ARDS,急性呼吸窘迫综合征;CPP,脑灌注压;CWS,脑性耗盐综合征;DI,尿崩症;ICP,颅内压;INR,国际标准化比值;MAP,平均动脉压;PaCO2,二氧化碳分压;PaO2,氧分压;SBP,收缩压;SIADH,抗利尿激素分泌异常综合征;SpO₂,外周血氧饱和度;VAP,呼吸机相关性肺炎:
癫痫是TBI后常见致残性并发症,约20-50%患者受累(取决于损伤严重程度和部位)。按发生时间可分为早期(伤后<7天)和晚期(>7天)癫痫。早期创伤后癫痫50%发生于24小时内,儿童(30-35%)及穿透性脑损伤、皮质挫伤或硬膜下血肿患者更易发生(成人发生率10-15%)[98]。这些因素也增加晚期癫痫风险,后者潜伏期较长但80%于伤后2年内发作。
《脑创伤基金会指南》在权衡治疗获益与风险后,推荐使用苯妥英钠降低早期创伤后癫痫发作(IIA级证据)[33]。需注意:早期抗癫痫药物不能预防迟发性癫痫或创伤后癫痫,也不改善功能预后[99]。预防性抗癫痫治疗应短期使用(尤其苯妥英钠可能影响神经认知功能恢复)。对早期创伤后癫痫患者,需立即启用抗癫痫药物并持续数周。除苯二氮䓬类(劳拉西泮、地西泮)外,磷苯妥英、丙戊酸钠和左乙拉西坦是常用有效药物[100]。
约17%的TBI患者发生急性肾损伤,90%以上见于伤后5天内,与死亡率升高相关[101]。病因包括低血压/血流动力学不稳定、神经体液改变、横纹肌溶解、创伤直接效应或药物肾毒性[102]。男性及重型TBI患者更易发生。早期管理策略包括:通过液体复苏维持肾灌注、纠正电解质紊乱(对低血压/血流动力学不稳定患者尤为重要)。严重病例可能需要肾脏替代治疗(尽管适应证尚未明确且无证据显示改善TBI预后)。需密切监测血尿素氮和钠浓度以防脑水肿,故连续性肾脏替代治疗通常优于间歇性血液透析(尤其对血流动力学不稳定或高颅压风险患者)。
多达2/3的TBI患者出现电解质紊乱,涉及钠、钾、镁和钙异常[103]。钠失衡最常见,源于下丘脑/垂体等水盐调节中枢损伤或肾/肾上腺功能不全。低钠血症可导致脑水肿、颅内压升高并阻碍脑功能恢复。临床表现包括尿崩症(DI)、脑性耗盐综合征(CSW)和抗利尿激素分泌异常综合征(SIADH)(图4)。
TBI后DI通常为一过性,因抗利尿激素分泌减少导致水重吸收下降,表现为低渗性多尿、脱水和高钠血症。SIADH因抗利尿激素过量分泌引起水潴留和低钠血症。CSW则通过肾脏钠水丢失导致低容量性低钠血症。这些病症可同时出现,需通过监测电解质和液体平衡实施针对性治疗:轻度DI行补液治疗,重度DI加用激素替代;SIADH予高容量生理盐水输注;CSW需含钠液体扩容。
钙镁失衡因其对细胞功能和神经元兴奋性的关键作用而备受关注。低钙血症和低镁血症会增加癫痫风险,需谨慎补充。
最新指南建议血流动力学稳定后24-72小时内启动肠内营养支持,力争伤后7天内达到全量营养。通常优选幽门后喂养途径,但若因此延迟营养支持,经胃途径早期喂养也可接受。仅当肠内营养禁忌时才推荐肠外营养[79]。
预后评估对确定治疗强度、指导康复策略及决策是否撤除生命支持至关重要。然而,即使采用成熟的预测工具,功能恢复或死亡率的预测仍不精确且存在显著不确定性[2,104]。研究表明,ICU中TBI患者的主要死亡原因是撤除治疗,多发生于伤后2周内,这凸显了谨慎预后评估的极端重要性[105]。
虽然格拉斯哥昏迷评分(GCS)[106]、瞳孔反应和年龄等临床因素与TBI预后相关,但其可靠性参差不齐。单一预测指标不足以精确评估预后,因此开发了整合多变量的预测模型,如"严重颅脑损伤后糖皮质激素随机化研究"(CRASH)和"国际TBI预后与临床试验分析计划"(IMPACT)模型[107]。尽管这些模型提高了预测准确性,但其可靠性仍属中等,使用时需结合更广泛的临床背景。
鉴于这种复杂性,预后评估应采用多模态方法,包括系列临床评估、神经影像学和电生理检查[108]。功能磁共振成像和脑电图有助于更好地理解意识障碍的病理生理机制[109],并辅助预后判断。
临床医生必须承认所有预测模型固有的不确定性,并向决策代理人透明传达预后评估结果,强调预后是连续谱而非二元分类。伦理考量要求尊重患者价值观的共同决策,以最小化过早撤治的风险。未来研究应聚焦于通过整合生物标志物(如胶质纤维酸性蛋白[GFAP]和泛素羧基末端水解酶L1[UCH-L1])[110]、先进影像技术和机器学习方法优化预测模型,实现个体化结局预测。
尽管TBI的病理生理机制全球相似,但许多地区难以实现理想管理。尽管中低收入国家(LMICs)疾病负担更重,现有文献主要基于高收入国家(HICs)的研究。
HICs主导的文献设定了难以普遍适用的标准。特定环境优先级与广泛的资源和资金限制相互影响,阻碍了许多HICs解决方案的采纳。需要因地制宜的方法[49]。最新研究表明,尽管资源有限,LMICs的6个月预后结果可与HICs相当[111]。前瞻性测试证实,标准化流程可改善预后,基于临床表现和神经影像(无需ICP监测)的CREVICE共识方案安全有效[112-114]。提供适应当地实际的"TBI管理算法工具箱"是现实选择[115]。
ICU床位严重不足限制了许多患者获得重症监护。需研究将去骨瓣减压术作为非手术资源限制替代方案的普遍做法是否有效。经济可重复使用的无创ICP监测技术可显著提升护理质量和效率。
优秀的ICU护理需院前院后支持。医疗转运资源匮乏、距离遥远和交通拥堵等问题阻碍了针对继发性脑损伤的早期干预,影响救治成功率和院前存活筛选。在更大规模解决方案出现前,创新利用现有资源(如培训出租车司机作为第一响应者[116]和建立分级TBI复苏网络)可能缓解这些障碍,但需要严格的转运、复苏和到达数据支持。
出院后康复在可及性和可负担性方面基本缺失,削弱了急性期治疗带来的恢复潜力。应研究创新过渡方案(如利用核心家庭成员实施康复治疗),获取前瞻性长期随访数据至关重要。
理解并平衡TBI管理的多因素需求与当前可用资源,需要多学科协作及行政部门对问题严重性的认识。必须将HICs文献中的生理学"解决方案"与实际情况相结合以指导有效治疗。需用更务实的概念取代将所有资源有限现实笼统归为LMICs的误导性做法。
数十年来,TBI管理主要将其视为急性事件。严重病例根据意识水平和CT表现识别,需在急性期采取一系列干预预防或减轻继发性脑损伤(通常以统一的ICP和CPP阈值为指导)。历史上,对较轻TBI无针对性干预,对严重TBI急性期后也无公认治疗方案。一旦急性期结束,结局即被视为不可逆转。
生物标志物和先进影像研究表明,TBI并非单一病理实体[117](图5),可根据影像和生物标志物特征分层,为开发个体化治疗策略奠定基础。胶质纤维酸性蛋白(GFAP)、泛素羧基末端水解酶L1(UCH-L1)和S100钙结合蛋白(S100B)等生物标志物可用于排除GCS 13-15分疑似TBI患者的CT检查需求。损伤当日这些标志物的升高程度可评估潜在脑损伤严重程度,其血浓度也有助于预测GCS 3-12分TBI患者6个月功能恢复[79]。
图5 血液生物标志物在TBI分类中具有时间依赖性应用价值。在急性期(<24小时),GFAP、UCH-L1和S100B有助于创伤性颅内损伤的诊断和预测(已获FDA/EMA批准)。在亚急性期(1-30天),Nfl、GFAP和S100B可预测神经影像学异常和长期预后。虽然在慢性期(>30天)的证据有限,但Nfl、GFAP和p-tau有望作为持续性损伤和神经退行性变的指标。GFAP,胶质纤维酸性蛋白;p-tau,磷酸化tau蛋白;Nfl,神经丝轻链;DAMPs,损伤相关分子模式;IL,白细胞介素;TNF-alpha,肿瘤坏死因子α;NSE,神经元特异性烯醇化酶;UCH-L1,泛素羧基末端水解酶L1:
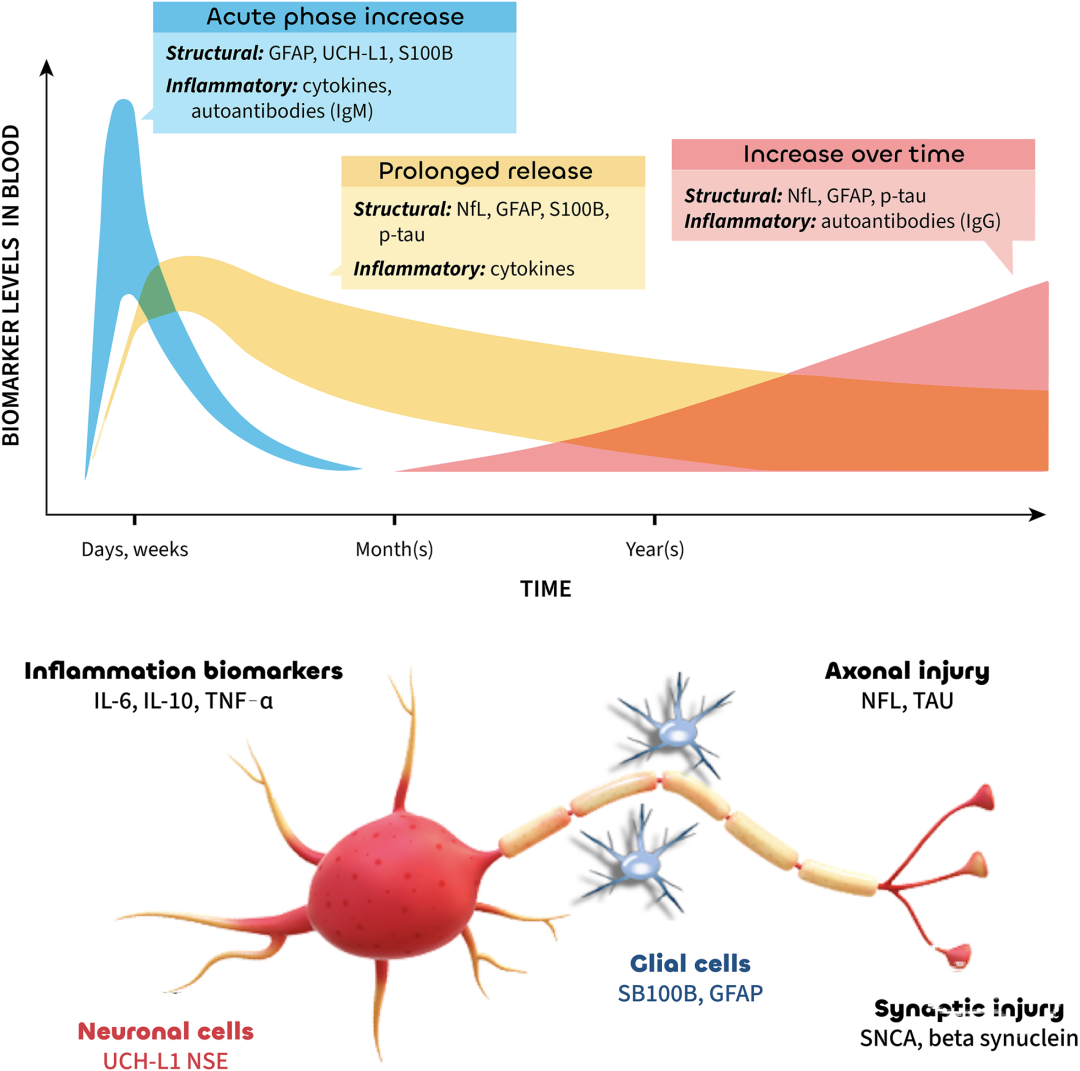
神经炎症和继发性脑损伤在急性期后数月甚至数年仍持续活动[118,119],因此靶向神经炎症通路和氧化应激可能减轻继发损伤并改善预后。间充质干细胞疗法通过作用于多种修复机制,在解剖损伤恢复阶段展现潜力,对认知和感觉运动功能具有积极作用[120],部分神经调节疗法也显示出前景[121]。
人工智能(AI)驱动的决策支持有望革新神经重症管理[122],尽管目前多数应用仍处于技术成熟度较低阶段[123]。AI已用于神经影像和脑电图解读,提高工作效率并实现实时癫痫检测(但其角色是辅助而非替代临床医生)。利用多模态神经监测数据的预测模型不仅能个性化定义继发性脑损伤,还可提前预测以实现主动预防,这需要临床实践向基于概率的干预转变[124]。
即使对严重损伤,传统康复方法结合神经可塑性靶向治疗和脑机接口也有望改善长期功能恢复[125]。最后,鉴于目前全球TBI护理差异和多数病例发生在中低收入国家的现状[2],通过远程医疗、标准化指南和资源匮乏地区的能力建设解决这些不平等至关重要。
尽管需要重新思考临床试验设计的清晰性、效率、整合性和利益相关方协调性[126],但仍需开展大规模多中心试验评估创新药物和非药物干预措施。需进一步研究以更好理解TBI涉及的多因素机制,从而更深入认识患者特征和表型,实现治疗个体化和预后改善。
创伤性脑损伤仍是临床医生面临的重大挑战。通过聚焦颅内/外并发症所致继发性脑损伤的早期发现和治疗,积极治疗和监测技术进步已改善死亡率和神经功能恢复。但关于最佳实践和护理标准仍存疑问,特别是可能帮助个体化治疗和定义治疗表型的预后工具。未来研究应着重理解TBI后恢复的自然史、确立精确分类标准和术语、更深入认识影响预后的因素,以实现该人群的精准诊断、预后判断和监测。
Intensive Care Med
. 2025 Jun;51(6):1112-1127. doi: 10.1007/s00134-025-07967-1. Epub 2025 Jun 16.
Traumatic brain injury management in the intensive care unit: standard of care and knowledge gaps
*本文转载自微信公众号“脑血管病及重症文献导读”,脑医汇获授权转载
![]()
声明:脑医汇旗下神外资讯、神介资讯、脑医咨询、Ai Brain 所发表内容之知识产权为脑医汇及主办方、原作者等相关权利人所有。
投稿邮箱:NAOYIHUI@163.com
未经许可,禁止进行转载、摘编、复制、裁切、录制等。经许可授权使用,亦须注明来源。欢迎转发、分享。
投稿/会议发布,请联系400-888-2526转3。




