尼莫地平(Nimodipine)是一种二氢吡啶类L型钙通道拮抗剂,是预防动脉瘤性蛛网膜下腔出血(aSAH)患者发生迟发性脑缺血(DCI)的主要治疗手段之一[1, 2]。尽管它并不能显著预防血管造影显示的血管痉挛,但研究表明其可降低脑梗死发生率并改善功能预后[1, 2]。
大多数临床医生在日常实践中都会使用尼莫地平。MANTRA调查研究结果显示,在292名受访者中,高达88%的医生使用尼莫地平预防DCI,其中大多数(71.3%)采用口服或肠内给药方式[3]。
此外,神经重症监护学会(Neurocritical Care Society)的最新指南[4]特别推荐aSAH患者口服尼莫地平,以减少DCI和脑梗死发生率并改善功能预后(强推荐,中等证据质量)。而美国心脏协会/美国卒中协会(AHA/ASA)更新的指南则建议:“aSAH患者应尽早开始肠内尼莫地平治疗,以预防DCI并改善功能预后”(I类推荐,证据等级A)[5]。
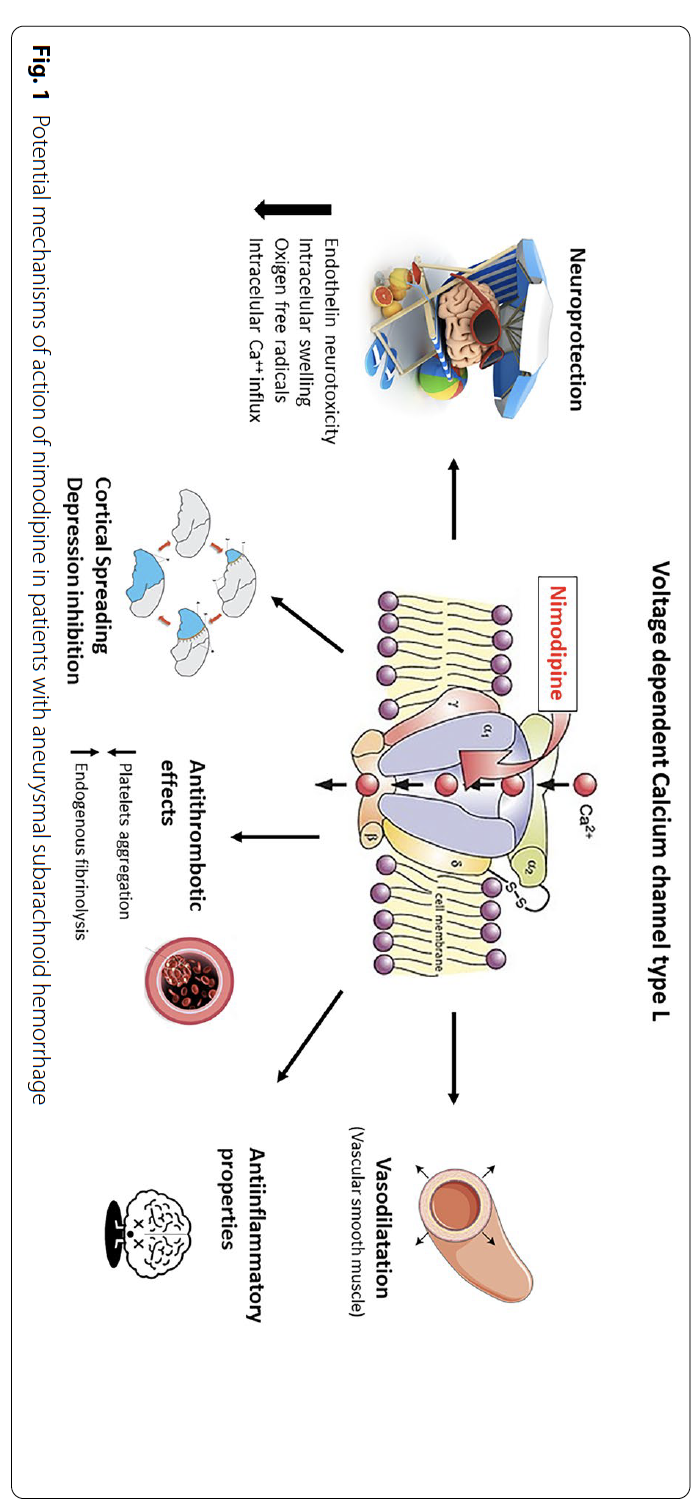
然而,目前指南支持的尼莫地平改善神经功能预后的证据仍存在多方面争议。一方面,Bellapart等[6]研究表明,在血管造影证实存在血管痉挛的患者中,尼莫地平仅能降低死亡和植物状态风险,但对较轻的神经功能缺损无显著改善作用。此外,尼莫地平在aSAH中的确切作用机制尚不明确[1, 2]。尽管其血管舒张特性最初支持“尼莫地平可减轻血管痉挛及其后果”的假说,但最新证据表明,该药物的积极作用可能涉及其他机制[2],包括但不限于减少皮质扩散性抑制、增强内源性纤溶活性从而减少脑微血栓形成[2](图1)。
本文中,我们将探讨尼莫地平给药途径、剂量和时机的争议,并讨论未来研究的潜在方向。
尼莫地平的药代动力学
与药效学特性
尼莫地平口服吸收迅速,1.5小时内达血药峰浓度。由于其首过代谢效应显著,口服生物利用度约为13%[7]。尼莫地平95%与血浆蛋白结合,在肝脏代谢,终末消除半衰期约为8-9小时,但初始消除较快(半衰期1-2小时)[7],其代谢产物无活性。该药物脂溶性高,可透过血脑屏障。
在一项针对23名持续静脉输注尼莫地平的患者的研究中,动脉血和脑脊液(CSF)中的尼莫地平浓度无相关性[8]。但该研究发现,CSF浓度存在个体差异,且较高的CSF浓度与更好的长期临床预后相关[8]。此外,近期发表的NEWTON随机对照试验(RCT)评估了单剂量脑室内缓释尼莫地平微粒在aSAH患者中的应用,结果显示CSF中尼莫地平浓度较高,血管痉挛、DCI及补救治疗需求减少,但对临床结局无显著影响[9]。
尼莫地平通过细胞色素P450 3A4(CYP3A4)系统代谢,因此可能与神经重症患者常用药物发生相互作用[7]。CYP3A4抑制剂(如红霉素、克拉霉素、利托那韦、酮康唑、伏立康唑、伊曲康唑、氟西汀、西咪替丁和丙戊酸)可升高其血药浓度;而CYP3A4诱导剂(如卡马西平、苯巴比妥和苯妥英)则会降低其血药浓度[7]。
给药途径
神经重症监护学会与AHA/ASA指南均基于数十年前的RCT研究[10, 11],推荐口服或肠内给予尼莫地平[4, 5]。
MANTRA调查显示,71%的受访者采用口服/肠内给药,9%使用静脉给药,20%联合使用两种途径[3]。静脉给药因更高的低血压风险而备受争议[12-14]。近期Rass等[12]研究表明,口服/肠内给药的低血压发生率为1/10,而静脉给药为1/3,支持既往研究结论[13, 14]。观察性数据表明,低血压和血压变异性与aSAH患者的不良预后相关[15]。
然而,与空腹给药相比,尼莫地平与食物同服会降低血药峰浓度和生物利用度[7],这在神经重症监护病房中尤为棘手。此外,近期一项多中心研究指出,不同肠内尼莫地平制剂及给药技术可能存在不等效性,这可能与辅料差异、给药操作不一致或准确性不足、以及生物利用度变化有关[16]。因此,口服与肠内给药可能无法完全互换——口服剂型为胶囊,而肠内给药可能通过预充注射器或从胶囊中提取药物[16]。值得注意的是,某些国家的尼莫地平为片剂,其药代动力学特征与胶囊剂型不同(至少在健康受试者中如此)。
近期荟萃分析表明,口服与静脉给药在预防不良预后、DCI及神经功能缺损方面效果相当[17, 18],但这些分析受限于静脉给药的临床研究数量较少。尽管静脉途径的主要顾虑是低血压风险(但相较于口服/肠内制剂,静脉给药不受进食和首过效应影响,血药浓度波动更小),且aSAH患者日益普及的微创/有创血流动力学监测可能提升静脉给药的安全性并改善预后[19],作者认为仍需开展RCT直接比较口服/肠内与静脉途径的疗效。需特别指出,传统静脉尼莫地平制剂含25%乙醇,可能刺激血管,故需经中心静脉导管给药。目前一项行业资助的RCT(NCT05995405)正在评估新型静脉制剂(采用非离子表面活性剂胶束溶解尼莫地平,不含高浓度乙醇),结果尚未公布。
动脉内给药是另一种潜在选择。对于诱导高血压治疗无效的DCI患者,动脉内尼莫地平解痉治疗已被广泛应用[3, 20],但该方式可能引起血压波动,需增加血管加压药用量以维持目标血压。Weiss等[21]提出改良方案,证明动脉内解痉治疗可降低血压管理目标而不影响疗效。Vossen等[22]研究显示,约半数接受动脉内挽救性解痉治疗的患者长期预后良好。
脑室内给药也已被探索。一项I/IIa期研究确定了aSAH患者脑室内缓释尼莫地平的最大耐受剂量(800 mg),且未观察到相关低血压(肠内给药组低血压发生率为17%,3/18)[23]。但后续NEWTON RCT研究发现,尽管600 mg单剂量脑室内缓释尼莫地平(EG-1962)可降低血管痉挛、DCI及挽救治疗需求,却未能改善90天临床结局,试验因此提前终止[9]。
剂量与给药间隔
临床最常用方案为60 mg口服/肠内给药,每4小时一次,持续21天[5]。但需强调的是,该剂量与预后的量效关系缺乏证据支持。更高剂量(90 mg/4 h)虽可能增加良好恢复率,但3个月死亡率也有非显著性升高趋势(尼莫地平组47.2% vs 安慰剂组39%)[24]。而120 mg/4 h的剂量则因半数受试者出现显著低血压被警示[25]。值得注意的是,Allen等[10]的里程碑研究采用负荷剂量(0.7 mg/kg)后按0.35 mg/kg每4小时给药,以80 kg患者为例,实际剂量(56 mg负荷量+28 mg维持量)远低于现行推荐剂量,提示aSAH患者的最小有效剂量仍有待确定。
尼莫地平相关低血压常导致剂量分割、减量或停药[4, 5, 26, 27]。回顾性研究提示调整给药方案与不良预后相关,但这些结论可能存在偏倚——剂量调整多发生在确诊DCI/血管痉挛或启动升压治疗时[28-30]。剂量分割可能改变口服尼莫地平"锯齿状"药时曲线,降低疗效(静脉给药则可维持相对稳定的血药浓度)。此外,年龄、性别、肝肾功能及基因多态性均可导致血药浓度显著差异[31],不同制剂和给药技术也会影响生物利用度[7, 16, 31]。
尽管尼莫地平浓度与预后的相关性证据有限[31],作者认为未来需重点研究该关联,以指导aSAH患者的个体化给药。一项比较口服、静脉及动脉给药后脑内药物浓度的研究(NCT04649398)正在进行,可能为优化给药策略提供依据。该领域现有研究多纳入轻-中度aSAH患者,而重症患者的剂量需求可能存在差异。
给药时机与疗程
现行指南建议在出血后96小时内(即"血管痉挛窗"前)启动尼莫地平治疗[7],但最佳时机仍有争议。例如西班牙重症医学会将"发病12小时内给药"列为质量标准[32]。
关于疗程,经典研究[10, 11, 24]及指南[5]支持21天方案,但也有学者认为不应超过14天[7]——这与血管痉挛高风险期的时间窗相符。虽无前瞻性RCT比较不同疗程,但单中心回顾性研究显示14天[33, 34]或更短[35]疗程(尤其对轻-中度aSAH患者[34])可能获得相似疗效。考虑到DCI病理生理认知的更新及尼莫地平安全性争议,作者认为这是未来研究的重要方向。
尼莫地平的预防性应用获益最早见于40年前一项多中心RCT:125例aSAH患者中,96小时内启动尼莫地平治疗(0.7 mg/kg负荷量+0.35 mg/kg q4h×21天)使重度血管痉挛致残/致死率从安慰剂组的13.3%降至1.78%(p=0.03)[10]。但该研究报道的血管痉挛发生率低于当代数据,可能与当前监测技术的进步减少了漏诊相关。
后续样本量最大的英国动脉瘤尼莫地平试验(n=554)采用固定剂量60 mg q4h×21天,结果显示尼莫地平组脑梗死相对风险降低34%(95%CI 13-50%),不良预后风险降低40%(95%CI 20-55%)[11]。该研究未聚焦血管痉挛本身,而是以脑梗死和临床结局为终点。值得注意的是,21天内提前停药率达23%(主要因血管造影阴性),且尼莫地平组再出血率更低(9% vs 14%)[11]。
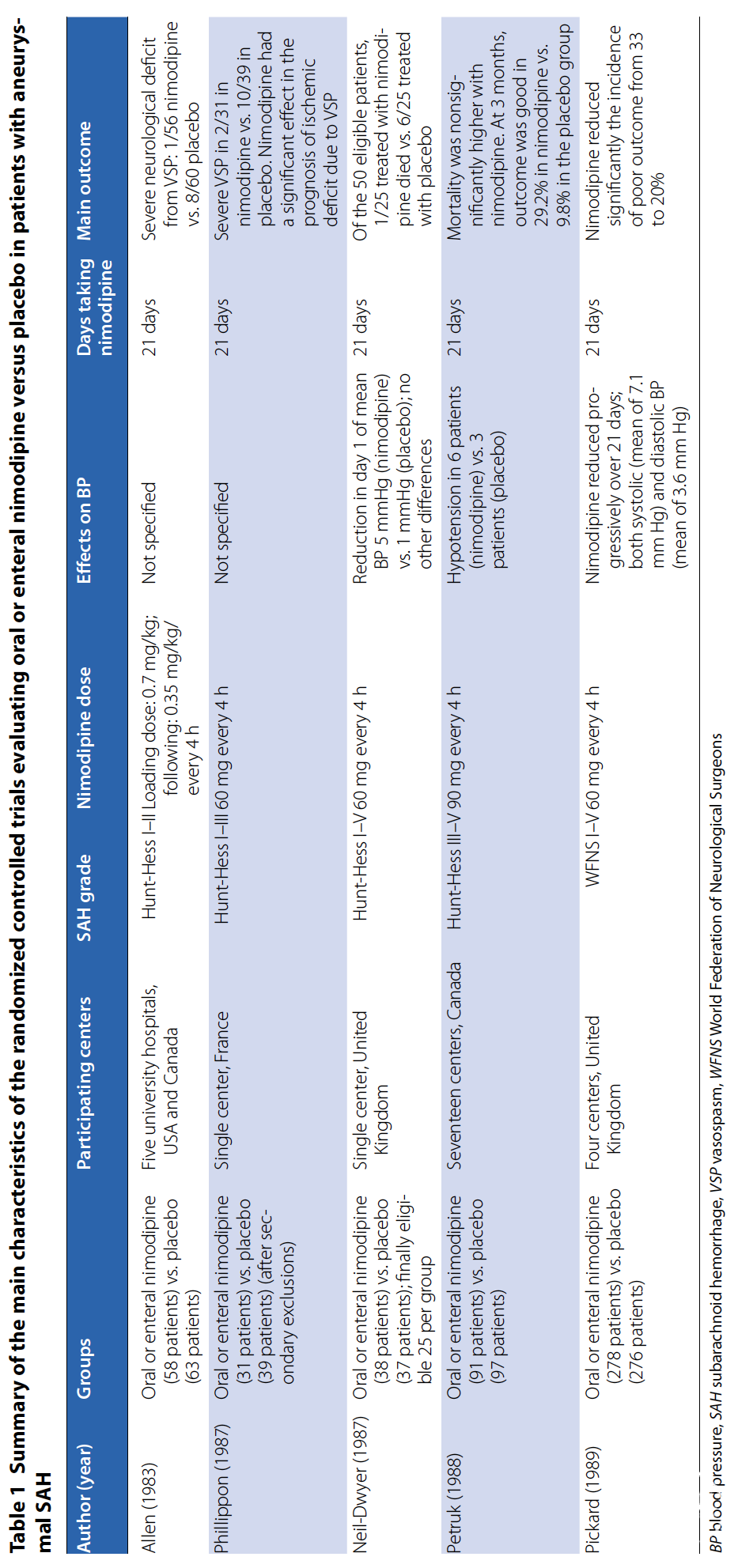
同期其他样本量较小的RCT研究在重症[24]和轻-中度aSAH患者[36]中均观察到相似结果。值得注意的是,这些研究中尼莫地平组与对照组出现严重血管痉挛的患者比例并无显著差异[24-36]。Neil-Dwyer等[37]虽未评估血管痉挛,但发现尼莫地平并未增加脑血流量,却与死亡率降低相关[34]。表1总结了迄今评估口服/肠内尼莫地平对比安慰剂的RCT主要特征。
一项纳入13项研究的荟萃分析显示,尼莫地平组不良预后风险显著降低(RR 0.69,95%CI 0.60-0.78),同时死亡率(RR 0.50,95%CI 0.32-0.78)和血管痉挛发生率(RR 0.68,95%CI 0.46-0.99)也明显下降[38]。而最新范围综述(纳入8项RCT)指出,仅3项研究显示尼莫地平能降低缺血性缺损导致的死亡/植物状态风险(RR 0.62,95%CI 0.45-0.86)[6]。这些差异反映了该领域研究的局限性:早期试验在病情严重度、入组标准、定义、给药方案及结局指标等方面存在明显异质性,且尼莫地平代谢变异性大、药物相互作用频繁。
神经重症医师需认识到,尼莫地平最初的应用基础是预防血管造影显示的脑血管痉挛。但现代DCI概念已远超血管痉挛范畴[1,21,39-41],尼莫地平通过尚未完全阐明的机制改善预后(图1),甚至在不预防血管痉挛的情况下仍有效[2,35-42]。这引发新的思考:若在2024年开展安慰剂对照试验,鉴于aSAH诊疗模式已发生根本性变革(如避免高血容量、微创/有创监测技术的普及、血管内治疗进步等)[2,5],尼莫地平的获益是否依然显著?
从实践角度看,对已上市药物开展超说明书用药研究,比开发新药更易实施[2]。但尼莫地平在创伤性脑损伤等其他急性脑损伤中未显示获益[43],提示需重新评估其当前在aSAH中的应用策略。不同脑损伤病因可能影响其神经保护效果,这为给药途径、剂量和时机的优化提供了理论基础。采用贝叶斯分析等新型研究设计,或探索尼莫地平与其他疗法联合应用的"集束化治疗"方案(如脑出血治疗模式[44]),可能更具研究价值。
尽管尼莫地平是aSAH治疗的基石,其现行给药方案仍存在诸多争议。作者认为,当前伦理委员会不太可能批准尼莫地平对照安慰剂的RCT(尤其对重症患者),但针对不同给药途径、剂量和时机的比较研究仍有广阔空间。未来应通过创新试验设计,进一步优化这一经典药物的临床应用策略。
Neurocrit Care
. 2025 Apr;42(2):334-340. doi: 10.1007/s12028-024-02182-0. Epub 2024 Dec 17.
Nimodipine in Aneurysmal Subarachnoid Hemorrhage: Are Old Data Enough to Justify Its Current Treatment Regimen?
*本文转载自微信公众号“脑血管病及重症文献导读”,脑医汇获授权转载
![]()
声明:脑医汇旗下神外资讯、神介资讯、脑医咨询、Ai Brain 所发表内容之知识产权为脑医汇及主办方、原作者等相关权利人所有。
投稿邮箱:NAOYIHUI@163.com
未经许可,禁止进行转载、摘编、复制、裁切、录制等。经许可授权使用,亦须注明来源。欢迎转发、分享。
投稿/会议发布,请联系400-888-2526转3。





