Percheron于1973年首次描述Percheron动脉(artery of Percheron,AoP)这一罕见解剖变异,该动脉作为后大脑动脉(PCA)P1段发出的单一分支,替代了本应双侧存在的丘脑穿通动脉,负责供应双侧丘脑旁正中区[1]。AoP变异存在于4%-12%的人群中,约占所有缺血性卒中的0.1%-2%[2]。丘脑血供通常主要来源于后交通动脉(PComA)以及PCA的P1、P2段发出的穿通小分支[1,3]。考虑到显著的个体差异和重叠分布,丘脑血管供血传统上分为四个区域:前部、旁正中区、下外侧部和后部[2](图1)。
图1 1.1 (A) 丘脑血液供应示意图。AN,前核;LN,外侧核;MDN,内侧背核;PUL,枕核。改编自Renard等人。图1.2 显示供应内侧丘脑的旁正中动脉解剖变异的示意图:(A) I型:左右旁正中动脉分别独立起源于双侧PCA。(B) IIA型:双侧旁正中动脉均单独起源于左侧或右侧PCA。(C) IIB型(Percheron动脉):Percheron动脉解剖结构;从左侧或右侧PCA发出的单一分支分叉供应双侧丘脑。(D) III型:双侧旁正中动脉起源于连接双侧PCA的动脉弓:

急性AoP缺血在对称性、范围和受累区域方面存在很大变异性,这主要源于个体间丘脑动脉供血的差异[2-4]。AoP管径过小,常规CT或MR血管成像难以显示,少数情况下可在PCA上观察到极细的共同主干(图2)[4]。AoP梗死的诊断具有时间敏感性,延误或误诊可能错失溶栓治疗时机,导致患者临床状况进一步恶化。
图2 三维容积重建CT血管成像显示Percheron动脉(AoP),可见其作为单一血管干从左后大脑动脉(PCA)发出(箭头标示):

本文旨在通过影像学资料直观展示成人AoP梗死的多样化表现,并重点探讨可能与之混淆的重要病变,从而提高对丘脑卒中患者的识别与诊断准确性。
当AoP发生闭塞时(作为丘脑旁正中区的唯一血供来源),可见特征性缺血表现,在MRI上呈现为双侧丘脑旁正中区信号异常伴弥散受限。部分病例还可累及中脑喙部。双侧旁正中梗死与典型的临床三联征相关,表现为:意识障碍、记忆功能障碍和垂直凝视麻痹[2,4]。
AoP闭塞导致丘脑旁正中区梗死,可伴或不伴中脑受累[2]。根据已知的旁正中动脉供血区变异,已描述的AoP梗死主要有四种类型(均累及丘脑旁正中区),包括:双侧丘脑旁正中区伴中脑梗死(最常见);单纯双侧丘脑旁正中区梗死;双侧丘脑旁正中区及前部梗死;双侧丘脑旁正中区、前部及中脑联合梗死[2-4]。
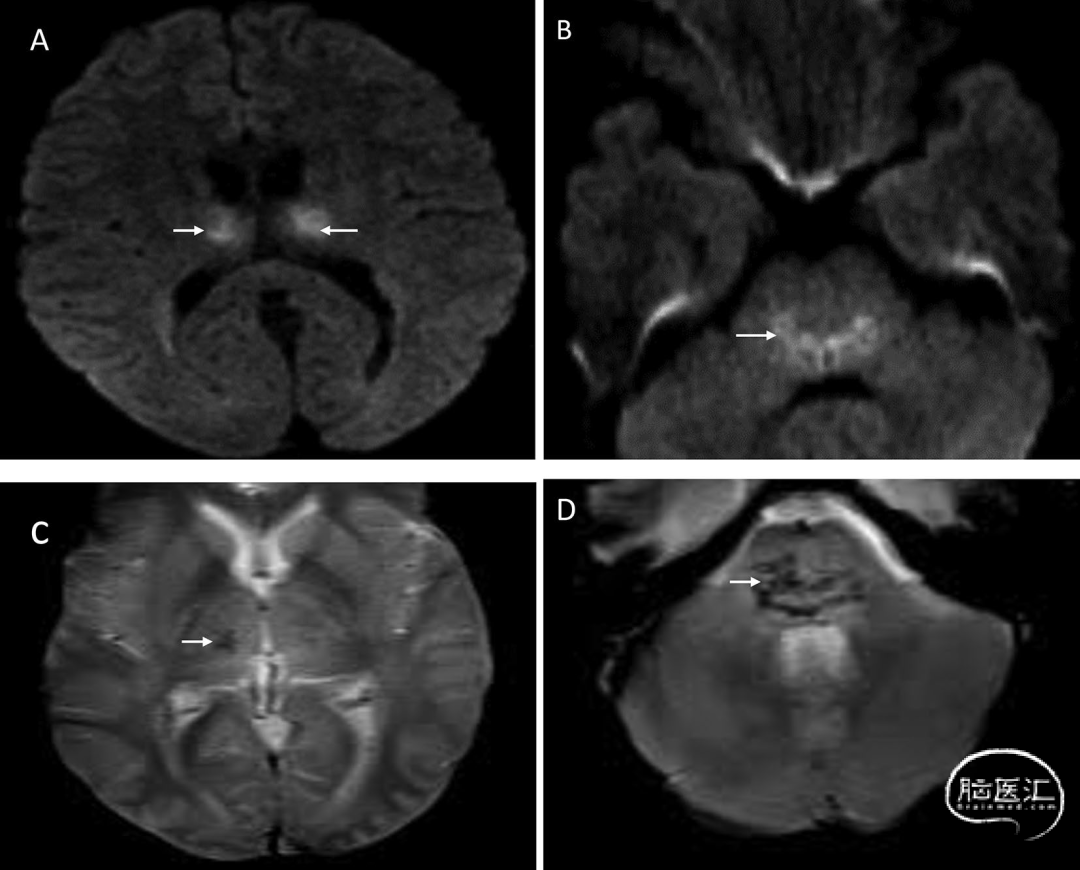
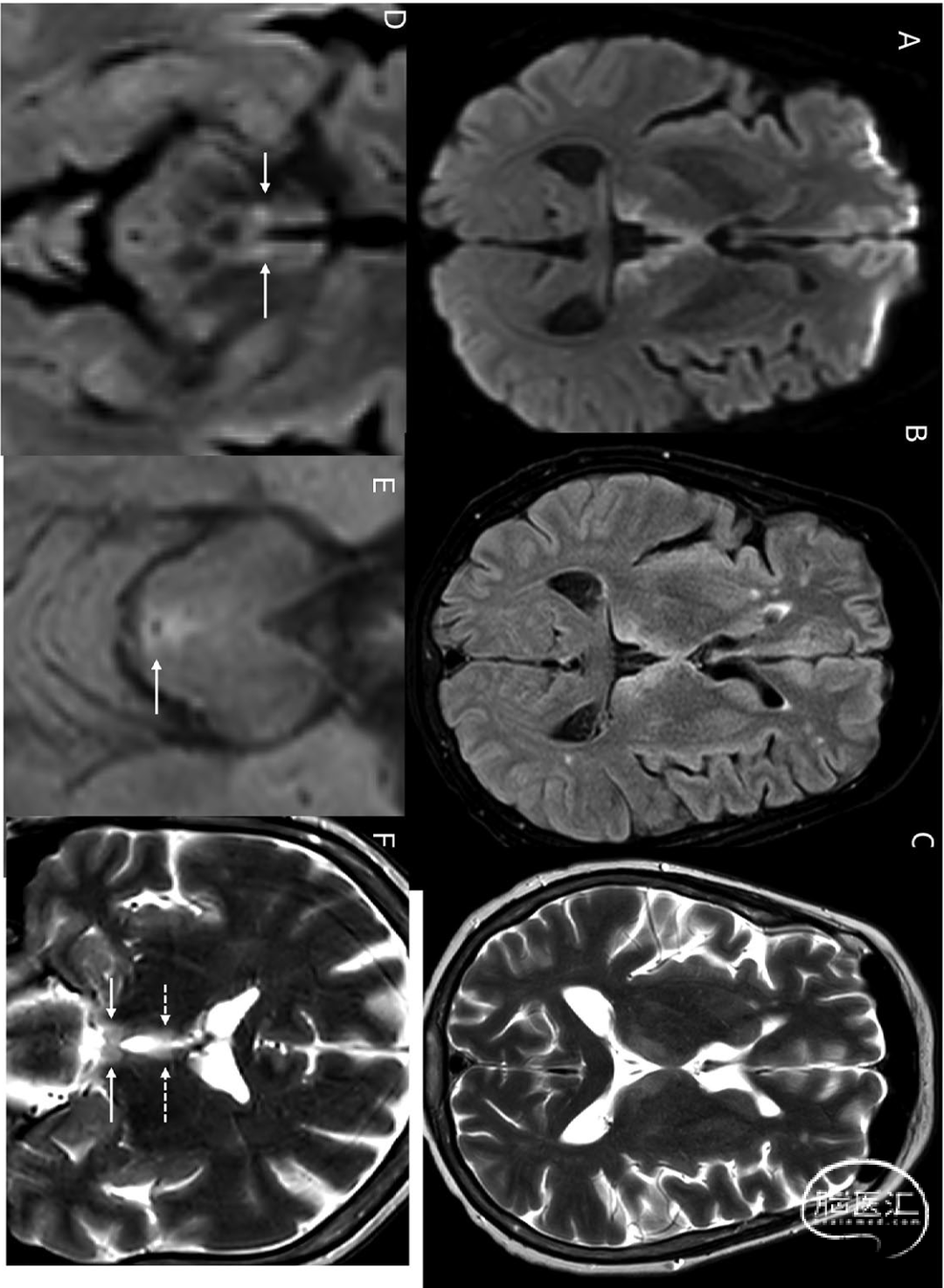
磁共振成像(MRI)序列是显示AoP梗死最有效的方法,其中弥散加权成像(DWI)最为敏感。DWI显示双侧丘脑旁正中区弥散受限(图3)。中脑"V征"[2]描述的是中脑受累情况。Lazzaro等[2]发现,67%的AoP梗死患者在FLAIR和DWI序列上,中脑脚间窝的软脑膜表面可见V形高信号(图4)。CT在早期可能相对正常,仅当梗死进展后才可在CT上显示为丘脑旁正中区的低密度灶(图4)。
图3 MRI显示的Percheron动脉梗死:65岁男性患者,表现为垂直凝视麻痹和记忆障碍。轴位DWI图像[A]显示双侧丘脑前内侧弥散受限[箭头标示],相应FLAIR序列呈高信号[箭头B]。中脑腹侧可见弥散受限[箭头C]。本例中脑水平的轴位FLAIR图像可清晰观察到"V字征"[箭头D]:
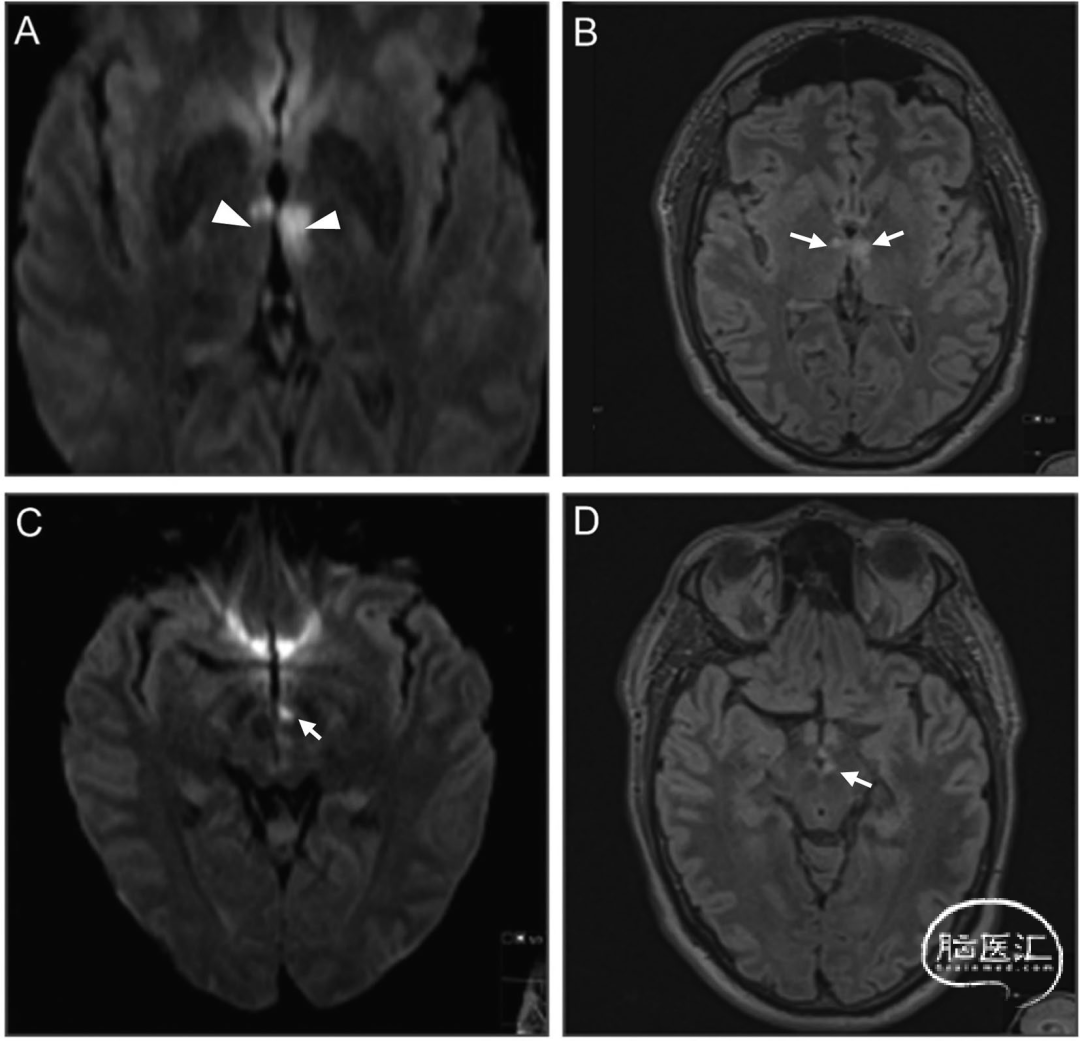
图4 轴位FLAIR[A]与轴位DWI[B]图像显示轮廓分明的"V字征"(箭头标示)。该征象表现为沿中脑脚间窝软脑膜表面在弥散加权及FLAIR序列上的高信号,形成V形外观。[C]轴位CT图像显示已形成的丘脑前部梗死灶,表现为低密度区域(箭头标示):
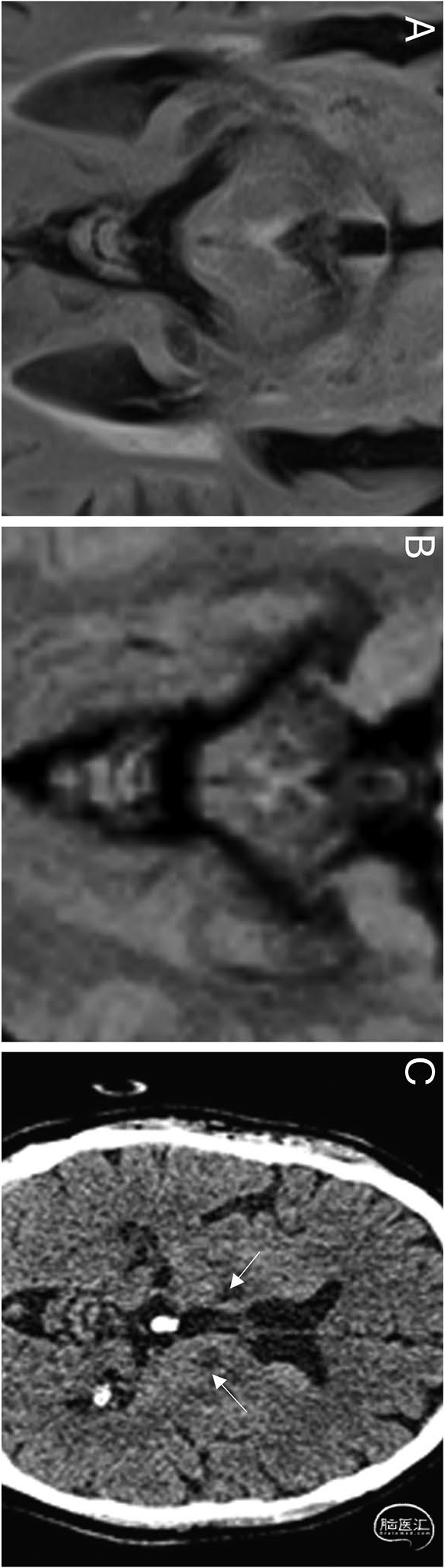
基底动脉尖闭塞的特征性表现为累及基底动脉远端分支供血区(小脑、下丘脑、间脑内侧及丘脑内侧)中两个或以上区域的缺血性病灶[5,6]。其最常见病因为:动脉粥样硬化性闭塞(26-36%,由严重狭窄导致的局部血栓形成)和心源性栓塞性闭塞(30-35%)[6]。
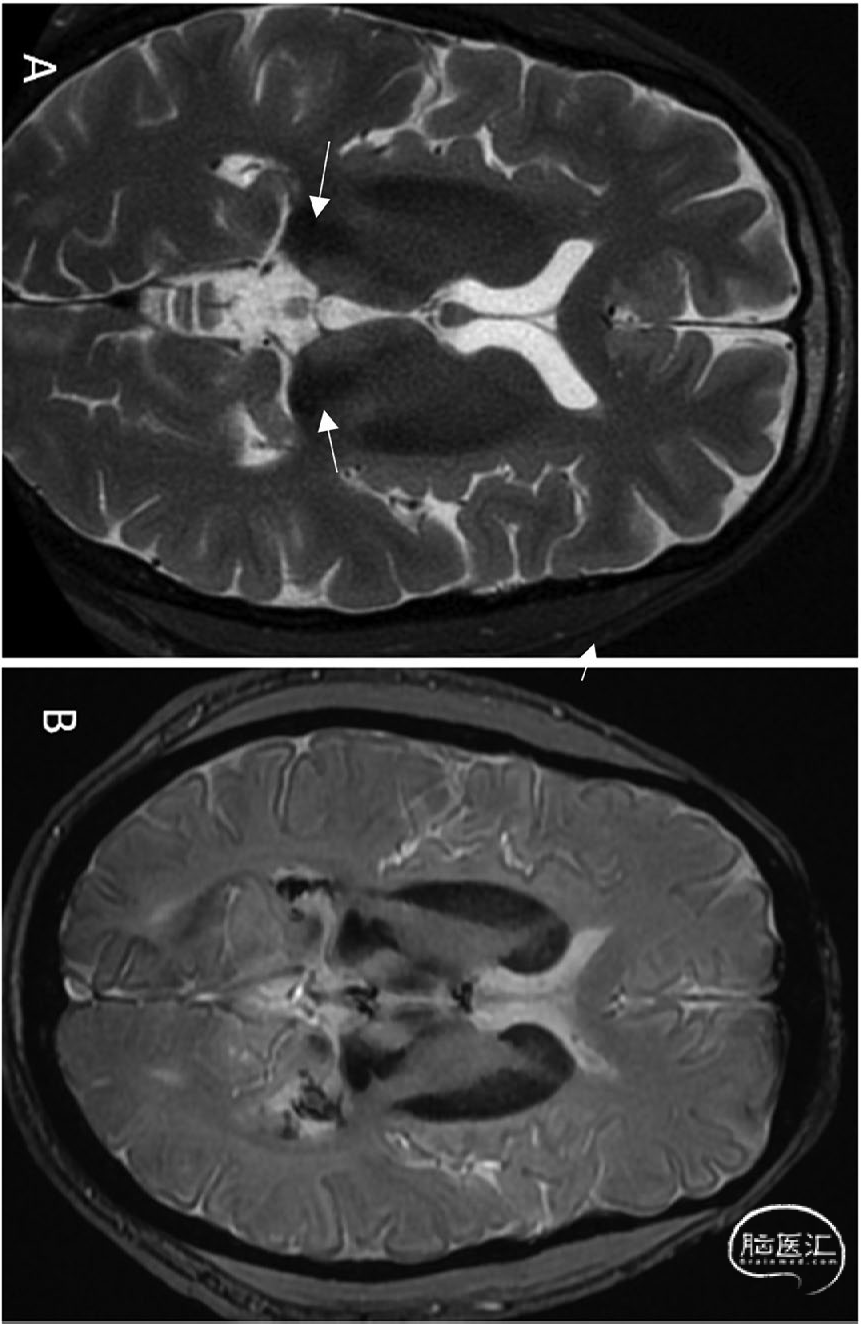
临床实践中常难以鉴别局灶性血栓形成与Percheron动脉(AoP)闭塞。CT颅内血管成像若显示基底动脉高密度征及充盈缺损,可确诊为基底动脉尖血栓形成而非AoP变异血栓栓塞(图5)。基底动脉尖综合征还可能伴随小脑上动脉及大脑后动脉供血区梗死,此特征不见于单纯AoP梗死。
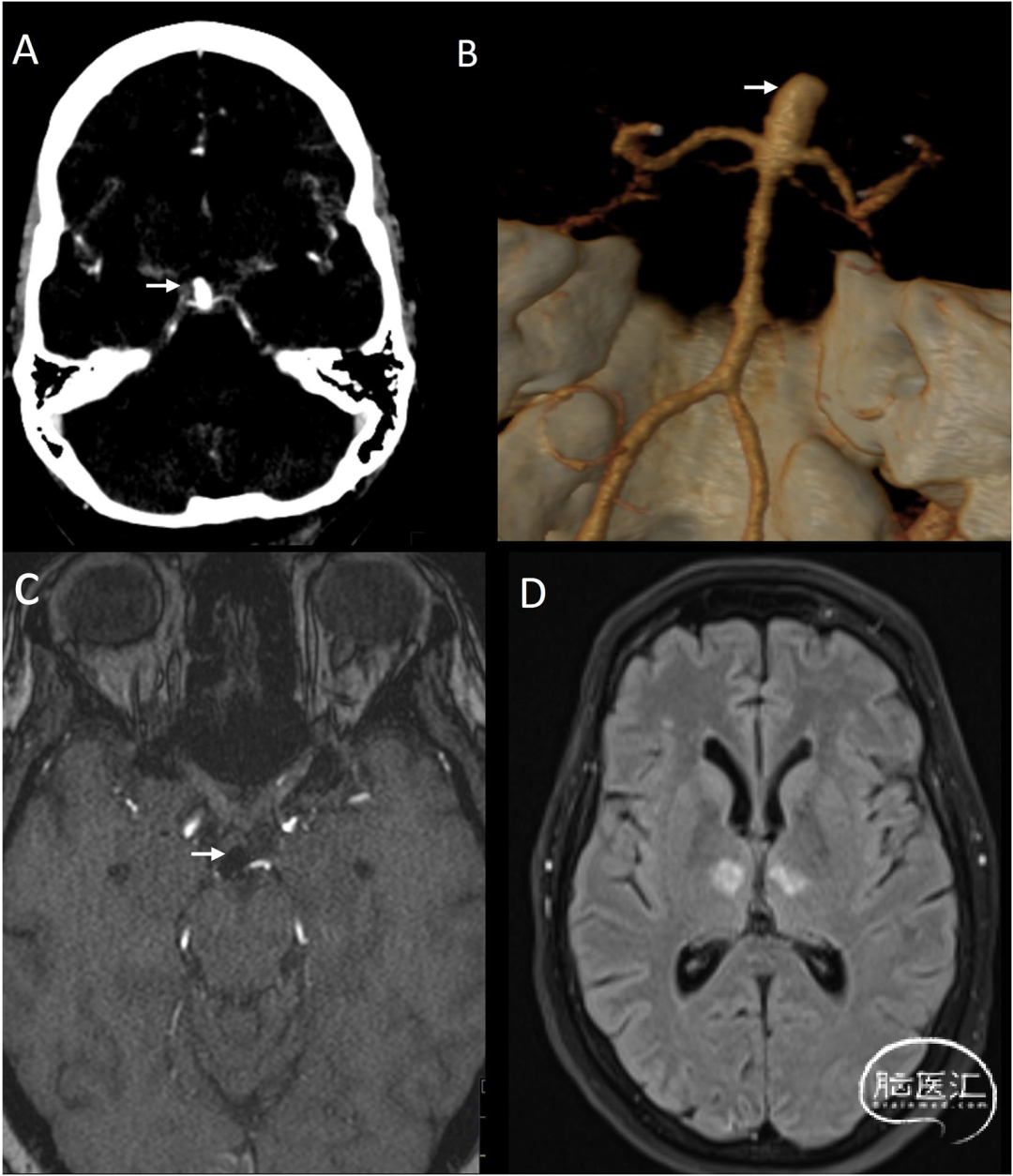
需特别指出,在血管内治疗基底动脉尖动脉瘤时,使用Guglielmi可脱弹簧圈(GDC)相关的血栓栓塞事件虽属罕见,但确认为已知并发症,可能导致双侧丘脑内侧梗死(图6)。
图5 基底动脉尖血栓的CT表现:头颅平扫矢状位[A]与轴位[B]图像显示基底动脉尖高密度血栓(箭头标示)。轴位DWI序列可见左侧小脑上部[C]及双侧丘脑旁正中区[D]弥散受限,提示梗死灶:
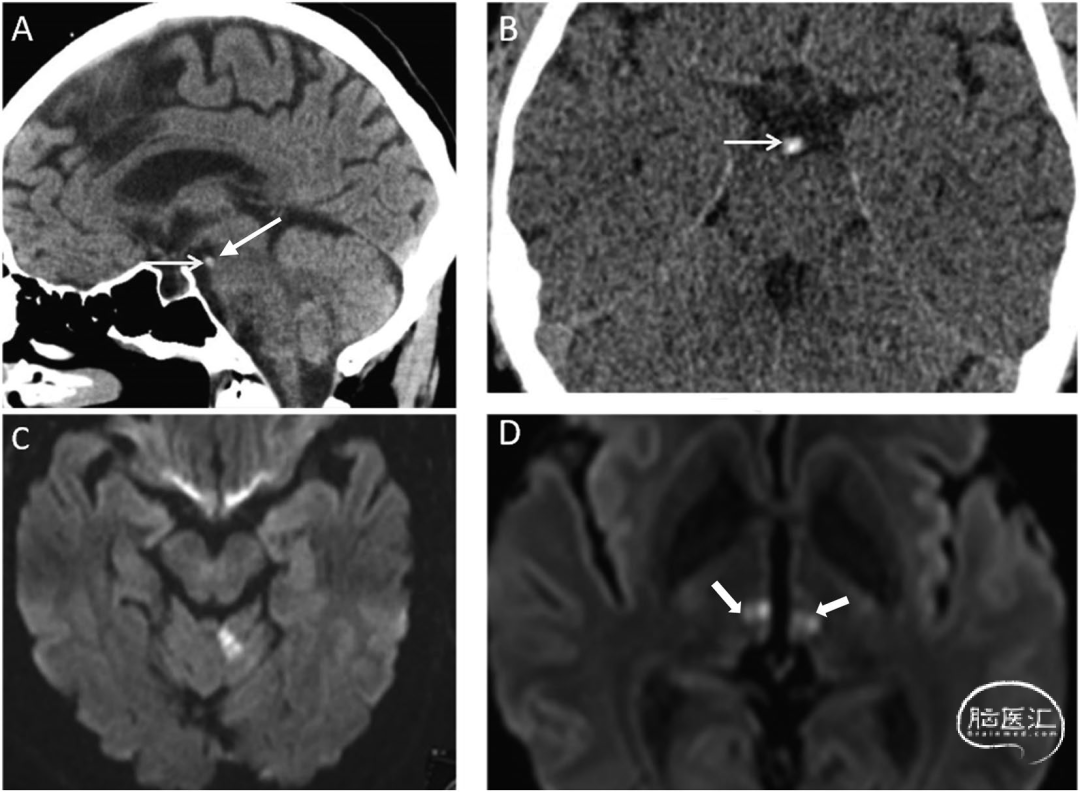
图6 56岁基底动脉尖动脉瘤患者影像表现:[A]CT血管成像显示动脉瘤(箭头),三维容积重建CT血管成像显示更清晰[箭头B]。患者择期接受GDC弹簧圈血管内治疗。动脉瘤栓塞术后出现意识模糊。术后MRI显示:TOF序列可见栓塞后的动脉瘤(C图箭头),轴位FLAIR图像显示因PCA发出的丘脑供血AoP穿支动脉闭塞导致的双侧丘脑旁正中区梗死灶(D):
深部脑静脉血栓(Deep cerebral venous thrombosis,DCVT)可累及大脑内静脉、Galen静脉、Rosenthal基底静脉及其属支,其导致的丘脑梗死(约占10%)[7]易与Percheron动脉(AoP)血栓混淆。常见诱发因素包括:遗传性血栓倾向、高同型半胱氨酸血症、脱水、药物、妊娠、恶性肿瘤及自身免疫性疾病等[7]。
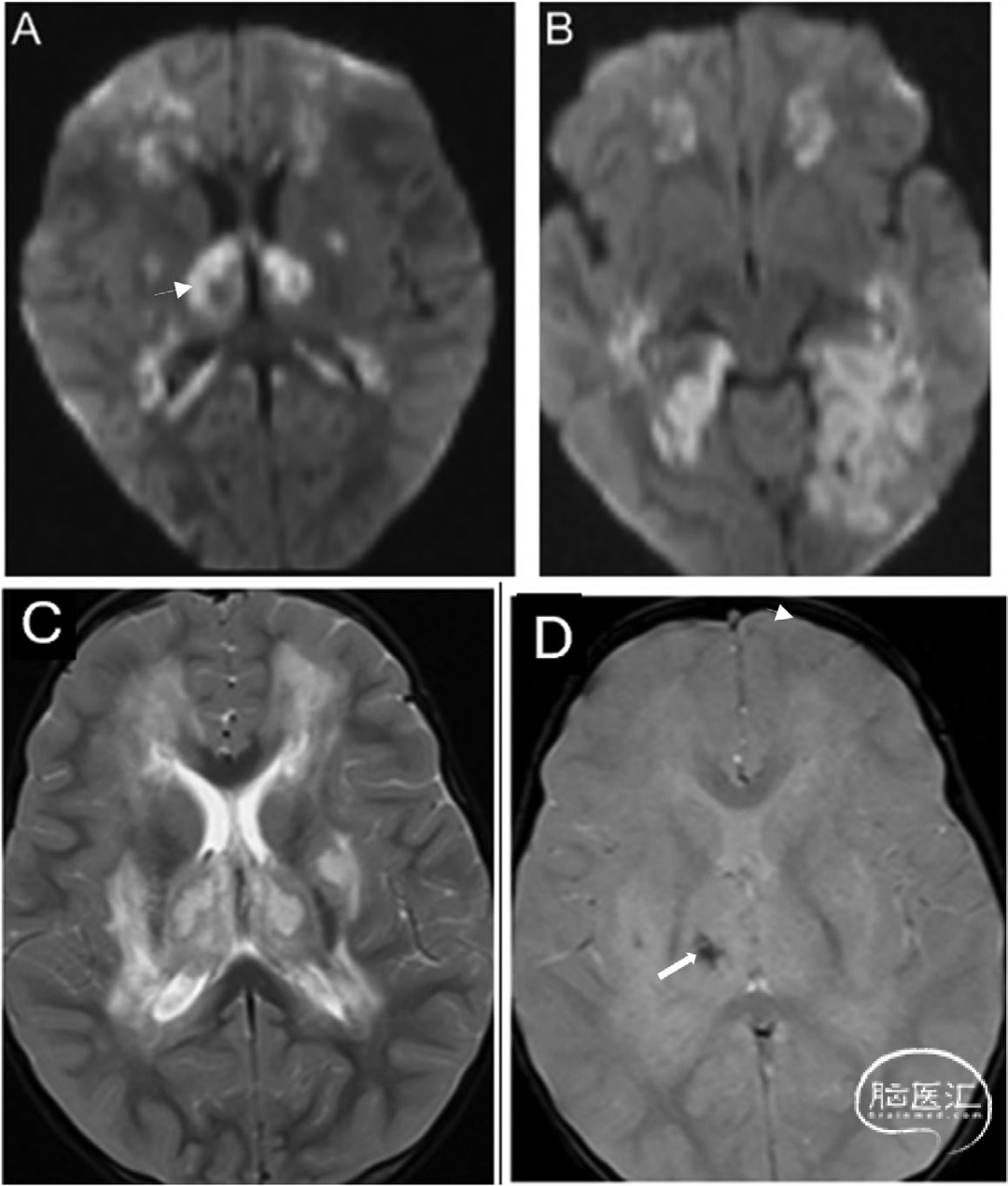
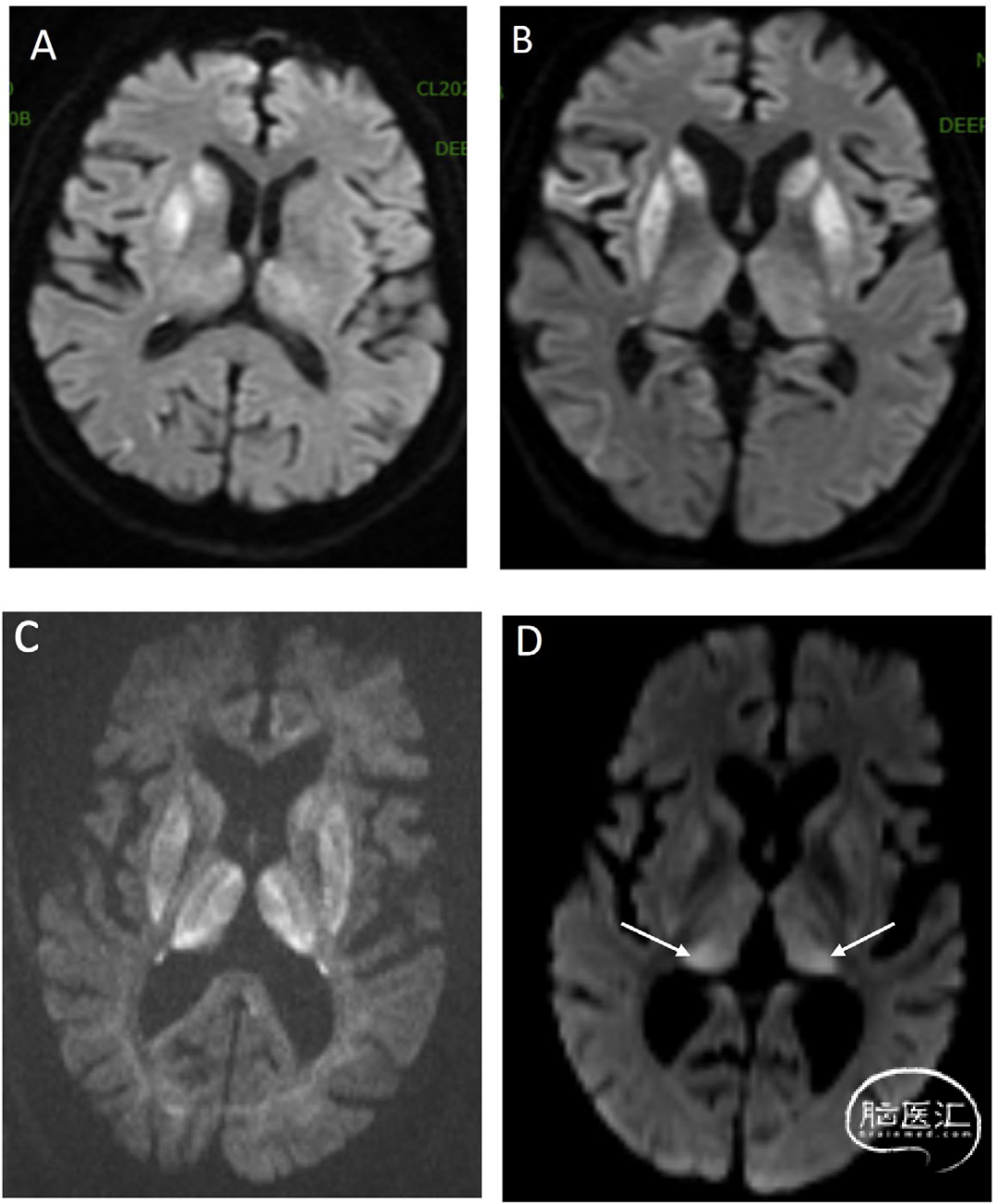
DCVT临床表现缺乏特异性,常见症状包括:短期头痛、意识模糊、癫痫发作、恶心呕吐、复视及视乳头水肿[7]。与AoP梗死相比,深静脉梗死具有以下特征:丘脑受累更对称,常累及基底节区及邻近白质(图7),DWI可无真正弥散受限(因水肿多为血管源性而非细胞毒性),若出现弥散受限,通常可完全缓解。CT的影像学特征:双侧丘脑低密度灶,可延伸至基底节区;非增强CT可见大脑内静脉(ICV)、Rosenthal静脉及Galen静脉高密度征(图8)。MRI诊断线索:磁敏感加权成像(SWI)显示静脉梗死灶出血转化,MR静脉造影可见大脑内静脉血流缺失[8]。
图7 产后32岁女性(伴蛋白C缺乏症)大脑内静脉血栓形成影像表现:T2加权像[A]显示双侧丘脑水肿性高信号,轴位DWI[B]伴ADC值升高[C],提示血管源性水肿;梯度回波序列[D]可见磁敏感伪影(箭头),提示小出血灶;MR TOF静脉造影[E]显示深静脉系统血流信号缺失:
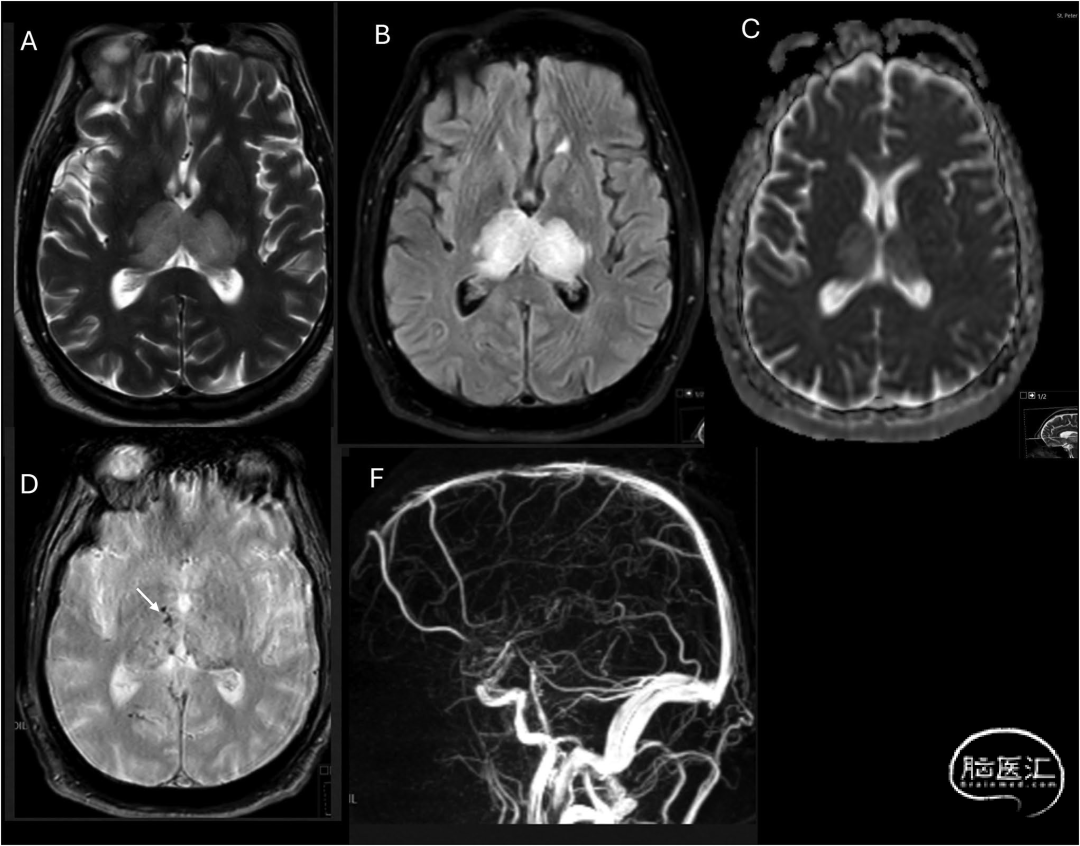
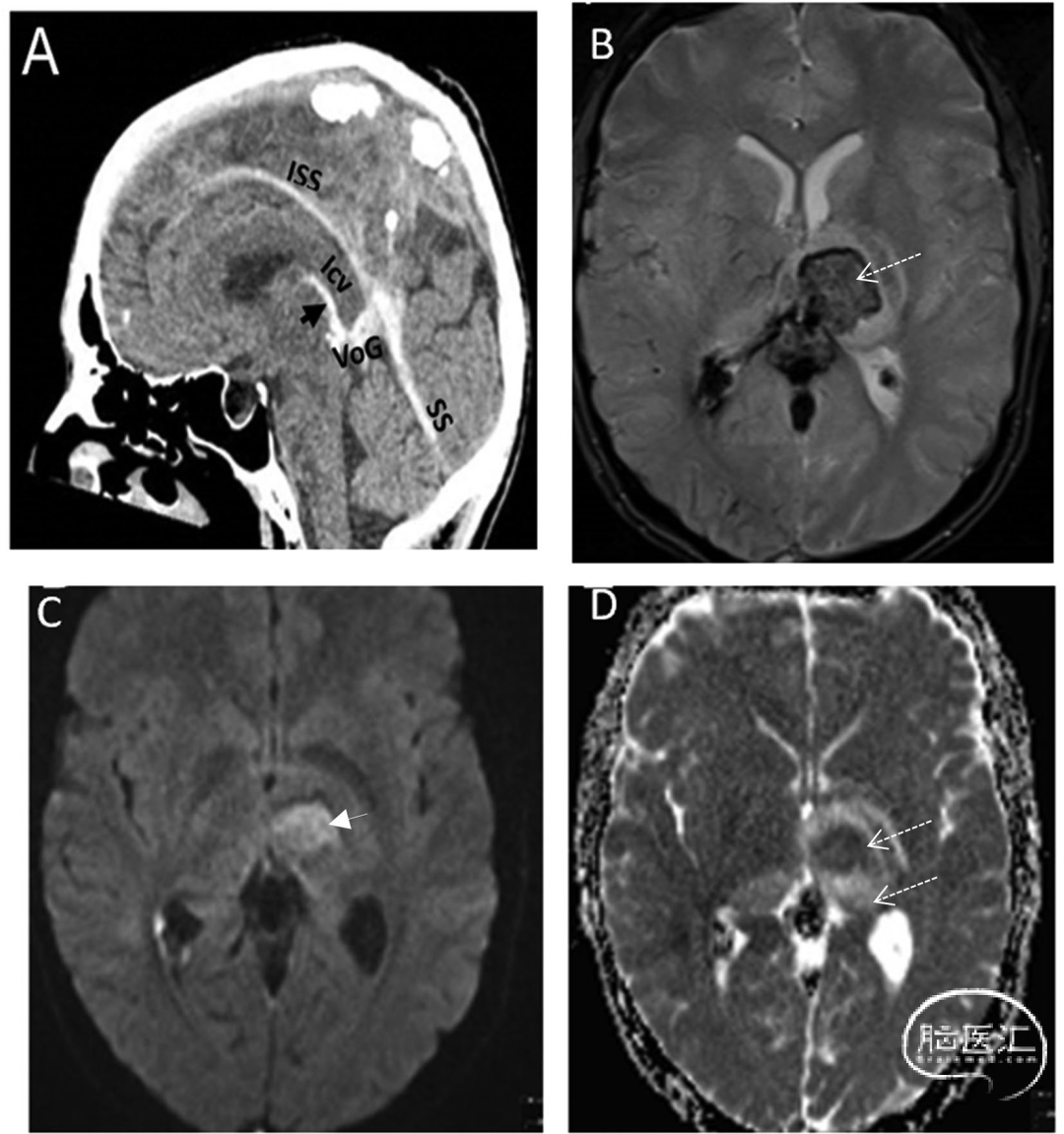
图8 非增强头颅CT正中矢状位[A]显示深静脉系统高密度血栓,累及下矢状窦(ISS)、大脑内静脉(ICV)、Galen静脉(VoG)和直窦(SS)。梯度回波成像[B]可见左侧丘脑血肿(箭头),DWI序列[C]显示弥散受限伴相应ADC值降低[D]。周围血管源性双侧丘脑水肿未呈现真实弥散受限,而表现为ADC值升高的T2透射效应,符合出血性静脉梗死特征:
多种感染性疾病可模拟Percheron动脉(AoP)血栓形成。累及丘脑的病毒性脑炎包括日本脑炎、西尼罗河脑炎,以及近年来具有丘脑受累倾向的呼吸道病毒(如H1N1流感病毒和COVID-19脑炎)[9,10]。急性病毒性脑炎的诊断主要依据临床表现和实验室检查(尤其是脑脊液分析)[10]。对于出现丘脑信号异常的患者,发热病史应警惕脑炎等鉴别诊断。
由节肢动物传播的黄病毒感染,在流行区具有高致死率和致残率[10]。其特征性病变最常见于双侧丘脑、黑质和基底节区[10](图9)。早期丘脑和感觉相关皮层受累提示感觉通路在神经侵袭中的重要作用[11]。
图9 17岁癫痫伴发热患者MRI表现:轴位T2WI[A,B]显示双侧丘脑(A-箭头)及脑桥(B-箭头)高信号,DWI[C,D]可见弥散受限。日本脑炎病毒IgM抗体ELISA检测呈高滴度阳性:
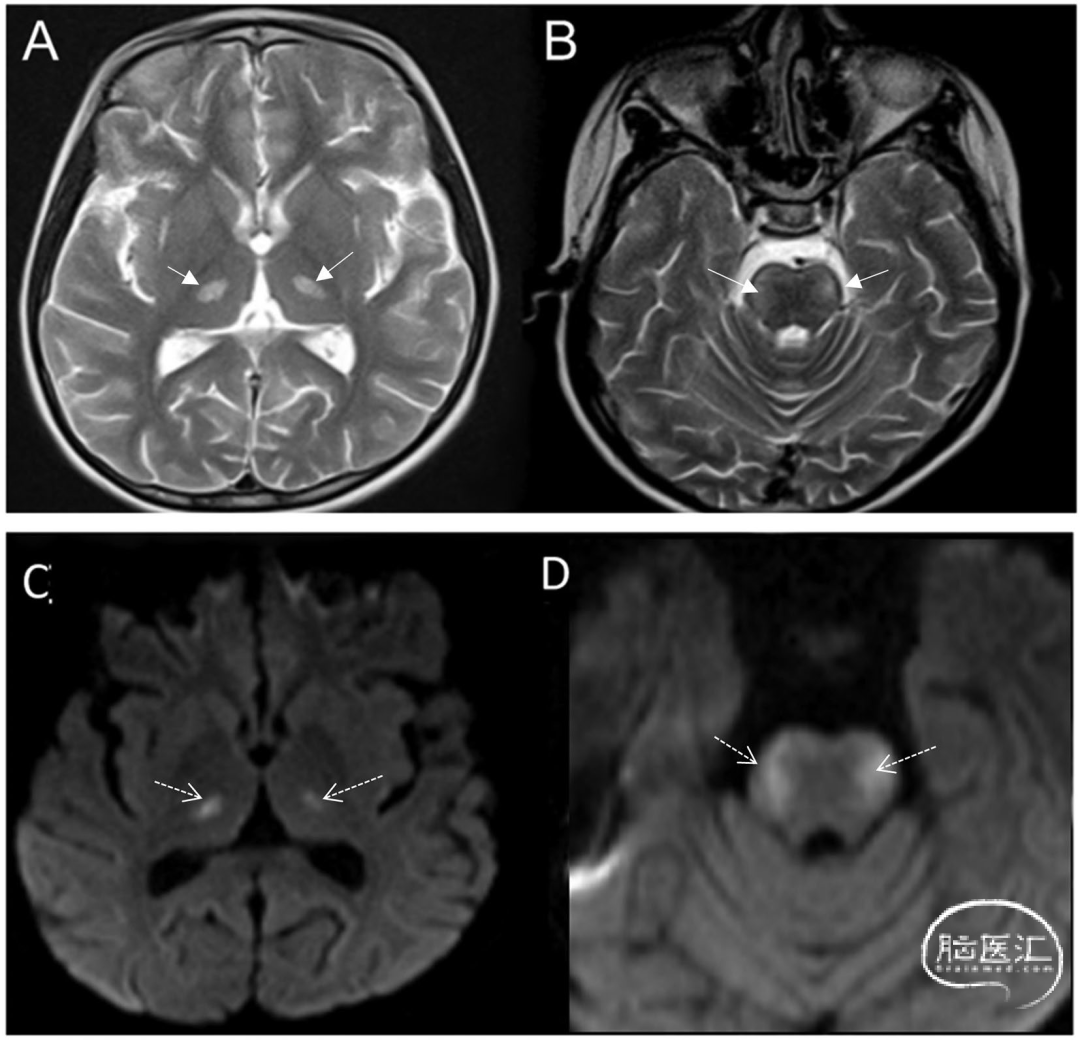
已知可累及丘脑的疾病,表现为出血性病灶伴基底节、脑干和小脑不同程度受累[12](图10)。这两种疾病不仅MR特征高度重叠,其流行区域和临床表现也极为相似,常造成诊断困难。双侧丘脑T2/FLAIR高信号伴出血虽是脑型疟疾的非特异性表现,但具有典型性(图11)。其脑部并发症源于寄生红细胞血管内滞留导致的潜在脑毒性[13]。放射科医师应提高警惕,尤其对近期有流行区旅居史且出现发热、意识障碍的患者。
图10 感染性脑炎病例:18岁女性登革出血热患者,临床表现为发热、意识障碍及癫痫发作。箭头标示DWI序列上丘脑[A]与小脑[B]对称性弥散受限。小脑出血灶表现为:梯度回波序列磁敏感伪影(箭头C)及矢状位T1WI高信号(箭头D):
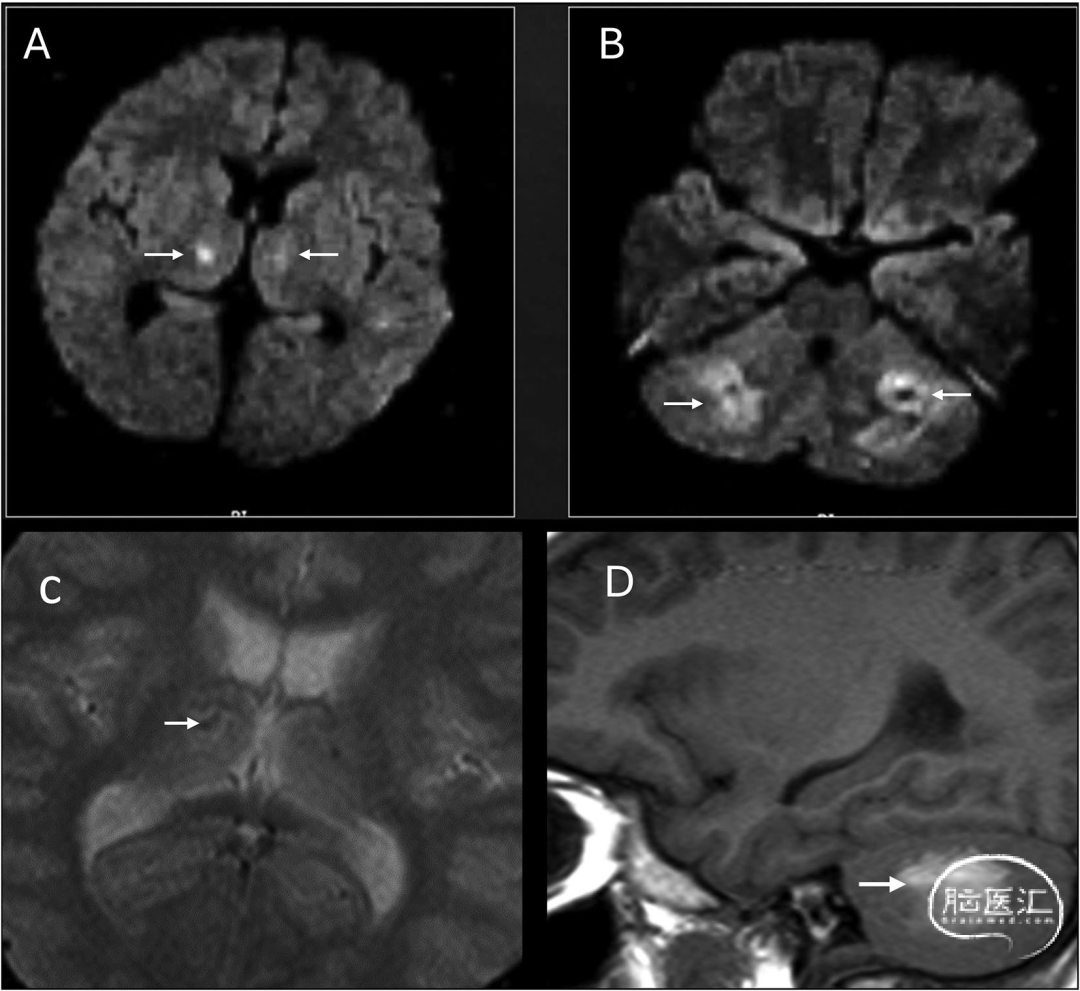
图11 脑型疟疾:22岁患者急性起病,表现为发热伴寒战及谵妄,外周血涂片(PBS)疟原虫阳性。轴位DWI显示丘脑(A箭头)与脑桥(B箭头)对称性弥散受限,梯度回波序列(GRE)可见对应出血灶所致的磁敏感伪影(C、D箭头):
流感等病毒感染(包括COVID-19)的罕见并发症,与颅内细胞因子风暴相关[14]。最具特征的MR表现为对称性多灶性病变(常累及丘脑)伴斑片状强化(图12)。
图12 69岁COVID-19肺炎合并症患者MRI表现:轴位DWI[A,B]显示丘脑及幕上白质多灶性斑片状弥散受限区,轴位T2W[C]对应信号异常,梯度回波序列(D)示右侧丘脑磁敏感伪影(箭头),提示出血灶患者收治ICU时存在合并症,MRI表现符合COVID-19相关急性坏死性脑病:
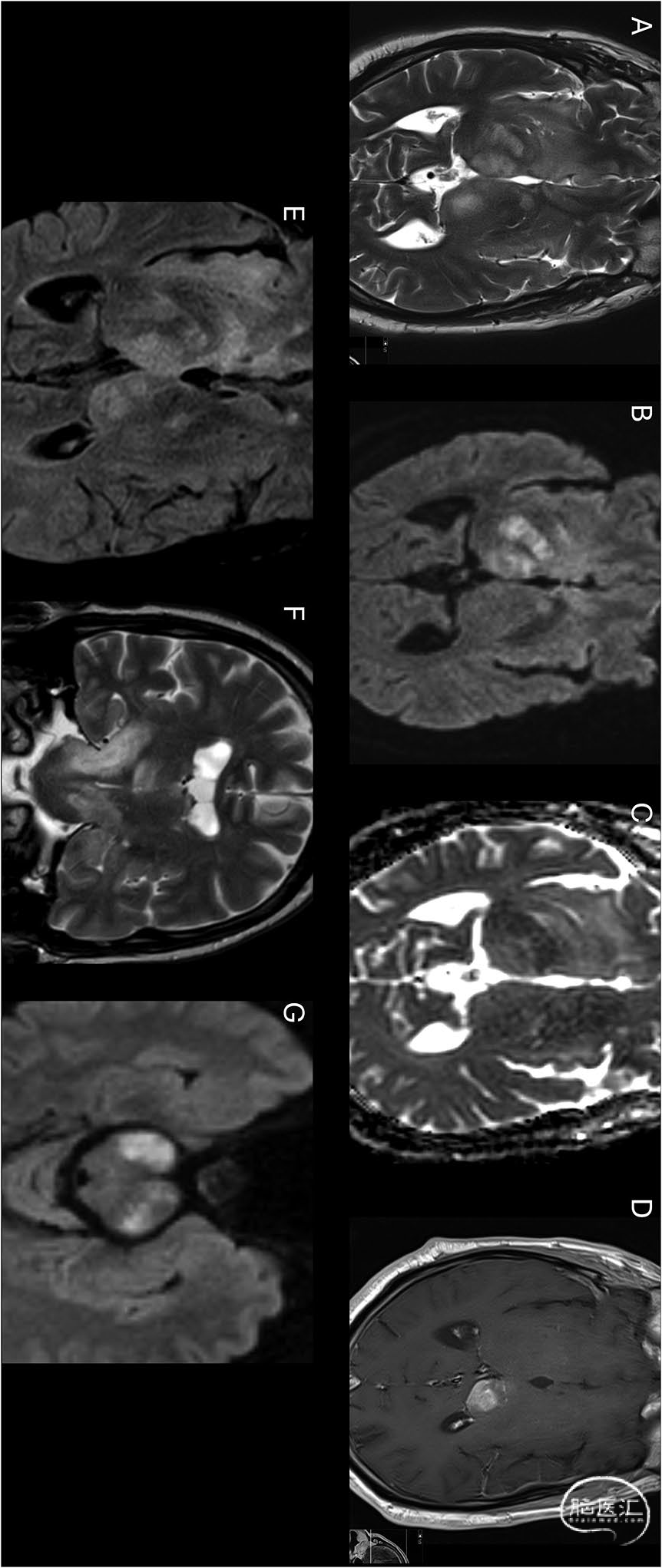
双侧丘脑胶质瘤占所有脑肿瘤的1-1.5%[15],其典型MR表现包括:双侧丘脑体积增大伴T1低信号,通常无对比增强(但中高级别肿瘤可出现强化)(图13),T2加权像呈高信号,可延伸至周围白质及中脑结构。丘脑受累还可见于其他浸润性星形细胞瘤、淋巴瘤及转移瘤。若存在已知原发灶且病灶多发伴瘤周水肿(尤其灰白质交界区),多提示转移瘤诊断。弥漫性中线胶质瘤(DMG)H3 K27突变型,作为特殊肿瘤类型,可累及丘脑[16](图13)。Ikeda等研究强调:DWI-Gd不匹配征(病灶DWI高信号但T1增强无强化),此征象提示DMG不良预后[17]。
图13 经活检证实的H3K27突变型弥漫性中线胶质瘤病例:轴位T2[A]显示累及双侧丘脑的弥漫浸润性肿块,DWI[B]与ADC图[C]示肿块内斑片状弥散受限(以右侧丘脑-内囊区为著),钆增强T1成像[D]显示左丘脑非弥散受限区域强化,呈现DWI-钆增强不匹配征。FLAIR[E]与冠状位T2[F]显示:病变广泛浸润特性及瘤周水肿,双侧大脑脚及脑干受累,DWI[G]证实双侧大脑脚弥散受限:
视神经脊髓炎(NMO)、多发性硬化(MS)和急性播散性脑脊髓炎(ADEM)等脱髓鞘疾病可累及丘脑。研究表明MS的灰质受累(尤其丘脑)与认知功能下降及丘脑萎缩相关[18]。MS的丘脑病灶虽不常见,但在长期病例中可能出现(图14)。其特征为:典型分布区(皮质旁、脑室周围或幕下)并存脱髓鞘斑块。ADEM虽与MS影像特征重叠,但更常累及丘脑和基底节,增强扫描通常可见强化[3]。单相病程+近期感染/疫苗接种史更支持ADEM诊断。NMO病灶分布与AQP4高表达区一致,因第三脑室周围软脑膜位置,可累及旁正中丘脑。
图14 19岁复发缓解型多发性硬化患者(接受Ocrelizumab治疗)MRI表现:T2W[A]与FLAIR[B]显示双侧丘脑不对称卵圆形高信号病灶,增强T1WI呈低信号且无显著强化[C]。T2W成像可见:脑室周围白质病灶(垂直于胼胝体-透明隔界面分布),幕下多发病灶(脑干、小脑[E]及脊髓[D])。支持MS诊断的依据:阳性寡克隆区带,病灶形态学与分布特征,疾病复发特性。初期AQP4与MOG抗体检测阴性:
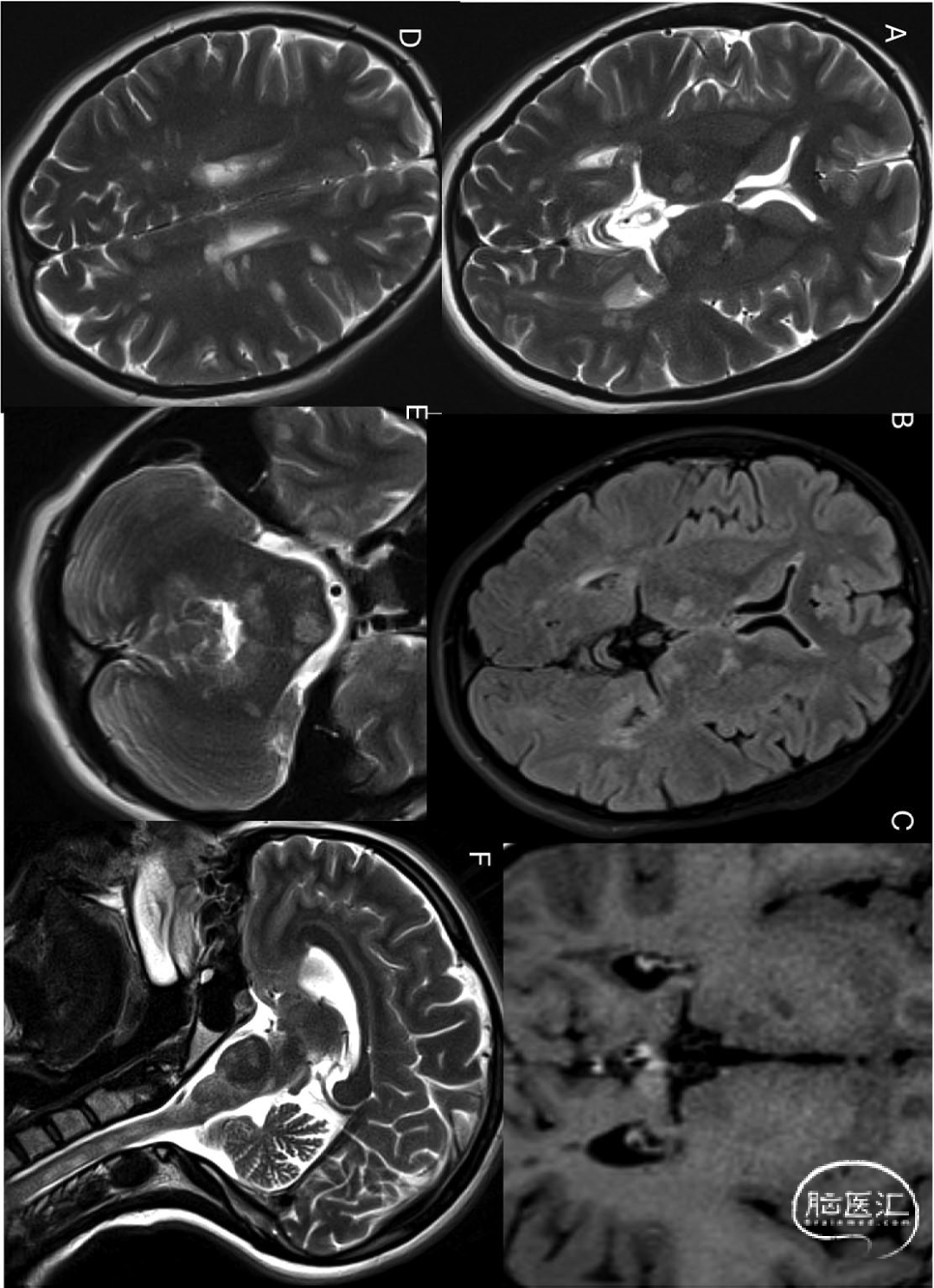
渗透性脱髓鞘综合征和Wernicke脑病等代谢/中毒性疾病可导致双侧丘脑异常,需结合特定代谢紊乱或中毒史诊断。Wernicke脑病(硫胺素缺乏)常见于慢性酒精中毒或严重营养不良者。特征性T2/FLAIR对称高信号伴弥散受限,典型累及区:导水管周围灰质、乳头体、丘脑内侧核及顶盖板(图15)。渗透性脱髓鞘综合征:可累及壳核、丘脑和小脑[3]。其他疾病包括:高氨血症、一氧化碳中毒、缺氧缺血性脑病等。
图15 51岁,男性,Wernicke's脑病,既往慢性酒精中毒。患者临床表现为共济失调、感觉神经病变及垂直复视。MRI显示:DWI[A]、FLAIR[B]及T2WI[C]可见双侧丘脑内侧对称性信号异常,DWI序列显示乳头体[D]及导水管周围灰质[E]信号异常(箭头标示),冠状位T2[F]示乳头体与丘脑内侧T2高信号(虚线箭头标示):
克雅病(CJD)以快速认知衰退为特征,具有致死性[19]:DWI常见皮层、基底节和丘脑信号异常(图16)。"丘脑枕征"对散发型CJD相对特异(但变异型或家族型也可出现)[19]。
图16 克雅病(CJD)影像演变:病例1:55岁快速进展性痴呆患者,初次MRI[A]:DWI序列显示右侧纹状体及丘脑内侧弥散受限,3个月后随访[B]:双侧纹状体及丘脑内侧对称性弥散受限范围扩大。病例2:另一CJD患者DWI[C]:双侧基底节及丘脑对称性弥散受限,特征性"丘脑枕征"(箭头标示)[D]:
Leigh综合征、Wilson病、Fabry病和Fahr病等可在儿童/成人中表现为双侧丘脑异常,反映该区域病理机制的多样性。脑铁沉积性神经变性(NBIA):以基底节和丘脑铁沉积为特征,T2WI对称低信号+梯度回波序列磁敏感效应。无铜蓝蛋白血症(ACP):极罕见成年起病的常染色体隐性遗传病,CP基因突变导致基底节、丘脑及皮层铁异常沉积[20](图17)。
图17 无铜蓝蛋白血症影像表现(20岁患者,伴锥体外系症状):轴位T2加权像[A]显示双侧基底节及丘脑核团显著低信号,梯度回波序列[B]更清晰显示上述部位低信号(箭头标示),GRE序列可见大脑皮层薄层低信号(提示异常铁沉积):
本图谱研究系统阐述了Percheron动脉(AoP)梗死的多样化影像学表现,着重强调了识别其重要鉴别诊断的临床价值,指出必须结合细致的临床评估与影像学特征综合分析。中脑"V字征"作为关键诊断特征,可显著提高AoP梗死的诊断准确性。放射科医师应当全面掌握导致双侧丘脑异常的各种病因及其对应的影像谱系。深化对这些影像特征的认识与理解,将有助于提升疑似丘脑卒中患者的临床诊疗水平。
Neuroradiology
. 2025 Apr;67(4):785-798. doi: 10.1007/s00234-025-03585-2. Epub 2025 Mar 10.
Imaging the artery of Percheron: a pictorial review of associated pathology with important mimics of bithalamic abnormalitie
*本文转载自微信公众号“脑血管病及重症文献导读”,脑医汇获授权转载
![]()
声明:脑医汇旗下神外资讯、神介资讯、脑医咨询、Ai Brain 所发表内容之知识产权为脑医汇及主办方、原作者等相关权利人所有。
投稿邮箱:NAOYIHUI@163.com
未经许可,禁止进行转载、摘编、复制、裁切、录制等。经许可授权使用,亦须注明来源。欢迎转发、分享。
投稿/会议发布,请联系400-888-2526转3。





