《Cancers (Basel)》2025年5月3日在线发表意大利Hospital Trust of Verona,的Michele Longhi , Riccardo Lavezzo , Valeria Barresi ,等撰写的《伽玛刀在治疗罕见鞍区肿瘤中的作用:附9例报告。The Role of Gamma Knife Surgery in the Treatment of Rare Sellar Neoplasms: A Report of Nine Cases》(doi: 10.3390/cancers17091564.)。

简介:
所谓的“鞍区肿块”组由异质性肿瘤和肿瘤类似病变组成,由于临床和影像学特征重叠,其鉴别诊断可能具有挑战性,这些特征可以在“常见”和“不常见”病变中找到。选择正确的治疗策略仍然是艰巨的,需要组织学分析。伽玛刀放射外科(GKRS)已被报道为一种安全有效的治疗方法。本研究的目的是评估GKRS治疗罕见鞍区肿瘤患者的单中心术前数据、术后结果和长期随访。
鞍区病变是一个庞大且异质性的肿块群,包括原始和转移性肿瘤、炎症性疾病、血管病变和发育异常。最常见的病变是垂体腺瘤(PA),非腺瘤性鞍区病变并不多见,占不到10%。
由于临床、激素和放射学表现重叠,鉴别诊断可能相当困难;事实上,有时除了组织学检查外,并没有特殊的非腺瘤性非分泌性病变的特征。在这篇文章中,我们介绍了2004年至2015年用Leksell伽玛刀放射治疗罕见和不寻常鞍区病变的经验。对于每个病例,我们提供简短的临床表现,诊断途径,神经外科手术(当进行时),放射外科治疗,以及从我们的临床报告的回顾性分析中获得的整个随访期。
作者考虑建议对这些病变进行伽玛刀放射外科(GKRS),目的是显著降低术后复发或进展的风险,从而避免重复切除和进一步的永久性手术相关并发症的风险。将这些病变纳入GKRS适应证的理由是,这些病变可以适当地被认为是良性肿瘤形式。事实上,一些作者认为RCC和颅咽管瘤之间有密切的关系,因为它们有一个共同的组织学起源,来自Rathke裂的鳞状上皮残留物。此外,同一例患者从RCC向颅咽管瘤的转变也有报道。据我们所知,这是第一系列经组织学证实的罕见和不寻常的鞍区病变用GKRS治疗。
方法:
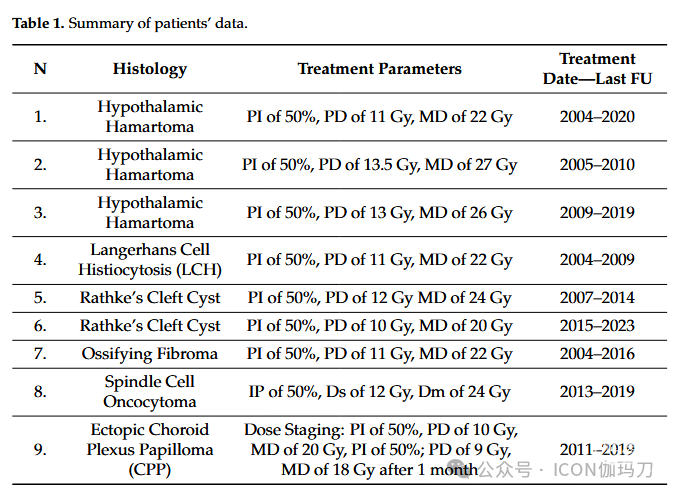
根据标准方案,我们回顾性地确定并分析了2004年至2015年期间接受GKRS治疗的9例患者。病变包括下丘脑错构瘤(HH)、Rathke囊肿(RCC)、朗格汉斯细胞组织细胞增生症(LCH)、梭形细胞嗜酸细胞瘤(SCO)、脉络膜丛乳头状瘤(CPP)和骨化纤维瘤(OF)[hypothalamic hamartoma (HH), Rathke's cleft cist (RCC), Langerhans cell histiocytosis (LCH), spindle cell oncocytoma (SCO), choroid plexus papilloma (CPP), and ossifying fibroma (OF).]。在6例接受手术的患者中,组织学诊断得到了证实,而在3例患者中,诊断是基于特征性的临床和放射影像学表现(2例HH和1例RCC)。术前、术后资料来源于医学档案,并通过临床及神经影像学定期检查进行长期随访。
从1993年到2024年,超过16,000名患者在维罗纳AOUI接受了伽玛刀放射外科。其中,11例罕见鞍区肿瘤患者接受GK治疗,其中9例患者至少随访5年,符合本研究条件。
在以前的报道中对放射外科技术已经有详细的描述。
将与磁共振成像(MRI)兼容的Leksell Model G型立体定向框架(Elekta Instruments AB, Stockholm, Sweden)应用于患者头部后,对患者进行立体定向高分辨率1.5特斯拉MRI,并进行特定序列,以获得病变三维形状和周围正常结构的精确信息。在获得包括轴位、冠状位和矢状位图像的调查后,进行了对比后钆剂(Gadobutrol) 2mm厚的冠状位“动态”检查,目的是区分垂体柄和腺体的RCC残留物。对比增强后1毫米各向同性体素体积扫描,用于定义靶体积和确定靶坐标,以及轴位CISS(稳态构造干涉)图像,以清楚地识别视神经前通路。然后使用市售软件制定三维治疗计划,即Leksell Gamma Plan软件(版本8.3,Elekta Instruments)。放射外科团队使用多个准直器创建了一个高度适形的剂量计划,并进行了剂量选择。平均处方剂量为10Gy,按50%等剂量线归一化。剂量被处方以使用对比增强成像确定的整个病变体积。根据病变体积、病变与视器官的距离、治疗前视力缺陷的程度选择剂量。在严格遵守已知视神经耐受性(始终保持<12 Gy)的情况下,给予靶区可能的最高剂量。为此,在治疗前对前视神经通路的体积暴露进行了详细的评估。使用Perfexion型和201个Co60 源Leksell Gamma单元(Elekta Instruments AB, Stockholm, Sweden)进行放射外科。所有伽玛刀放射外科均在局部麻醉下根据标准化方案进行;常规监测包括心电图、脉搏血氧仪和通过安装在伽玛刀室的高分辨率摄像机进行的患者视频监测。所有手术中患者的体位相同。
放射外科治疗后疗程及随访。
患者均在治疗后24小时内出院。他们在第一年和之后每年每隔6个月接受一次体格检查、视野测试、实验室测试和磁共振成像系列对比增强成像。为了评估肿瘤体积,使用Gamma Plan软件8.3.1及其后续版本或瑞士日内瓦大学医院开发的OsiriX医学成像程序(4.19版本)测量肿块病变。局部肿瘤生长控制被定义为病灶完全消失、缩小或病情稳定。长期随访数据包括最后一次神经外科或肿瘤随访时的临床和神经放射影像学状况。
结果:
在我们的研究中,所有治疗过的“罕见”鞍区病变,在中长期随访期间均有成功的影像学和临床反应。
本组9例患者,男2例,女7例,平均年龄49岁(24-78岁)。所有患者均有肿瘤鞍区病变,病因学/影像学诊断为下丘脑错构瘤(HH)、Rathke囊肿(RCC)、朗格汉斯细胞组织细胞增生症(LCH)、梭形细胞嗜酸细胞瘤(SCO)、脉络膜丛乳头状瘤(CPP)和骨化纤维瘤(OF)。在6例接受手术的患者中,组织学诊断得到证实,而在3例患者中,诊断基于特征性放射影像学表现(2例HH和1例RCC)。主要症状为头痛和视力下降,其次为疲劳、激素紊乱、颅神经麻痹、癫痫(特别是HH的痴笑性发作)和尿崩症。
3.1. 下丘脑错构瘤(n = 3)
在我们的研究中,下丘脑错构瘤是最常见的病变。
病例1:一名24岁的男性表现出长期的痴笑和不良癫痫发作史。他在上世纪90年代被诊断出患有缓慢增长的HH。由于药物治疗(5种药物)无法控制癫痫发作,在患者拒绝手术后提出了GKRS。病变相对较大:磁共振图像(MRI)显示下丘脑结节呈错构瘤状,向右到达右侧第三脑室,形成并决定右半侧视交叉的血流。在尾部,它推进到斜坡后区,并与基底动脉相连。2004年,为了避免过度照射视交叉和视觉通路,提出了一种放射外科治疗方案(外周等剂量线(PI)为50%,处方剂量(PD)为11 Gy,最大剂量(MD)为22 Gy,积分剂量为148.7毫焦耳(mJ), 12 Gy体积7.71 cc)。由于患者拒绝开颅手术,且出现耐药性癫痫发作,建议采用GKRS治疗。病变很大,位于关键结构(视交叉,基底动脉)附近,使放射外科成为更安全的选择。该病例在多学科背景下进行了讨论。(图1)。
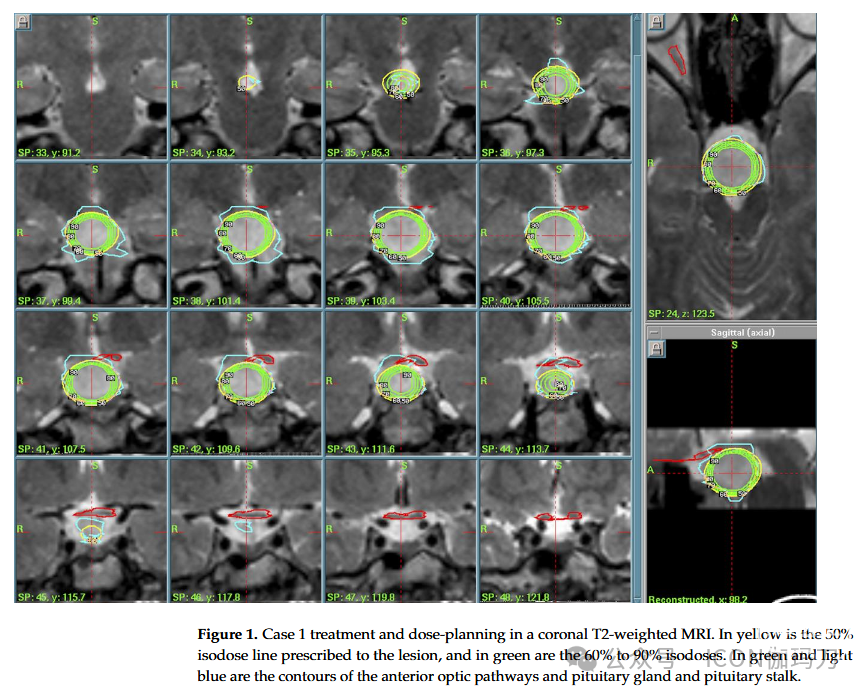
图1。病例1在冠状位T2加权MRI上的治疗和剂量计划。黄色为病变处方的50%等剂量线,绿色为60%至90%等剂量线。绿色和浅蓝色是前部视神经通路和垂体和垂体柄的轮廓。
术后过程顺利,患者出院后无新的神经功能障碍。患者接受了临床和影像学随访,最后一次MRI(2020年8月)未见病变再生,无病理强化。患者目前使用2种抗癫痫药物(左乙拉西坦和卡马西平)治疗,对残余单纯性部分癫痫发作控制良好。下一次随访磁共振将于今年进行。
病例2:24岁男性,复视病史6个月,既往诊断为下丘脑错构瘤,累及右侧海绵窦。在另一个中心进行显微手术(双额开颅)后,组织学上证实了诊断。临时诊断后,手术中断,建议放射外科治疗。考虑到具有挑战性的位置和并发症的风险,在多学科讨论后选择了辅助GKRS治疗。治疗参数(2005年)如下:PI为50%,PD为13.5 Gy, MD为27 Gy,总剂量为95.2 mJ, 12 Gy体积为7.13 cc(图2)。患者治疗当日出院,无新的神经功能障碍。经过5年良好的临床和放射影像学随访,患者失访(no longer contactable)。
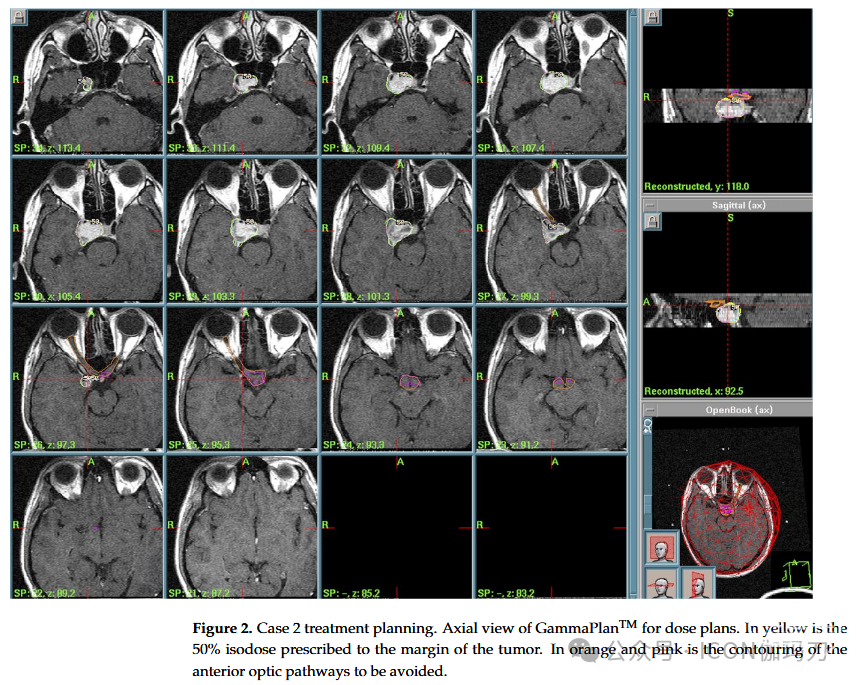
图2。病例2治疗方案。GammaPlanTM轴向视图的剂量计划。黄色部分为肿瘤边缘的50%等剂量线。橙色和粉色是要避免的前部视神经的轮廓。
病例3:一名29岁男性,长期出现部分复杂和痴笑性癫痫发作,精神状态改变,危重期具有侵袭性。MRI显示下丘脑无强化病变占据第三脑室和乳头体的底部。在采取观望方法后,后续MRI显示下丘脑病变缓慢且进行性增长,也累及鞍区至视交叉。癫痫发作出现耐药性,因此建议采用GKR 治疗(PI为50%,PD为13 Gy, MD为26 Gy,总剂量51.2 mJ, 12 Gy体积4.18 cc)代替手术(由于患者拒绝并经过多学科评估)并实施(2009)。(图3)患者放射外科治疗后出院,无神经功能障碍。临床和影像学随访显示肿瘤生长控制良好(2019年8月),患者未出现视野缺损或激素损伤。过去的神经学评估(2019年8月)报告了2种抗癫痫药物(左乙拉西坦和丙戊酸[Levitiracetam and Valproate])对癫痫发作的良好控制。
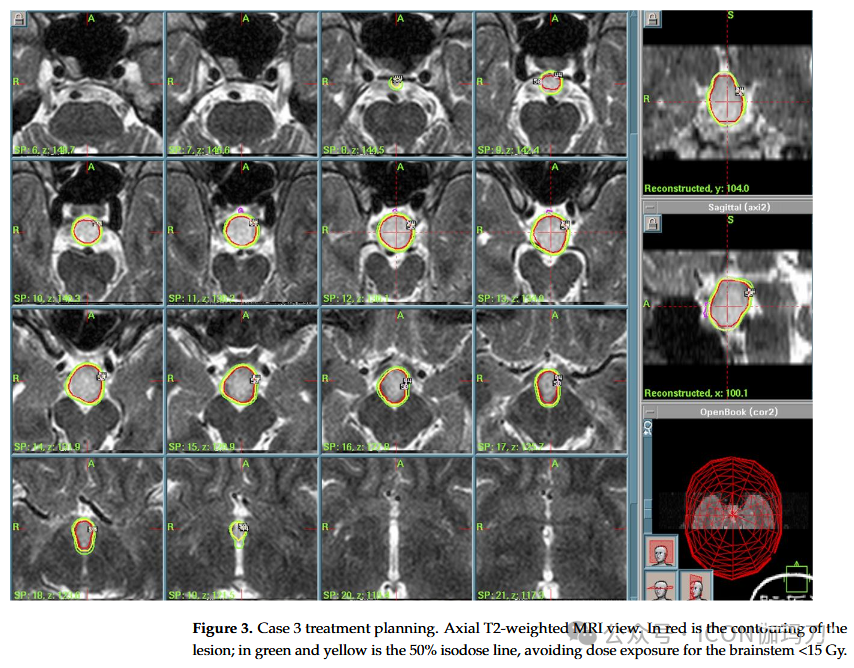
图3。病例3治疗方案。轴位T2加权MRI视图。红色是病变的轮廓;绿色和黄色为50%等剂量线,避免脑干<15 Gy的剂量暴露。
3.2. 垂体柄朗格汉斯细胞组织细胞增生症
病例4:一名47岁女性,临床病史为垂体功能减退、记忆力减退、双眼视野恶化,于2007年2月在神经外科手术一年后转介至我诊所接受鞍区残余LCH的辅助治疗。MRI显示扩张性病变累及第三脑室底,使视交叉和垂体柄脱位。GKRS被用作辅助治疗,以避免第二次高风险手术。这一决定是在跨学科评估之后做出的。2004年开始治疗,PI为50%,PD为11 Gy, MD为22 Gy,总剂量为15.8 mJ/12 mJ, 12 Gy体积为1.06 cc/0.65 cc,治疗耐受良好,术后2天出院。随访至2009年,未发现放射影像学或临床恶化。然后,她在随访中迷失了方向。
3.3. Rathke囊肿(RCC)
病例5:一名45岁的意大利女性于2006年1月因6个月的疲劳、多尿、烦渴、高泌乳素血症和闭经病史转介至我诊所,并接受抗利尿激素激动剂(去氨加压素)治疗。增强MRI(2005年7月)显示一个10毫米,界限清楚的鞍上病变。病变在T1加权钆显像上未见明显强化。在接下来的两个月里,患者开始主诉左侧颞叶偏盲,通过视野检查确诊(图4)。
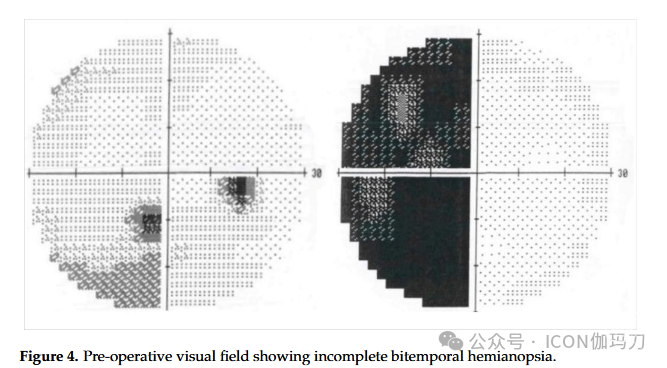
图4。术前视野显示不完全双颞偏盲。
新的MRI(2005年11月)显示病变扩大(20mm), T1加权成像伴有轻度运动障碍增强。由于病变主要位于鞍上,被认为是颅咽管瘤,因此计划经颅切除。2006年1月,患者行双额开颅术,经额下后视交叉入路部分切除病变。术中获得的组织标本用福尔马林固定,石蜡包埋,切片,苏木精和伊红(H-E)染色。然后用光学显微镜检查这些标本。组织病理学检查显示,囊肿内衬纤毛立方和柱状上皮,无异型性,充满黏液样物质。这些结果与典型的RCC一致(图5A-C)。
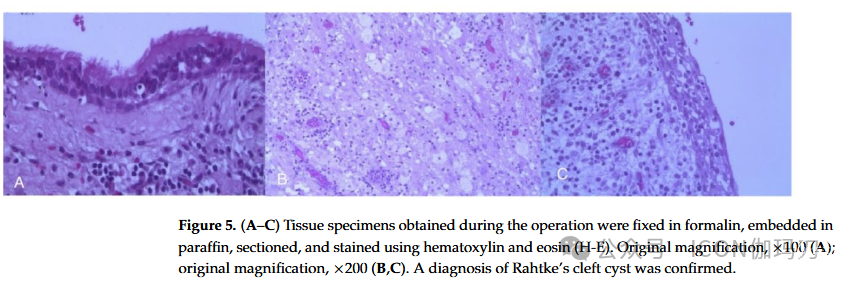
图5。(A-C)术中获得的组织标本用福尔马林固定,石蜡包埋,切片,苏木精和伊红染色(H-E)。原始放大倍数,×100 (A);原始放大倍数,×200 (B,C)。确诊为Rahtke裂隙囊肿。
无急性术后并发症。然而,延迟的血清分析显示全垂体功能低下,患者开始完全激素替代治疗。
2006年12月进行的进一步MR检查显示存在10毫米的残余。在对临床病例进行多学科讨论后,由神经外科医生、放射肿瘤学家和医学物理学家组成的放射外科小组根据患者的情况决定用GK治疗RCC残余。2007年3月行放射外科治疗。剂量计划参数(为单次治疗量身定制)为PI为50%,PD为12 Gy, MD为24 Gy,前部视通路剂量始终<12 Gy,如文献所述(图6)。
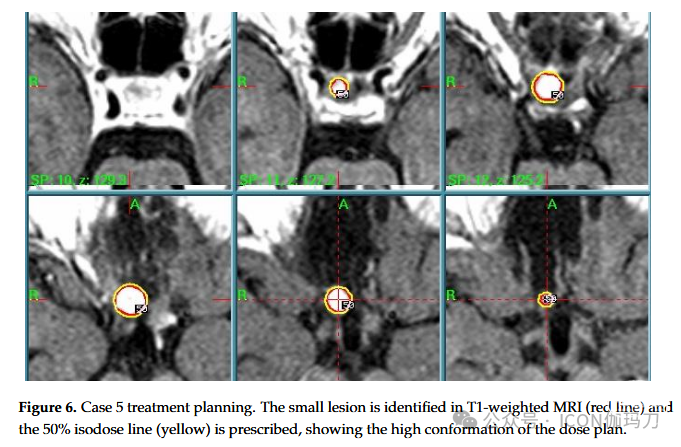
图6。病例5治疗方案。在T1加权MRI中发现小病变(红线),并按50%等剂量线(黄色)处方,显示剂量计划的高度一致性。
放射外科后早期无大碍。连续随访未发现任何副作用的发生。视野检查和血清激素水平分析证实神经眼科和内分泌状况均稳定。连续MRI记录了RCC残余的进行性缩小,在GKRS治疗后88个月的最后一次MRI随访(2014年7月),神经影像学结果显示病变完全消失。
病例6:一位78岁的女性,有长期的视力缺陷和老年性黄斑变性的临床病史。视野测量显示左眼有严重的缺陷,这与她的黄斑变性无关。MRI示囊性鞍区病变,视交叉升高,影像学提示为肾细胞癌。激素剂量显示皮质醇缺乏和催乳素升高。患者年龄较大,有合并症;由于病变靠近视交叉且患者拒绝手术干预,选择GKRS作为非侵袭性选择。
患者于2015年11月接受GKRS治疗 (PI为50%,PD为10 Gy, MD为20 Gy),治疗当日出院。最后一次随访MRI(2023年10月)显示病变囊性部分缩小,患者目前有稳定的视野缺损,无新的神经系统症状。
3.4. 筛窦骨化性纤维瘤
据我们所知,既往仅有一例小儿骨化性纤维瘤手术切除后辅助放疗以改善局部生长控制的报道。
病例7:一名70岁女性,最近出现左眼上睑下垂,视野缺损,复视,额部头痛。MRI显示大量扩张性病变侵袭蝶窦,伴有斜坡和筛窦糜烂。患者在另一中心接受神经外科手术,组织学检查显示为砂砾性骨化纤维瘤(psammomatoid ossifying fibroma)。术后MRI显示蝶窦及斜坡周围残留病变。辅助放疗总剂量为59 Gy,分30次进行。术后6个月的MRI显示,斜坡周围残留肿瘤持续存在,并延伸至蝶鞍底,即筛窦的后部。尽管先前的手术和放疗,仍然存在残余肿瘤。由于解剖复杂性和先前的辐射暴露,GKRS被一个多学科团队选择来优化局部控制。2004年进行治疗(PI为50%,PD为11 Gy, MD为22 Gy)。术后过程顺利,患者出院回家。患者于2016年去世,享年83岁(GKRS治疗后12年);死亡原因与骨化性纤维瘤无关。(图7)。
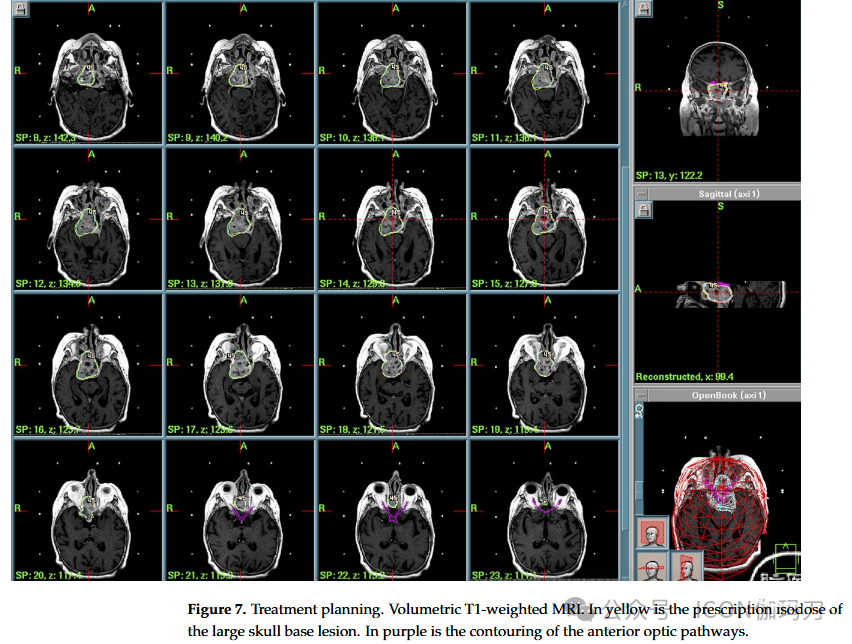
图7。治疗计划。体积T1加权MRI。黄色是大颅底病变的处方等剂量。紫色是前部视神经的轮廓。
3.5. 梭形细胞嗜酸细胞瘤(SCO)
病例8。一位71岁的女性,由于垂体功能减退症,表现为短期虚弱,偶尔头痛,食欲不振,血压不稳定。患者开始激素替代治疗,但不久之后,她出现了迅速恶化的视野缺损。MRI(2012年3月)显示由于存在扩张性强化病变,鞍区扩张。患者通过内镜经鼻蝶入路接受手术。组织学结果在图8中突出显示。
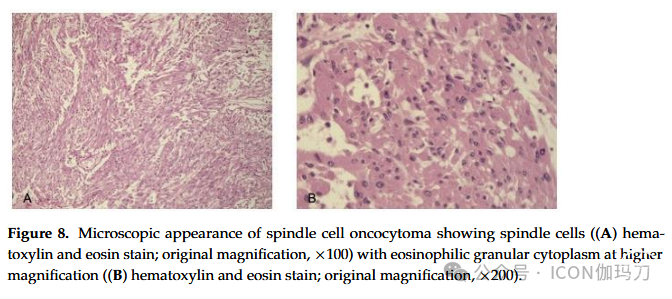
图8。梭形细胞嗜酸细胞瘤的显微镜外观显示梭形细胞((A)苏木精和伊红染色;原始放大倍数,×100),高倍倍率下的嗜酸性颗粒细胞质((B)苏木精和伊红染色;原始放大,×200)。
术后过程顺利,患者出院回家。术后12个月,由于病变复发,患者再次出现视野恶化,因此她接受了第二次内镜手术,部分切除病变。患者术后视力恢复,由于第三次手术风险过高(IP为50%,Ds为12 Gy, Dm为24 Gy,总剂量38.8 mJ, 12 Gy体积2.67 cc),最终于2013年前往GKRS进行辅助治疗。临床和影像学随访至2019年(后Covid -19时代患者失访),肿瘤生长控制良好,患者继续进行垂体功能减退的药物替代治疗,未出现新的神经功能障碍。
3.6. 脉络丛乳头状瘤(CPP)
例9。一名56岁女性患者因持续头痛、左眼视力进行性恶化、平衡障碍10天入住神经外科。在神经病学检查中,患者表现为轻度构音障碍,步态共济失调,双侧构音障碍,Romberg试验阳性。脑MRI显示第四脑室有一个规则形状的病变,伴有脑室系统的初始扩张。患者行寰枕下颅骨切除术以切除上述病变;术后疗程正常,术后12天出院。组织学显示乳头状结构,纤维血管核心被一个或多个柱状上皮细胞覆盖;免疫组化分析发现细胞角蛋白表达,未见胶质原纤维酸蛋白表达。据此,诊断为I级CPP。随访8年后的大脑MRI显示,在视交叉附近的鞍鞍上区出现一个新的病变(直径11 × 12 mm),轻度压迫视隐窝。CT-PET检查显示病变呈高代谢。考虑到手术入路的风险和可能的并发症,患者于2011年接受了GKRS(剂量分期放射外科,覆盖整个肿瘤体积,PD较低;第一阶段,治疗:PI 50%, PD 10 Gy, MD 20 Gy, PI 50%;第二阶段:PD为9Gy, MD为18Gy, 1个月后)。放疗后1个月,患者抱怨持续打嗝和吞咽固体和液体困难,MRI显示鞍上病变(稳定)和位于髓质上的新病变(直径9.5 × 15 mm),囊性成分在随后的MRI中逐渐增加,因此患者通过重新打开先前的枕下入路进行了第二次神经外科治疗。组织学和免疫组织化学分析显示非典型II级CPP (Ki-67 8-10%)。最后一次MRI控制证实了鞍区层面的对合。患者行视野测量显示双颞偏盲,双眼下外象限视网膜敏感性降低。该患者于2019年因 脑脊液播散(liquoral seeding)死亡。病例数据汇总见表1。
表1。患者资料汇总。
讨论:
4.1. 垂体腺瘤和非腺瘤性鞍区病变
众所周知,垂体腺瘤是鞍区最常见的肿瘤。然而,对于其他非腺瘤性病变,如颅咽管瘤、Rathke裂隙囊肿和梭形细胞嗜酸细胞瘤,鉴别诊断有时可能很困难。
梭形细胞嗜酸细胞瘤、脉络膜丛乳头状瘤和Rosai-Dorfman病等罕见病变会使识别和建立适当的治疗变得更加复杂。
鉴于这种复杂性,多学科方法对于准确诊断和最佳治疗至关重要。
神经放射学成像,如组织病理学,是强制性的区分这些实体;例如,细胞角蛋白谱如CK8和CK20可以识别来自Rathke裂隙囊肿的颅咽管瘤。
4.2. 下丘脑错构瘤
下丘脑错构瘤是罕见的异位先天性病变,被描述为癫痫性病变,特别是下丘脑后部和乳头体,而前丘脑错构瘤通常会发生内分泌障碍。HH有多种分类,但最常用的分类是基于HH与第三脑室之间的解剖关系的MR成像结果。多种神经外科方法已被描述为管理癫痫性下丘脑错构瘤(HHs)。其中,伽玛刀放射外科(GKRS)已被证明是一种有效的微创选择,用于选定的患有小I型或III型病变的儿科患者。GKRS提供了与显微外科切除相媲美的癫痫控制结果,同时提供了更有利的神经风险概况。然而,它的主要局限性是治疗效果的延迟,这需要长期随访才能充分评估治疗反应和临床结果。
治疗策略包括显微手术、内镜检查、放射外科,以及最近的聚焦超声,这些方法在控制癫痫发作方面的成功率各不相同。
放射外科,特别是伽玛刀放射外科,已被证明是安全有效的一线治疗,有效地控制癫痫发作,同时保持内分泌功能。射波刀放射外科在治疗与HH 相关的严重癫痫病例方面也显示出希望,提供了另一种非侵袭性替代方案。
4.3. 朗格汉斯细胞组织细胞增生症(LCH)和其他组织细胞增生症
朗格汉斯细胞组织细胞增生症是一种罕见的特发性疾病,其特征是组织细胞在各种组织和器官中不受控制的克隆性增殖,尚不清楚其发病机制。LCH的发病率为百万分之1-2例,特别是在成人中,中枢神经系统的侵袭极为罕见,因为LCH通常涉及儿童患者,影响颅骨、柱、股骨和骨盆并伴有溶骨病变。病灶在中枢神经系统(CNS)内的位置对于建立正确的治疗方案至关重要。
LCH是另一种罕见的影响下丘脑-垂体轴的病变,临床上可导致内分泌病变,包括尿崩症、垂体功能低下或前部视神经通路。
一些病例表现为视交叉或垂体柄的孤立病变,进一步使诊断复杂化。由于其不同的表现,早期识别和及时干预是至关重要的。
对于无症状患者和未累及关键区域的病变可考虑保守治疗。高剂量皮质类固醇治疗LCH相关性垂体炎已被提出,但由于类固醇的副作用仍存在争议。伽玛刀和射波刀放射外科已被建议用于控制病变生长。治疗方式包括复发性或持续性病变的补救性立体定向放疗,而多灶性疾病则需要全身化疗。
4.4. Rathke裂囊肿
Rathke裂囊肿(RCCs),也被称为中间部囊肿,是胚胎时期Rathke囊袋残余形成的良性病变。RCC通常位于垂体前叶和后叶之间的鞍区。这些病变是常见的偶然“无症状”发现(出现在4-33%的尸检中),但它们可能占症状性鞍和鞍上病变的6-10%。患者的平均年龄在40 - 50岁之间,有以女性为主的趋势。
症状性头痛、视觉障碍、垂体功能减退、闭经和溢乳通常在发现时就已出现。垂体炎也有报道,由异物对囊肿内容物的反应引起。其他症状较少报道:低钠血症、无菌性脑膜炎、视神经炎、尿崩症和海绵窦综合征。
RCC的关键位置使其手术治疗特别具有挑战性。
我们建议将GKRS用于RCC,目的是显著降低术后复发或进展的风险,从而避免重复切除的需要和进一步永久性并发症的风险。将RCC纳入GKRS适应证的理由是,这些病变可以被恰当地认为是良性肿瘤形式。事实上,一些作者认为RCC和颅咽管瘤之间有密切的关系,因为它们有一个共同的组织学起源,来自Rathke裂隙的鳞状上皮残留物。此外,在同一例患者中也有从RCC向颅咽管瘤转变的报道。最后,众所周知,GKRS可以有效治疗颅咽管瘤。作者发现RS治疗前出现的所有症状都消失了,没有内分泌功能障碍或肿瘤复发。
4.5. 其他形式
骨化性纤维瘤是一种纤维-骨性良性病变,于1872年首次被描述,最常见于头颈部,但累及筛窦是相当罕见的。
骨化纤维瘤(OF)主要是颌骨(下颌骨和上颌骨)和颅面骨骼的纤维骨性病变。然而,其发生在鞍区是极其罕见的,文献中只有少数病例被报道。在鞍区,骨化纤维瘤可能起源于胚胎残余或能够成骨的间充质组织。其在该区域的发展尚不清楚,但可能与颅骨或鼻窦内异常的纤维-骨活动有关。
患者的平均年龄在20 - 30岁之间,女性患病率略高(2:1)。病因尚不清楚,但一些作者认为起源于牙齿的牙周韧带。临床表现因肿瘤位置的不同而不同,从无症状、偶然发现的病变到鼻塞。
梭形细胞嗜酸细胞瘤发生于腺垂体,由于其高复发率和相关的出血风险,是一种手术挑战。
梭形细胞嗜酸细胞瘤是最近发现的一种良性腺垂体非腺瘤性肿瘤。SCO是一种罕见的WHO一级肿瘤,主要发生在50-60岁的成年人中,性别分布均匀。它主要影响大脑的鞍区和鞍上区,通常起源于垂体前叶。它由梭形细胞和嗜酸性嗜瘤细胞质组成(因此得名“嗜酸细胞瘤”)。其细胞呈束状,有丝分裂活性低,无明显的异型性,这有助于将其与更具侵袭性的肿瘤区分开来。
以前只有很少的病例报道立体定向放射治疗SCO,但GKR可能是一个有效的替代复发病例。
然而,需要进一步的研究来确定长期结果。
同样,Rosai-Dorfman病,一种良性组织细胞疾病,可以模仿其他鞍区病变,因此准确诊断至关重要。
脉络膜丛乳头状瘤(CPPs)是一种罕见且生长缓慢的中枢神经系统神经外胚层肿瘤,占所有原发性脑肿瘤的不到1%,起源于脉络膜丛上皮细胞。这些肿瘤最常见的位置是侧脑室三角区(婴儿和儿童)和第四脑室(成人)。然而,在极少数情况下,它们可以发生在脑室外部位,如小脑-脑桥角、后颅窝、脑干、骶管、脑实质和鞍上区。在我们的一系列不寻常的鞍区病变,我们报告一个病例的鞍上CPP放射影像类似垂体腺瘤。
除了在我们的系列中治疗的罕见鞍区肿瘤外,其他不寻常的病变也已成功地通过放射外科治疗,据文献报道。Vasquez等描述了伽玛刀放射外科(GKRS)对表皮样瘤的治疗,强调了其在控制生长和减少与附着囊肿壁相关的手术风险方面的作用。同样,Cohen-Inbar等提出了一项颅内血管外皮细胞瘤的多中心研究,这是一种典型的侵袭性肿瘤,立体定向放射外科提供了有希望的局部控制率和可接受的毒性。
Albano等报道了原发性鞍部黑色素细胞瘤和其他鞍旁肿瘤,表明原发性放射手术和术后辅助放疗,包括立体定向技术,对传统上需要手术切除的肿瘤都是有效的。
这些报告强调了放射外科技术在鞍区和鞍旁区域各种罕见病变的安全、有效和微创治疗中的作用。我们的研究结果与这些观察结果一致,表明GKRS应被视为一种有价值的治疗选择,不仅适用于常见的鞍区病变,也适用于更广泛的罕见和组织学多样化的肿瘤。然而,需要更大的系列和更长的随访来验证这些初步的有利结果。
4.6. 放射治疗作为补救疗法
立体定向放射治疗,包括伽玛刀和射波刀放射外科,已经成为治疗复发性或难治性鞍区病变或手术不可行的病例的关键方法。这些模式提供高精度和备用的关键结构,如垂体柄和前部视神经通路。
伽玛刀放射外科提供高度聚焦的辐射,对周围组织的暴露最小,使其成为治疗局部肿瘤和该区域病变的首选方法。
相反,长期研究强调平衡治疗效果和潜在副作用的重要性,特别是在辐射引起的内分泌疾病中。放射外科患者对内分泌功能进行细致的随访是必要的。放射外科的未来发展,如分割方案,旨在进一步减少并发症,改善患者的预后。
4.7. 新兴见解和研究需求
如前所述,罕见鞍区病变的临床表现和预后的可变性突出了在治疗计划和决策方面多学科合作的必要性。
放射外科也被证明对罕见的垂体肿瘤、残余/复发或不适合手术的患者是安全有效的。
结论:
长期随访结果表明,GKRS治疗罕见鞍区病变安全有效,毒性极低。据我们所知,本报告是在单个大型医疗中心中使用GKRS治疗罕见鞍区病变的最大系列,表明GKRS可能是一种有效的非侵袭性辅助治疗选择。需要进一步的研究和更多的患者来证实这些罕见鞍区病变的残余是否可以在不治疗的情况下自行退缩,或者其他非侵袭性治疗是否可以像GKRS治疗一样有效。
鞍区和鞍上区是多种病理的宿主,每种病理都需要量身定制的诊断和治疗方法。影像学和放射外科的进步,加上对罕见病变生物学的深入了解,继续扩大有效管理的视野。整合这些模式,同时保持以患者为中心的焦点仍然是医疗的基石。
声明:脑医汇旗下神外资讯、神介资讯、神内资讯、脑医咨询、Ai Brain 所发表内容之知识产权为脑医汇及主办方、原作者等相关权利人所有。




