

第一作者:孙紫瑜a,赵文轩a,费喜峰b,何豹a
通讯作者:石磊a,张臻c,蔡世忠d
作者单位:a昆山市第一人民医院神经外科/南京医科大学姑苏学院,b苏州九龙医院神经外科/上海交通大学医学院,c江苏大学附属昆山医院放射科/中国医科大学/南京医科大学姑苏学院,d苏州大学附属儿童医院儿童与青少年保健科
https://doi.org/10.1038/s41598-025-96047-x
摘要:
胶质瘤对传统治疗的反应不佳,肿瘤细胞的迁移仍是治疗中的重大挑战。上皮-间充质转化(EMT)在胶质瘤细胞侵袭中具有关键作用,转化生长因子β1(TGF-β1)是促进胶质母细胞瘤(GBM)增殖、迁移和EMT的关键因子。尽管磁场广泛应用于多种疾病的诊断和治疗,但其对胶质瘤细胞EMT的影响尚不明确。本研究旨在探讨静态磁场(SMF)是否能够抑制胶质瘤细胞的EMT和转移。采用U251和U87胶质瘤细胞系进行细胞功能实验,以研究其功能和表型变化。结果显示,TGF-β1处理增强了胶质瘤细胞的侵袭和迁移能力,同时降低了细胞凋亡。然而,当SMF与TGF-β1处理联合使用时,观察到细胞迁移和侵袭能力显著降低,凋亡率增加。此外,这种联合治疗显著降低了间充质标志物N-cadherin和β-catenin的蛋白表达,并减少了基质金属蛋白酶(MMP)-2的水平。综上所述,这些发现表明SMF可能通过抑制EMT来减轻胶质瘤细胞的转移。因此,SMF有望成为一种减少胶质瘤转移的有前景的治疗方法。
关键词:胶质瘤,磁场,上皮-间充质转化,转化生长因子β1
引 言
中枢神经系统(CNS)肿瘤的发病率因地区而异。例如,欧洲的发病率最高,约为每年每10万人中有6.59例,而美国的发病率约为每年每10中有万人5.74例。相比之下,亚洲的发病率最低,低于每年每10万人3例1。胶质瘤是一种恶性原发性脑瘤,被认为起源于携带肿瘤启动突变的神经干细胞或祖细胞2。这些肿瘤具有快速增长、侵袭性强和预后不良的特点,中位生存期约为14.6个月。胶质母细胞瘤(GBM)的五年生存率为5.1%3。
目前,胶质母细胞瘤的治疗采用手术、放疗和化疗的联合方案。然而,传统治疗方法在预防肿瘤复发和转移方面效果不佳。近期研究表明,上皮-间充质转化(EMT)可能在肿瘤侵袭和药物耐受中发挥关键作用。EMT是一种可逆的过程4;其特点包括上皮细胞极性丧失、细胞间粘附力减弱以及细胞迁移能力增强。EMT在胚胎发育中已被证实具有关键作用,但其在体内肿瘤转移中的作用仍存在争议5,6。例如,在肾器官形成过程中,包绕输尿管芽的间充质通过EMT发育成肾上皮,随后又通过间充质-上皮转化(MET)过程进一步发展7。同样地,EMT可促进肿瘤细胞的转移。癌细胞经历EMT,从上皮状态转变为类似间充质的状态,获得迁移和侵袭能力,从而从原发肿瘤部位脱离并迁移到远处位置。当到达新部位后,它们通过间充质-上皮转化重新转变为类似上皮的状态,从而促进转移灶的肿瘤生长8,9。据认为,肿瘤环境微中的各种细胞外信号影响下,癌细胞会发生EMT10。其中涉及的主要信号通路包括TGF-β、Wnt、Notch和Hedgehog信号通路,这些通路均与EMT过程相关。其中,TGF-β通路可能是EMT的主要诱导因子11。此外,具有EMT特征的细胞通常通过表达基质金属蛋白酶(MMPs)来降解和侵袭细胞外基质12。胶质母细胞瘤中上皮-间充质转化的存在仍有争议13,但EMT生物学过程与胶质瘤患者的预后显著相关14,表明EMT进展与胶质母细胞瘤预后不良之间关系密切15。
所有生物体每天都暴露于磁场(MF)环境中,这引发了人们对磁场潜在健康影响的关注。由于磁场具有广泛频率、振幅和强度,其直接的生物学作用靶点尚未完全明确,生物学效应也呈现多样性16。有证据表明,长期暴露于磁场可能增加癌症发病率。2002年,世界卫生组织(WHO)下属的国际癌症研究机构(IARC)将静态和极低频(300kHz-300GHz)磁场列为可能的人类致癌物。然而,特定强度的磁场对肺癌17和乳腺癌18等多种癌症表现出抑制作用。静态磁场(SMF)影响肿瘤的确切机制尚不完全清楚。一种假说认为,磁场可通过诱导活性氧(ROS)介导的DNA损伤,导致细胞凋亡和铁死亡17,19。另一种观点认为,静态磁场通过减少肿瘤血管内的血流20和抑制血管生成21来抑制肿瘤生长。在胶质瘤中,细胞活力显著下降可能与细胞周期蛋白依赖性激酶1(CDK1)蛋白表达降低有关,而非凋亡22。在我们以往的研究中,已证实强度为1000高斯±100高斯的静态磁场对胶质瘤细胞具有抑制作用。然而,静态磁场对胶质瘤EMT过程的影响尚不清楚。
本研究旨在探讨静态磁场对胶质瘤EMT的抑制作用。研究发现,经转化生长因子β1(TGF-β1)诱导的胶质瘤细胞表现出显著的EMT特征,而当暴露于强度为1000高斯±100高斯的静态磁场时,其迁移和侵袭能力明显降低。此外,细胞凋亡增加,间充质标志物(包括N-cadherin、β-catenin)和基质金属蛋白酶(MMP)-2表达减少。这些结果为胶质瘤治疗提供了新的策略。
材料与方法
细胞系与细胞培养
人胶质母细胞瘤细胞系U87和U251购自中国科学院细胞库(中国上海),于高糖DMEM(Gibco/Biosharp)培养基中培养,培养基添加10%胎牛血清(FBS)(Gibco)和1%青霉素-链霉素溶液(PS)(青霉素100U/ml,链霉素100mg/ml)。胶质瘤细胞在37°C、含5% CO₂的湿润环境中培养,每2-3天更换一次培养基。在实验处理中,将细胞暴露于10ng/ml的TGF-β1(PeproTech)环境中。
细胞克隆与集落形成实验
EdU增殖实验
细胞凋亡检测
细胞迁移和侵袭实验
Western blot
统计分析
结果
TGF-β1促进胶质瘤细胞的迁移和侵袭
在多种细胞类型中,TGF-β1被证实可以抑制细胞增殖,在上皮细胞和淋巴细胞中尤为明显。然而,在某些肿瘤细胞中,TGF-β1却能反常地促进细胞侵袭和迁移。为了探究TGF-β1对胶质母细胞瘤细胞的影响,我们对U87和U251细胞进行10ng/ml TGF-β1处理,处理时长为72小时。如图1A所示,经TGF-β1处理后的细胞形态发生了变化,呈现出类似间充质细胞的梭形。在细胞克隆实验中,证实了TGF-β1对U87和U251细胞可能具有促进增殖的作用(图1B)。为了更深入地验证TGF-β1对细胞增殖的影响,我们采用了EdU检测实验。如图1C所示,经过72小时的TGF-β1处理后,倒置荧光显微镜下观察发现,与空白对照组相比,细胞增殖能力略有提升,但这种提升并不具备统计学意义,这表明TGF-β1对胶质瘤细胞的主要影响并非通过显著增强其增殖能力来实现。
然而,经TGF-β1处理的U87和U251细胞凋亡显著减少(图1D)。为了探究TGF-β1是否影响细胞迁移和侵袭能力,采用Transwell实验检测经TGF-β1处理72小时的U87和U251细胞的迁移和侵袭能力。与对照组相比,经TGF-β1处理的U87和U251细胞迁移和侵袭能力显著增强(图1E)。因此,这些发现表明TGF-β1可促进胶质母细胞瘤细胞的迁移和侵袭。
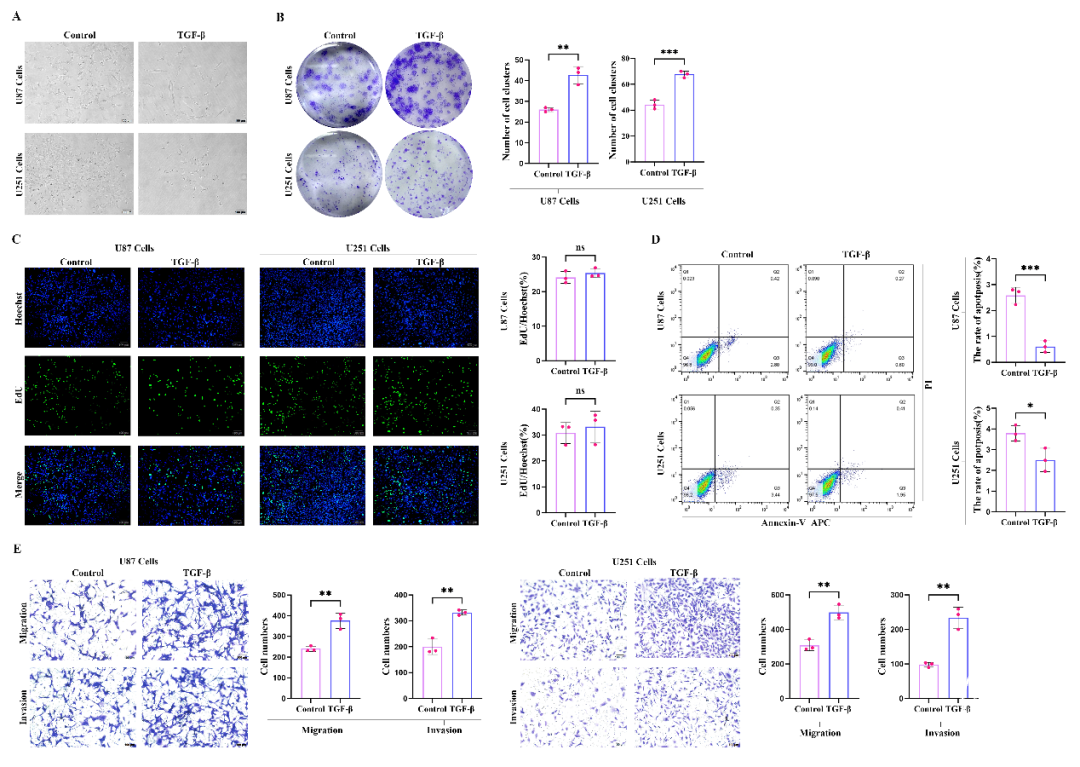
图1. TGF-β促进胶质瘤细胞的增殖、迁移和侵袭。(A)经TGF-β1处理后,在10×放大倍数下通过倒置荧光显微镜观察U87和U251细胞的形态变化;(B和C)TGF-β1对U87和U251细胞增殖能力的影响;(D)与对照组相比,TGF-β1干预显著降低了凋亡细胞的数量;(E)在Transwell实验中,评估了细胞迁移和侵袭能力,并通过t检验分析了不同组别的细胞计数。经72小时TGF-β1处理后,GBM细胞的迁移和侵袭能力显著增强。ns:p>0.05;:p<0.05;:p<0.01;:p<0.001;****:p<0.0001。
磁场抑制经TGF-β1处理的胶质母细胞瘤细胞
为了探究静态磁场(SMF)是否可以调节TGF-β1对胶质母细胞瘤细胞的影响,我们对U87和U251细胞进行了72小时的TGF-β1、SMF或两者联合处理。虽然单独的SMF对细胞形态的影响较小,但它成功逆转了TGF-β1诱导的形态变化,这种逆转在U87细胞中尤为明显(图2A)。此外,我们采用Annexin V/PI双染色法评估了SMF对胶质母细胞瘤细胞活力的影响。结果显示,静态磁场增加了U87和U251细胞系中凋亡细胞的比例。经过72小时的TGF-β1处理后,凋亡水平下降;然而,当TGF-β1处理与静态磁场联合使用时,凋亡细胞的比例再次增加(图2B)。此外,Transwell实验进一步证实了静态磁场是否能够抑制胶质母细胞瘤细胞的迁移和侵袭能力(图2C)。与对照组相比,磁场抑制了U87和U251细胞的迁移和侵袭,并逆转了TGF-β1的促迁移效果。
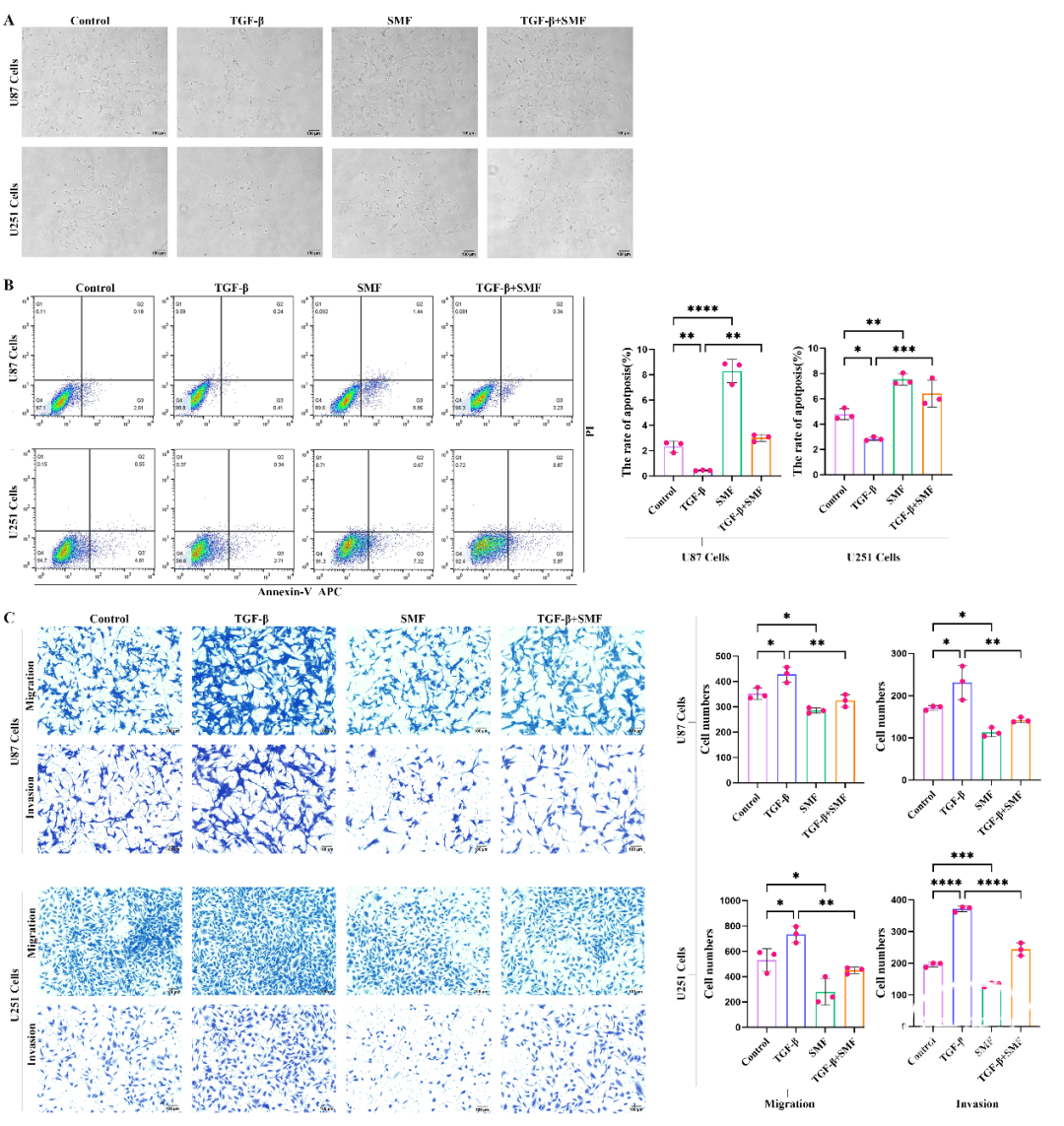
图2. 静态磁场抑制经TGF-β1处理的胶质瘤细胞。(A)在10×放大倍数下,通过倒置荧光显微镜观察到的U87和U251细胞经TGF-β1、静态磁场(SMF)或两者联合处理后的形态变化。(B)静态磁场增加细胞凋亡;经72小时TGF-β1处理后,凋亡减少,但联合处理使凋亡增加。(C)静态磁场抑制细胞迁移和侵袭,而TGF-β1则增强细胞增殖和侵袭;联合处理减少细胞迁移和侵袭。ns:p>0.05;:p<0.05;:p<0.01;:p<0.001;****:p<0.0001。
静态磁场调节胶质母细胞瘤细胞中与上皮-间充质转化相关基因的表达
为确认静态磁场是否调节与上皮-间充质转化(EMT)相关基因的表达,我们进行了Western blot分析,以评估EMT标志物的蛋白表达水平。结果显示,与对照组相比,仅暴露于静态磁场的U87和U251细胞中,间充质标志物N-cadherin和β-catenin的蛋白水平降低,基质金属蛋白酶(MMP)-2的表达也减少。经TGF-β1(10ng/ml)处理72小时后,U87和U251细胞中N-cadherin、β-catenin和MMP-2的蛋白表达显著增加。然而,当静态磁场与TGF-β1联合应用时,与单独使用TGF-β1相比,N-cadherin、β-catenin和MMP-2的共同表达相对减少(图3)。综上所述,这些结果表明静态磁场可以抑制TGF-β1诱导的胶质母细胞瘤细胞的EMT过程。
图3. 静态磁场调节胶质瘤细胞中与上皮-间充质转化(EMT)相关基因的表达。在TGF-β1和静态磁场干预下,U87和U251细胞中与EMT相关蛋白的表达情况。原始印迹/凝胶图呈现在补充信息中。ns:p>0.05;:p<0.05;:p<0.01;:p<0.001;****:p<0.0001。
讨论
本研究旨在探讨静态磁场(SMF,1000±100Gs)对胶质瘤细胞上皮-间充质转化(EMT)的抑制作用。研究结果显示,SMF能显著抑制TGF-β1诱导的胶质瘤细胞EMT过程,降低细胞迁移和侵袭能力,同时显著增加细胞凋亡。通过Western blot分析,我们观察到SMF处理可降低N-cadherin、β-catenin和MMP-2等关键EMT标志物的表达水平。这些结果表明,SMF有望作为胶质瘤治疗中的辅助疗法,为遏制肿瘤转移提供新策略。
首先,我们的研究结果与既往研究一致,证实了TGF-β1作为EMT的主要诱导因子,可增强胶质瘤细胞的迁移和侵袭能力23,24。TGF-β1能诱导细胞形态变化,促使其呈现间充质表型,进而增强细胞侵袭性。这与以往强调TGF-β信号通路在胶质瘤细胞恶性进展中关键作用的研究相呼应25。尽管TGF-β诱导EMT的机制已得到广泛研究,但该过程仍较为复杂,且高度依赖肿瘤微环境26,27。因此,抑制TGF-β1诱导的EMT是胶质瘤治疗的关键难题。
静态磁场在胶质瘤治疗中的应用尚处于探索阶段。既往研究表明,静态磁场可抑制特定肿瘤类型的细胞增殖并促进凋亡28,29。本研究发现,静态磁场显著抑制TGF-β1诱导的上皮-间充质转化(EMT),明显降低胶质瘤细胞的迁移和侵袭能力。具体而言,静态磁场处理下调了N-cadherin和β-catenin的表达,这些标志物通常与细胞间粘附力降低和运动能力增加相关30。此外,MMP-2表达下调可能在减少基底膜和细胞外基质降解中发挥作用31,从而限制胶质瘤细胞的侵袭行为。
静态磁场对细胞凋亡的影响是本研究的另一重要发现。与TGF-β1处理的胶质瘤细胞凋亡显著减少相比,TGF-β1与静态磁场联合处理显著增加了凋亡率,表明静态磁场通过独特机制增强细胞凋亡。以往研究表明,静态磁场可能通过影响细胞周期相关蛋白表达来抑制胶质瘤细胞增殖22。然而,本研究结果表明,静态磁场在促进凋亡和抑制EMT方面的作用机制可能独立于其对细胞增殖的影响。未来研究应进一步探讨静态磁场对胶质瘤细胞凋亡信号通路的具体调节作用,以更深入地阐明其治疗机制。
此外,本研究提出了一种利用静态磁场(SMF)抑制TGF-β1诱导的上皮-间充质转化(EMT)的潜在治疗策略。由于TGF-β信号通路的复杂性32,直接抑制该通路存在一定的挑战和潜在副作用33。作为一种非侵入性物理干预措施,SMF可能通过下调EMT相关标志物和促进凋亡,有效减少胶质瘤细胞的迁移和侵袭。然而,由于SMF的生物效应因磁场强度、暴露时间和细胞类型等实验条件而异34,因此有必要开展更多的体内实验来验证SMF的治疗效果和安全性。
总之,本研究为静态磁场在抑制TGF-β1诱导的EMT方面的作用提供了新的见解,显著降低了胶质瘤细胞的迁移和侵袭能力。SMF通过下调EMT相关标志物和促进凋亡,可能成为一种独特的物理干预手段,为胶质瘤治疗提供有前景的辅助方法。鉴于SMF在不同细胞类型和体内条件下的效果存在差异,未来研究应进一步探讨SMF在胶质瘤治疗中的作用机制,以优化其临床应用。
参考文献
致谢
本研究由国家自然科学基金(82273472)、苏州神经肿瘤与纳米仿生重点实验室、苏州医疗卫生创新项目(SKYD2022002)、苏州科技局项目(SKY2022173,SKY2023188)以及苏州卫生重点医学人才培训项目(GSWS2020112)资助。资助方在研究设计、数据收集与分析、决定发表或稿件撰写方面未发挥任何作用。
声明:脑医汇旗下神外资讯、神介资讯、神内资讯、脑医咨询、Ai Brain 所发表内容之知识产权为脑医汇及主办方、原作者等相关权利人所有。





