提示
前言
神经肿瘤是颅内常见病,主要包括神经上皮肿瘤、脑膜瘤、转移瘤及淋巴瘤等。从483期开始将刊发“第二轮神经肿瘤系列”,与同道共享,欢迎大家批评指正和交流讨论。
引言
颅内原发性Rosai-Dorfman病(Rosai-Dorfman Disease, RDD)是一种罕见的良性组织细胞增生性疾病,发病机制尚不明确,临床表现多样,易与其他颅内肿瘤混淆。其临床诊疗策略应依据病变大小、位置及其神经功能影响而定。因此,术前影像学的准确鉴别诊断对制定合理的治疗方案具有重要意义。对于术后病理诊断明确、但因解剖位置复杂或邻近重要神经结构而无法实现全切的患者,需结合病变生物学行为、术后残留情况以及患者临床症状,酌情考虑密切随访、放射治疗或免疫抑制等方案。本文报道一例桥小脑角区原发性RDD患者的诊治及随访过程,并结合既往文献,探讨其影像学特征与治疗策略,以期为临床诊治提供参考。
病例简介
患者,男性,41岁,因“右侧耳后疼痛1月余”入院。
患者一月余前无明显诱因下出现右侧耳后疼痛,无其他伴随症状,至当地医院检查,后续头颅磁共振提示:右侧桥小脑角区占位,听神经瘤可能。患者为进一步治疗来我院就诊,门诊拟“右侧桥小脑角区肿瘤”收住入院。
诊疗经过
入院后完善相关检查,排除手术禁忌症,术前增强MR检查提示右侧桥小脑角区占位,伴有周围骨质信号异常,黑色素瘤等恶性肿瘤不除外,颞骨CT提示颞骨岩部及枕骨斜坡右侧骨质破坏,双侧内听道未见明显扩张,术前经科室讨论后认为肿瘤性质待排,恶性肿瘤难除外,手术指征存在,拟行经乙状窦后桥小脑角区肿瘤切除手术治疗。
术前影像学检查:术前头颅增强MR影像(图1)显示右侧桥小脑角区占位,T2呈低信号,T1呈等信号,强化后明显强化,恶性肿瘤难除外。颞骨CT提示颞骨岩部及枕骨斜坡右侧骨质破坏。
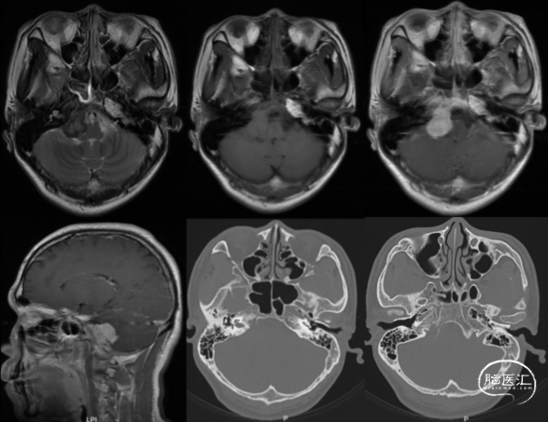
图1.术前头颅增强MR影像和颞骨CT影像,可见右侧桥小脑角区占位, T2呈低信号,T1呈等信号,强化后明显强化,CT可见颞骨岩部及枕骨斜坡右侧骨质破坏。
术中发现:术中经乙状窦后入路探查,术中见病变组织起源于岩骨,质地较韧,血供一般,岩骨骨质侵犯破坏。前庭神经、耳蜗神经及面神经受挤压水肿移位。病变组织包绕右侧椎动脉,无法彻底分离,且与小脑前下动脉关系密切。术中多次冰冻病理检查提示纤维组织中有大量淋巴样细胞浸润。术中与病理科沟通后认为目前病灶不首先考虑肿瘤,考虑病灶与周围神经血管关系密切,全切肿瘤后神经功能障碍加重,遂决定行大部肿瘤切除。
患者术后磁共振复查右侧桥小脑角区病变组织大部切除,颈静脉孔区及岩骨部分肿瘤残留(图2),术后患者声音较术前嘶哑,右侧轻面瘫,无其他神经功能障碍。
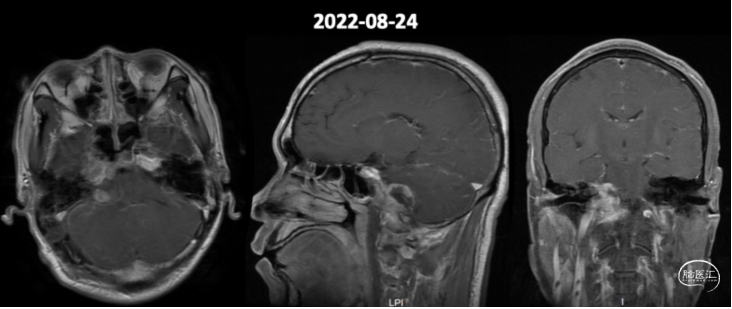
图2.术后头颅增强MR影像,可见颈静脉孔区及岩骨部分肿瘤残留。
病理结果
术后病理诊断:增生的纤维组织中大量淋巴浆细胞浸润及组织细胞聚集,结合免疫组化机分子检测,考虑Rosai-Dorfman病(图3)。
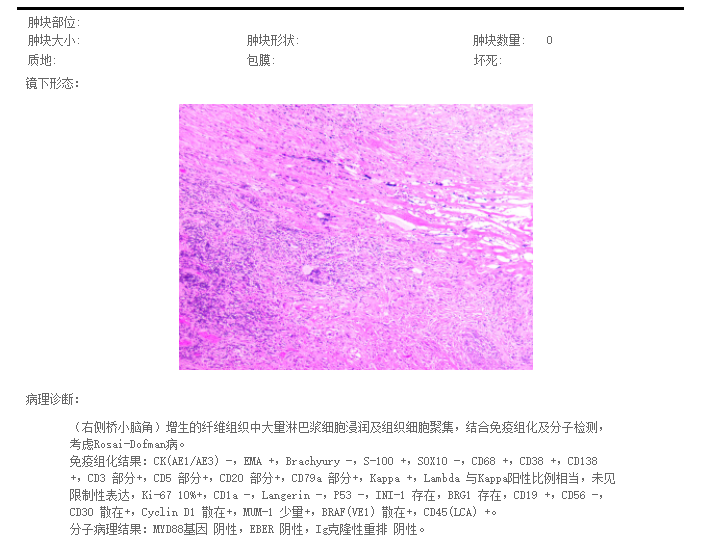
图3.术后病理结果。
随访过程:术后结合病理诊断颅内原发性的Rosai-Dorfman病,且单发病灶位于桥小脑角区,因其与周围神经血管结构(包括椎动脉、小脑前下动脉、听神经、面神经及后组颅神经等)关系密切,术中仅行大部切除,残留组织主要位于颈静脉孔区及岩骨部分。术后经多学科会诊,结合现有文献及临床指南,考虑Rosai-Dorfman病的生物学行为以缓慢进展为主,部分病例甚至呈自然缓解趋势,决定在患者无明显神经功能障碍的前提下,暂不行进一步放化疗,采取密切影像学随访观察策略。术后与患者及家属充分沟通,并制定随访计划。截至目前,患者已完成术后2年随访,期间复查头颅MR如下,病灶无明显进展。
术后2月复查MR提示术区累及枕骨颈静脉结节深部残留强化,较术后基本相仿(图4)。
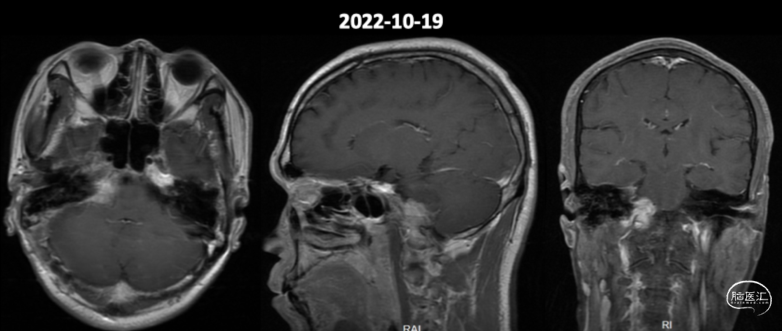
图4.术后2月头颅增强MR影像。
术后4月复查MR提示术区强化残留病灶较前基本相仿(图5)。
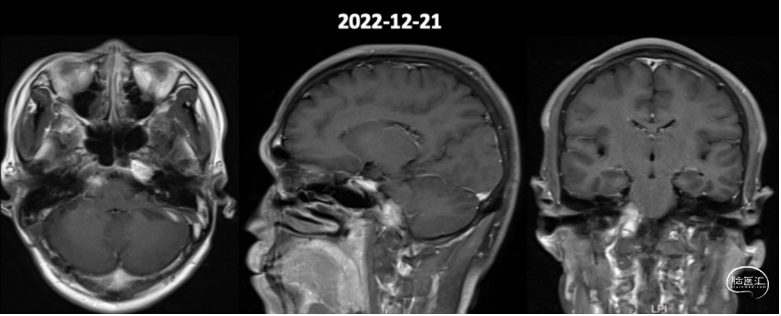
图5.术后4月头颅增强MR影像。
术后8月复查MR提示强化残留病灶稳定(图6)。
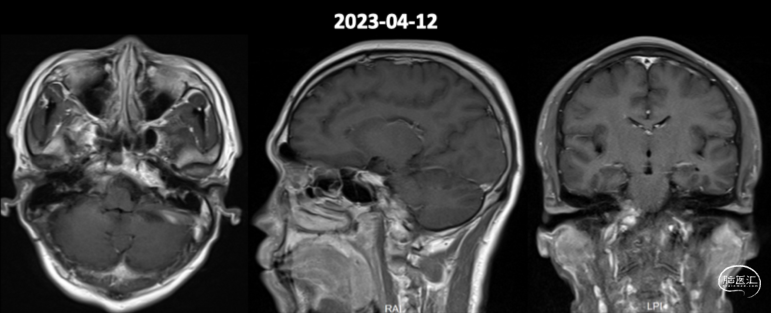
图6.术后8月头颅增强MR影像。
术后1年复查MR提示强化残留病灶较前稍变小(图7)。
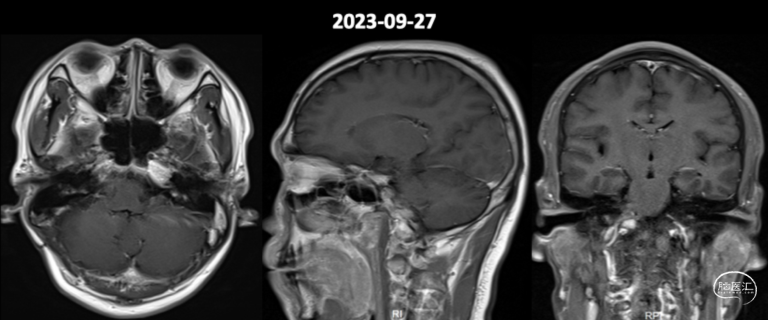
图7.术后1年头颅增强MR影像。
术后2年复查MR提示强化残留病灶较术后1年复查相仿(图8)。
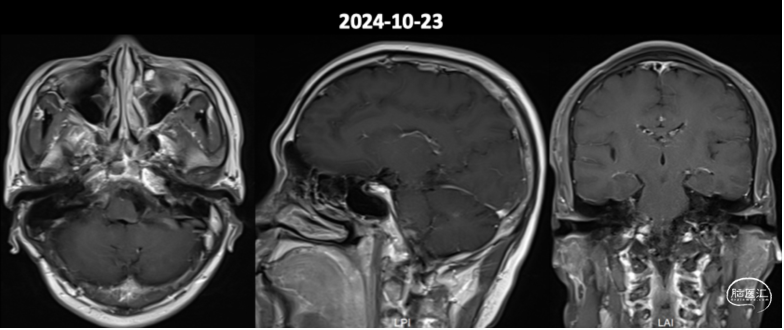
图8.术后2年头颅增强MR影像。
随访期间患者主诉右侧轻度面瘫好转,声音改善,未再出现新发神经功能障碍。生活质量基本未受影响,后续随访仍在进行中。
讨论
Rosai-Dorfman病(Rosai-Dorfman Disease, RDD)是一种罕见的良性组织细胞增生性疾病,特征性表现为窦组织细胞增生,并伴大量浆细胞和淋巴细胞浸润,又称“伴有巨大淋巴结肿大的窦组织细胞增生症”。该病最早于1965年由Destombes首次报道,后于1969年由Rosai与Dorfman系统描述并命名。其病因尚不明确,可能与感染因素(如EB病毒、HHV-6、多瘤病毒、克雷伯杆菌等)相关,也有研究认为其具有自身免疫或炎症反应的特征。RDD以颈部淋巴结无痛性肿大为最典型表现,但也可累及其他部位,包括皮肤、眼眶、鼻腔、骨骼、泌尿生殖系统等。当病变局限于中枢神经系统(CNS)且无其他系统受累时,称为颅内原发性Rosai-Dorfman病(Primary Intracranial RDD),其发病极为罕见,仅占RDD总病例数的5%左右。
颅内RDD多表现为孤立性硬膜下或硬膜外肿块,其影像学表现缺乏特异性,术前常误诊为脑膜瘤、神经鞘瘤等肿瘤性病变。文献提示颅内RDD的影像学特征主要包括以下几点:在CT表现上,病灶常呈高密度影,增强后可见均匀明显强化,周围常伴有脑实质水肿,并可引起不同程度的占位效应。MRI表现方面,T1序列上病灶一般为等信号,增强后呈明显均匀强化;T2序列多为低-等信号,伴有病灶周围水肿表现。此外,部分病例可见脑沟变浅或轻度皮质增厚,提示可能伴发一定程度的硬脑膜炎。RDD病灶在磁共振波谱(MRS)上常表现为脂质峰和乙酰天冬氨酸峰升高,提示肉芽肿性病变的代谢特征,同时可见胆碱峰升高,但不如肿瘤性病变显著。灌注加权成像(PWI)则显示相对低的脑血容量(rCBV)灌注表现,提示病灶组织中富含纤维组织而血供相对较低。
因RDD在影像学上常与脑膜瘤相似,术前需重点与其进行鉴别(图9),归纳其影像学的鉴别要点如下:
T2信号特征:脑膜瘤在T2加权序列上可呈低、等或高信号,而RDD病灶一般表现为低信号,提示其组织成分较致密;
边界与浸润特征:脑膜瘤边界清晰,常呈良性包裹性生长;而RDD病灶边界不规则,可伴有脑实质或蛛网膜下腔浸润,并常见脑沟变浅;
血供及灌注情况:脑膜瘤普遍血供丰富,增强明显;而RDD病灶则常为低血供,虽增强明显但血管走形较少,表现为相对低rCBV灌注值;
波谱代谢特征:RDD病灶表现肉芽肿性病变的代谢特征,虽有胆碱峰升高,但不如脑膜瘤显著;
骨质改变:脑膜瘤常见颅骨高密度改变、骨破坏或钙化(bone;而这些改变在RDD中通常缺如;
因此,T2低信号、相对低rCBV灌注值及特征性MRS谱图,可作为中枢神经系统RDD的重要影像学诊断线索。
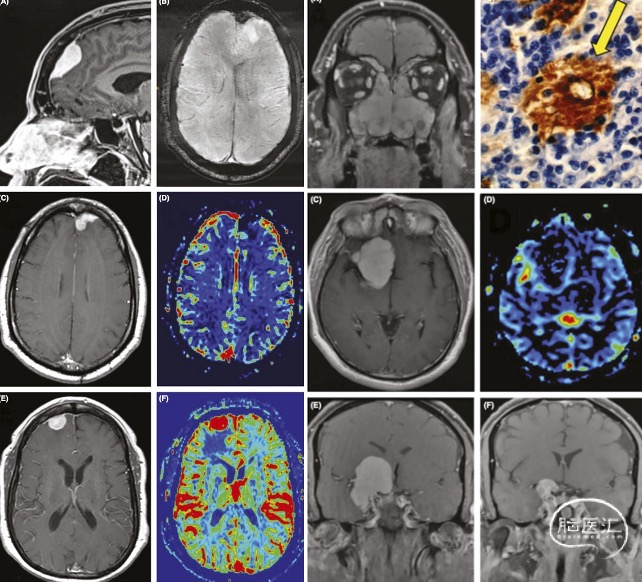
图9.文献报道的两例RDD病灶的头颅增强MR和磁共振灌注影像,提示病灶明显强化,病灶部位存在相对性低灌。
目前对于颅内原发性Rosai-Dorfman病(CNS-RDD)尚无统一治疗指南,治疗策略需个体化制定,依据病变位置、大小、神经功能受累情况及组织学特征综合判断(图10)。手术切除仍为首选治疗手段,尤其适用于孤立性、具压迫症状或有进展性表现的病灶。研究显示,全切除可显著降低复发率,然而由于部分病灶邻近重要神经血管结构,常难以实现完整切除。在此类情况下,保留部分病灶、最大程度减压同时保护功能区,是目前公认的合理策略。术后辅助放疗可用于控制残留病灶或预防复发,文献报道中30–50Gy剂量放疗在部分病例中有效抑制病灶进展,尤其适用于不能再次手术者。但需考虑潜在的神经损伤,故建议针对进展性病灶而非稳定残留组织。
药物治疗方面,糖皮质激素(如泼尼松)在部分系统性RDD病例中显示良好反应,在CNS孤立病灶中也被尝试用于术后辅助治疗或无手术适应证者。免疫抑制剂如甲氨蝶呤(MTX)、硫唑嘌呤(6-MP)及利妥昔单抗(Rituximab)在复发或激素抵抗性病例中也有一定效果。此外,针对具有MAPK通路突变(如BRAF、KRAS)的RDD患者,靶向治疗(如MEK抑制剂Cobimetinib)在近期研究中表现出潜在疗效,但CNS病例相关证据仍有限。
值得注意的是,大多数颅内RDD呈现温和的生物学行为,部分病例甚至可表现为自然缓解趋势。对于术后存在部分切除或残留病灶、且无明显神经功能障碍的患者,可考虑采取密切影像学随访观察策略,以避免不必要的过度干预。本病例即采取此策略,术后随访两年内病灶影像学表现稳定,进一步支持了保守治疗方案在此类患者中的可行性和有效性。
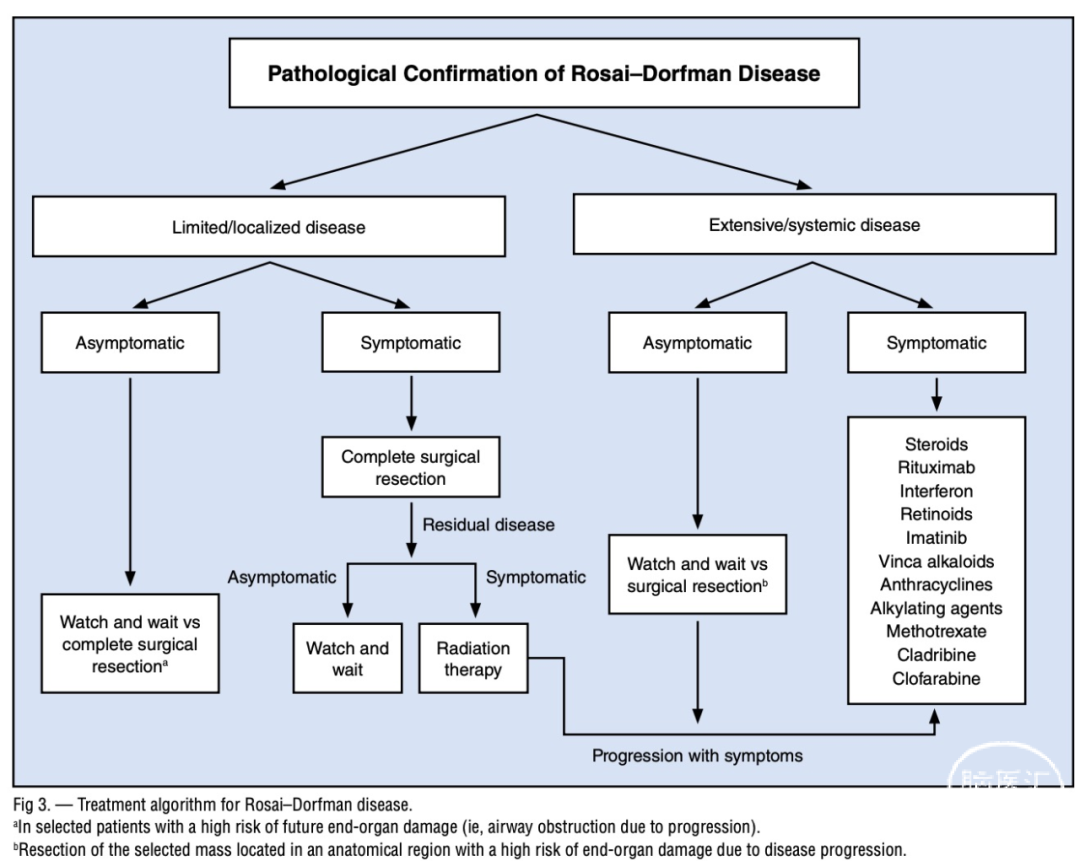
图10.文献报道病理诊断Rosai-Dorfman病的治疗策略。
综上所述,颅内原发性Rosai-Dorfman病(RDD)极为罕见,其临床表现及影像学特征常与脑膜瘤等良性占位性病变相似,术前准确的鉴别诊断对于制定合理的治疗策略具有重要意义。治疗应综合考虑病灶位置、大小及对神经功能的影响,制定个体化方案。目前,手术切除仍是主要治疗手段,整体预后良好。对于术后残留或无法全切的病例,应结合病灶的生物学行为,采取密切的影像学随访,以动态评估病情变化,并为后续治疗决策提供依据。
参考文献
往期回顾

声明:脑医汇旗下神外资讯、神介资讯、神内资讯、脑医咨询、Ai Brain 所发表内容之知识产权为脑医汇及主办方、原作者等相关权利人所有。







