
硬脑膜动静脉瘘(Dural Arteriovenous Fistula, DAVF)是一种较为少见却危害严重的颅内血管疾病,约占脑血管畸形中的10%-15%。其发病机制主要是硬脑膜动脉与静脉之间形成异常交通,致使动脉血直接流入静脉,进而打破颅内正常的血流动力学平衡,引发一系列严重的病理改变。DAVF的临床表现复杂多样,搏动性耳鸣是常见症状之一,其节律与心跳节律一致。颅内出血是DAVF最为严重的临床表现,可导致剧烈头痛、呕吐、意识障碍甚至昏迷。DAVF可致静脉引流障碍脑组织水肿,导致患者认知障碍及癫痫发作。DAVF异常血流动力学还可致颅内高压,引起视力障碍及视野缺损等症状。
CT血管成像(Computed tomography angiography, CTA)和磁共振血管成像(Magnetic resonance angiography, MRA)等无创影像学评估在DAVF的诊疗过程中占据着举足轻重的地位。影像学检查能够清晰地显示颅内血管的异常形态,如瘘的集中位置、供血动脉和引流静脉的特征等,为后续的治疗提供坚实的基础。不同类型的DAVF在影像学上具有不同的表现特征,根据这些特征进行准确分型,进而制定个性化的治疗方案,提高治疗的精准性和有效性。同时影像学检查可用于评估治疗效果,通过对比治疗前后的影像学图像,能够直观地了解硬脑膜动静脉瘘的栓塞情况、血管形态的改变以及血流动力学的恢复情况等,及时调整治疗策略。
数字减影血管造影(Digital subtraction angiography, DSA)作为诊断DAVF的金标准,能清晰显示血管结构,通过动态、连续的血管造影图像,清晰地展示硬脑膜动静脉瘘的具体位置,明确显示供血动脉的来源和走行,以及引流静脉的特征和引流方向,为诊断和治疗该疾病提供关键信息。通过精确的影像学评估,制定合理的治疗计划,如介入治疗途径的选择、外科手术及放射治疗等。
编写专家
复旦大学附属华山医院
张晓龙

01.
DAVF分型
Cognard和Borden等人都证实了DAVF的病程进展与静脉引流模式密切相关,这也是传统DAVF分型的血流动力学基础。在这两种分型方法中,DAVF可大致分为低级别 (非侵袭性或良性, Borden I型, Cognard I–IIa型) 和高级别 (侵袭性或恶性, Bordon II–III型, Cognard IIb–V型) 静脉引流模式 (表1) 。低级别DAVF静脉引流的特点是引流至硬脑膜静脉窦,不伴有皮层静脉逆流;而高级别DAVF静脉引流特点是伴有皮层静脉逆流 (Cortical venous reflux, CVR) 。高级别DAVF静脉引流模式与颅内出血 (Intracranial hemorrhage, ICH) 、非出血性神经功能缺损 (Non-hemorrhage related neurological defect, NHND) 脊髓静脉引流异常的发生密切相关,并可根据分型预测其发生风险,分型越高ICH及NHND或脊髓静脉引流异常发生风险越高。
表1. DAVF根据颅内静脉引流模式分级
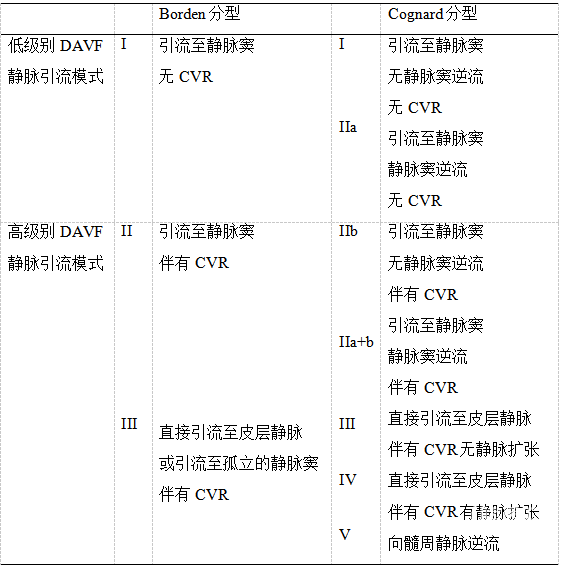
注:CVR皮层静脉逆流
DAVF的动-静脉移行结构可以发生在硬膜固有静脉和骨内静脉的任何部位,随后指向两个不同的引流方向:即桥静脉和静脉窦,形成了三种规律性引流模式(图1)。基于该静脉血管构筑,以解构和定位DAVF精准治疗的靶区为切入点,本中心提出DAVF新的形态学分型。依据引流节点在选择性造影中的显影顺序分为三型。
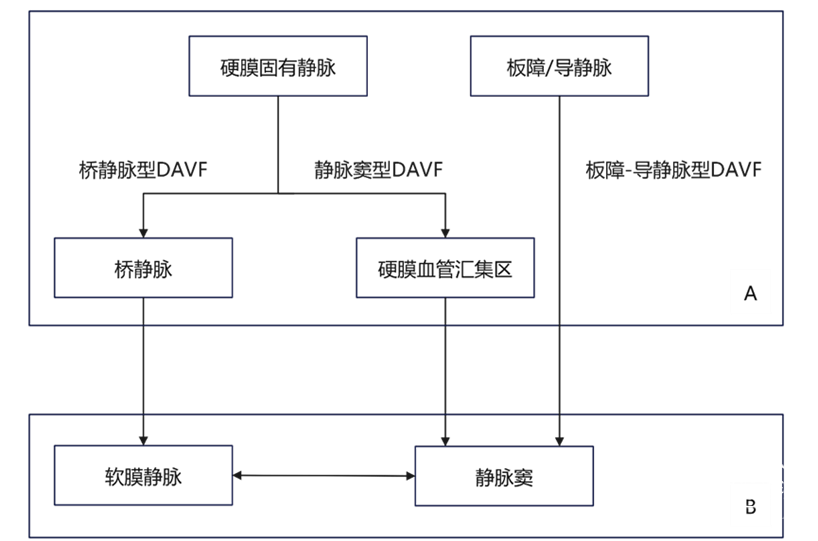
注:A为DAVF的精准栓塞靶区,B为下游引流结构
图1. 硬脑膜动静脉瘘(DAVF)三种分型的引流模式与治疗靶区
1.静脉窦型硬脑膜动静脉瘘(dural sinus type DAVF, DS-DAVF),以下简称窦型DAVF,即动-静脉移行起自硬膜固有静脉,主要通过硬膜血管汇集区(shunted pouch, SP)向静脉窦引流,软膜静脉可通过静脉窦逆流间接显影。影像学表现为静脉窦早于软膜静脉显影(图2)。
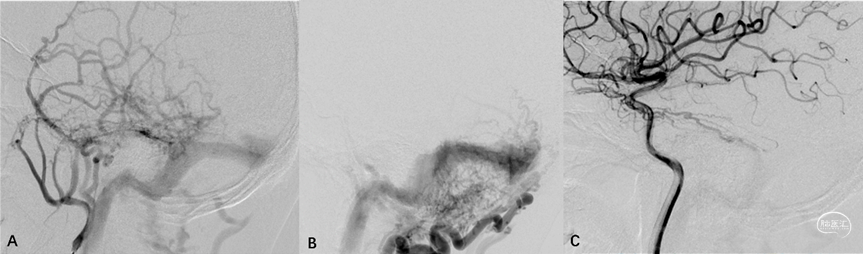
图2. 窦型DAVF的血管构筑与硬膜血管汇集区。侧窦区窦型DAVF,起自硬膜固有静脉系统向横-乙交界区汇聚(A-C)
2.桥静脉型硬脑膜动静脉瘘(bridging vein type DAVF, BV-DAVF),即动-静脉移行起自硬膜固有静脉,经桥静脉硬膜内段向软膜静脉逆流。由于桥静脉向静脉窦直接引流受阻,动静脉瘘无法直接进入静脉窦,而通过侧枝吻合进入邻近静脉窦。影像学表现为桥静脉-软膜静脉早显,并早于静脉窦显影(图3)。
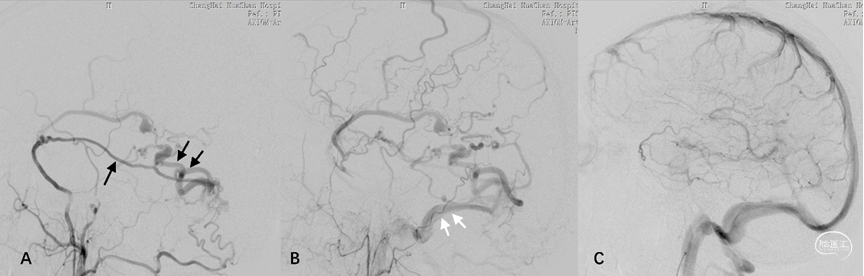
图3. 桥静脉型DAVF的血管构筑。侧窦区桥静脉型DAVF的起点位于桥静脉硬膜内段,由MMA(黑箭)供血,向软膜静脉逆流(A)。同侧乙状窦(双白箭)晚于桥静脉-软膜静脉间接显影(B)。脑静脉窦期显示静脉窦血流通畅,侧裂浅静脉回流被DAVF竞争性抑制(C)
3.板障-导静脉型硬脑膜动静脉瘘(diploic-emissary vein type DAVF, DEV-DAVF),即动-静脉移行起自骨内的板障静脉或穿骨的导静脉,向静脉窦或浅表静脉系统引流。影像学表现为骨内静脉结构早显,并早于静脉窦显影(图4)。
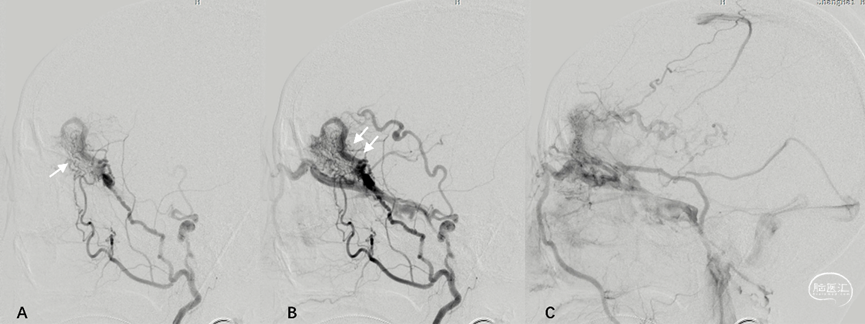
图4. 骨内静脉系统与板障-导静脉型DAVF。板障-导静脉型DAVF,骨内的初级静脉(A白箭)汇聚至板障静脉SP(B双白箭),经蝶顶窦-海绵窦向眼静脉侧裂浅、深静脉逆流(C)。
02.
CT检查技术在DAVF诊断中的应用
2.1 普通CT平扫表现
普通CT平扫在硬脑膜动静脉瘘(DAVF)的诊断中,主要通过显示一些间接征象来提示病变的存在。当DAVF导致颅内血管破裂时,CT可清晰显示脑内血肿、蛛网膜下腔出血或静脉性梗死等情况。脑内血肿表现为脑实质内边界清晰的高密度影,其形态和位置因出血部位而异,可为圆形、椭圆形或不规则形,周围常伴有不同程度的脑水肿,表现为低密度影环绕。蛛网膜下腔出血则在脑沟、脑池内呈现高密度铸型,如鞍上池、外侧裂池等部位高密度影填充,使正常的脑沟、脑池形态消失。静脉性梗死表现为异常引流静脉相关引流脑区低密度影。
有穿颅血管供应DAVF或有导静脉异常引流时,穿颅血管骨质压迹在CT上可见骨质缺损表现。CT平扫可观察到增粗、迂曲的血管影,硬脑膜血管扩张可表现为局部密度增高,呈条索状或结节状影,这些血管影在脑实质表面或硬脑膜附近分布。可看到大脑表面的血管明显增粗,呈蚯蚓状走行,增强扫描后这些血管影强化明显。然而普通CT平扫对DAVF的诊断存在一定的局限性。对于低流量的DAVF,其间接征象可能不明显,容易导致漏诊。
2.2 CT血管成像(CTA)检查
CTA在硬脑膜动静脉瘘的诊断中具有重要价值,能够清晰显示供血动脉及引流静脉的情况。CTA可明确供血动脉来源和走行,可来自颈内动脉系统、颈外动脉系统或椎动脉系统。CTA可显示引流静脉扩张、迂曲的形态以及引流方向。引流静脉的扩张程度和走行方向对于判断病变的严重程度和治疗方案的选择具有重要意义。CTA通过三维重建技术,可以准确判断硬脑膜动静脉瘘与周围血管和组织的关系,为手术治疗或介入治疗提供解剖信息。
CTA在诊断DAVF时,可结合多种后处理技术,如最大密度投影(Maximum intensity projection, MIP)、容积再现(Volume rendering, VR)等,进一步提高病变的显示效果。MIP技术能够突出显示血管的形态和走行,对于观察供血动脉和引流静脉的全貌具有优势;VR技术则可以提供更加立体、直观的图像,有助于医生全面了解病变的空间位置和周围结构的关系。
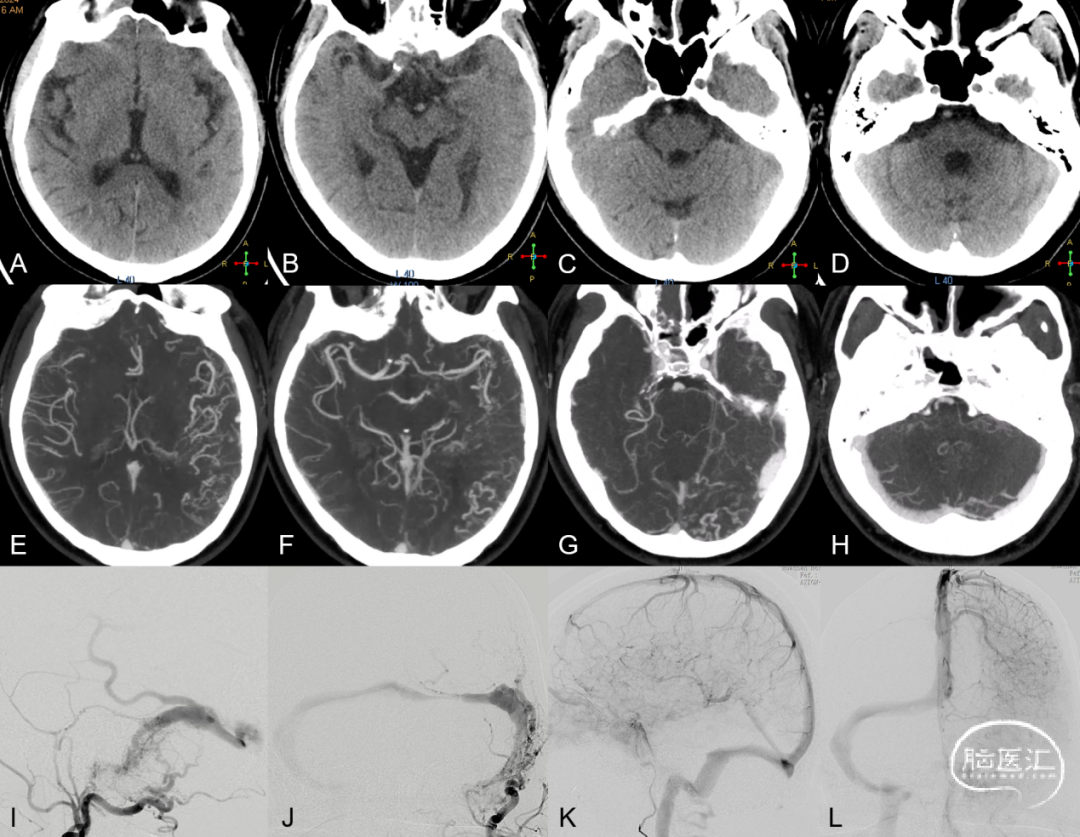
图5. CT平扫建左侧颞叶低密度影,脑回变浅,提示左侧颞叶肿胀,局部发生静脉性梗死 (A-D) ;左侧侧窦高密度 (C、D) ,提示静脉窦异常引流;CTA示左侧颞叶异常血管影,提示静脉引流瘀滞 (E-G),左侧横窦局部增宽及狭窄 (G、H) 。左侧颈外动脉造影证实左侧侧窦区硬脑膜动静脉瘘,左侧横窦狭窄,向对侧侧窦逆流,并向Labbe静脉逆流 (I、J) ;左侧颈内动脉造影示左侧大脑半球引流瘀滞,Labbe静脉不显影 (K、L) 。
2.3 动态CTA检查
四维CTA在硬脑膜动静脉瘘的诊断和随访中展现出独特的优势,可动态观察血管的血流情况,准确评估瘘口的血流动力学特征,可实时观察动脉期、静脉期的显影顺序,以及血流在血管内的流动方向和速度变化。随访时,四维CTA可以多次重复检查,监测血管形态的改变以及血流动力学的恢复情况。如在随访中发现瘘口有部分残留,且周围血管出现新的扩张和血流异常,可及时调整治疗方案,采取进一步的治疗措施。
03.
MRI技术在DAVF中的应用
3.1 传统MRI序列
传统的MRI序列,包括T2加权成像 (T2 weighted imaging, T2WI) 、液体衰减反转恢复序列 (Fluid attenuated inversion recovery, FLAIR) 、弥散加权成像 (Diffusion weighted imaging, DWI) 及非增强磁共振血管造影 (Magnetic resonance angiography, MRA) 等。在没有创伤及电离辐射的情况下对DAVF进行非侵入性的初步评估,同时可以揭示脑组织和血管结构的变化。伴有静脉高压的高级别DAVF,使用T2WI、FLAIR及DWI可以检测到局灶性脑组织水肿、颅内出血和血管流空。MRA还可以显示DAVF的特定解剖特征,例如扩张的供血动脉、异常的引流静脉及静脉窦等,在诊断方面具有较高的敏感性和特异性。
3.1.1 T2WI、FLAIR及DWI
DAVF静脉引流区正常脑组织血液引流受限,出现血管源性水肿,即表现为T2/FLAIR高信号,表现为静脉源性脑水肿,与静脉逆流和侵袭性症状密切相关。在完成有效的DAVF治疗后,这种高信号通常会逐渐消失。预示着T2/FLAIR高信号血管源性水肿具有可逆的临床过程。T2/FLAIR高信号是随着时间推移发生局灶性神经病变的一个独立指标。
DWI在DAVF的应用上价值有限,高级别DAVF如果静脉淤滞及静脉逆流得不到及时纠正,受累脑区静脉源性脑水肿逐渐进展,发展至细胞毒性水肿,DWI表现为高信号。DWI表现为高信号的细胞毒性脑水肿提示及时纠正DAVF血流动力学异常对于阻断DAVF侵袭性进展是必要的。
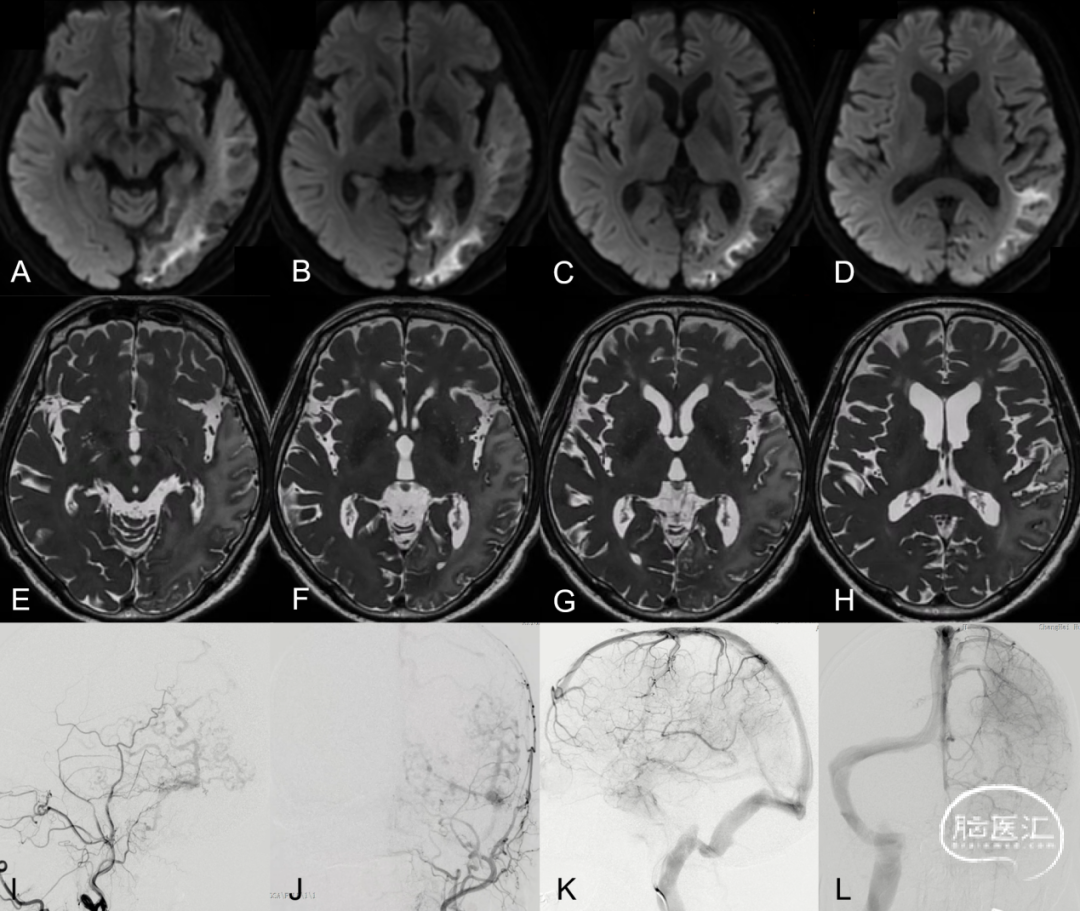
图6. A-D弥散加权成像DWI显示左侧颞枕叶细胞毒性水肿;E-H T2WI成像显示左侧颞枕叶血管源性水肿;以上Labbe静脉相关脑区异常水肿征象提示同侧Labbe静脉引流异常。I、J左侧颈外动脉造影证实左侧侧窦区硬脑膜动静脉瘘,向Labbe静脉极其附属皮层静脉逆流;左侧颈内动脉造影示左侧Labbe静脉不显影,颞枕叶静脉引流瘀滞。
3.1.2 TOF-MRA (Time of flight, TOF)
TOF-MRA是筛查和诊断DAVF并对DAVF进行分区定位的常用方法。DAVF的形态学特征包括供血动脉特点、瘘口部位、颅内静脉血栓形成等情况。识别DAVF血管构筑特点对于指导临床治疗具有非常重要的实用价值。有研究报道称TOF-MRA诊断DAVF的敏感性高达79.49% (95%置信区间CI: 66.81%–92.16%) ,特异性达100% (95%置信区间CI: 100.00%–100.00%) ,其主要诊断效力在于识别责任动脉及引流静脉。TOF-MRA原始图像具有较高的空间分辨率,对DAVF的关注点主要集中在瘘口复合体的基本形态,主要包括供血动脉、引流静脉、共同静脉端及逆流皮层静脉。
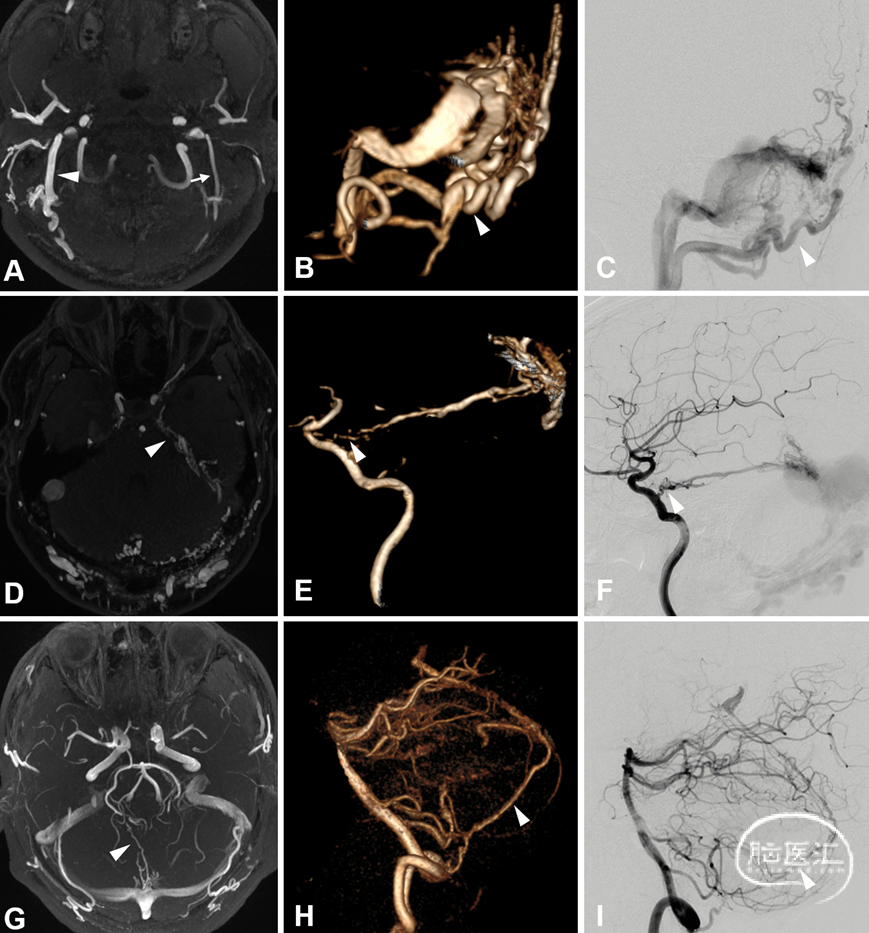
图7. 右侧枕动脉 (Occipital artery, OA) 参与DAVF供血,轴位最大信号投影 (Maximum intensity projection, MIP) 图发现右侧OA (箭头示) 较左侧OA (细箭示) 直径增宽、信号明显增强 (A) ;3D TOF血管重建,剪除周围血管后可以清晰显示右侧OA明显增粗 (B箭头示) ;右侧枕动脉造影证实右侧OA参与DAVF供血 (C箭头示)。左侧脑膜垂体干 (Meningo-hypophyseal trunk, MHT) 参与DAVF供血,轴位MIP图发现左侧MHT直径明显增宽、信号明显增强 (D箭头示) ;3D TOF血管重建清晰显示左侧MHT明显增粗 (E箭头示) 。左侧颈内动脉造影证实左侧MHT参与DAVF供血 (F箭头示) 。右侧脑膜后动脉 (Posterior meningeal artery, PMA) 参与DAVF供血,轴位MIP图发现右侧PMA直径明显增宽信号增强 (G箭头示) ;3D TOF血管重建显示右侧PMA明显增粗 (H箭头示) 。右侧椎动脉造影证实右侧PMA参与DAVF供血 (I箭头示) 。
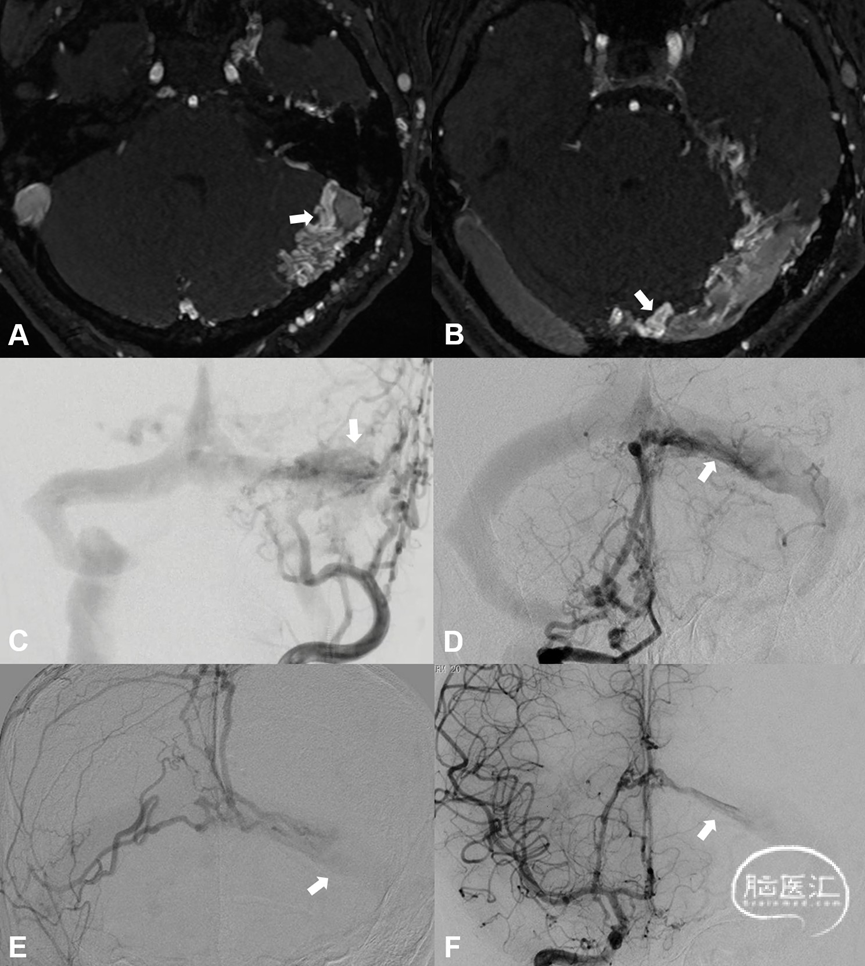
图8. 识别共同静脉端。3D TOF-MRA轴位可以识别左侧侧窦区DAVF弥散引流静脉集中向左侧横-乙状窦交界区 (Common collector, 共同静脉端,A箭示) 及窦汇区汇流 (共同静脉端,B箭示) 。DSA造影证实DAVF弥散,向横乙交界区及窦汇区附近汇流 (共同静脉端,C-F箭示) 。
3.2 高阶MRI技术在DAVF中的应用
与传统MRI技术相比,高阶MRI技术如动态增强MRA (Dynamic contrast enhanced, DCE-MRA) 、磁敏感加权成像 (Susceptibility weighted imaging, SWI) 和血管壁MRI (Vessel wall, VW-MRI) 可提供更多有价值的诊断信息。可以提供有关DAVF血流动力学信息、脑组织及血管结构信息及管腔及管壁实时病理生理特征信息。
3.2.1 动态增强MRA
动态增强MRA (Dynamic contrast enhanced, DCE-MRA) 可以提供良好的时间分辨率,识别颅内血流动力学,协助DAVF的Borden或Cognard分型。静脉引流方向可预测颅内出血 (ICH) 及非出血性神经功能缺损 (NHND) 的风险。有学者进行了DCE-MRA与DSA对比,结果表明DCE-MRA可以对DAVF进行诊断和识别静脉引流方向,可以作为术前的初步判断DAVF静脉引流的工具。DCE-MRA可识别供血动脉、瘘口位置及引流静脉,同时给出全颅血流动力学特征,是在评估DAVF有无侵袭性倾向的无创检查手段。
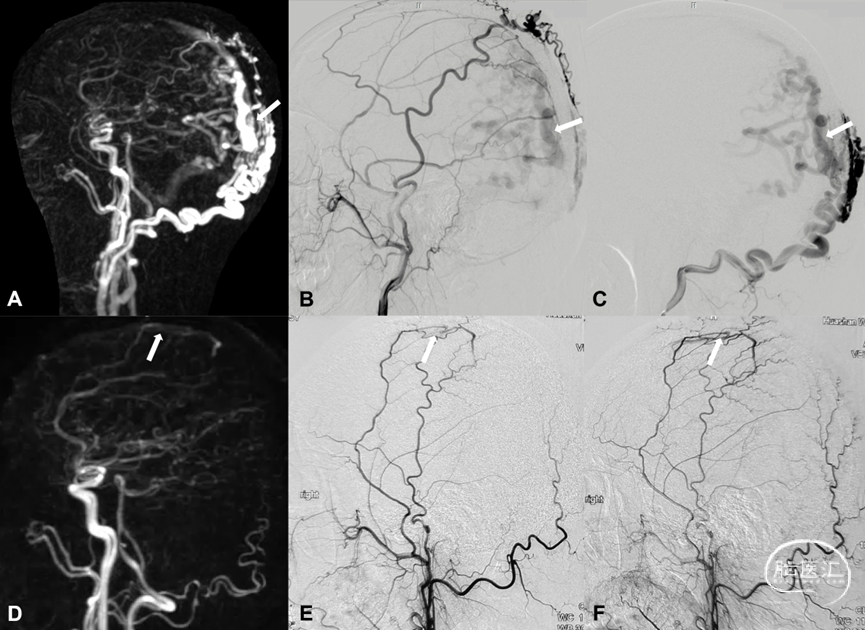
图9. 硬脑膜动静脉瘘定位。DCE-MRA示上矢状窦区桥静脉型DAVF (A白箭) ,超选择颈外动脉及枕动脉造影证实DAVF位于上矢状窦区桥静脉 (B、C白箭) 。DCE-MRA检查发现上矢状窦区桥静脉上的低流量DAVF (D白箭) ,颈外动脉造影证实DAVF位于上矢状窦区桥静脉 (E、F白箭) 。
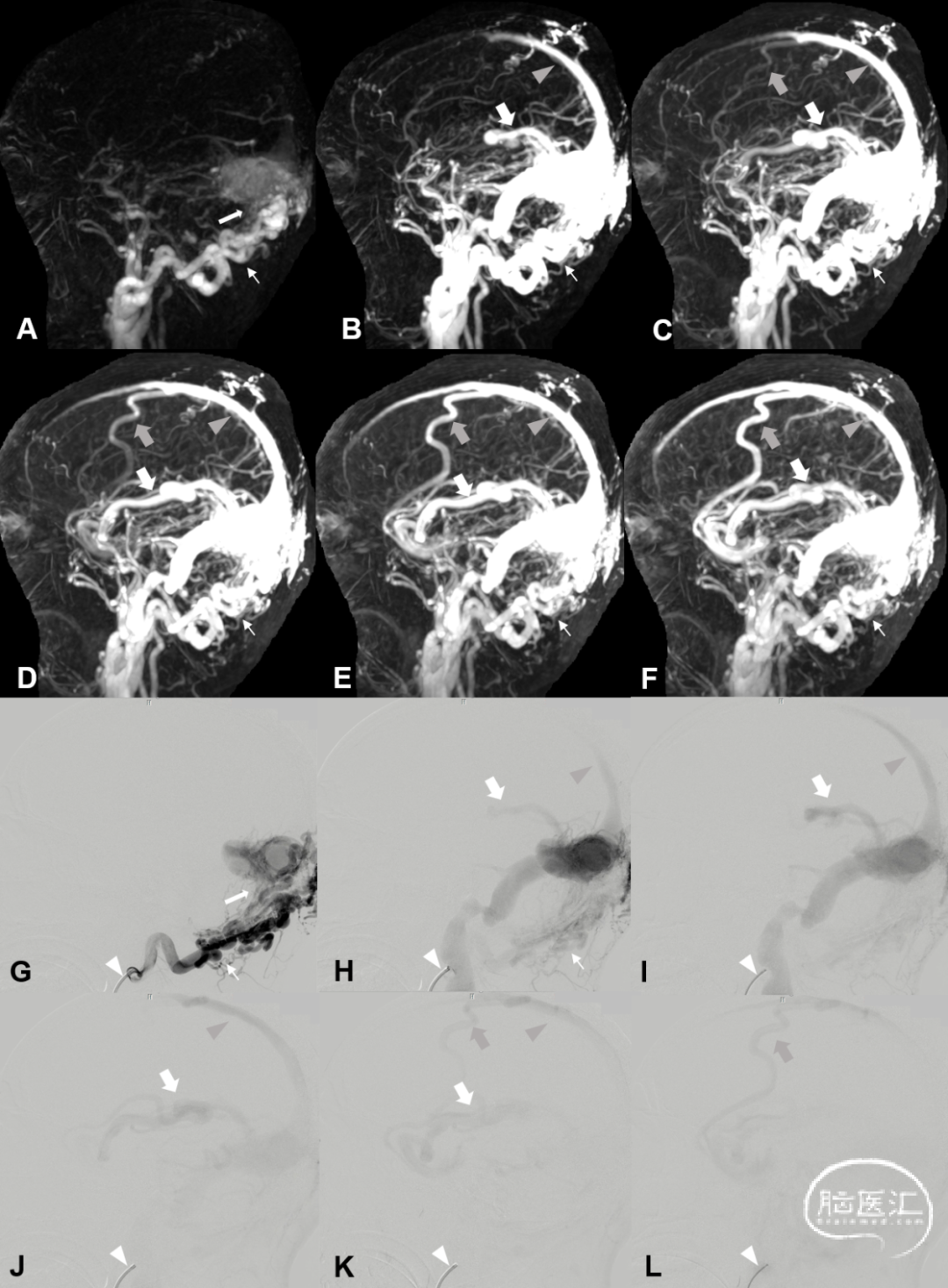
图10. 硬脑膜动静脉瘘分型:Cognard IIa+b级DAVF患者颅脑DCE-MRA及DSA图像。DCE-MRA发现右侧横-乙状窦区DAVF (A-F, 每帧图像的时间间隔为2s) ,主要供血动脉为右侧枕动脉 (细箭) 。DAVF发生在右侧横-乙状窦区 (A白箭) ,伴有上矢状窦逆流 (B-F灰箭头) 、Trolard静脉 (C-F灰箭) 和Labbe静脉 (B-F白箭) 逆流。DSA (G-L,每帧的间隔时间为2秒) 证实右侧横-乙状窦区DAVF。导管 (G-L白箭头) 置于右侧枕动脉 (G、H细箭) 。DAVF发生在右侧横-乙状窦区 (G白箭) ,伴有上矢状窦逆流 (H-K灰箭头) ,Trolard静脉 (K、L灰箭) 和Labbe静脉 (H-K白箭) 逆流。
3.2.2 磁敏感加权成像(Susceptibility weighted imaging, SWI)
磁敏感加权成像 (Susceptibility weighted imaging, SWI) 可以检测脑内结构磁化率的轻微变化。动脉血中以氧合血红蛋白为主,是逆磁性物质,在SWI上表现为高信号;静脉血中以脱氧血红蛋白为主,是顺磁性物质,在SWI上表现为低信号。DAVF发生后,静脉血中脱氧血红蛋白被动脉中氧合血红蛋白置换,在SWI上可表现为静脉内高信号。利用SWI含铁血黄素低信号的特点,评估DAVF累及脑区内有无出血的发生。DAVF发生临近部位迂曲扩张静脉内是否有动脉血的引流,以此判断是引流动脉血的受累静脉,还是引流静脉血的淤滞静脉,以及推断DAVF瘘口及引流静脉所处位置。
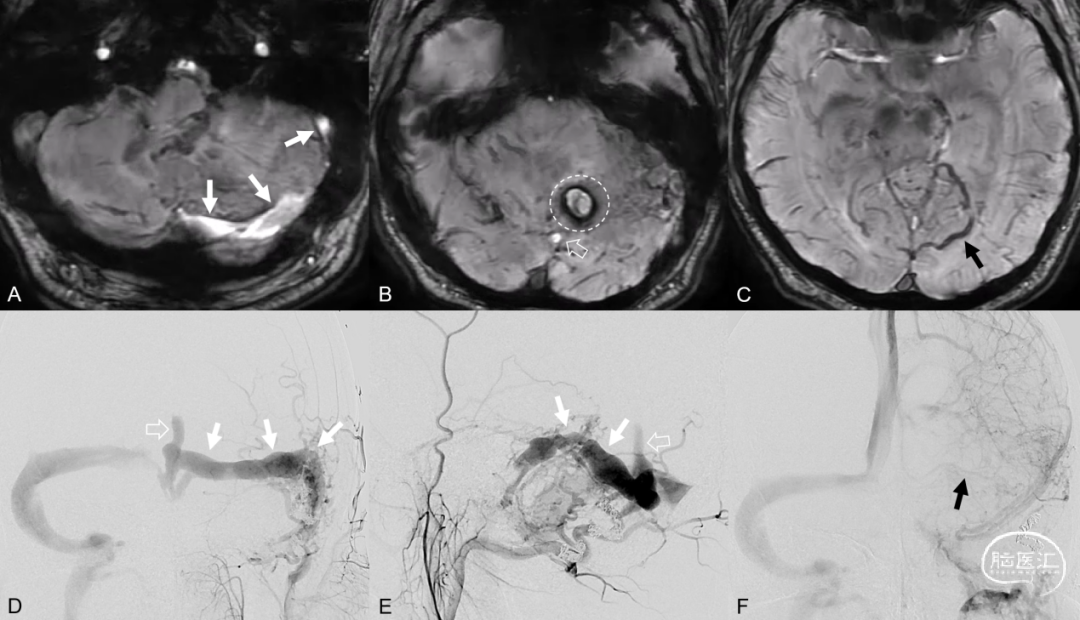
图11. SWI显示右侧侧窦高信号-动静脉分流 (A白箭) ,提示硬脑膜动静脉瘘发生部位在右侧侧窦;直窦高信号提示硬脑膜动静脉瘘向直窦逆流 (B空箭) ,左侧小脑高信号周围低信号环 (B白环) ,提示颅内出血;瘀滞静脉低信号 (C黑箭) 。DSA造影可见右侧侧窦区硬脑膜动静脉瘘 (A、B白箭) ,向横窦及直窦逆流 (D、E空箭) ;静脉瘀滞 (F黑箭) 。
3.2.3 高分辨率磁共振血管壁成像 (MR Vessel wall imaging, MR-VWI)
MR-VWI在DAVF的应用发现自发性破裂的血管壁表现出明显强化的特点。血管壁强化与出血具有一定的相关性,有关强化机制可能是动脉血冲击引起的静脉壁炎性改变,导致局部管壁脆弱而促使血管容易破裂出血。MR-VWI亦可以显示静脉窦腔内结构,提示有无静脉窦血栓,亦可以评估经静脉EVT手术路径的可行性,进而辅助制定手术策略。
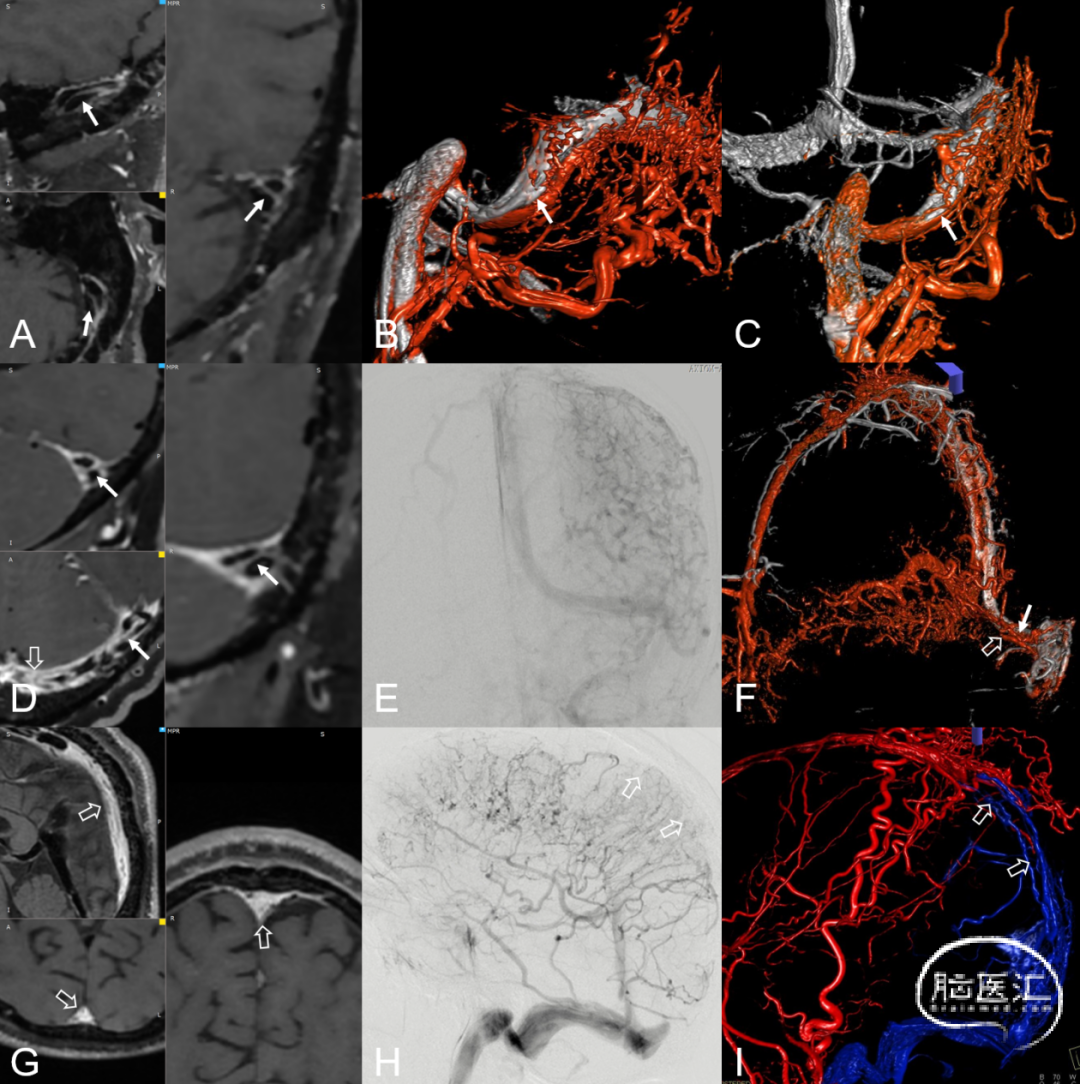
图12. 高分辨率管壁成像及DSA图像对DAVF静脉窦腔内结构特征评估。左侧侧窦窦内可见静脉脊结构 (A细箭) 。3D融合DSA (颈内动脉静脉期旋转造影+颈外动脉旋转造影) 证实了静脉脊的存在,静脉脊 (B、C细箭) 将乙状窦分成了两部分,上部负责正常的引流功能,下部为DAVF引流出口。左侧侧窦见静脉脊 (D细箭) 及血栓 (D空箭) 。DSA证实了静脉脊 (E、F细箭) 及血栓 (E、F空箭) 存在。静脉窦内血栓形成静脉脊形态无法分辨 (G空箭) 。DSA证实血栓 (H、I空箭) 存在
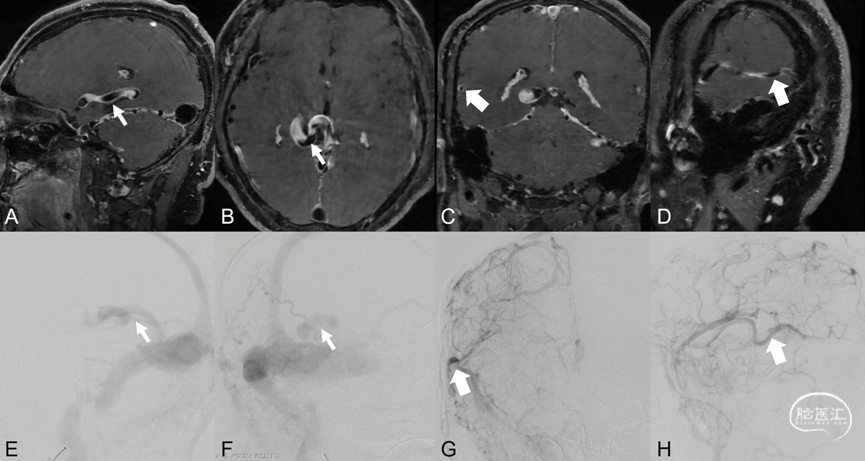
图13. DAVF逆流皮层静脉及瘀滞静脉的高分辨率管壁成像及DSA图像。高分辨率管壁成像显示逆流皮层静脉壁 (A、B白箭) 。DSA证实逆流皮层静脉 (E、F白箭) 。高分辨率管壁成像见瘀滞静脉壁 (C、D白粗箭) 。DSA证实此静脉为瘀滞静脉 (G、H白粗箭)
04.
数字减影血管造影(DSA)
数字减影血管造影(Digital subtraction angiography, DSA)作为诊断硬脑膜动静脉瘘(DAVF)的金标准,在显示瘘口、供血动脉和引流静脉方面具有无可比拟的优势,为临床诊断和治疗提供了最为关键的信息。在瘘口显示方面,DSA能够清晰、准确地定位瘘口的位置,观察动脉与静脉之间的异常交通,这对于判断疾病的性质和制定治疗方案至关重要。DSA在显示供血动脉方面表现出,能够全面展示供血动脉的来源和走行,无论是来自颈内动脉系统、颈外动脉系统还是椎动脉系统的供血动脉,DSA都能清晰呈现其分支情况和向瘘口供血的路径。DSA可清晰显示引流静脉迂曲扩张以及引流方向。通过观察引流静脉能够了解病变的血流动力学特征,判断静脉回流是否受阻,以及是否存在皮质静脉拟流等重要信息。
在血管内介入治疗过程中借助DSA的实时影像,将微导管准确地送至瘘口部位,然后注入栓塞材料,如弹簧圈、Onyx或Glubran胶等物质,以阻断异常的血流通道。在实际操作中,能够清晰地看到微导管的位置和栓塞材料的填充情况,确保栓塞过程的安全性和有效性。DSA可以在治疗后进行复查,评估治疗效果,及时发现是否存在瘘口残留或复发等情况。在随访过程中,通过DSA观察DAVF有无残余及复发、血管形态的改变以及血流动力学的恢复情况,为进一步的治疗决策提供依据。
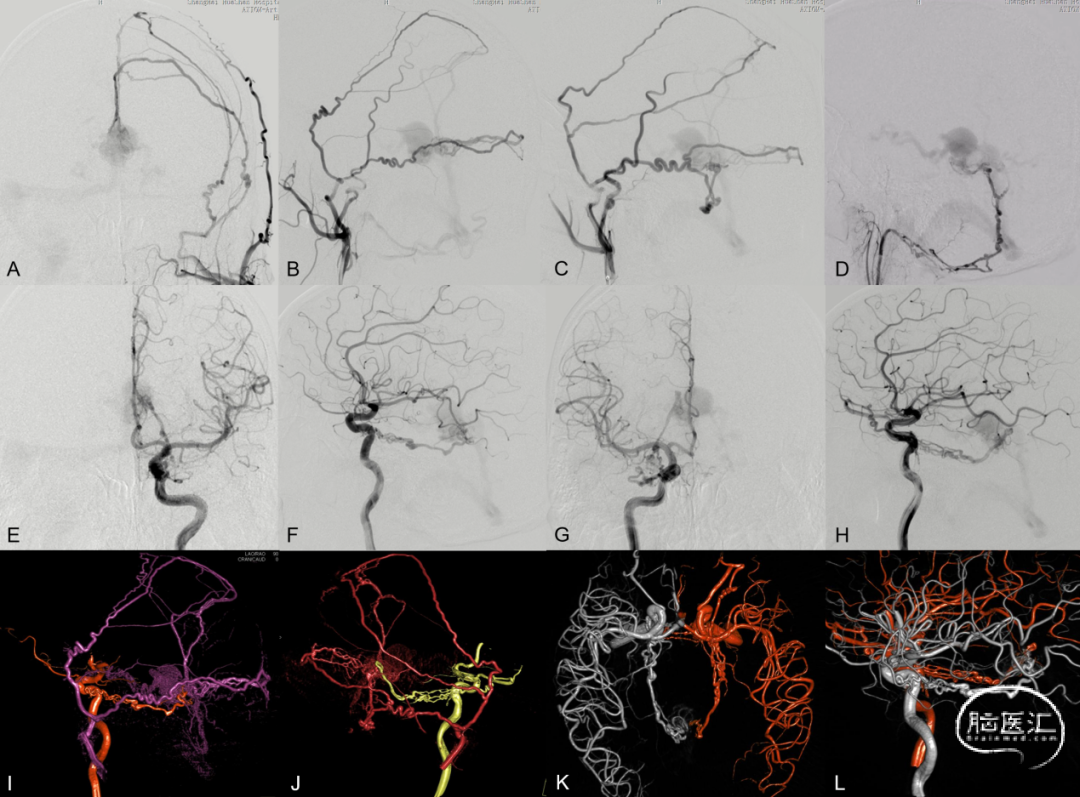
图14. 左侧颌内动脉 (A、B) 、右侧颌内动脉 (C) 、右侧咽升动脉 (D) 及双侧颈内动脉 (E-H) 造影示镰幕交界区硬脑膜动静脉瘘,供血动脉主要为双侧脑膜中动脉、右侧咽升动脉神经脑膜支及双侧脑膜垂体干,在Galen静脉处汇集,向深部静脉逆流并向直窦引流。DSA三维融合重建 (I-L): 左侧颈内颈外动脉融合 (I) 、右侧颈内颈外动脉融合 (J) 、双侧颈内动脉融合 (K、L) 显示静脉汇集区位于Galen静脉后部,此处即为栓塞治疗的靶区
DAVF的血管构筑包括本中心提出的新分型、Cognard分型、部位、偏侧性、初级静脉结构的位置,伴有静脉流出道梗阻以及与邻近梗阻静脉窦的位置关系。DAVF的偏侧分为左侧、右侧及中线病变。DAVF的位置包括:侧窦区、天幕区(包括天幕缘及天幕内侧)、上矢状窦区、前颅底、窦汇区、髁前区、大脑镰及其他少见部位。DAVF的初级静脉结构包括:(1)硬膜血管汇集区(Shunted pouch, SP);(2)桥静脉硬膜内段;(3)骨内静脉湖。以上结构通过常规血管造影及三维融合成像进行评估,对结构定位不确定时,参考高分辨磁共振(magnetic resonance imaging, MRI)、双容积融合成像辅助定位。以下为不同部位不同类型的硬脑膜动静脉瘘DSA特点。

图15. 侧窦区窦型DAVF典型血管构筑。初级硬膜静脉由脑膜中动脉(MMA)及枕动脉供血,向横-乙交界区血管汇集区(SP)(白箭)汇聚后进入静脉窦,乙状窦内间隔形成(A-C)。天幕岩部硬膜初级静脉向横-乙交界区SP汇集(双白箭),枕动脉血供经乙状窦垂直段SP(白箭头)进入静脉窦,并伴有上矢状窦(SSS)后部血栓形成(D-F)。DAVF经乙状窦颈静脉孔区SP(双白箭头)进入静脉窦并逆流,伴有乙状窦颈静脉孔段闭塞(G-I)
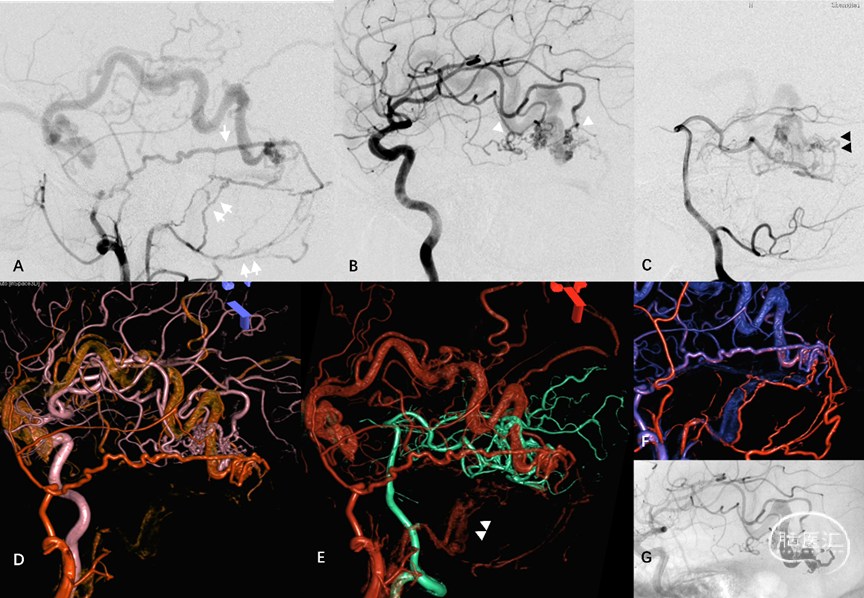
图16. 侧窦区桥静脉型DAVF典型血管构筑。MMA(白箭)、脑膜后动脉(双白箭)、大脑中动脉硬膜支(白箭头)及大脑后动脉硬膜支(黑双箭头)向Labbe桥静脉硬膜内段汇集(A-C)。MMA与颈内动脉(ICA),MMA与椎动脉,MMA与咽升动脉分别行双容积融合成像(D-F)。经动脉栓塞后Onyx胶在桥静脉及软膜静脉起始部的铸型(G)
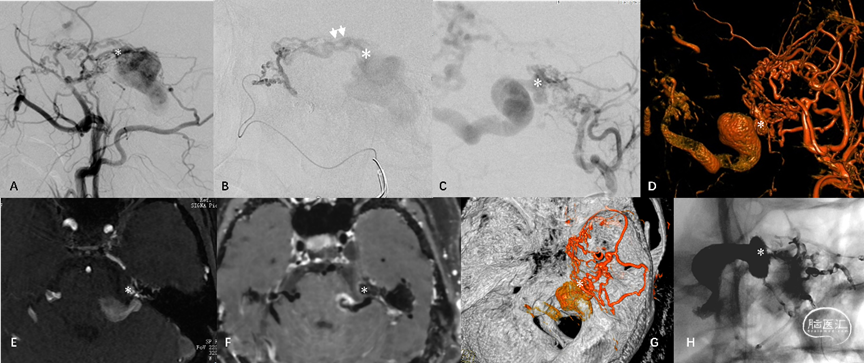
图 17. 天幕缘组DAVF典型血管构筑。A-D:ECA发出的供血分支向天幕缘桥静脉(星号)汇集,经扩张的桥外侧静脉向对侧同名静脉引流。颌内动脉超选择造影(B)显示翼管动脉管径增粗,移行为硬膜静脉结构(双白箭)再汇入共同静脉端。F-G:TOF及增强磁共振、DAVF与颅骨的双容积融合成像显示桥静脉起始部(星号)位于岩尖的天幕游离缘。G:TAE后Onyx胶在桥静脉起始部的铸型
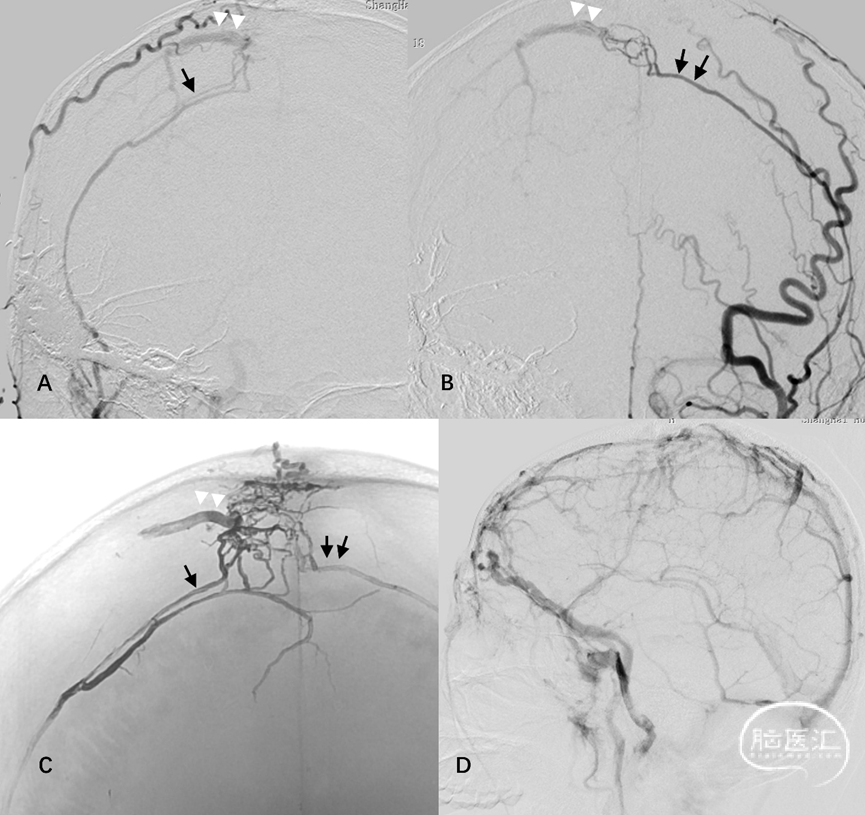
图 18. 上矢状窦区桥静脉型DAVF典型血管构筑。A-B:双侧MMA(单、双箭)向大脑上静脉桥静脉汇集。C:TAE后Onyx胶在硬膜动脉网(单、双箭)及桥静脉(双白箭头)的铸型。D:患者合并SSS中部血栓
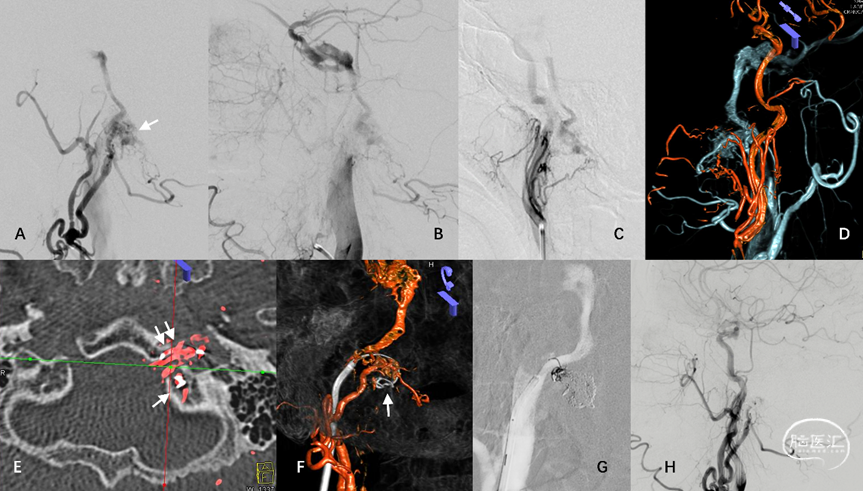
图19. 髁前区DAVF典型血管构筑。A-C:枕动脉、咽升动脉供血分支向颈静脉结节静脉丛(JTVC)(白箭)汇集,经岩下窦向海绵窦、侧裂浅静脉逆流。D:ECA主干与咽升动脉双容积融合成像。E:位于骨内的JTVC(白箭)是髁前区板障-导静脉型DAVF的初级静脉结构。F:术中利用微导丝与静脉双容积融合成像定位。G-H:TVE闭塞JTVC及髁前静脉,治愈性栓塞DAVF同时保护岩下窦
05.
其他影像学检查技术
除了上述常用的影像学检查技术外,超声、PET-CT等技术在DAVF的诊断中也有一定的应用,它们各自具有独特的优势,但也存在一定的局限性。经颅多普勒超声(Transcranial Doppler, TCD)在DAVF的诊断中具有一定的价值,可检测到供血动脉血流速度增快、搏动指数降低等异常血流动力学改变 。超声检查还具有操作简便、无创、可重复性强等优点,可作为一种初步筛查的手段。PET-CT作为一种功能影像学检查技术,在DAVF的诊断中也有其独特的作用。PET-CT可以提供病变部位的代谢信息,通过观察局部脑组织的代谢变化,有助于评估DAVF对脑组织的影响。PET-CT检查发现病变周围脑组织的代谢异常增高,结合其他影像学检查结果,医生判断该患者的病变对周围脑组织的影响较大,需要采取更积极的治疗措施。然而,PET-CT检查所提供的血管解剖信息相对较少,对于瘘口的位置、供血动脉和引流静脉的详细情况显示不如DSA、MRA及CTA等检查方法。在诊断DAVF时,PET-CT通常需要与其他影像学检查方法相结合,才能提供更全面、准确的诊断信息。
06.
总结及展望
硬脑膜动静脉瘘(DAVF)的影像学诊断研究将聚焦于新型影像学技术的发展与应用,旨在进一步提高诊断的敏感性及特异性。在DAVF的研究中,未来可开发针对DAVF相关分子标志物的特异性探针,通过分子影像学技术,实现对DAVF的早期诊断和精准定位。利用特异性探针标记血管内皮生长因子(Vascular endothelial growth factor, VEGF)等与DAVF发生发展密切相关的分子探针,能够在分子水平上检测病变部位的VEGF表达情况,从而更早地发现DAVF的病变,为疾病的早期干预提供可能。
多模态影像学融合将是未来DAVF影像学诊断的重要发展方向。目前单一的影像学检查方法虽各有优势,但也存在局限性,难以全面满足临床诊断的需求。未来的研究可致力于将多种影像学检查方法进行有机融合,实现优势互补,提高诊断的准确性和特异性。将CTA或MRA的高分辨率和DSA的动态血管成像优势相结合,通过图像融合技术,可在同一图像上同时显示血管的解剖结构和血流动力学信息,为医生提供更全面的病变信息。在治疗过程中,多模态影像学融合还可用于实时监测治疗效果,通过对比不同影像学检查方法在治疗前后的图像变化,及时调整治疗方案,提高治疗的成功率。
人工智能(Artificial intelligence, AI)技术在医学影像学领域的应用日益广泛,未来也将在DAVF的影像学诊断中发挥重要作用。AI通过深度学习算法,能够对大量的影像学数据进行快速分析和处理,从而提高诊断的效率和准确性。通过对大量DAVF患者的影像学数据进行学习和训练,AI模型可以自动识别DAVF的影像学特征,如瘘口的位置、供血动脉和引流静脉的形态等,进行辅助诊断。AI技术还可以用于预测DAVF的治疗效果和预后,通过分析患者的影像学数据、临床症状和治疗方案等信息,建立预测模型,为制定治疗决策提供参考。
编写团队简介

张晓龙
点击上方图片
声明:脑医汇旗下神外资讯、神介资讯、脑医咨询、Ai Brain 所发表内容之知识产权为脑医汇及主办方、原作者等相关权利人所有。
投稿邮箱:NAOYIHUI@163.com
未经许可,禁止进行转载、摘编、复制、裁切、录制等。经许可授权使用,亦须注明来源。欢迎转发、分享。
投稿/会议发布,请联系400-888-2526转3。





