

第一作者:刘雨辰,付后鑫
通讯作者:王杭州
其他作者:孙景轩,张荣庭,仲亿,杨天权,韩勇,向永军,苑斌,周儒轩,陈民
作者单位:苏州大学附属儿童医院神经外科
https://doi.org/10.1038/s41598-025-95784-3
背 景
轻型创伤性脑损伤(mTBI)合并微量硬膜下血肿(SDH)患儿被报道需要神经外科手术干预(NI)的风险较高。然而,目前识别需要NI的mTBI合并微量SDH患儿的能力仍然有限。本研究旨在开发一个预测这些患者需要NI的列线图模型。
方 法
利用mTBI合并微量SDH患者的人口统计学、临床、影像学和实验室数据,建立了预测NI的列线图。采用最小绝对收缩与选择算子(LASSO)回归和最佳子集回归(BSR)方法筛选变量和选择预测因素。通过多变量逻辑回归构建列线图模型。利用受试者工作特征曲线下的面积(AUC)、校准曲线、Hosmer-Lemeshow检验和决策曲线分析评估模型的表现。
结 果
通过BSR筛选,确定创伤后癫痫、贫血以及蛛网膜下腔深度这三个因素为显著的预测因素,并据此开发出了列线图。经自助抽样法验证(进行了500次重抽样),该列线图的AUC值为0.893(95% CI,0.844–0.942)。模型展现出了良好的校准性能,决策曲线分析结果表明,当阈值概率介于7%到83%之间时,使用该列线图来预测NI能够带来净收益。
结 论
本研究成功开发了一种新型的列线图模型,能够较为准确地评估3岁以下mTBI合并微量SDH儿童需要NI的风险,有望为临床决策提供有力的支持。
关键词:轻型创伤性脑损伤;硬膜下血肿;预测模型;列线图
前言
每年全球约有6900万人发生创伤性脑损伤(TBI),其中超过80%为轻型TBI(mTBI)[1,2]。儿童TBI的发生率估计为每10万人中47至280人,其中3岁以下儿童的发生率最高[2-5]。硬膜下血肿(SDH)是最常见的颅内出血形式之一,也是需要神经外科手术干预(NI)风险较高的类型[6]。在过去十年中,mTBI合并SDH患者的数量显著增加[7]。尽管大多数mTBI合并微量SDH的儿童在保守观察期间不会发生临床恶化,但有研究发现在婴幼儿群体中更有可能需要NI[8-11]。
然而,由于该群体的疾病普遍性及症状常常较为隐匿,导致优先处理这些患者面临较大挑战。此外,家属常因担心可能的辐射损伤而反对进行头部CT复查。这些因素可能会延误临床医生对疾病进展的识别,导致不良结局的发生。
因此,准确识别mTBI合并微量SDH的婴幼儿群体中哪些患者需要NI,对于提高临床警觉性并及时干预具有重要意义。然而,目前尚无明确的共识指南用于mTBI合并微量SDH患者的神经外科管理[12]。现有的预测模型主要集中于成人患者[13-15]。本研究旨在开发一个列线图模型,用于预测3岁以下mTBI合并微量SDH儿童需要NI的风险,并基于人口统计学、临床、影像学和实验室数据为临床决策提供支持。
方法
研究设计与人群:
本研究回顾性地招募了2015年6月至2024年6月期间,因SDH入院的儿童患者,所有患者的数据均来自电子病历系统。研究的纳入标准为:(1)影像学诊断为TBI;(2)微量SDH(患者入院时幕上血肿小于10ml或幕下血肿小于5ml);(3)年龄≤3岁。排除标准包括:(1)儿童格拉斯哥昏迷量表(GCS)评分<13[16];(2)开放性脑损伤;(3)入院时CT提示脑疝或弥漫性脑水肿;(4)伤后48小时内未做CT检查或在保守观察期间未复查CT。
本研究已获得苏州大学附属儿童医院伦理委员会批准,符合赫尔辛基宣言(2024CS102)。由于本研究为回顾性研究,伦理委员会批准了豁免告知同意书。
数据收集与定义:
研究者从医院的电子病历系统中收集了以下信息:(1)人口统计学信息,包括年龄、性别、体重和出生时胎龄;(2)外伤史详情,包括受伤至就诊的时间、受伤机制、呕吐、创伤后癫痫发作(PTS)以及入院时的儿童GCS评分;(3)入院时的实验室检查结果,包括凝血酶原时间(PT)、活化部分凝血活酶时间(APTT)、国际标准化比值(INR)、凝血酶时间(TT)和纤维蛋白原(FIB)。创伤后24小时内发生的癫痫发作被记录为PTS。贫血的诊断依据入院时血红蛋白水平和患者的年龄[17]。
头部CT影像由两位经验丰富的神经外科医师独立评估,若存在分歧,则通过协商达成一致。系统性记录的影像学特征包括颅骨骨折、颅内血肿、硬膜下积液和脑挫伤。血肿体积采用非增强CT横断面(层厚2.5mm)上的(ABC)/2法进行估算。蛛网膜下腔的深度定义为脑回表面至颅骨内板之间的最大距离[8,18-20],该测量在侧脑室水平的横断CT图像上进行,记录左右两侧的平均值。
研究终点:
神经外科医生决定或计划手术被视为“金标准”。由于部分家庭可能拒绝手术,研究者还查阅了沟通记录,识别出虽然医生建议手术但因家属拒绝而未实施者。频繁呕吐、意识水平恶化以及复查头部CT提示血肿体积明显增大,通常被视为手术指征。本研究的研究终点定义为:在保守观察期间,患者接受了NI,或神经外科医生明确提出拟进行手术。
统计分析:
符合正态分布的定量数据以均值±标准差表示,不符合正态分布的数据以中位数(P25, P75)表示。分类变量以频数和百分比表示。对于正态分布的定量数据,采用独立样本t检验;不符合正态分布的数据则采用非参数检验。分类变量之间的比较使用卡方检验。
为避免模型过拟合或欠拟合,采用最小绝对收缩与选择算子(LASSO)回归和最佳子集回归(BSR)方法筛选变量[21-23]。BSR中变量的选择以贝叶斯信息准则(BIC)为依据[24]。采用限制性立方样条(RCS)评估连续变量与结局之间的非线性关联,并将具有非线性关系的变量转化为分类变量。通过方差膨胀因子(VIF)评估自变量间的多重共线性。
在完成变量筛选后,使用多变量逻辑回归构建预测模型并绘制列线图。通过计算受试者工作特征曲线下面积(AUC)评估模型区分能力,并通过自助重抽样法(重抽样次数为500)进行内部验证。模型校准度进行Hosmer-Lemeshow检验评估,临床实用性则通过决策曲线分析(DCA)进行评估。
所有数据分析使用R语言(版本4.2.1)、R的survey软件包(版本4.1-1)完成。双侧P值<0.05被认为具有统计学意义。
结果
基线特征:
在研究期间,共有555名年龄≤3岁的mTBI合并微量SDH患儿被苏州大学附属儿童医院收治,其中133名因不符合标准被排除(见图1)。最终纳入的422名患者中,有41名(9.72%)接受了NI。患者的人口学、临床、影像学和实验室特征见表1。
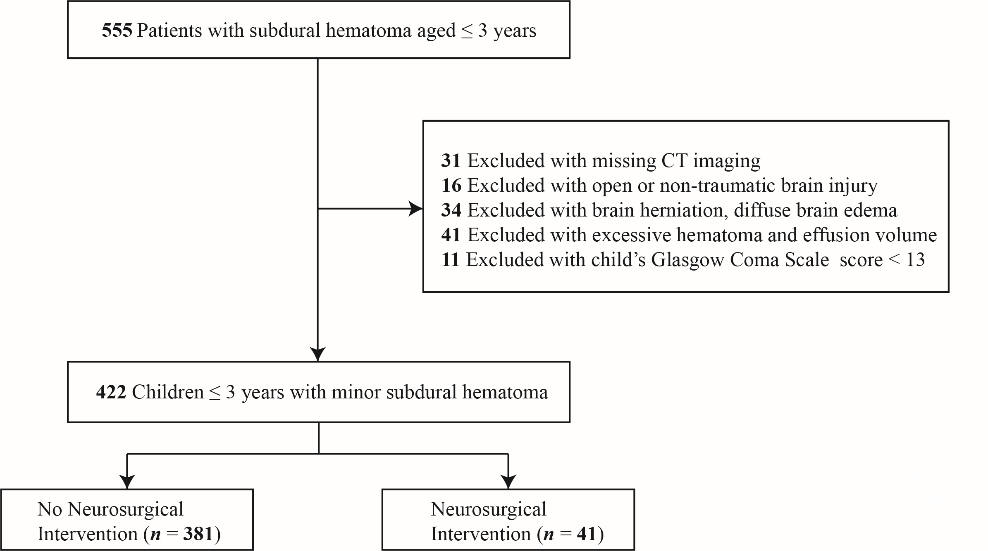
Fig. 1 Flow diagram of study design.
Table 1 Demographic, clinical, radiographic, and laboratory data of patients.
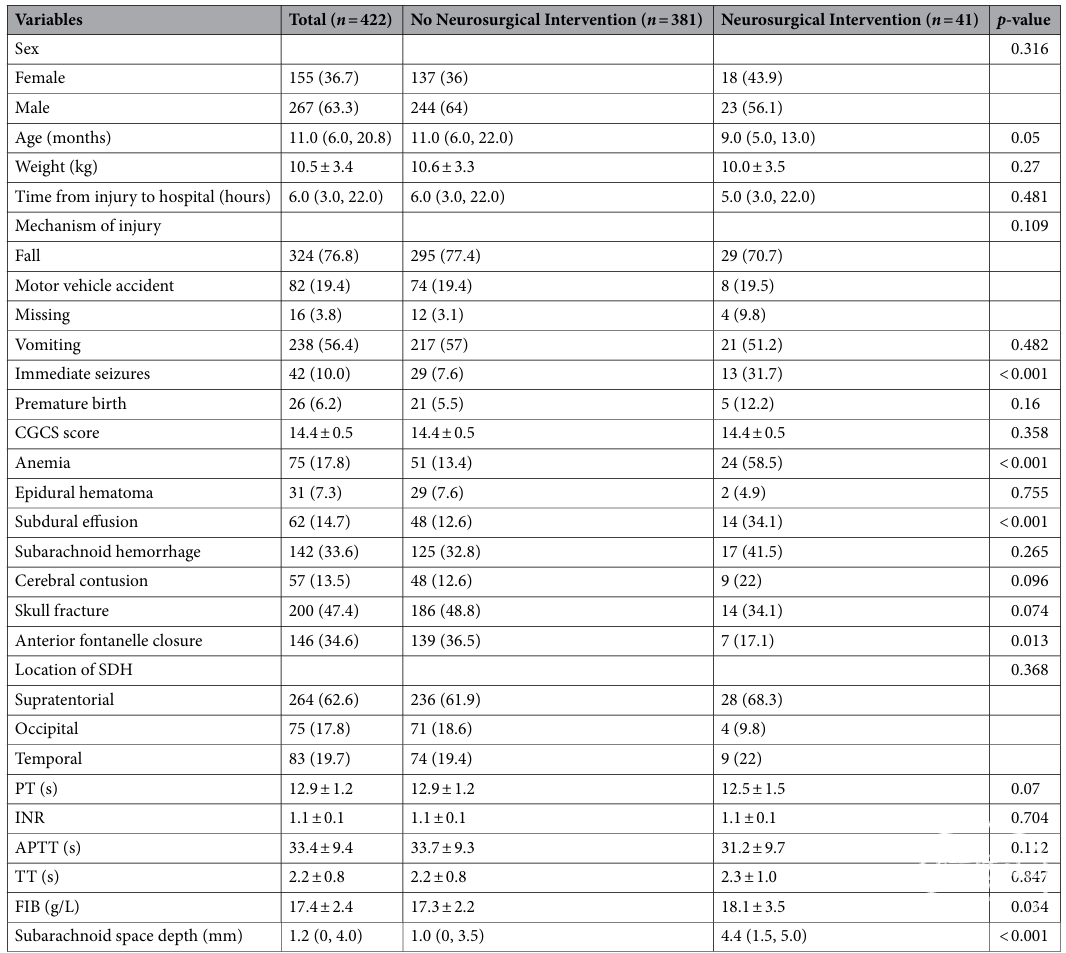
CGCS: child’s Glasgow coma scale; SDH: subdural hematoma; PT: prothrombin time; INR: international normalized ratio; APTT: activated partial thromboplastin time; TT: thrombin time; FIB: fibrinogen.
与未接受NI相比,干预组的患者年龄更小(9 [5, 13] 月 vs. 11 [6, 22] 月)、贫血比例更高(24例 [58.5%] vs. 51例 [13.4%])、更常出现硬膜下积液(14例 [34.1%] vs. 48例 [12.6%])以及PTS(13例 [31.7%] vs. 29例 [7.6%])。此外,干预组患者的PT水平更低(12.5 ± 1.5 vs. 12.9 ± 1.2),FIB水平更高(18.1 ± 3.5 vs. 17.3 ± 2.2),蛛网膜下腔深度明显增大(4.4 [1.5, 5.0] mm vs. 1.0 [0, 3.5] mm)。
特征变量筛选:
采用BSR方法基于最小BIC值选择最优变量组合,最终选定的三项变量为贫血、PTS和蛛网膜下腔深度,构建了模型1(见图2A和B,BIC最低值为 -65.2)。同时,研究者还使用LASSO回归将初始的23个变量缩减至5个具有非零系数的显著预测因子(见图2C和D),并据此构建了模型2,该模型包含贫血、蛛网膜下腔深度、PTS、PT及硬膜下积液五个变量。
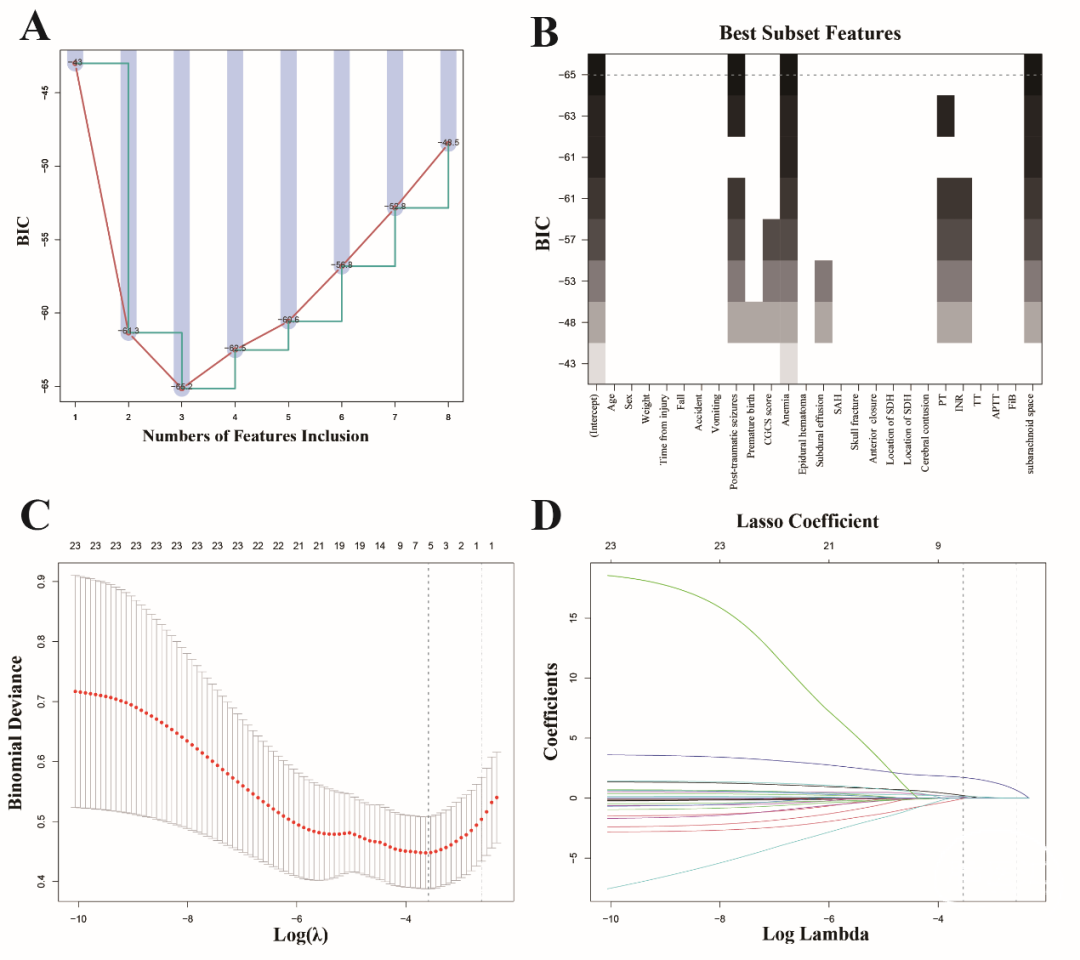
Fig. 2 Predictor selection was performed using LASSO regression analysis with tenfold cross-validation and BSR based on the minimum BIC. (A) The BSR method achieved the lowest BIC of -65.2. (B) The final number of selected variables was three. (C) The tuning parameter (lambda) selection in LASSO regression was based on the minimum criterion (left dashed line) and the 1-SE criterion (right dashed line). (D) A coefficient plot was generated for the log(lambda) sequence. In this study, the selection of predictive factors was guided by the minimum criterion (left dashed line), resulting in the identification of five non-zero coefficients. LASSO: least absolute shrinkage and selection operator; SE: standard error; BIC: Bayesian information criterion; BSR: best subsets regression.
两个模型中的变量均未违反VIF标准,说明无明显多重共线性。RCS分析显示,蛛网膜下腔深度和PT与NI风险之间呈线性关系。
模型开发与性能评估:
研究者使用自助重抽样法(重抽样次数=500)对模型进行了内部验证。模型1的AUC为0.893(95%CI:0.844–0.942),模型2的AUC为0.901(95%CI:0.859–0.943)(见图4A)。通过DeLong检验比较两个模型的预测性能,结果显示两者之间无统计学差异。因此,为提高临床应用的便利性,最终选择变量更少的模型1进行进一步评估。最终,该模型中的三个预测因子(贫血、PTS、蛛网膜下腔深度)被整合构建成列线图模型(见图3)。
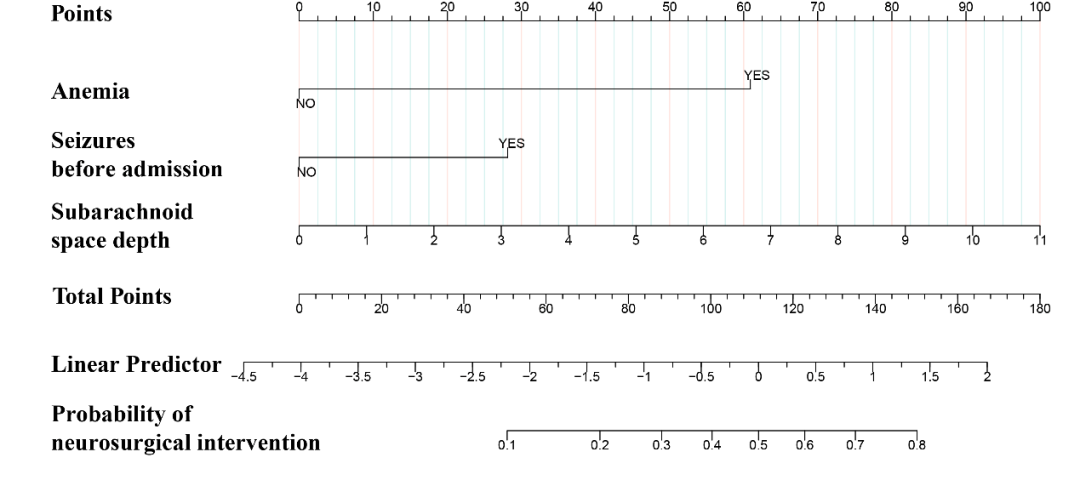
Fig. 3 The nomograms predict the risk of neurosurgical intervention in children aged ≤ 3 years with mTBI and minor SDH.
模型的校准曲线显示预测值与实际结果之间一致性良好(见图4B)。Hosmer–Lemeshow检验的P值为0.793,提示模型校准良好,无统计学差异,进一步验证了其有效性。基于本研究建立的列线图,决策曲线分析显示,当NI的阈值概率在7%至83%之间时,使用该列线图可为临床带来净获益(见图4C)。
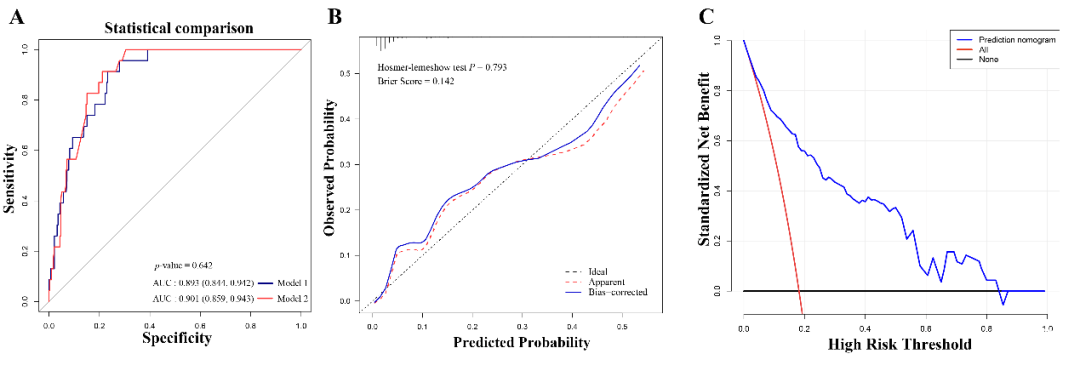
Fig. 4 Performance of the nomogram model: (A) ROC curve for the risk of neurosurgical intervention in children aged ≤ 3 years with mTBI and minor SDH. (B) Calibration curve for Model 1. (C) Decision curve analysis for Model 1. ROC: receiver operating characteristic; AUC: area under the curve.
综上结果表明,该列线图模型基于所纳入的预测因子,能够准确、稳定地评估3岁以下mTBI合并微量SDH儿童需要NI的概率。
列线图模型在线工具
为方便临床应用,研究者开发了一个基于网络的交互式计算器,输入三个关键变量即可获取个体化预测结果。该工具现已上线,网址为:https://lyc-9876.shinyapps.io/dynnomapp/
讨论
长期以来,儿童mTBI一直是全球公共卫生关注的重点[25]。mTBI后的损伤影响可能持续超过两周,部分患者甚至可持续超过三个月[26]。然而,目前尚缺乏针对mTBI合并SDH患儿NI的明确共识指南[12]。此外,既往的预测模型主要基于成人人群[13-15]。婴幼儿mTBI在流行病学特征、影像表现、生理功能和预后方面与成人存在显著差异。因此,有必要开发一个创新性模型,利用婴幼儿特有的指标进行风险评估,以指导临床决策。
本研究开发并验证了一个基于网络的列线图模型,旨在预测3岁以下mTBI合并微量SDH儿童在保守观察期间需要NI的风险。该模型仅整合了三个易于获得的预测因子:贫血、PTS及蛛网膜下腔深度,模型表现出良好的校准度和区分度。据我们所知,这是首个专门用于评估该特殊人群保守观察期间NI风险的列线图模型。该可视化模型及其在线工具有望为医务人员提供个体化的风险评估支持,优化临床管理与决策。
既往的病例系列研究指出,蛛网膜下腔深度可能与mTBI合并微量SDH儿童发生急性颅内高压的风险有关[8-11]。蛛网膜下腔扩大(ESS)是良性外部脑积液的典型表现,其发生率约为每1000名活产婴儿中有0.4例[27]。ESS通常在3岁前自行缓解。然而,Lee等人认为,ESS合并创伤性SDH的患儿更易进入“急性期”[10]。在Kumar等人的研究中,35%(7/20)的ESS合并SDH患儿需要紧急手术[11]。在本研究中,蛛网膜下腔深度被确认为预测3岁以下mTBI合并微量SDH患儿保守治疗期间需要NI的关键因素。
在儿童mTBI中,PTS的发生率估计为5%至21%[28],其主要诱因包括缺血和神经元缺氧[29]。大量研究表明,mTBI合并PTS的患者住院时间更长,临床恶化的风险也更高[28,30,31]。本研究亦证实了这一结论适用于3岁以下的患儿群体。
据世界卫生组织2019年估算,全球6至59个月儿童中约有40%患有贫血[17]。既往研究表明,贫血可显著降低TBI患者的静脉血氧饱和度[32]。Hidenobu等研究发现,血红蛋白水平与外伤性颅内血肿的进展呈负相关[33]。本研究结果亦与之相符,强调临床上应对合并贫血的患儿给予更多关注。
本研究亦存在一些局限。首先,本研究为单中心回顾性研究,尚需多中心验证以评估该列线图模型在不同地区及国家的适用性。此外,部分参数的动态变化难以持续监测。尽管如此,本研究首次开发了针对3岁以下mTBI合并微量SDH患儿NI风险的预测模型,具有较强的实用价值。
结论
本研究所建立的预测模型可用于评估3岁以下mTBI合并微量SDH患儿需要NI的风险。该模型展现出良好的预测能力,但其有效性和广泛适用性仍需进一步研究加以验证。
参考文献
通讯作者简介
王杭州 主任医师
苏州大学附属儿童医院
● 神经外科学博士,主任医师,副教授,硕士研究生导师
● 目前担任苏州大学附属儿童医院神经外科学科带头人、科室主任
● 中国医师协会小儿神经外科专业委员会委员、江苏省医学会小儿外科分会委员、江苏省医师协会神经外科专委会脊髓脊柱学组副组长
● 国家临床重点专科骨干成员,2020年度王忠诚神经外科青年医师奖获得者,苏州市卫生系统青年拔尖人才,7次获省、市资助赴德国、英国、法国等研修
● 入选2017-2018年度中国名医百强榜,入选互联网服务2021、2022、2023、2024年度好大夫榜
● 主要研究方向:脊髓脊柱神经外科、中线深部神经系统肿瘤,颅脑创伤基础理论、脑脊液动力学研究以及小儿神经外科
声明:脑医汇旗下神外资讯、神介资讯、神内资讯、脑医咨询、Ai Brain 所发表内容之知识产权为脑医汇及主办方、原作者等相关权利人所有。








