
脑静脉窦血栓形成(Cerebral venous sinus thrombosis, CVST)是一种特殊的卒中类型,是青少年卒中的一个重要原因,占所有卒中患者的0.5%-1%,每年发病率估计为>10/100万,并且在过去10年中不断增加。常见的临床症状包括头痛、癫痫发作、意识改变、视物模糊、视乳头水肿、神经功能缺损,因发病症状多样常难以与其他神经系统疾病鉴别而造成误诊,延误治疗。抗凝治疗是CVST的一线治疗。然而,单纯抗凝治疗并不总能达到血管再通,甚至血栓仍进展加重,严重静脉回流障碍造成颅高压,这常是不良临床结局的重要因素。对于这些药物难治性病例,血管内治疗(Endovascular treatment EVT)通过介入装置直接清除血栓,更有效快速达到血管再通。
编写专家
首都医科大学宣武医院
陈健

01.
血管内治疗(EVT)脑静脉窦血栓现状
美国心脏协会/美国卒中协会(American Heart Association/ American Stroke Association, AHA/ASA)指南推荐血管内治疗用于那些尽管经过充分抗凝治疗但症状仍恶化的患者,或有颅内出血风险,可能导致显著占位效应的患者。国际脑静脉和硬脑膜窦血栓形成研究(International Study on Cerebral Vein and Dural Sinus Thrombosis, ISCVT)显示,约30%患者具有1个或多个预后不良危险因素(男性、年龄>37岁、精神状态障碍、入院时颅内出血、脑深静脉血栓形成、中枢神经系统感染和癌症),虽然抗凝治疗仍然预后不良。因此,这些患者可能适合接受血管内治疗。此外,在2019冠状病毒病(COVID-19)大流行期间发表的一些小型初步研究表明,疫苗诱发的CVST病例发生不良预后的风险可能很高,并且通常对一般药物治疗无反应,这提示EVT可能对这一患者亚群有益。因此,标准治疗无效或病情严重通常作为血管内治疗的适应症,包括:(1)抗凝治疗失败的补救治疗;(2)重症CVST。
目前指南推荐缺乏明确的具体措施,这使临床医师和神经介入医师在临床实践面临困惑,这些也是在EVT研究中的挑战:1.哪些患者可从EVT中获益,既往研究抗凝预后不良的临床情况是否真正是血管内取栓治疗的是适应人群?大多数研究没有分析不同的患者群体,也没有根据闭塞部位、影像特征对患者进行分层分析,因此无法筛选出适合EVT的患者。随着对疾病研究深入以及血管内技术的进步,需要更多的研究和随机对照试验来更好地确定患者的选择和结局评估。2.什么时机启动EVT?在药物治疗仍未缓解症状的患者中,EVT作为补救治疗延迟进行机械取栓,静脉血栓演变而发生结构变化,会降低有效血运重建的机会,血管内治疗和药物治疗都更难清除血栓。随着时间的推移血栓成分变化,其对纤溶药物的耐药性增加,并且纤维蛋白比例显著影响血栓的力学性能,导致机械取栓困难,增加手术风险,影响EVT结果。目前将EVT作为补救治疗多用于有较陈旧的纤维蛋白致密血栓的病例,可导致成功再通率及临床获益降低。研究显示50%~70%的CVT患者在就诊时表现出亚急性非特异性症状,这导致诊断治疗延迟,约50%仅接受抗凝治疗的患者和60%接受EVT治疗的患者未能实现完全再通,这可能与20%的CVST患者功能障碍或死亡有关。一项对CVST取栓前进行磁共振黑血血栓成像检查研究显示该影像检查有助于判断血栓成分,从而帮助选择适合血管内治疗患者。随着研究深入,EVT作为补救性治疗逐渐转变为有危险因素患者的重要治疗方法。早期识别重症CVST及预测病情进展恶化潜在风险,筛选适合的患者,尽早启动优化的EVT治疗,简单高效安全清除血栓,达到良好再通。3.不能确定哪种EVT方法和装置在CVST可以获得最佳血管再通。由于缺乏适合的装置,介入技术要求高,导致再通治疗困难,这极大限制了EVT实施,多个荟萃分析都显示各中心自行决策方案及需要多种不同方法联合应用。2015年后新一代取栓支架和抽吸装置的出现改善大动脉闭塞所致急性脑梗死患者的临床结局,同样,研发适用于脑静脉窦疾病EVT的装置是突破困境的重要研究方向。4.没有对EVT技术成功的准确评估,也没有准确全面评价临床结局的指标体系。CVST患者较年轻,而常用的mRS评分等预后指标不适用于CVST,影像学评估EVT的标准尚未建立。
急性期迅速重建静脉窦内的血流,可以缓解高颅压及脑组织持续损伤,避免脑疝和颅内出血发生,实现血管再通对于改善临床症状和预防远期神经系统也并发症至关重要。研究显示,持续性静脉闭塞与较差的功能结局相关,CVST患者获得完全再通显示更可能获得良好结局。EVT通过机械清除血栓及局部药物溶栓使静脉窦道再通,可迅速改善脑静脉引流,降低颅内压,也有利于抗凝和(或)溶栓药物作用;与单纯药物治疗相比,机械取栓可确保更快的血管再通,降低对脑组织损伤,更可能获得良好的功能结果。在具有高风险患者中,这种早期血管再通可以阻止血栓进展,降低新发颅内出血、颅内高压的风险,从而降低复发率和死亡率。在已有颅内出血的患者,早期血管内机械取栓可减少溶栓剂和抗凝剂的用量,降低出血加重风险。此外,EVT取栓后即便仅达到部分再通,血栓负荷的降低可使药物更好发挥作用,有利于自体纤溶系统溶解残留的血栓;或者未达到所有静脉窦再通,但重要静脉引流部分恢复,有助于侧枝建立,颅内压恢复,也可能获得良好临床结局。
为了确定血管内治疗在CVST的疗效,仅进行了一项随机对照试验。脑静脉血栓形成的溶栓或抗凝治疗(thrombolysis or Anticoagulation for Cerebral Venous Thrombosis, TO-ACT)是在有至少一项不良结局危险因素的CVT受试者中比较最佳药物治疗加EVT与单独最佳药物治疗的唯一随机试验。从2011年10月至2016年10月纳入了67例患者,目的是比较CVST在最佳药物治疗基础上加用EVT。试验因无效而提前终止,表明两组的结局无显著差异。然而,研究的局限性可能影响了本试验的结果。首先,患者是在2011—2016年纳入的,当时医师取栓技术有限,绝大多数的新型取栓装置当时尚未上市,其中大多数研究是在2015年之前进行的,当时血栓取栓装置的可用性非常有限,大多数操作包括局部溶栓和/或旧的介入装置及技术,如使用导丝或球囊破碎取栓。血管内治疗采用AngioJet导管联合局部溶栓,AngioJet装置与较低的血管再通率和较高的并发症风险相关。动脉缺血性卒中(AIS)的血管内治疗在2015年获得突破,机械取栓的技术以及装置的性能显著提高,提高了血管再通率和安全性,接受机械血运重建的患者临床结局有显著改善。随着新型取栓装置应用及动脉取栓术的完善,神经介入医师能够实施更安全、更有效的操作,这使CVST血管内治疗也随之有所改善。
CVST取栓装置的设计与开发经历了多个阶段,现今临床上多用取栓方式(见表1)主要包括:导管直接抽吸、取栓支架取栓、药物溶栓、AngioJet碎栓、球囊取栓、血管成形术等,常采用联合技术进行取栓治疗,包括:球囊取栓+导管抽吸、支架取栓+导管抽吸、机械取栓+药物局部溶栓、球囊扩张成形术+支架植入术。
表1不同取栓装置特点
目前还没有足够的证据确定哪一种EMT方案可以取得最好的疗效,在许多情况下,需要多种治疗方法联合应用。目前最常采用多种取栓方法与大管腔抽吸导管的联合应用。Solitaire FR设备(Covidien Neurovascular, Irvine, California)是一种激光切割、自膨式可回收的支架,FDA批准将其用于颅内大血管阻塞导致的缺血性卒中。有报道称,使用Penumbra血栓抽吸系统联合Solitaire FR装置治疗CVST患者有较好的疗效,是近年治疗CVST应用中最多的EVT方法。动脉取栓支架直径大小及力学结构对于脑静脉血栓作用力较弱,既不能有效捕获血栓,也不能进行血管内血栓机械破碎,因此在治疗CVST,尤其是负荷量较大的亚急性血栓很难实现再通。Penumbra抽吸导管及中间导管的研发使得顺应性改善可以成功到达静脉窦远端,以及大管腔设计增强了清除血栓的作用,但仍存在导管与静脉窦血管直径不匹配问题,在亚急性大负荷量形成的病例中,清除血栓困难。目前上市的动脉取栓装置的缺点(见表1)在于由于它是为动脉取栓设计的,没有适用于脑静脉窦的规格;对于亚急性慢性血栓或大量血栓不能抓取捕获,机械破碎作用微弱,无管腔支撑恢复血流作用,因此不能有效抽吸清除达到再通;多种装置联合,反复操作复杂,可能会造成器械断裂损坏,增加血管损伤风险;清除直窦深静脉系统血栓存在困难;有造成肺栓塞的风险;费用高。
目前的临床实践中由于上述局限性,多采用多种治疗方式联合的多模式治疗策略。目前对各种联合治疗方案尚没有设计合理的大样本前瞻性对照试验,具体治疗取决于各中心医师决策,筛选患者以及EVT方法均存在较大的异质性,导致数据存在较大偏倚,研究结果不能明确EVT在CVST治疗作用。
02.
脑静脉取栓装置的设计与研发
与颅内动脉或外周静脉相比,颅内静脉血栓形成常常是大负荷量亚急性血栓特点,颅内静脉的解剖结构(血管行程、管腔直径、腔内结构、管壁)存在很大差异,以及病理生理血流动力学变化不同,因此目前针对动脉及外周静脉的取栓装置及支架系统不适用于脑静脉窦血栓。缺乏针对专用CVT的安全、有效的EVT装置是阻碍EVT实现再通的重要因素。
脑静脉窦与动脉解剖结构差异大,静脉窦管腔直径大(6-10mm),横截面呈类三角形,血管走形迂曲度大,管腔内解剖情况复杂(条索、分隔、蛛网膜颗粒),静脉血流缓慢,静脉引流模式复杂变异多,而且静脉血栓多为急性期后血栓(超过7天),血栓演变开始机化,以纤维蛋白为主要成分,并逐渐胶原蛋白沉积以及钙化,在血液成分、炎性细胞及炎性因子参与下,其结构变得致密,并与血管壁紧密贴合,血栓逐渐延展增长累及更大范围更多静脉窦。正是由于上述特点,脑静脉窦血栓血管内治疗与动脉血栓治疗不同,不同时期静脉窦血栓采取不同的治疗模式及策略:急性期及亚急性期血栓,取栓装置破碎血栓+大管腔导管抽吸血栓;慢性期血栓,存在局部管腔狭窄,血流淤滞,血管成形术(球囊扩张+支架植入术);如果广泛慢性血栓导致的管腔狭窄及闭塞,目前是治疗的难点,还很难实现血管再通。因此,对于严重的CVST患者应尽早诊断,明确存在病情进展的危险因素及药物治疗无法控制,应尽快启动血管内治疗,以更好实现血管再通。
针对CVST的治疗需求,宣武医院吉训明院士研究团队正在研发新型的静脉窦专用取栓装置。该装置的关键技术具有以下优势:①精确性:能够适应不同直径的静脉系统,器械直径可调节。精确性:静脉窦取栓装置可以在狭窄或复杂的静脉窦系统中有效操作,定位精确且不易对周围组织造成损伤,特别适用于静脉系统解剖结构复杂的区域。②有效性:采用双支架结构,工作面积大,通过多种机械作用(支撑、破碎、捕获、抽吸)有效清除血栓。相较于单纯的抗凝药物治疗,取栓装置能够快速移除血栓,有助于在短时间内改善血流情况,显著减少血栓对脑组织的损害。取栓装置能够灵活适应不同血栓部位和类型,包括新鲜血栓和慢性血栓,可用于多种静脉窦闭塞的病人。③操作安全:设计旨在减少对皮层静脉的损伤,降低并发症风险。减少并发症:通过机械方式直接清除血栓,降低了出血风险和药物副作用。部分装置在设计上具有防止血栓脱落或二次栓塞的结构,使手术安全性更高。手术时间短、恢复快:与传统手术相比,微创取栓手术时间较短,创伤小,患者术后恢复较快,有助于提升预后效果。
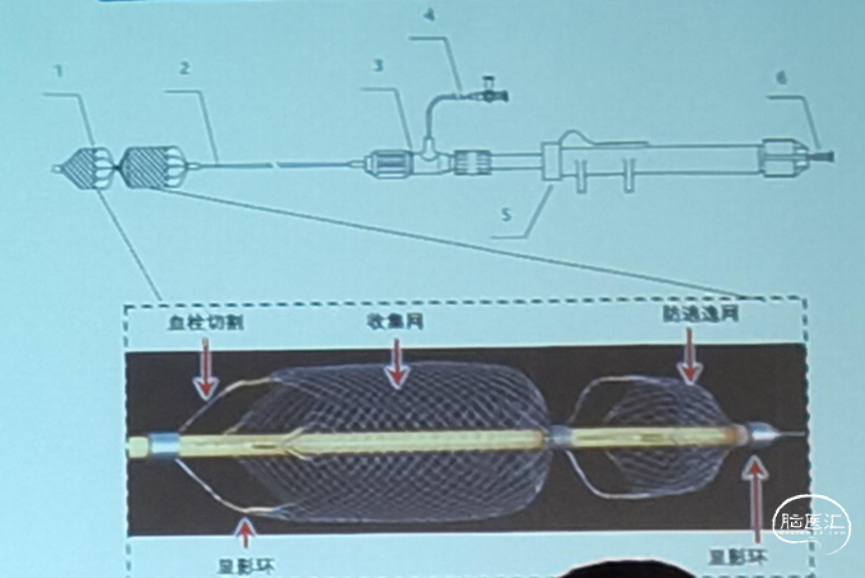
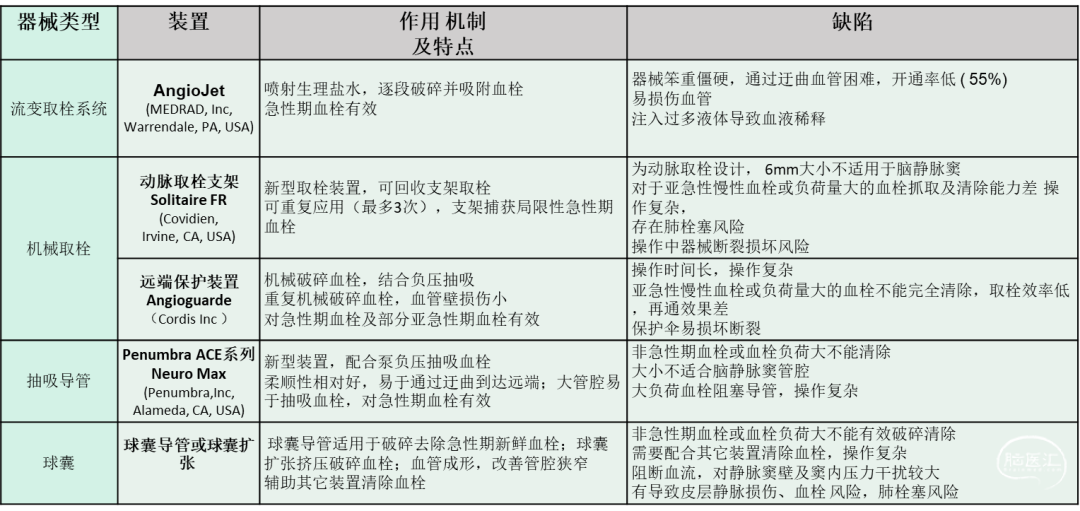
图1 研发取栓装置
在临床前期力学研究、体外模型试验及猪模型动物实验中,装置显示出良好的柔韧性和顺应性,能够有效降低血管壁刺激和损伤的风险。初步单中心临床研究表明,新型静脉实取栓装置在即刻和远期完全再通率方面显著优于传统的Angioguard+Stering球囊取栓方法。此外,该装置还能够缩短手术时间,降低术后头痛的严重程度和频率。
该单中心研究为随机对照试验一共纳入60例患者,试验组应用研发的脑静脉窦碎取栓装置(规格型号:VT-7-25-1250;VT-10-25-1250),对照组应用以往的取栓装置,即Angioguard保护伞及球囊导管。两组各30例,在年龄、性别构成、体重指数(BMI)、发病-手术时间、高颅压、颅内病灶等基线数据及NIHSS、mRS、GCS等临床功能评分均无明显差异(见表2)。两组病例均为发病28天以内急性亚急性期血栓,发病到治疗时间无统计学差异,上矢状窦是最常见的血栓部位,但试验组更多病例发病时间较长,并且更多病例累及了3个静脉窦(93.3%),血栓负荷量更大,但这与疾病临床症状严重程度无相关性。两组脑组织损伤病灶(缺血性及出血性)比例均超过60%(试验组有63.3%有静脉性脑梗死、36.7%有颅内出血,对照组有70%静脉性脑梗死、45%颅内出血),并且二组均在血管内治疗前应用抗凝剂治疗而无明显改善,因此均为保守治疗无效、累及静脉窦广泛、血栓负荷量较大病例。二组患者多数获得了良好临床结果(90天mRS 0-2分别为83.3%,79.3%)。但随着时间延长,试验组慢性症状(严重慢性头痛)的病例出现低于对照组倾向,在最终随访期患者头痛程度及持续时间、工作能力恢复,试验组均优于对照组。通过初步临床随机对照试验结果及手术操作实践,显示研发的脑静脉取栓装置相对于以往传统取栓方法能够更简便快速清除静脉窦内大量血栓,并且达到更好的再通效果,未出现严重并发症。
由于静脉窦血栓特殊病理生理特点,应用动脉取栓装置很难实现大负荷量静脉血栓清除,而脑静脉窦取栓装置是研究团队针对疾病特点研制开发的专用器械,具有优势表现在以下几方面:首先,短时间内开通闭塞血管,恢复主通道正向血流,改善血流梗阻导致静脉高压及高颅压,减少脑组织损害持续的时间,避免因脑出血缺血加重以及严重脑水肿导致脑疝形成,这是重症静脉窦血栓的主要死亡原因;其次,尤其对于大负荷量血栓及急性期后的纤维蛋白为主要成分致密血栓,它们对抗凝及溶栓治疗存在抵抗作用,机械碎取血栓不仅达到血栓“减容作用”,而且破坏血栓致密结构,增加药物作用表面积,更有利于溶栓及抗凝药物发挥作用;第三,恢复的血流使管腔充盈,形成正向血流,避免皮层静脉淤滞血栓形成,以及病理性血管再通,异常的引流通路,可造成间断回流障碍及高颅压,这与长期慢性头痛、工作能力受损及生活质量下降相关,并可增加发生硬脑膜动静脉瘘(DAVF)风险;第四,国外研究的报道的取栓时间多超过120分钟,而静脉窦碎取装置操作简单快捷,可以减少过多操作导致的血管损伤等并发症发生,大大缩短了操作时间(13-55分钟),减少患者及医生放射线暴露剂量;第五,应用脑静脉取栓装置达到再通率与以往其他研究相似,但它具有更好的再通效果,这可影响长期预后,减少因血流淤滞血栓复发风险,还减少了慢性高颅压、慢性头痛、硬脑膜动静脉瘘(DAVF)的发生,改善患者生活质量,还有助于中青年患者学习工作能力的恢复。这说明,脑静脉窦取栓装置在器械结构设计上更适应静脉窦血栓病理特征及脑静脉解剖结构,相对于传统取栓方法具有更高的安全性和有效性。
应用脑静脉窦碎取装置治疗过程顺利,静脉窦血栓取栓机制与动脉取栓不同:不是仅通过器械捕获局限的急性期血栓,而在复杂血管内环境中:静脉窦-大量血栓-器械相互作用更为重要,研发的装置在设计结构上具有优势:脑静脉取栓装置输送系统具有良好柔顺性及操控性,可以通过颅底经过迂曲血管顺利到达颅内远端静脉窦血栓部位;脑静脉窦取栓装置为自膨式编织闭合式支架,具有特殊的网格结构及密度分布,适当的径向扩张力,通过装置运动对于静脉血栓具有良好机械破碎、切割作用;双支架结构,增加了有效工作面积,提高清除效率;直径的可调节性(3-10mm范围),适合不同直径的静脉窦管腔,并起到自动对中作用,闭合网式结构,避免机械操作过程中对血管壁及腔内生理结构(条索、分隔、蛛网膜颗粒)造成牵拉损伤;通过直径调节适应不同静脉窦管腔大小及内部形态,一方面可以机械切割破碎大负荷部分机化的血栓,使其通过负压抽吸排出体外,另一方面,可以通过编织网径向力与血栓嵌合,将血栓捕获排出体外,这两方面共同作用使取栓效率显著提高。脑静脉取栓装置工作段为独特双编织网篮结构,具有更好贴壁性,适应管腔内复杂的结构及血栓,避免对血管壁引流静脉入口挤压,不会将小栓子挤压至皮层静脉内,破碎的血栓通过远端及近段取栓网回收,以及配合负压抽吸导管作用,避免血栓逃逸导致肺栓塞风险。
输送脑静脉取栓装置和支架等装置需要适配的脑静脉通道导管,由于静脉窦走形迂曲,到达存在大量血栓的部位常较为困难,因此研发的导管前段存在不同柔韧度节段,提高导管的可操控和柔韧性,建立稳定的通道,能够帮助取栓装置通过迂曲血管达到血栓部位,便于取栓装置进行取栓,此外,由于具备大孔径导管特性,还可以在远端配合取栓支架抽吸清除血栓。研发装置采用复合材料加工成型,具有较高的弯曲顺应性、高抗折性、良好的生物兼容性。同时通过特殊设计的远端开口,减少导管远端在移动过程中对血管壁的损伤。(见图2)

图2 静脉导管
在血管内治疗中由于静脉血栓机化导致管腔狭窄,严重影响血流,需要通过球囊扩张支架成形术消除狭窄,改善血流淤滞。脑静脉窦支架主要应用于静脉窦腔内病变导致狭窄,出现高颅压水肿压迫导致静脉窦塌陷,支架支撑有助于保持血流通畅,抵抗高颅压对静脉窦压迫,避免血栓复发,血管再闭塞。另外,静脉窦支架也适用于特发性高颅压伴静脉窦狭窄及颈静脉狭窄治疗。与取栓装置一样,目前没有专用于脑静脉的支架系统,多应用颈动脉支架,存在很多缺陷。
但目前由于没有专用的脑静脉支架系统,通常是应用超说明书应用的颈动脉支架来实现救治。国内外各类相关指南中,有关放置脑静脉窦支架没有明确阐述,各个医疗中心对于支架的选择、治疗策略皆有较大的差异性。而且颈动脉支架应用于静脉窦操作难度大、风险高,存在介入支架手术相关并发症,这些因素均导致了此技术在我国不能顺利发展,迫切需要研发更安全有效的脑静脉窦专用支架应用于临床。
脑静脉窦与动脉在解剖结构、血流动力学特点、病理生理改变均明显不同。脑静脉窦病变多发于上矢状窦、横窦、乙状窦,这些血管均为硬脑膜构成,横截面呈类三角状、壁薄、管腔大、无弹性;乙状窦-颈内静脉结合部位扩张成为颈静脉球,颈静脉球部大小差别较大,可发现颈静脉孔区迂曲角度较大并伴有颈静脉球高位;横窦-乙状窦存在较大弯曲角度;重要皮层静脉引流入静脉窦;腔内存在蛛网膜颗粒、纤维小梁等结构。这些导致静脉窦支架植入术具有非常大挑战性。无论装置的输送系统还是支架本身特性都需要充分考虑适应脑静脉窦血管特点。由于窦壁的弹性回缩及静脉血管内没有使之保持通畅的高压血流,因此静脉窦狭窄单纯球囊扩张很少有效,只有支架支撑可保证静脉窦的持续畅通,支架特性及大小选择非常重要。脑静脉窦管径较大无弹性,需要有一定径向支撑力且直径较大的血管支架系统对抗高颅压的压迫;但过大的径向扩张力会更大刺激血管壁,造成严重管壁损伤及炎症反应,导致患者术后患侧头痛头胀不适,支架内血栓形成,长期慢性刺激增加再狭窄及硬脑膜动静脉瘘发生几率,因此良好的静脉窦支架特性要适合更好顺应性操控性,顺利到达病变目标血管,又要具有适当支撑力抗压性能,目前应用的颈动脉支架特性不能实现,限制了静脉窦支架的临床应用。
目前无专门的脑静脉窦支架及颈静脉支架,应用的颈动脉支架系统并不符合脑静脉窦及颈静脉流出道的生理解剖特性。在实际临床应用中,不能顺利解除静脉窦狭窄,达到良好血管重建;或不能维持适当支撑力,起到持久改善静脉回流及脑脊液引流作用;支架后血栓形成、支架造成窦壁损伤、炎症因子上调等多种因素可能促进血管结构异常。目前所使用支架报道常见的副作用及并发症包括:急性期出现的支架同侧的持续头痛、血栓形成、支架贴壁性差与支架移位、支架过度弯曲折断、支架阻断重要皮质静脉引流入静脉窦造成恶性高颅压、穿破血管出血;慢性期出现的支架邻近部位再狭窄(发生率14%)及需要二次手术(发生率6-13%)、硬脑膜动静脉瘘形成。这些支架均为长期植入性编织或激光雕刻支架,主要为颈动脉狭窄及胆道设计,为开环性或闭环性自膨式支架。应用于静脉窦及颈静脉狭窄存在诸多缺陷:1.较硬的颈动脉外周支架输送系统常常难以通过颈静脉孔区存在骨嵴结构及迂曲角度较大的颈静脉球、横窦-乙状窦交界弯曲角度较大狭窄段,狭窄程度严重管腔,需要借助介入装置,复杂“同轴技术”选择合适导引导管、中间导管以及微导管导丝技术,反复操作,技术难度大,并有失败可能;2.持久支撑力差及支架长度不适用,不能持续有效维持静脉窦长段通畅,在高颅压外压持续存在时易塌陷,造成再狭窄及高颅压加重;3.顺应性不符合静脉窦生理弯曲。狭窄常发生在横窦远端或横窦与乙状窦交界弯曲处,支架不能很好顺应血管走形,造成支架打折弯曲,不能维持血流通畅;3.激光雕刻开环支架,容易刺激血管壁,导致局部内皮细胞以及血管平滑肌细胞的非特异性炎症反应及功能障碍,局部血小板聚集以及凝血功能的改变,继发血栓形成,静脉窦再狭窄及硬脑膜动静脉瘘形成;4.颈动脉自膨式支架(Wallstent)定位不准确,造成支架移位,狭窄段覆盖长度不够;5.支架贴壁性差,不适用于静脉窦类三角形无弹力管腔,易在支架与管壁之间形成血液瘀滞,致使血栓形成;6.支架覆盖管腔,影响皮层静脉引流入静脉窦,造成重要引流静脉闭塞,出现恶性高颅压,静脉性梗死伴出血;7.脑静脉为低压血管,血流较动脉缓慢,易内膜增生再狭窄,需要服用较强抗血小板聚集及抗凝药物至少6个月;8.支架顺应性不好刺激硬膜引起慢性头痛;9.长期引起硬膜结构异常硬脑膜动静脉瘘形成。由于支架网堵塞引流皮层静脉,导致静脉淤滞和血栓形成,瘘口主要位于支架覆盖的窦道,特别是支架的远端,支架放置时的外伤性动作和支架本身硬度造成损伤,长期炎症因子及血管生长因子(VEGF)水平的升高可能促进了动静脉瘘的形成。
由于上述支架存在缺陷,造成脑静脉流出道梗阻不能有效缓解。迫切需要克服上述支架不足,研究更优化的静脉窦支架系统,符合脑静脉窦解剖生理特点,具备更好的操控性、顺应性和有效支撑力,与静脉窦之间有更好的贴壁性,减少对引流皮层静脉损伤及窦壁的刺激,减轻炎症反应,建立适用于颅内压增高、脑静脉高压、脑静脉流出道梗阻状态的血管重建体系。目前临床应用均依赖欧美日本进口支架系统,种类选择尺寸大小受限制,而且费用高,不属于医保报销范围,给患者家庭及社会带来沉重经济负担。
首都医科大学宣武医院吉训明团队结合丰富的临床研究数据及临床实际治疗经验,自主研发新型脑静脉支架系统,研究正在进行中。为贴合静脉解剖特点,支架选用镍钛金属丝编织,使装置具有较高的顺应性和贴壁性,同时具备合适径向支撑力,能够准确定位。网状结构设计减少对血液流影响,两端口闭环设计减少端口对血管壁的刺激。(见图3)
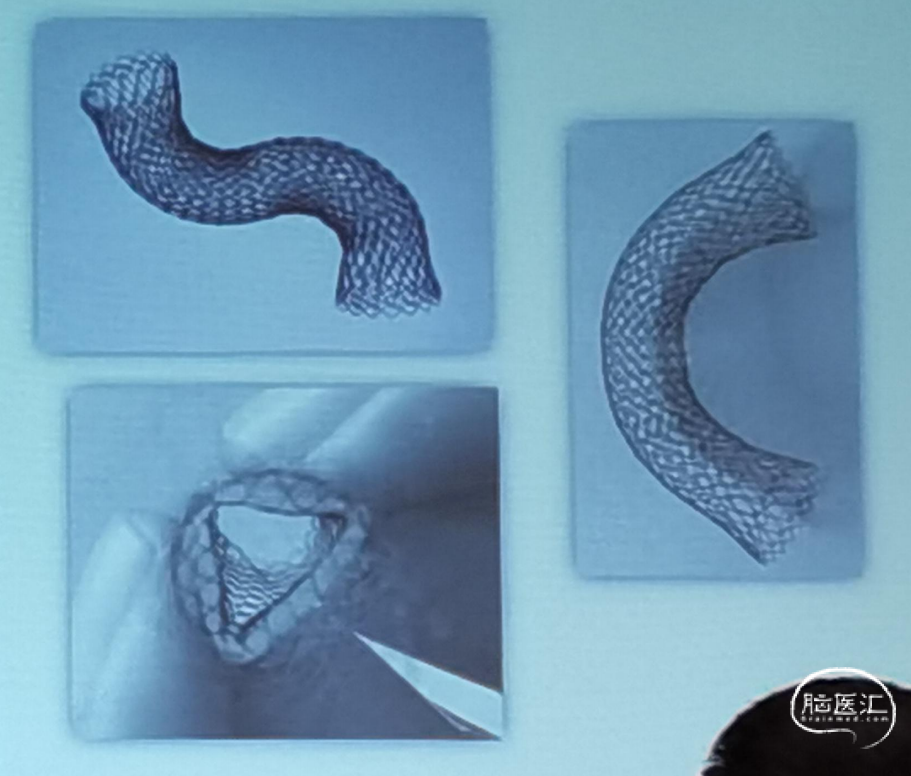
图3 静脉支架
03.
研究困境与未来方向
脑静脉器械研发为创新性研究,由于脑静脉系统解剖特点独特性以及脑静脉系统疾病的复杂性,在研究中常遇到困境和面临很多挑战,也是需要不断研究探索改进的主要内容。总结如下:
1.不同直径血管、复杂腔内结构,路径迂曲
编织结构改善使装置可操作性、顺应性及柔韧性更好。可调节直径的取栓装置能够更好的适配静脉窦直径,支撑管腔快速调节。根据不同手术入路,研发不同规格的取栓装置,改进输送材料的亲水性及可操控性,进一步研发配套导管,建立稳定的通路及更有效抽吸血栓。
2.血栓特性多样性,负荷量大
取栓装置有破碎、捕获和抽吸多功能,需要考虑取栓装置的有效工作面积。同时,术前影像学与血栓类型研究,能够辅助选择更合适的取栓策略。机械取栓与药物溶栓联合治疗,提高再通效果。通过人工智能技术应用,智能化取栓系统有助于提高装置设计的科学性和精确性,降低手术风险。
3.并发症风险
常见取栓后并发症有窦壁损伤、穿破出血或栓子脱落导致远端栓塞等。改造装置柔顺性,避免操作对窦壁及皮层静脉损伤。同时,需要具备栓子捕获功能,防止栓子脱落肺栓塞。取栓操作流程简化,配合导管血栓抽吸能够缩短手术时间,从而降低并发症风险。借助智能手段更科学评估静脉窦再通手术效果和风险。
未来,针对CVST的血管内治疗需要进一步的大样本量前瞻性比较研究,以评估新型取栓装置的有效性和安全性。同时,研发改进适用于治疗静脉窦血管病变的介入导管、支架系统等也将是未来重要的研究方向。人工智能技术快速发展在EVT器械研发中显示出巨大的潜力,智能化EVT系统有助于提高装置设计的科学性和精确性,降低手术风险。
04.
总结
目前,EVT治疗仍作为补救性治疗用于抗凝治疗失败,或严重神经功能损害重症患者;早期识别可获益的亚组病人进行EVT治疗能更好临床结局。目前多种动脉EVT装置联合应用静脉窦再通治疗,但操作仍存在较多困难,研发的脑静脉窦专用介入装置及技术,在临床前研究及初步临床研究中显示可以安全有效的实现再通。取栓装置研发中遇到的难题,需要临床医生与器械材料工程师共同合作解决,未来人工智能及机器人技术辅助可使治疗更加精准完善。
编写专家简介

吉训明
中国工程院院士、中国医学科学院学部委员;首都医科大学副校长、北京脑重大疾病研究院院长、首都医科大学宣武医院卒中中心主任;兼国家卫生健康委百万减残工程专委会主任、互联网医疗诊治技术国家工程研究中心和国家卒中抢救中心主任、中国老龄健康促进工程专委会主任和国际适应医学会主席;担任《Brain Circulation》《Neuroprotection》《Conditioning Medicine》等杂志主编。长期从事脑卒中防治与转化医学研究,专注于我国动脉和静脉性卒中发病机制、脑血流重建与神经保护研究。主持973、863、国家重点研发计划、军民融合重大项目和国家自然科学基金重大项目,成果以通讯作者发表于《N Engl J Med》《Lancet Neurol》《Nature》等期刊,被引18600余次,连续五年入选Elsevier中国高被引学者。获发明专利和软著等授权104项,国家科技进步二等奖2项、省部级科技进步一等奖4项、何梁何利基金科学与技术进步奖、吴阶平医学创新奖和全国创新争先奖等。

陈健
医学博士,神经外科主任医师,研究方向主要为缺血性脑血管病的外科临床和基础研究。特别是在急诊脑卒中动脉取栓、重症颅内静脉窦血栓及颅内静脉窦狭窄等脑血管疾病方面具有丰富的经验。
主持包括国家自然科学基金在内的多项科研课题,作为骨干参与国家“863”项目及国家自然基金等支持的“缺血性脑血管病的血管内介入治疗及亚低温神经保护”的研究工作,以第一作者发表SCI文章十余篇。

周陈
首都医科大学脑重大疾病研究中心

吴艳
首都医科大学宣武医院
点击上方图片
声明:脑医汇旗下神外资讯、神介资讯、脑医咨询、Ai Brain 所发表内容之知识产权为脑医汇及主办方、原作者等相关权利人所有。
投稿邮箱:NAOYIHUI@163.com
未经许可,禁止进行转载、摘编、复制、裁切、录制等。经许可授权使用,亦须注明来源。欢迎转发、分享。
投稿/会议发布,请联系400-888-2526转3。








