作者:周龙1,雷盼1,宋平1,李知阳1,张惠凯1,魏航宇1,高论1,华秋伟1,叶晖1,陈谦学1,张思磊2#,蔡强1#
#共同通讯作者:张思磊
#通讯作者:蔡强;电话:+86-15072358160;E-mail:cqno@sina.com
1武汉大学人民医院神经外科
2仙桃市第一人民医院神经外科
https://doi.org/10.1038/s41598-025-86731-3
目的:探讨3D Slicer重建及3D打印定位技术联合经颅神经内镜技术在脑室-腹腔分流手术中的技巧及其优缺点。方法:回顾性分析我院从2021年10月至2023年3月利用3D Slicer重建及3D打印定位技术联合经颅神经内镜技术进行脑室-腹腔分流手术治疗脑积水的患者的临床资料。结果:共收集资料完整的病例33例,其中男性19例,女性14例,年龄10-81岁,所有患者均通过颅脑CT或MRI检查确诊,并使用3D Slicer重建及3D打印定位,术中使用神经内镜辅助置管完成脑室-腹腔分流手术,并且术后通过颅脑CT及3D Slicer重建确认引流管位置,其中30例引流管位于同侧侧脑室额角或中央部,3例位于对侧侧脑室额角或中央部,所有患者均置管成功并且位置良好。结论:根据每位脑积水患者的独特脑室系统特征,使用3D Slicer重建技术确定个体化的穿刺点及穿刺方向,测量好穿刺深度,通过3D打印导板精准定位,并在神经内镜可视化的辅助下,精准地将脑室导管尖端送入侧脑室额角或中央部,提高了手术的成功率,降低了堵管的风险。同时,我们团队新开发的穿刺点(“蔡氏点”),其穿刺路径为无血管区域,可以降低穿刺出血风险,但其位置和穿刺方向还需进一步前瞻性临床研究来确定。
【关键词】3D Slicer;3D打印;脑积水;神经内镜;脑室-腹腔分流手术
脑积水是以痴呆、步态不稳和小便失禁为特征的神经外科常见疾病,严重影响患者的生活质量,增加家庭和社会负担。脑室-腹腔分流术(Ventriculoperitoneal Shunt,VPS)是主要的治疗方法,可以明显改善患者的临床症状,提高患者的生活质量,恢复患者的社会职能。但由于脑室导管尖端常被脑室内的脉络丛包裹或分流管脑室端位置不佳、感染等原因,常规的VPS手术的失败率高[1];在美国,VPS和/或VPS后的翻修手术约占每年所有神经外科手术的近三分之一[2]。文献报道[3],基于头皮表面解剖标志的徒手侧脑室穿刺置管是一种“盲穿”手术,其不准确率接近50%。目前的研究显示[1,3]在精准导航定位联合神经内镜直视下的侧脑室置管术可以显著的弥补以上缺陷,降低复发率及减少并发症的发生率。
3D Slicer是一款免费的开源医学图像处理软件,对操作系统的要求不高,普通的个人电脑均可以运行。文献报道[4-7],3D Slicer已被应用于各种神经外科疾病的术前规划,如脑肿瘤、脑出血、脑动脉瘤、癫痫等。3D Slicer的优点是可以重建颅内病灶、重要结构、脑沟脑回等的三维图像,清晰立体地显示出它们之间的关系,指导术前规划和手术[8]。随着3D重建技术的发展,3D打印已被广泛应用于临床实践中[9,10]。Li等[11]已经将3D打印定位联合神经内镜技术应用于脑出血的手术治疗,并取得了良好的效果。神经内镜技术的进步改变了颅脑手术的可视化和导航能力,拓宽了神经外科手术的领域。神经内镜具有良好的光照、多角度视野、近距离观察等优点,目前广泛应用于神经外科各项手术中[12-16]。
本回顾性研究介绍了3D Slicer重建及3D打印技术进行术前规划及精准定位的新方法、新技术,术中联合神经内镜辅助直视下置入脑室导管,提高了手术效率及安全性,降低术后各种并发症的发生率及堵管风险。
本回顾性临床研究收集了我院自2021年10月至2023年3月利用3D Slicer重建及3D打印定位技术联合经颅神经内镜技术辅助进行脑室-腹腔分流手术治疗脑积水的患者的临床资料。共收集资料完整的病例33例,其中男性19例,女性14例,年龄10-81岁,所有患者均通过颅脑CT或MRI检查确诊,并使用3D Slicer重建及3D打印定位,术中使用神经内镜辅助置管完成脑室-腹腔分流手术,并且术后通过颅脑CT及3D Slicer重建确认引流管位置,所有患者均置管成功并且位置良好。术后1-3月门诊或电话随访,详细临床信息见表1。
术前采集患者颅脑薄层CT原始数据,格式为DICOM,将患者的上述数据导入到3D-Slicer系统(https://www.slicer.org),重建脑室系统、头皮,制作3D虚拟现实模型及3D打印定位导板模型。3D虚拟现实模型有助于我们了解异常扩大的脑室系统形态及在颅内的位置结构关系,3D打印定位导板可以辅助确定最佳的体表穿刺位置,帮助术前定位。根据我们既往的临床经验,我们设计的最佳体表穿刺点位于三角区穿刺点及枕角穿刺点中间(目前我们称之为“蔡氏点”),通过此处穿刺可以直达侧脑室额角附近,并且穿刺路径为颅内无血管区域。
我们根据Benjamin Y等[17]开发的评价脑室端导管位置好坏分级系统统计引流管位置:1级,导管尖端最佳位置位于同侧侧脑室额角或中央部;2级,导管尖端位置位于对侧侧脑室额角或中央部部;3级,导管尖端位置位于非靶向脑脊液间隙;4级,导管尖端位置位于脑实质内。所有患者或家属均已签署手术知情同意书。在涉及人类参与者的研究中进行的所有程序都符合机构和/或国家研究委员会的伦理标准,以及1964年赫尔辛基宣言及其后来的修正案或类似的伦理标准。本研究已获得我院临床研究伦理委员会批准(WDRY2022-K099)。中国临床试验注册中心的注册号为ChiCTR2300074887。本病例系列已按照《PROCESS Guideline》进行报告[18]。
患者,女性,53岁,因脑出血术后脑积水入院。既往无高血压、糖尿病等病史。入院时患者为脑出血术后第18天,意识模糊,气管切开状态。入院颅脑CT提示脑室系统扩大,脑积水,脑室周围间质水肿(图1A)。我们将患者术前颅脑薄层CT的DICOM数据导入3D Slicer软件进行重建处理,制作3D虚拟现实图像(图1D), 然后设计3D打印定位导板、确认脑室穿刺点及穿刺方向、穿刺深度(图1E),并且导板需要包含双眼及一侧的耳廓轮廓。术前通过3D打印定位导板准确定位穿刺点体表位置(图1F),设计微创直切口(图1G)。术中我们使用神经内镜辅助置管,可以直视下观察侧脑室内结构(图1H),准确放置引流管位置(图1I)。术后复查颅脑CT提示引流管位置良好(图1B-C),术后通过3D Slicer重建引流管和脑室,可以清楚的观察到引流管位于侧脑室额角(图1J)。术后颅脑CTA检查提示引流管走行区域为颅内无血管区域(图1K-L),这极大的降低了穿刺出血的风险。
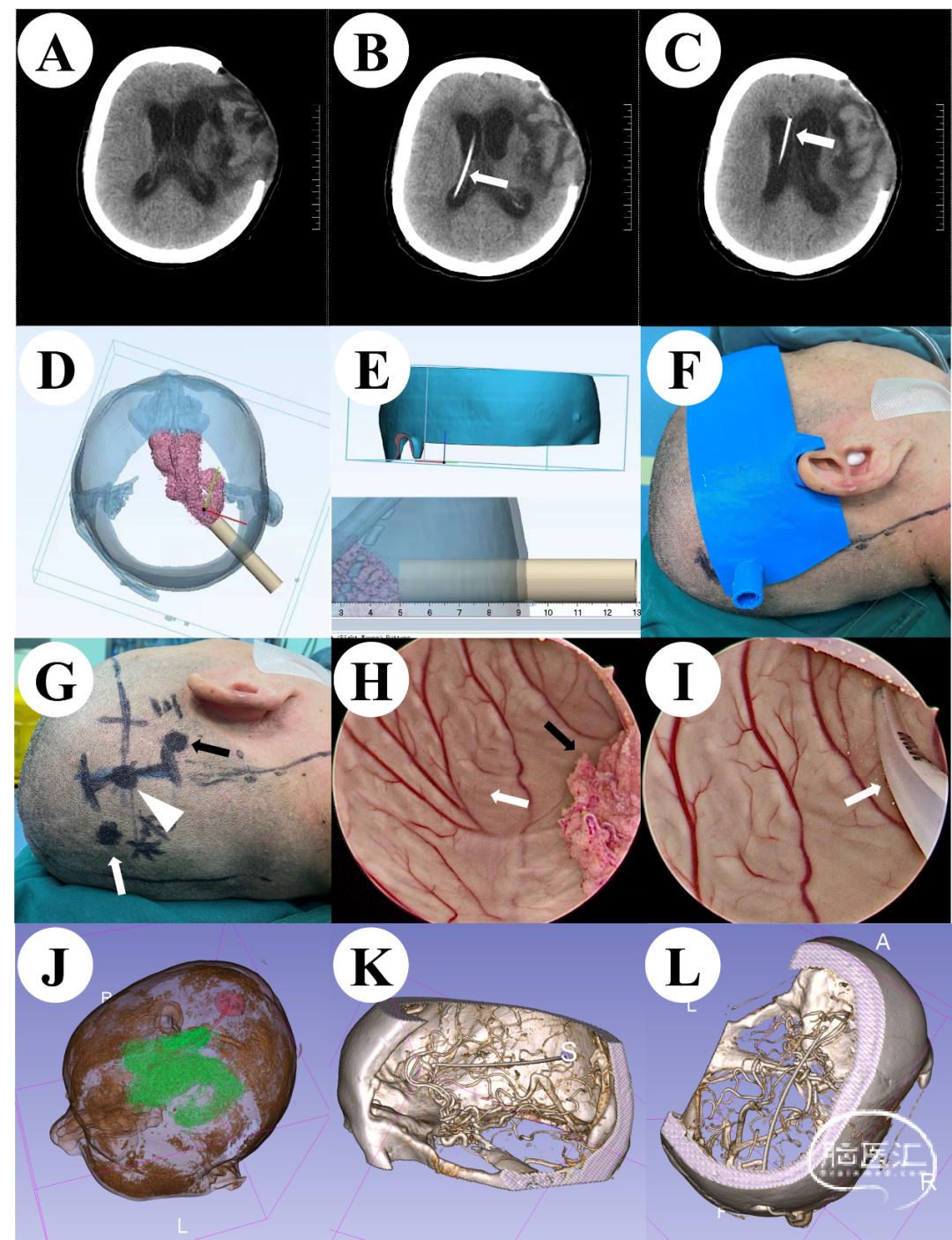
图1 A:术前颅脑CT;B-C:术后颅脑CT,箭头指示分流管;D:手术前使用3DSlicer重建的虚拟现实图形;E:3D定位导板虚拟现实图形;F:基于3D打印导板的术前定位;G:微创切口,白色三角形代表“蔡氏点”,黑色箭头代表三角形区穿刺点,白色箭头代表枕角穿刺点;H:在神经内镜下的侧脑室中,黑色箭头显示脉络丛,白色箭头显示透明隔结构;I:在神经内镜直视下插入心室分流管;J:使用3D Slicer重建侧脑室和引流管;K-L:术后头颈CTA显示分流管区域无血管。
患者,女性,81岁,因颅内动脉瘤术后脑积水入院。既往无高血压、糖尿病等病史。入院时患者为颅内动脉瘤破裂导致蛛网膜下腔出血,行颅内动脉瘤开颅夹闭术后1年,神志清楚,精神差,反应迟钝。入院颅脑CT及MRI均提示脑室系统扩大,脑积水,脑室周围间质水肿(图2A-C)。我们将患者术前颅脑薄层CT的DICOM数据导入3D Slicer软件进行重建处理,制作3D虚拟现实图像(图2E), 然后设计3D打印定位导板、确认脑室穿刺点及穿刺方向、穿刺深度(图2F)。术前通过3D打印定位导板准确定位穿刺点体表位置(图2G),设计微创直切口(图2H),采取锁孔骨窗(图2I)。术中我们使用神经内镜辅助置管,可以直视下观察侧脑室内结构(图2J),准确放置引流管位置(图2K)。术后复查颅脑CT提示引流管位置良好(图2D),术后通过3D Slicer重建引流管和脑室,可以清楚的观察到引流管位于侧脑室中央部(图2L)。
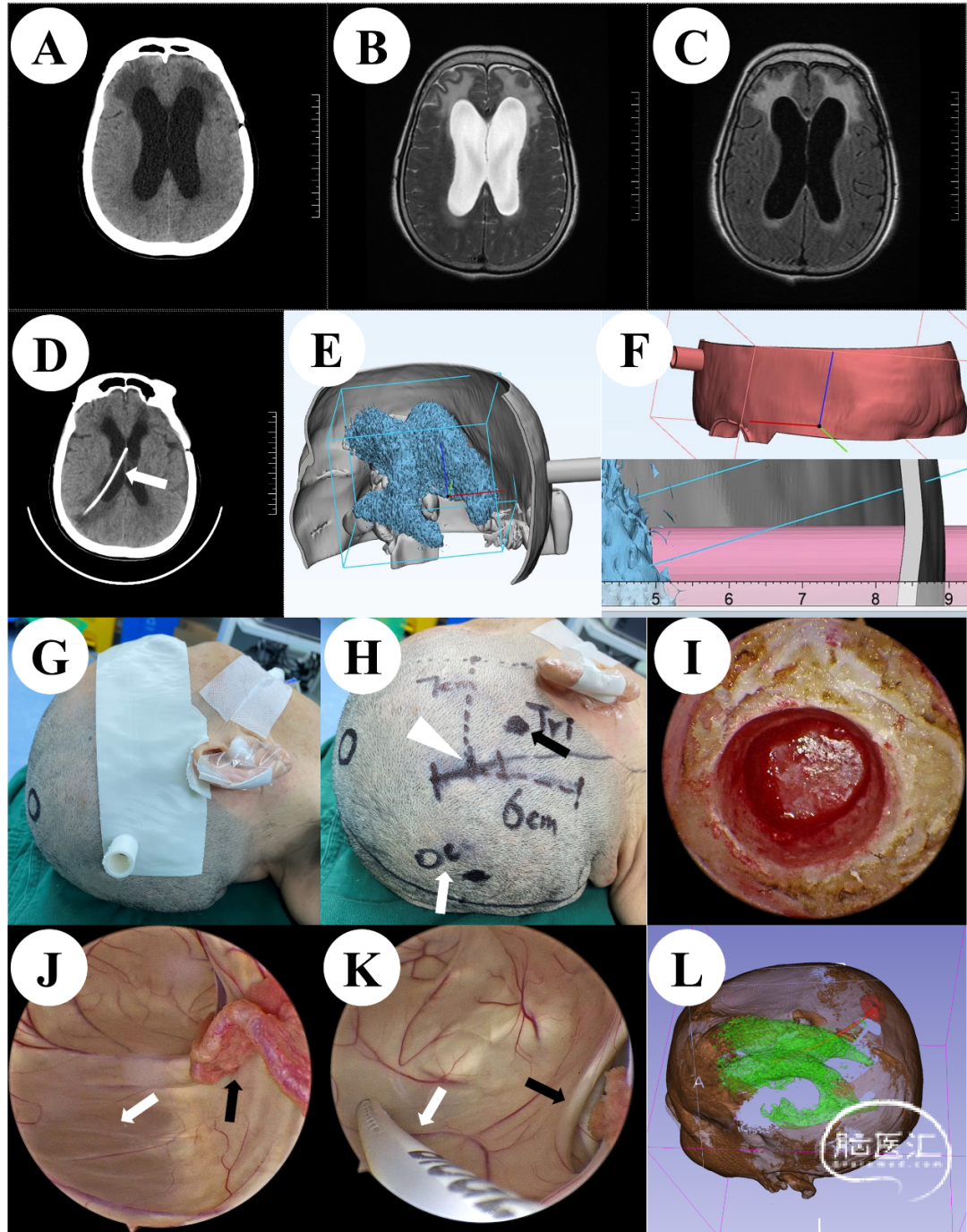
图2 A:术前颅脑CT;B-C:术前颅脑MRI;D:术后颅脑CT,箭头指示分流管;E:手术前使用3D Slicer重建的脑室系统的虚拟现实图形;F:3D定位导板虚拟现实图形;G:基于3D打印导板的术前定位;H:微创切口,白色三角形代表“蔡氏点”,黑色箭头代表三角形区的穿刺点,白色箭头代表枕角穿刺点;I:锁孔技术;J:在神经内镜下的侧脑室,黑色箭头表示脉络丛,白色箭头表示透明隔结构;K:在神经内镜直视下插入分流管脑室端(白色箭头),黑色箭头表示室间孔结构;L:使用3D Slicer重建侧脑室和引流管。
患者,男性,40岁,因反应迟钝、行走不稳检查发现脑积水入院。既往无高血压、糖尿病等病史。入院时患者神志淡漠,精神差,伴恶心、无呕吐,有反应迟钝及行走不稳等情况。入院颅脑CT提示脑室系统扩大,脑积水(图3A)。我们将患者术前颅脑薄层CT的DICOM数据导入3D Slicer软件进行重建处理,制作3D虚拟现实图像(图3C), 然后设计3D打印定位导板、确认脑室穿刺点及穿刺方向、穿刺深度(图3D)。术前通过3D打印定位导板准确定位穿刺点体表位置(图3E),设计微创直切口(图3F)。术中我们使用神经内镜辅助置管,可以直视下观察侧脑室内结构(图3G),准确放置引流管位置(图3H)。术后复查颅脑CT提示引流管位置良好(图3B),术后通过3D Slicer重建引流管和脑室,可以清楚的观察到引流管位于对侧侧脑室额角(图3I)。使用3D Slicer将术后颅脑CT及术前颅脑CTA数据融合后重建虚拟现实图像,可以清楚显示引流管走行区域为颅内无血管区域(图3J-K),这极大的降低了穿刺出血的风险。
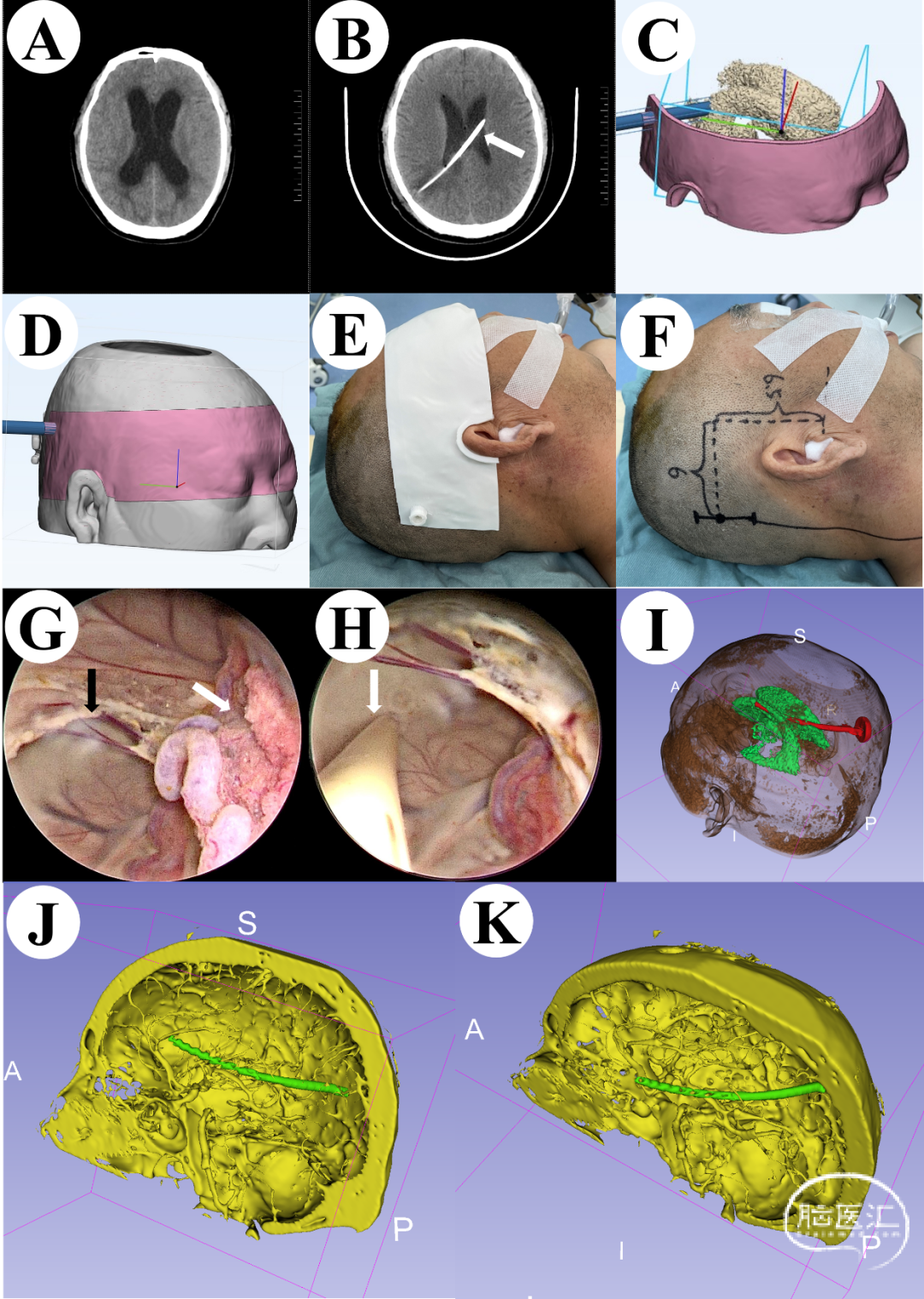
图3 A:术前颅脑CT;B:术后颅脑CT,箭头指示分流管;C:手术前使用3D Slicer重建的脑室系统虚拟现实图形;D:3D定位导板虚拟现实图形;E:基于3D打印导板的术前定位;F:微创切口;G:在神经内镜下的侧脑室中,黑色箭头表示已经穿孔的透明隔,白色箭头表示脉络丛结构;H:在神经内镜直视下插入脑室腹腔分流管的脑室端;I:使用3D Slicer重建侧脑室和引流管;J-K:使用3D Slicer融合术后颅脑CT和术前脑CTA数据,重建虚拟现实图像,显示分流管区域无血管。在所有33例资料完整的脑室-腹腔分流手术治疗脑积水的患者中,14例为脑出血后继发性脑积水,8例为蛛网膜下腔出血后继发性脑积水,5例为不明原因出现头晕、反应迟钝等神经系统症状后就诊时发现脑积水,3例为脑外伤后继发性脑积水,2例为脑脊液循环通路上脑肿瘤术后继发性脑积水,1例为颅内感染后出现继发性脑积水。根据Benjamin Y等设计的分流管位置分级,其中1级30例,位于同侧侧脑室额角或中央部;2级3例,位于对侧侧脑室额角或中央部部。
VPS是神经外科治疗脑积水的最常用的方法,但这种手术的失败率高,1年的复发率高达40%,2年的复发率约为50%[19],机械障碍是导致分流失败最常见的原因,其中大约67.7%是脑室导管阻塞[20]。神经内镜可获得脑室内和导管管周围区域的直视图,可以帮助我们识别导管机械阻塞的不同原因。研究显示脑室导管的侧孔可以被脉络丛、室管膜、脑组织、肉芽组织、新形成的血管等堵塞[19]。侧脑室额角无脉络丛组织,将脑室导管置入侧脑室额角可降低脉络丛阻塞的风险;但仍有报道显示,即使手术后导管是通畅的,但当脑室尺寸减小时,导管尖端可能会插入脑实质内导致导管侧孔堵塞[19]。因此,在没有内镜辅助直视下的置管,我们无法掌握引流管在脑室内的长度,如果过度的强调将导管送入侧脑室额角而导致导管插入过长,极有可能导致导管尖端插入侧脑室额角脑实质内,即使当时没有插入,一旦引流效果较好,脑室系统缩小后导管尖端仍有可能进入脑实质内,最终导致分流失败。因此,常规的VPS被认为是失败率最高的神经外科手术。
传统的脑室导管置入方法失败率很高,原因是因为传统的脑室导管置入方法在很大程度上依赖于个人经验和对神经解剖特征的熟悉,而没有充分考虑患者个体的解剖变异情况。同时,因为“盲法”置入可能需要多次尝试以将导管放置到所谓的“最佳位置”,而反复的导管置入往往会对正常的脑组织造成新的损害,导管置入次数增加与并发症风险增加成正相关,多次置入会增加出血或感染的概率[3]。为了解决上述问题,精确导航联合神经内镜辅助下的导管置入方法将非常有益。研究[21]表明,在放置心室导管期间使用图像引导可以大大减少所需的成功插入次数,并提高导管插入的准确性。然而,由于目前可用的导航设备成本高、体积大、操作复杂、准备时间长,传统的导航设备通常不用于辅助放置脑室导管。
近年来,3D Slicer等多模态融合成像技术作为一种新的成像工具,在神经外科领域得到了广泛的应用[4],其特点是免费开源且操作简单,对计算机的配置要求不高,普通的个人电脑就可以运行,同时可进行功能扩展以及不断的优化升级。为了实现低成本、简便的术前导航方法,我们研究团队巧妙地采用了“虚拟现实”的概念,即将3D Slicer重建处理的半透明的脑室系统及头皮3D模型通过Sina/MosoCam手机APP的二重曝光功能巧妙的叠加在患者头上,形成复合视图,通过缓慢调整手机直至找到最合适的位置[22]。通过这种方法,神经外科医生可以通过手机镜头“可视化”脑室系统与头皮的关系。
Moneer KF等[23]研究显示,使用3D Slicer开发的这种导航系统,与传统导航系统的精确度几乎一致,误差只有2mm,但成本几乎是免费的;如果操作得当,这种新技术可以用更少的准备时间和更低的设备要求等优势取代传统的导航方法。
我们早期的临床实践显示[22],通过Sina/MosoCam手机APP的二重曝光功能进行投影定位,需要手动匹配患者的眼睛、鼻子或耳廓等体表标志,对操作者手的稳定性的要求极高,虽然可以通过手机支架等克服困难,但仍存在一定的不足。因此,我们在3D Slicer重建的基础上,新开发了3D打印导板定位系统,通过3D打印技术直接匹配患者眼、耳、鼻等体表标志,可以很好的解决上述问题。在我们团队后期的研究中,我们使用3D Slicer重建脑室系统与头面部体表标志的3D图形,然后设计出合适的穿刺点(目前我们称之为蔡氏点),选取穿刺点的原则是通过穿刺点垂直于脑组织表面穿刺能够最近到达侧脑室并且能够通过微调让脑室导管尖端到达同侧侧脑室额角或中央部,然后根据上述设计裁剪出我们需要的包含双眼、鼻根、耳廓及穿刺点的个性化3D导板模型,将数据导入3D打印机打印出来用于术前定位。整个设计过程经过我们熟练掌握后,平均需要约20min,而精简后的个性化定位导板打印平均需要约2h,因为VPS均为平诊手术,我们有足够的时间去设计规划及打印导板。同时,通过术后颅脑CTA重建图像(图1K-L)或使用3D Slicer将术后颅脑CT与术前颅脑CTA数据融合后重建图像(图3J-K),可以清晰显示,引流管穿刺通道区域为脑组织内无血管区域,这将极大的降低穿刺出血的风险。
常规的VPS脑室置管通常有侧脑室额角、枕角和三角区三种类型,其中三角区因为脉络丛面积大最容易导致导管阻塞已被放弃,一般选择没有脉络丛的侧脑室额角或枕角。侧脑室额角穿刺最容易,但分流管皮下隧道长并且需要绕过外耳道上方,操作起来复杂且需要多一个头皮切口,同时额部穿刺容易诱发癫痫。侧脑室枕角穿刺理论上癫痫发生率低,但枕角体积较小,并且穿刺时需要患者摆特殊的侧卧位,增加了穿刺的难度。在我们的临床实践中,我们特定的穿刺点(蔡氏点)位于侧脑室三角区与枕角穿刺点中间,穿刺时不需要特殊体位,并且通过神经内镜的直接可视化功能,手术者可以识别脑室的内部结构,如脉络丛、室管膜、室间孔等,还可以对导管进行微小调整,以将导管送达同侧侧脑室额角或中央部等无脉络丛结构的区域。我们的三个特殊病例依次展示神经内镜下正常厚度的透明隔(图1H)、极薄的透明隔(图2J)及穿孔的透明隔结构(图3G),利用30°工作镜头还可以看到室间孔结构(图2K)。
神经内镜辅助治疗脑积水似乎是一种替代性的微创治疗方法,它可以辅助行三脑室底造瘘手术或VPS。研究显示[24],神经内镜和VPS相结合是复杂多房性脑积水患者的首选治疗方法,它可以减少手术出血量,缩短手术时间,降低并发症发病率及缩短住院时间。同时,在神经内镜引导下放置脑室导管也可降低脑室导管位置错误的风险[25]。神经内镜辅助的VPS,手术中可以安全地去除感染引起的附着在脑室壁上的膜,也可以使用抽吸和其他侵入性器械清除脑室内沉淀物,减少分流管堵塞的风险[26]。Wei等[19]首次描述了神经内镜辅助下的VPS机械阻塞的3种手术翻修策略,这些方法可以减少手术时间、降低脑室出血的发生率和感染风险。他们报道的所有35名翻修患者在5年随访期间,均未出现任何分流阻塞或脑积水复发的迹象;并且有一例在手术过程中出现活动性出血,在神经内镜的辅助下,快速找到出血点并且成功止血,然后通过人工脑脊液反复冲洗脑室使脑室内没有残余血液导致后期导管堵塞。这也是使用神经内镜辅助下VPS的优势之一。
有的学者可能会担心神经内镜辅助手术会增加VPS感染的风险,而感染是导致手术失败的常见原因之一,常规VPS手术感染率报道差异很大,从0.17%到27.8%不等[27]。确实考虑到使用神经内镜辅助VPS会增加整个手术时间,同时多使用一种关键的手术器械也会使感染的可能性增加,可以推测手术相关感染风险会显著增加。Alexandre等[27]综述多篇文献显示,使用神经内镜本身不是手术感染的危险因素,神经内镜手术的感染风险与其他常规神经外科手术相似,使用神经内镜辅助VPS不会增加手术感染的风险。
根据每位脑积水患者的独特脑室系统特征,使用3D Slicer重建技术确定个体化的穿刺点及穿刺方向,测量好穿刺深度,通过3D打印导板精准定位,并在神经内镜辅助下,精准地将脑室导管尖端送入侧脑室额角或中央部,提高了分流手术的成功率,降低了堵管的风险。同时,我们团队新开发的穿刺点(“蔡氏点”),其穿刺路径为脑组织内的无血管区域,可以明显降低穿刺出血风险,但其常规化具体位置还需进一步前瞻性临床研究来确定。神经内镜技术的进步使得大多数神经外科手术在不需要显微镜的辅助下也可直视操作,这些工具有助于扩大我们的神经外科手术治疗的领域,值得在神经外科手术中推广使用。
[1]Song Z, Chen X, Sun Z, et al. The utility of combined neuroendoscopic- and laparoscopic-assisted ventriculo- peritoneal shunt as a treatment for patients with communicating hydrocephalus. Technol Health Care, 2021, 29(S1): 3-10.[2]Hochstetler A, Raskin J, Blazer-Yost B L. Hydrocephalus: historical analysis and considerations for treatment. Eur J Med Res, 2022, 27(1): 168.[3]Li Y, Chen X, Wang N, et al. A wearable mixed-reality holographic computer for guiding external ventricular drain insertion at the bedside. J Neurosurg, 2018, 1-8.[4]Hou X, Yang D D, Li D, et al. 3D Slicer and Sina appilication for surgical planning of giant invasive spinal schwannoma with scoliosis: A case report and literature review. Neurochirurgie, 2020, 66(5): 396-399.[5]Liao R, Liu L, Song B, et al. 3D-Slicer Software-Assisted Neuroendoscopic Surgery in the Treatment of Hypertensive Cerebral Hemorrhage. Comput Math Methods Med, 2022, 2022:7156598.[6]Wang H W, Wu C, Xue Z, et al. A Supplemental Technique for Preoperative Evaluation of Giant Intracranial Aneurysm. J Neurol Surg A Cent Eur Neurosurg, 2021, 82(5): 424-429.[7]Liu Q, Wang J, Wang C, et al. FreeSurfer and 3D Slicer-Assisted SEEG Implantation for Drug-Resistant Epilepsy. Front Neurorobot, 2022, 16:848746.[8]Ma J, Su S, Yue S, et al. Preoperative Visualization of Cranial Nerves in Skull Base Tumor Surgery Using Diffusion Tensor Imaging Technology. Turk Neurosurg, 2016, 26(6): 805-812.[9]Lan Q, Zhu Q, Xu L, et al. Application of 3D-Printed Craniocerebral Model in Simulated Surgery for Complex Intracranial Lesions. World Neurosurg, 2020, 134:e761-e770.[10]Bonda D J, Manjila S, Selman W R, et al. The Recent Revolution in the Design and Manufacture of Cranial Implants: Modern Advancements and Future Directions. Neurosurgery, 2015, 77(5): 814-824; discussion 24.[11]Li Y, Cheng H, Li Z, et al. Clinical Value of 3D-Printed Navigation Technology Combined with Neuroendoscopy for Intracerebral Hemorrhage. Transl Stroke Res, 2021, 12(6): 1035-1044.[12]Cai Q, Li Z, Wang W, et al. Hemorrhagic stroke treated by transcranial neuroendoscopic approach. Sci Rep, 2021, 11(1): 11890.[13]Cai Q, Guo Q, Zhang W, et al. Extradural anterior clinoidectomy and aneurysm clipping using transcranial neuroendoscopic approach: A case report. Medicine (Baltimore), 2019, 98(17): e15288.[14]Cai Q, Guo Q, Zhang W, et al. Surgical treatment of a posterior inferior cerebellar artery aneurysm via transcranial neuroendoscopic approach: A case report. Medicine (Baltimore), 2019, 98(17): e15304.[15]Cai Q, Ji B, Li Z, et al. Cerebral Arteriovenous Malformation Treatment by Full Transcranial Neuroendoscopic Approaches. Neuropsychiatr Dis Treat, 2020, 16:1899-1905.[16]Cai Q, Li Z, Guo Q, et al. Microvascular decompression using a fully transcranial neuroendoscopic approach. Br J Neurosurg, 2021, 1-4.[17]Yim B, Reid Gooch M, Dalfino J C, et al. Optimizing ventriculoperitoneal shunt placement in the treatment of idiopathic intracranial hypertension: an analysis of neuroendoscopy, frameless stereotaxy, and intraoperative CT. Neurosurg Focus, 2016, 40(3): E12.[18] Agha RA, Sohrabi C, Mathew G, et al. The PROCESS 2020 Guideline: Updating Consensus Preferred Reporting Of CasESeries in Surgery (PROCESS) Guidelines. Int J Surg, 2020, 84:231–235.[19]Wei Q, Xu Y, Peng K, et al. Value of the Application of Neuroendoscope in the Treatment of Ventriculoperitoneal Shunt Blockage. World Neurosurg, 2018, 116:e469-e475.[20]Singh I, Rohilla S, Kumawat M, et al. Comparison of total versus partial revision of primary ventriculoperitoneal shunt failures. Surg Neurol Int, 2013, 4:100.[21]AlAzri A, Mok K, Chankowsky J, et al. Placement accuracy of external ventricular drain when comparing freehand insertion to neuronavigation guidance in severe traumatic brain injury. Acta Neurochir (Wien), 2017, 159(8): 1399-1411.[22]Zhou L, Wang W, Wei H, et al. Clinical application of 3D Slicer combined with Sina/MosoCam multimodal system in preoperative planning of brain lesions surgery. Sci Rep, 2022, 12(1): 19258.[23]Faraj M K, Kailan S L, Al-Neami A Q H. A New Simple, Cost-Effective Navigation System (EASY Navigator) for Neurosurgical Interventions. World Neurosurg, 2022, 164:143-147.[24]Martinez-Berganza M T, Bergua B S, del Rio Perez C, et al. Biventricular hydrocephalus due to idiopatic occlussion of foramina of Monro. Neurologist, 2011, 17(3): 154-156.[25]Deopujari C E, Padayachy L, Azmi A, et al. Neuroendoscopy for post-infective hydrocephalus in children. Childs Nerv Syst, 2018, 34(10): 1905-1914.[26]Qin G, Liang Y, Xu K, et al. Neuroendoscopic lavage for ventriculitis: Case report and literature review. Neurochirurgie, 2020, 66(2): 127-132.[27]Giannetti A V, Pimenta F G, Clemente W T. Does the Simultaneous Use of a Neuroendoscope Influence the Incidence of Ventriculoperitoneal Shunt Infection? . World Neurosurg, 2017, 98:171-175.● 武汉大学人民医院神经外科主治医师。
● 武汉市东湖高新区紧急医学救援队成员。
● 中国民族医药学会外科分会理事。
● 获得湖北省科技进步奖三等奖1项(排名第6);参与国家自然科学基金面上项目1项;以第一作者或共同通讯作者发表核心论文22篇,其中SCI 10篇(总IF>40),中华系列5篇。
● 医学博士,武汉大学人民医院东院神经外科主任;二级主任医师,博士生导师,博士后导师,美国耶鲁大学访问学者及访问副教授。
● 湖北省神经内镜“领军人物”,建立了较为系统完整的经颅神经内镜体系;在国际上首创神经内镜联合钻孔引流的"二合一"手术治疗脑溢血,首创“三鞘技术”治疗全脑室铸型,首次完成大脑中动脉动脉瘤合并脑内血肿的神经内镜治疗,首次完成血管畸形并脑内血肿的神经内镜治疗,取得良好效果,获得业内同行及广大患者一致好评;对脑积水的神经内镜手术入路进行优化改进,扩大了神经内镜的手术适应症;开发3D-Slicer+Sina/Mosocam/3D打印影像重建精准定位并大规模应用于神经内镜。
● 获湖北省科技进步三等奖一项(排名第一);主持国家自然科学基金面上项目3项(82271518;81971158;81671306),省级课题8项,总经费约350万;以第一或者通讯作者发表SCI论文50篇,总影响因子315.2分,最高影响因子40.8分。

















