《Journal of Cerebral Blood Flow and Metabolism》杂志2025年2月13日在线发表日本、美国Mayo Clinic Rochester的Yasuhito Ueki , Ryan M Naylor , Sherief A Ghozy ,等撰写的《散发性脑动静脉畸形的进展:新的遗传见解,创新的动物模型和新兴的治疗方法。Advances in sporadic brain arteriovenous malformations: Novel genetic insights, innovative animal models, and emerging therapeutic approaches》(doi: 10.1177/0271678X251319913.)。

脑动静脉畸形(bAVMs)是颅内出血的重要原因,与严重的发病率和死亡率密切相关。目前的治疗方案包括手术、立体定向放射外科和血管内栓塞,但每种方法都有局限性。因此,迫切需要开发药物干预措施。最近在大多数散发性bAVMs中发现了活化的Kirsten大鼠肉瘤(KRAS)病毒癌基因同源突变,这为更全面地了解bAVMs的发病机制打开了大门,并指出了全新的可能的治疗靶点。在此,我们回顾了bAVM的遗传学、动物模型和治疗方法的现状。
引言
脑动静脉畸形(bAVMs)是指脑动静脉畸形通过血管病灶绕过正常的毛细血管循环,形成动脉血液向低压静脉系统的高流量分流。
脑AVM的治疗,特别是未破裂的脑AVM的治疗是有争议的,手术切除是治疗的金标准。然而,手术切除的安全性和有效性与脑AVM的大小、相关的脑重要功能区和/或静脉引流模式有关,并且只有一小部分脑AVM适合安全的手术切除。立体定向放射外科(SRS)是另一种潜在的治疗选择,可导致进行性血栓形成和AVM闭塞。然而,这一过程持续数月至数年,与自然史相比,潜伏期出血的风险没有变化。最后,血管内栓塞偶尔可以用于治疗目的,但治愈率低,并发症发生率高。目前,没有针对bAVM的药物干预,这代表了我们在治疗此类病变方面的一个主要差距。缺乏对脑AVM的药物干预是由于缺乏对脑AVM潜在发病机制的了解。
大多数bAVM是散发性的,没有家族史。最近发现,大多数散发性bAVM病例具有致癌性Kirsten大鼠肉瘤(KRAS)病毒癌基因同源突变,开辟了新的研究途径,为共享途径和潜在的靶向治疗提供了见解,并提高了我们对散发性bAVM的理解。发现的KRAS突变导致了新的动物模型的发展,如基因工程小鼠模型。这些模型非常接近地模拟了在人类bAVM 中发现的遗传改变,为研究该疾病的发病机制提供了有价值的工具。通过研究这些动物模型,研究人员可以深入了解KRAS突变如何促进bAVM的形成和进展,从而促进新治疗方法的发展。
通过对目前散发性脑AVM 的基因工程动物模型的全面概述,我们希望能激发进一步的研究,并为开发这种对毁灭性疾病的有效治疗方法做出贡献。
KRAS简介
KRAS最初是在Kirsten肉瘤病毒12中发现的,它作为一个分子开关,精细地控制各种信号通路。上游刺激,如血管内皮生长因子(VEGF),可以激活KRAS, KRAS随后介导参与细胞增殖、细胞迁移和血管生成的各种信号通路,包括MAPK(丝裂原活化蛋白激酶)-ERK(细胞外信号调节激酶)通路和PI3K(磷酸肌肽3激酶)-AKT(蛋白激酶B)-mTOR(哺乳动物雷帕霉素靶蛋白)通路。
MAPK-ERK通路
MAPK-ERK通路是活化KRAS的典型下游信号通路。激活的KRAS将RAF(快速加速纤维肉瘤)定位到质膜,导致RAF活化。然后,活化的RAF磷酸化并激活MEK(丝裂原活化蛋白激酶),MEK磷酸化并激活ERK。激活的ERK进入细胞核,激活多种转录因子,这些转录因子控制参与细胞增殖、迁移和血管生成的基因表达。RAS-MAPK-ERK通路的过度激活涉及多种癌症,如肺癌、结直肠癌和胰腺癌。bAVM中的KRAS突变可能与异常的AVM驱动功能相关,如血管生成和血管发育异常。因此,阐明控制KRAS信号和MAPK-ERK通路的机制对于开发靶向治疗bAVM至关重要。RAS-MAPK-ERK通路在散发性bAVM发病机制中的作用及其潜在的治疗方法见图1所示。

图1。散发性脑动静脉畸形(bAVM)的基因突变、信号通路和潜在治疗靶点。RAS(大鼠肉瘤)-MAPK(丝裂原活化蛋白激酶)-ERK(细胞外信号调节激酶)信号通路参与散发性bAVM。配体结合和激活受体酪氨酸激酶,如VEGFR2(血管内皮生长因子受体2),激活Kirsten大鼠肉瘤(KRAS), MAPK-ERK信号通路导致内皮细胞增殖、细胞迁移和血管生成。散发性bAVM的靶向治疗包括贝伐单抗、sotorasib(索托拉西布)、dabrafenib(达拉菲尼)和trametinib(曲美替尼)。VEGF:血管内皮生长因子;RAF:快速加速纤维肉瘤;MEK:丝裂原活化蛋白激酶。
散发性bAVM的体细胞突变
Nikolaev等首次发现在大多数bAVM组织样本中存在体细胞活化KRAS突变(G12V、G12D和Q61H)。从那时起,一些研究人员已经确定了散发性AVM中涉及RAS-MAPK-ERK途径的体细胞突变。Hong等首次在脊髓AVM和bAVM中检测到激活BRAF (v-Raf小鼠肉瘤病毒癌基因同源物B)突变和KRAS (G12A和S65 A66insDS)的两个新突变。Priemer等证明了首次报道的bAVM中KRAS G12C突变病例。这些结果表明,体细胞KRAS/BRAF突变和MAPK-ERK信号通路在中枢神经系统AVM的发病机制中起关键作用。Goss等和Gao等分别研究了包括KRAS和BRAF在内的体细胞突变与散发性bAVM表型的关系。然而,作者没有发现KRAS/BRAF突变的存在与bAVM表型(包括年龄、性别、表现症状、病变位置和病变大小)之间的显著关联。Bameri等进行了一项系统综述和荟萃分析,以评估KRAS/BRAF突变在bAVM中的患病率。在6项研究中,1726例AVM患者中KRAS突变的患病率为55%,而BRAF突变的患病率为7.5%。
散发性脑AVM的动物模型
一些临床研究已经在人类bAVM中发现了体细胞KRAS/BRAF突变,但尚不清楚这些突变如何参与bAVM。建立临床相关的动物模型对于研究KRAS/BRAF突变在bAVM发展中的致病作用以及发现潜在的人类bAVM药物干预至关重要。最近,通过改造KRAS/ braf中体细胞内皮细胞(EC)特异性功能获得突变,建立了模拟人类散发性bAVM特征的小鼠和斑马鱼模型。
Fish等通过将组成型活性KRAS突变引入ECs,建立了第一个KRAS诱导的转基因bAVM小鼠和斑马鱼模型。使用内皮特异性Cre驱动因子诱导出生后和成年小鼠脑ECs中KRAS G12D的表达。两个年龄组中近50%的小鼠在引入后8周发生了bAVM。成年小鼠的脑血管系统已经完全形成,在发育早期,bAVM的形成可能不一定需要生理性血管生成。KRAS G12V诱导的转基因胚胎斑马鱼几乎有50%也发生了AV分流。在斑马鱼中建立的AV分流可以通过药物抑制MEK活性来逆转,但对PI3K活性的抑制却很难。这些发现表明,ECs中KRAS激活突变可能通过MAPK-ERK而不是通过PI3K-AKT通路导致bAVM表型。
Park等利用靶向脑内皮的腺相关病毒-KRAS G12V (AAV-BR1-KRAS G12V)建立了KRAS诱导的散发性bAVM小鼠模型。小鼠经眶后窦注射AAV-BR1-KRAS G12V。经AAV-BR1-KRAS G12V处理的小鼠在诱导后9周均出现1例或多例bAVM,该bAVM模型具有较高的再现性。值得注意的是,这种方法诱导的脑AVM显示出由扩张的血管、供血动脉和引流静脉组成的缠结病灶,模拟了人类脑AVM的形态特征。KRAS G12V诱导的bAVM的形成在发展早期被MEK抑制剂Trametinib(曲美替尼)抑制。然而,尚不清楚曲美替尼是否对已经建立的bAVM有效。
Nguyen等测试了曲美替尼是否可以缓解血管缺损的进展,如血管扩张和局灶性病变的形成。通过建立LoxP-STOP-LoxP-Kras (G12D);Cdh5 (PAC)-CreERT2小鼠[记为iEC-Kras (G12D *)], KRAS在突变小鼠的所有血管内皮细胞中被诱导激活。由于在PN第8天观察到血管缺损,因此在此时间点开始使用曲美替尼治疗。到PN第14天,载药处理的iEC-Kras (G12D∗)小鼠的存活率为21.5%,而曲美替尼处理的iEC-Kras (G12D∗)小鼠在同一时间的存活率为76.9%。此外,曲美替尼处理的iEC-Kras (G12D *)小鼠虽然仍然存在血管缺陷,但比对照物较轻。Park等和Nguyen等均证实曲美替尼对KRAS诱导的AVM小鼠模型具有预防和治疗作用。这些结果表明,曲美替尼可能治疗人类患者的bAVM,强调了临床试验的必要性。
Fraissenon等建立了KRAS G12C驱动血管畸形的两种小鼠模型KRAS G12C- CDH5和KRAS G12C- CAGG,以评估特异性KRAS G12C抑制剂sotorasib的有效性。KRAS G12C-Cdh5小鼠模型进展缓慢,死亡率低,而KRAS G12C-CAGG小鼠模型表现出更严重的表型。突变小鼠的尸检显示,所有突变小鼠都有脑出血,并伴有脑血管畸形。这些小鼠模型的组织学检查证实了脑组织中存在典型的血管畸形,动脉扭曲,毛细血管结构丧失,静脉扩张。接下来,作者研究了sotorasib是否可以减少两种小鼠模型的血管畸形体积。KRAS G12C-Cdh5和KRAS G12C-CAG小鼠在Cre诱导后2天每日口服sotorasib剂量,连续治疗4个月。在KRAS G12C-Cdh5小鼠模型中,sotorasib处理的小鼠未出现脑血管畸形。在KRAS G12C-CAG小鼠模型中,所有给药小鼠在Cre重组后4周死亡。然而,经sotorasib处理的小鼠在他莫昔芬诱导后70天内仍然存活,没有明显的表型。sotorasib治疗小鼠的尸检未发现脑内血管畸形。这些发现表明,sotorasib在KRAS G12C突变的bAVM患者中具有基本原理。
Tu等首先建立了由体细胞BRAF V600E突变引起的散发性bAVM小鼠模型。在纯合子(Brafflox/flox)或杂合子(Brafflox/+)突变小鼠中,立体定向脑内注射AAV-BR1-Cre诱导BRAF V600E在脑ECs中的突变。两种类型的小鼠均可引起bavm,但Braffl/+突变小鼠的bavm基本呈现出一个以生长进展不那么积极和出血率较低为特征的病程,模拟了人类bAVM的特征。值得注意的是,该模型可以精确控制AAV的剂量和注射部位,显示出可以发展各种bAVM表型的优势,包括病变大小和位置,以及出血严重程度。BRAF v600e诱导的bAVM的形成在发育早期被BRAF药物抑制显著抑制。然而,在已经建立的bAVM病变中,治疗效果下降。这些结果可能表明,尽管RAS-MAPK-ERK通路的激活可能对初始异常血管形成至关重要,但一旦形成动静脉分流,随后的AVM生长可能不一定依赖于RAS-MAPK-ERK通路的激活。
在小鼠和斑马鱼模型中,仅在脑ECs中存在体细胞KRAS/BRAF激活突变就足以启动bAVM的形成,这为体细胞KRAS/BRAF激活突变在bAVM病理中起致病作用提供了支持性证据。这些模型模拟了人类bAVM的病理,可以成为阐明散发性bAVM发病机制和开发新的靶向治疗方法的宝贵平台。
散发性bAVM的潜在治疗靶点
贝伐单抗是一种VEGF酪氨酸激酶抑制剂,在一项临床试验中研究了基于血管生成抑制的散发性bAVM 的治疗方法。这是第一项评估贝伐单抗在散发性脑AVM 患者中的安全性和有效性的I期临床试验,主要结局指标是与治疗前磁共振成像相比脑AVM体积的变化(NCT02314377)。虽然在研究期间bAVM体积没有改变,但没有观察到严重的不良事件,包括颅内出血。贝伐单抗治疗耐受性良好,需要进一步的临床试验来评估剂量依赖性疗效。未来将进行2/3期临床试验,以评估贝伐单抗在症状性bAVM患者中的安全性和有效性(NCT06264531)。
在散发性bAVM中发现KRAS突变提示了靶向治疗这一信号通路的潜力。然而,KRAS很难集中在药理学上,因此大多数针对KRAS突变型癌症的治疗都集中在其下游靶点,如MEK. Trametinib,一种FDA批准的MEK抑制剂,在KRAS诱导的bAVM小鼠模型中抑制了bAVM的形成并减轻了已经建立的血管缺陷。一份病例报告描述了在KRAS阳性颅外AVM患者中超说明书使用曲美替尼,在治疗6个月后导致AVM的血流量大幅减少。 NCT04258046是一项2期临床试验,目前正在进行颅内外AVM患者接受曲美替尼治疗。一项试点研究(NCT06098872)目前也在调查曲美替尼在手术未破裂的bAVM中的应用。
FDA批准的BRAF抑制剂Dabrafenib(达拉非尼)也可能是一种很有希望的治疗bAVM的药物。Dabrafenib抑制BRAF v600e诱导的小鼠bAVM形成。一份病例报告描述了在BRAF v600e阳性颅外AVM患者中超说明书使用达拉非尼和曲美替尼,治疗3个月后AVM病变减少。曲美替尼和达非尼联合治疗有可能治疗AVM和癌症。靶向MAPK-ERK通路可能是治疗AVM的一种有希望的方法。然而,颅外AVM是增生性的,而bAVM则不是,这可能会影响bAVM对曲美替尼或达拉非尼的反应。需要进一步的研究来评估曲美替尼和达拉非尼对散发性脑AVM患者的安全性和有效性。
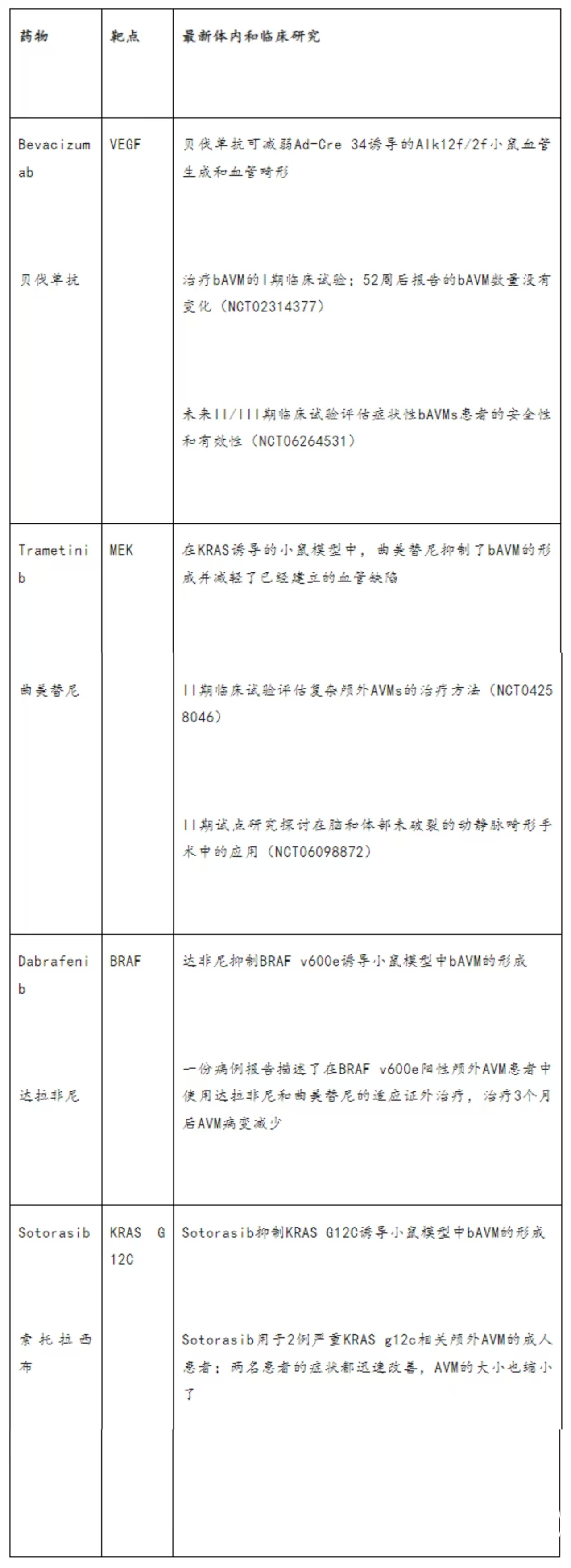
Sotorasib(索托拉西布)是一种特异性KRAS G12C抑制剂,最近已被FDA批准用于治疗KRAS G12C突变的晚期非小细胞肺癌患者。Sotorasib被用于两名患有严重KRAS g12c相关颅外AVM的成人患者。两例患者均迅速改善了症状,AVM大小也缩小了。靶向KRAS G12C似乎是KRAS G12C相关AVMs患者的一种有希望的治疗方法。这项研究揭示了基因检测在血管畸形中提供靶向治疗的重要性。在AVM中,KRAS G12C突变以前仅在1例中检测到。最常见的KRAS突变是KRAS G12V或KRAS G12D突变。尚未有KRAS G12V和KRAS G12D抑制剂被FDA批准,因此需要进一步的研究。表1总结了有前景的新型bAVMs药物。
表1。有前景的治疗散发性脑动静脉畸形的新药物。

未来研究方向
靶向治疗是否可以逆转已经建立的bAVM是有争议的。如果KRAS和MAPK-ERK信号通路的持续活性对于像癌症一样的bAVM的持续是必不可少的,药理抑制这些信号通路可能为散发性bAVM患者带来希望。在KRAS诱导的斑马鱼模型中,MEK抑制可以逆转已经建立的AV分流,并可以缓解已经建立的血管缺陷的进展,提高KRAS诱导的小鼠模型的存活率。这些有希望的结果需要在进一步的研究中得到证实。利用这些动物模型的持续研究可以为散发性脑AVM的病理生理学提供新的见解,并可能有助于开发新的药物治疗方法。
结论
合适的动物模型对于更好地理解KRAS相关途径和临床前测试新的治疗方法至关重要。旨在阐明bAVM发病机制的持续研究将为有效的bAVM治疗开辟新的研究途径,有可能改善患有这种毁灭性疾病的患者的预后。
声明:脑医汇旗下神外资讯、神介资讯、神内资讯、脑医咨询、Ai Brain 所发表内容之知识产权为脑医汇及主办方、原作者等相关权利人所有。




