提示
前言
神经肿瘤是颅内常见病,主要包括神经上皮肿瘤、脑膜瘤、转移瘤及淋巴瘤等。从483期开始将刊发“第二轮神经肿瘤系列”,与同道共享,欢迎大家批评指正和交流讨论。
病史简介
诊治经过
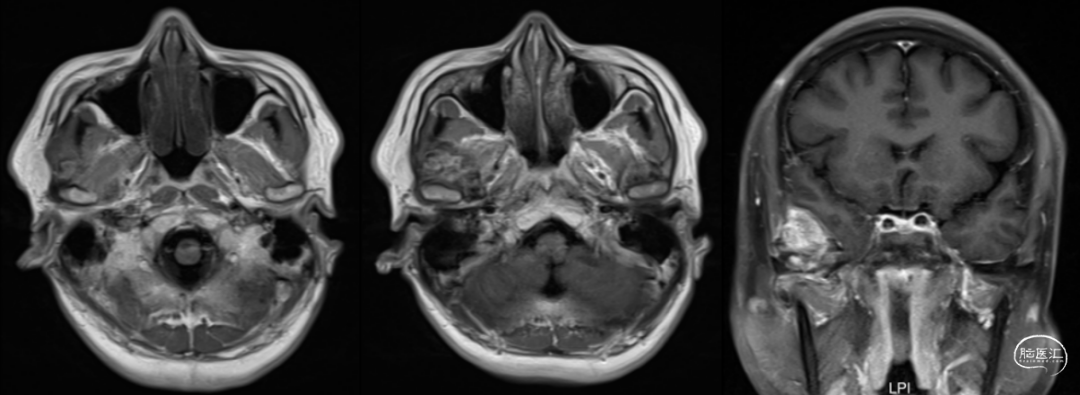
入院后完善常规检验检查,血常规、血生化、肿瘤标记物等无殊。头颅CT(图1)提示右侧颞部一大小约27*25*21mm结节状稍高密度影,边界尚清,邻近颞叶受压,颞骨增生硬化,考虑右侧颞部占位累及颞骨。头颅增强MRI(图2)提示右侧颞部结节状占位,等长T1,混杂T2信号影,DWI未见明显弥散受限,增强扫描明显不均匀强化,邻近颞叶及颞骨骨板受压,右侧颞部脑膜瘤考虑,请结合临床。

图1. 术前头颅CT提示:右侧颞部占位累及颞骨。

图2. 术前MRI提示:右侧颞部见一大小约28×21×23mm(上下×左右×前后径)结节状占位,病灶呈等长T1、混杂T2信号影,DWI未见明显弥散受限,增强扫描明显不均匀性强化,邻近颞叶及颞骨骨板受压;右侧颞部脑膜瘤考虑,请结合临床。
排除手术禁忌后,于全麻下经颞下入路行右侧颞底占位性病变切除术。手术经过简要如下:切开头皮、皮下及颞肌,见肿块穿透颅骨,与颞肌黏连紧密。剥离肿瘤与颞肌黏连后,适当磨开颞骨,见肿瘤位于中颅窝底,灰黄色,质地脆,血供较丰富,与硬膜粘连紧密,硬膜增生明显。刮除颅内病变后,见颅底骨质亦破损,部分病变向颞下窝侵犯。瘤内减容后切除颞下窝病变。术中冰冻提示:(右颞) 见上皮样细胞及多核巨细胞,肉芽肿性病变可能,脑膜瘤不能完全除外。术后常规予预防感染、补液治疗。术后患者恢复可,无神经功能障碍,无颞下颌关节活动异常。术后CT及MRI(图3)复查未见明显肿瘤残留。

病理结果
术后常规病理示:腱鞘滑膜巨细胞瘤伴软骨样化生(图4)。

免疫组化结果:CD34 -,EMA 小灶弱+,H3K27me3 存在,Ki-67 10-20%+,P53 -,S-100 局部+,SMA 局部+,SOX10 -,SSTR2 -,STAT6 -,Vimentin +,PR -,H3.3 G34W -,SATB2 -,H3 K36M(RM193) -,P63 散在+,CD99 部分+,Desmin 散在+,CD1a -,Langerin -,CD68 多核巨细胞+,CD163 部分+。
分子检测结果:USP6基因断裂重排阴性(FISH)。
UCLA病理诊断:腱鞘滑膜巨细胞瘤伴软骨样化生。
详见说明:本病例的临床、组织学和免疫组化特征最支持腱鞘滑膜巨细胞瘤伴软骨样化生,该肿瘤是腱鞘滑膜巨细胞瘤的一种罕见亚型,主要累及颞下颌关节(Hoch 2011, Wang 2019)。腱鞘滑膜巨细胞瘤通常具有CSF1和COL6A3基因融合,导致CSF1的过表达,可通过CSF1显色原位杂交(CISH)检测。最近,具有相似组织学特征,但有其它基因易位(比如FN1)的肿瘤被发现,并提出了一个新的术语“钙化性软骨样间叶肿瘤”(Liu 2021)。目前尚不清楚这两组肿瘤在临床行为和预后方面是否与颞下颌关节的腱鞘巨细胞瘤不同;鉴于此,我们继续使用腱鞘滑膜巨细胞瘤伴软骨样化生来描述具有本例所见的临床、组织学和免疫组化特征的肿瘤,而不考虑分子表现。发生于颞下颌关节处伴有软骨样化生的腱鞘滑膜巨细胞瘤病例偶尔会出现局部复发,转移比较罕见,因此还是需要持续的临床随访。
附录1:
该附录旨在报告外部实验室的分子检测结果。根据报告,本病例鉴定出FN1-TEK基因融合。该基因融合已被描述存在于所谓的“钙化性软骨样间叶性肿瘤”(Liu et al Mod Pathol. 2021 34:1373-1383)。正如最初的最终诊断说明中所指出的,由于钙化性软骨样间叶性肿瘤(CCMN)与腱鞘滑膜巨细胞瘤伴软骨样化生(TGCT)具有相似的组织学特征,因此尚不清楚这些病变是不同的肿瘤还是具有不同基因重排的同一种肿瘤。目前尚不清楚单独的分子发现是否会推动这些肿瘤分类为CCMN或TGCT,也不清楚这两组肿瘤的临床行为和预后是否不同。到目前为止,只有一个临床随访有限的CCMN小系列被描述。考虑到这些,目前,我们仍将该肿瘤归类为腱鞘滑膜巨细胞瘤伴软骨样化生,无论存在何种分子发现。我们建议继续进行临床随访,因为偶尔会出现局部复发,很少有转移性病例的报道。
患者术后常规随访,术后16月复查头颅增强MRI提示未见明显复发征象(图5)。

讨论
根据2020年第5版WHO肿瘤分类,腱鞘巨细胞瘤(Tenosynovial giant cell tumour,TGCT)是一种罕见的局部侵袭性间叶源性肿瘤。它起源于关节、腱鞘和滑囊的滑膜,以滑膜增生和含铁血黄素沉积为特征。根据其生长模式(局限性和弥漫性)和位置(关节内和关节外),这些肿瘤分为两种亚型:局限型TGCT(以前称为腱鞘巨细胞瘤/结节性腱鞘炎)和弥漫型TCGT(以前称为色素沉着绒毛结节性硬化/腱鞘炎/滑膜纤维性黄瘤)。
局限型TGCT好发于指端手足小关节附近,通常起源于小关节及腱鞘的滑膜层,惰性进展,大多数为良性肿瘤,切除之后罕见复发。相比之下,弥漫性TGCT不太常见,通常影响膝关节、髋关节或肩部等大关节,生物学行为上可表现出一定程度的侵袭性,复发较常见,但很少发生转移。特别地,累及颞下颌关节(TMJ)则更为罕见,自1973年Lapayowker的首次报告以来,文献总计报道百余例,所有病例中,有一半发生在40岁至60岁之间,男性略多[1]。
尽管该病曾被认为是反应性炎症,但目前普遍认为存在克隆性异常和自主生长能力,是其肿瘤源性的证据。其组织学上以滑膜细胞增殖为特征,大多数是非肿瘤反应性细胞,只有小部分细胞(2-16%)携带肿瘤相关性基因突变[2]。这些克隆性肿瘤细胞可表现为基因组畸变,可导致集落刺激因子1(CSF 1)基因的3 '端截断。核型异常包括5、7三体和染色体组t(1;2) (p13;q37)特征性易位,可致部分病例发生COL6A3-CSF1基因融合[3]。TGCT中的这些遗传重排导致CSF1 mRNA的局部过表达或更长的存在周期。CSF1通过其受体作用于单核吞噬细胞系的CSF1R表达细胞,导致酪氨酸激酶Src的第二信使活化和破骨细胞生成失调。此外,CSF1过表达可通过旁分泌“景观”效应募集非肿瘤性慢性炎症细胞如单核和多核破骨巨细胞[4-6]。然而,通过细胞遗传学或分子遗传学分析检测CSF1重排既不能用于诊断,也没有预测价值。TGCT依赖组织病理学进行确诊,特别是在影像学或临床表现不一致的情况下,具有重要意义[2]。典型病变主要由实性片状的单核滑膜样细胞组成,常见排列成绒毛状、假腺样或裂隙状,背景中常见多少不等的破骨样巨细胞、泡沫细胞、淋巴浆细胞浸润以及含铁血黄素沉积,细胞之间常见丰富的胶原性基质。而在软骨样亚型中,可见不同程度的软骨样化生[7]。Oda[8]指出,TGCT合并软骨样化生是罕见的。然而,最近的文献表明,TMJ的TGCT对软骨样化生有独特的偏好[9,10]。
累及TMJ的弥漫性TGCT的常见临床症状包括:颞下颌关节疼痛、耳前肿块、关节异响和闭锁、耳闷和耳鸣[10]。病灶可局限于关节内,但由于肿瘤的侵袭性,常常突破关节囊,向前内进入颞下窝、翼腭窝,向上破坏颞骨关节窝侵犯颅底甚至进入颅内,向后侵犯外耳道,向外侵犯腮腺咬肌区等[11]。有研究表明,约有2/3的病例中存在侵入中颅窝的表现[12]。CT影像上肿瘤多表现为边界不清的关节区肿块,可增强,常伴有溶解性关节旁病变伴不规则骨缘和中央钙化区,骨质破坏包括髁突、颅底[9,13]。影像检查和监测的金标准是MRI[13]。MRI不仅能显示肿物本身,而且能显示其对邻近软、硬组织的侵犯程度,在制定治疗计划和病变精确定位方面具有重要作用。含铁血黄素沉积而产生的泛磁效应致使在T1和T2加权像上均呈现较低信号影像,可作一种特征性改变。由于肿瘤成分的复杂性,影像学表现呈多样性,这可能与组织中含铁血黄素含量及其他成分的不同有关。
由于颞下颌关节弥漫性TGCT很少见,其症状和体征也具有特异性,该病的初步诊断对临床医生来说无疑是个挑战。鉴别诊断应考虑包括骨关节炎改变、成软骨细胞瘤、软骨肉瘤、动脉瘤性骨囊肿、横纹肌肉瘤、浆细胞瘤、胆脂瘤、骨内脑膜瘤、巨细胞修复性肉芽肿、焦磷酸钙沉积病和转移瘤。
弥漫性TGCT的最佳治疗策略尚不明确。颞下颌关节弥漫性TGCT的治疗手段主要为手术彻底切除病变组织,包括肿物、受累的滑膜、关节囊及相关骨结构。对有颅底破坏者,开颅探查以彻底切除病变,根据缺损情况考虑关节重建。因为生长模式多变,肿瘤可能累及面神经、迷路、三叉神经或颈内动脉岩骨段。对于外耳道前部的病例,颞下颅中窝入路伴或不伴颧弓截骨均可提供足够的手术通路。如果疾病侵犯外耳道、中耳和乳突,可以采用乳突-颅中窝联合入路或颞下窝入路[9]。然而,颞下颌关节的弥漫性TGCT累及相邻滑膜间隙,并扩展至邻近结构,通常很难获得完全切除[14]。鉴于疾病的局部侵袭性,当完全切除存在困难或高风险时,建议进行次全切除辅以术后放疗[15]。尽管研究发现次全切除术后联合放射治疗后,没有出现疾病进展的报道,但这些治疗组的规模很小,放疗的作用仍有待于进一步评估[1]。一项综述研究表明,随访12个月以上的复发率为9.52%,检测到复发所需的最早、平均和最长随访时间分别为15个月、34.5个月和60个月。侵犯中颅窝与复发无显著相关性(P=0.295)。因此,颞下颌关节弥漫性TGCT患者术后应每年随访,至少5年,以评估复发情况[1]。临床试验研究表明,对于不适合手术治疗或复发性TGCT患者,CSF-1R抑制剂如Pimicotinib(ABSK021)和PLX3397(Pexidartinib)可能是一种有前景的治疗选择,其具有抗肿瘤效应,能使肿瘤体积明显缩小,最终改善患者的功能预后[5,16]。但在治疗浓度下,该类靶向治疗药物可能带来潜在的副作用,包括疲劳、腹泻、贫血、低钠血症、转氨酶水平升高和中性粒细胞减少症,也需要临床关注[5,16]。因此,靶向治疗在TGCT治疗中的安全性和有效性仍需要进一步评估。
参考文献
往期回顾
声明:脑医汇旗下神外资讯、神介资讯、神内资讯、脑医咨询、Ai Brain 所发表内容之知识产权为脑医汇及主办方、原作者等相关权利人所有。







