本文为耶鲁大学医学院精神病学系 Kangjoo Lee 教授一作兼通讯作者发表于 PLOS Biology 的工作,题为“Human brain state dynamics are highly reproducible and associated with neural and behavioral features”。DOI:10.1371/journal.pbio.3002808。
Abstract
神经活动和行为在个体内(状态)和个体之(特质)存在差异。然而,状态-特质神经变异与行为之间的映射关系尚未得到充分理解。为了填补这一空白,我们量化了基于静息态功能磁共振成像的全脑共激活模式的瞬时变化。在健康年轻成年人中,我们在单个受试者水平上识别了共激活模式的可重复时空特征。我们证明,通过联合分析状态-特质神经变异和特征降维,可以揭示个体差异的一般模式,这些模式包括具有日常变异性的状态特异性神经特征和一般神经特征。主要的神经变异与行为表型的主要变异共变,涉及认知功能、情绪调节、酒精和物质滥用等方面。个体占据特定共激活模式的概率是可重复的,并且与神经和行为特征相关。这种对状态-特质变异的联合分析为开发可重复的个体生活功能结果的神经影像标记物提供了希望。
Introduction
功能磁共振成像(fMRI)领域一直试图描述人类大脑的功能组织及其与个体差异的关系。这些新兴方法可以识别神经特质(即特定于个体的)或状态(即随时间在个体内变化)的低维表征,这些表征可能预测行为表型。这一不断增长的研究表明,fMRI在表征复杂神经信号如何映射到人类行为变异方面具有巨大潜力。
静息状态下测量的脑活动自发波动(即静息态功能性磁共振成像,rs-fMRI)在时间和空间上具有丰富的时空信息,这些信息在个体内(状态)和个体间(特质)存在差异。然而,状态-特质rs-fMRI信号变化的联合特性仍然知之甚少,构成一个关键的知识空白。个体在rs-fMRI扫描时的心理状态可能受到许多内在(如代谢)或外在(如药物)因素的影响,这些因素直接影响复杂行为的神经回路激活。另一方面,可能还有其他维度导致大型神经影像数据集的变异性,并削弱其识别清晰脑-行为关系的能力。其中一个维度可能是时间变化的信号动态。例如,人格理论认为,特质被定义为在个体内部跨相似而个体间不同情境的思维、情感和行为模式,而行为状态则反映随时间和情境变化的模式。
历史上,rs-fMRI研究通过量化神经特质(例如,表征个体的静态功能连接)来研究它们如何在不同人群中与特定行为特质(如流体智力或一组临床症状)相关。神经状态动态或时间变化的rs-fMRI连接分析可用于理解个体差异。评估神经活动的瞬时变化可以提供与工作记忆中的任务切换和决策相关的潜在脑状态信息。通过对多个认知任务的任务fMRI数据进行降维,Shine及其同事提出,执行多样化认知任务和个体在流体智力上的差异可以通过全局脑活动的低维流形上的动态流动来描述。关于自发脑动态的状态和特质变异如何映射到复杂行为表型的个体变异,仍存在知识空白。
最近一项对3个大型联盟数据集(总计N = 38,863)的荟萃分析表明,使用数千个个体的数据,将结构MRI、rs-fMRI和任务fMRI激活的神经测量与包括认知能力或精神病理学在内的行为测量相关联时,在一般人群中,脑-行为关联的效应量较小(|r| < 0.2)。虽然大样本量对于发现和复制平均意义上的小的脑-行为关系至关重要,但这些最新进展留下了一个开放性问题,即可能存在强脑-行为效应,这些效应可以通过考虑时间变化信号动态的定量方法来观察。尽管如此,状态相关的定量方法在fMRI中的应用仍然未被充分利用,以表征可重复的脑-行为关系中的个体间差异。此外,结合rs-fMRI信号中的状态和特质信息可能提供关于个体脑-行为关联的收敛信息。为此,我们测试了以下假设:通过量化全脑时间变化的rs-fMRI信号中的状态和特质信息,可以实现可重复的神经-行为映射。
一种捕捉特质和状态神经特征的方法是分析rs-fMRI的共激活模式(CAP)。该分析侧重于每个时间点全脑血氧水平依赖(BOLD)信号的瞬时变化,提供了一种量化跨人群的共激活空间模式和神经时间组织模式个体差异的方法。几项研究报告了健康成年人类似的平均CAP模式,这些模式也显示出一些显著的性别差异,并受到处理任务条件的影响。CAP的空间和时间组织改变(例如,某个CAP状态占据的时间帧数)在不同意识水平]、精神分裂症、临床前精神病、抑郁症和双相情感障碍中被发现。所有这些研究都通过选择与预选(即种子)区域中高振幅信号相关的小部分时间点,表征患者和健康对照组之间的组水平效应,通常捕捉了脑动态的简约快照。虽然这些研究提供了CAP包含丰富信息的见解,但它们系统地忽略了BOLD波动的全部范围。换句话说,很少有研究利用整个BOLD信号范围来定义CAP。此外,据我们所知,尚未有研究调查利用整个BOLD信号波动范围的可重复CAP集合的个体内和个体间变异特性。最后,尚未有研究量化CAP特性的个体差异如何映射到复杂行为。
在这里,我们测试了以下假设:存在一个反映状态和特质脑动态的可重复CAP特征集,并且该特征集与多个行为领域的个体表型相关。为了解决这个问题,我们研究了来自337名健康年轻成人的rs-fMRI和行为数据,这些数据来自个体人类连接组计划(HCP)S1200数据集。为了优化解释CAP在个体内和个体间变异的神经特征,我们开发了一个基于CAP瞬时变化的状态-特质脑动态三轴模型。我们识别了3个可在单个体水平上量化的可重复CAP,展示了静息态网络空间轮廓的反复快照和个体特定的时间轮廓。通过分析CAP模式的时空状态-特质动态,数据揭示了始终表现出行为相关CAP特征的个体组。这些结果表明,开发可重复的脑-行为模型的关键步骤可能涉及初步映射能够稳健且可重复地捕捉神经特征中特质(个体间变异)和状态(个体内变异)联合变异的神经特征。
Materials and methods
Human Connectome Project (HCP) data set
参与者从华盛顿大学及其周边地区招募。我们从HCP S1200版本中选择了没有家庭关系的参与者,最终共有337名参与者纳入我们的分析。数据集中包含180名女性和157名男性的静息态fMRI数据,年龄范围为22至37岁(平均年龄=28.6,标准差=3.7),90%为右利手。全脑平面回波成像数据使用32通道头线圈在华盛顿大学改进的3T Siemens Skyra(Connectome Skyra)上采集,时间重复(TR)=720 毫秒,回波时间(TE)=33.1 毫秒,翻转角=52,带宽=2,290 Hz/像素,平面内视野(FOV)=208×180 毫米,72层,2.0毫米各向同性体素,多带加速因子为8。静息态fMRI血氧水平依赖(BOLD)图像在两天内采集。每天采集2次(每次14.5分钟)静息态fMRI,相位编码方向相反(左/右和右/左)。受试者被指示保持眼睛睁开并注视十字准线。基于任务成像数据也被采集,但未在本研究中使用。结构MRI使用以下参数采集:T1加权(0.7 毫米各向同性分辨率,TR=2400 毫秒,TE=2.14 毫秒,翻转角=8,平面内视野=224×224)和T2加权(0.7 毫米各向同性分辨率,TR=3200 毫秒,TE=565 毫秒,可变翻转角,平面内视野=224×224)。
Data preprocessing
我们按照HCP联盟提出的步骤对静息态fMRI进行预处理:(i)根据先前文献概述的“最小预处理”流程,包括强度归一化、相位编码方向解扭曲、运动校正和空间归一化到标准模板MSMAII,角度偏差惩罚(ADP);(ii)高通滤波(0.009 Hz);(iii)ICA-FIX用于去除伪影。接下来,每次扫描的“最小预处理”静息态fMRI以连接信息学技术倡议(CIFTI)文件格式表示,该格式结合了皮层表面数据和皮层下灰质位置(即“灰质坐标(grayordinates)”)的体积数据。使用Workbench v1.2.3和Matlab 2014b进行额外分析,使用定量神经影像环境和工具箱(QuNex)。
先前专注于CAP分析的研究表明,CAP属性在体素和区域水平上是一致的。为了在低维空间中分析CAP并减少将每个3D时间帧都纳入聚类过程的CAP分析的计算负担,我们应用了Cole-Anticevic脑网络分割(CAB-NP)分区。CAB-NP分区包括(i)180个双侧皮层分区(左右半球共360个),与人类连接组计划的多模态分区(MMP1.0)一致;以及(ii)358个皮层下分区,使用静息态功能BOLD协变与皮层网络解决方案定义。为了去除每次扫描开始/结束时的潜在伪影,每次静息态fMRI扫描的前100帧被去除。为了归一化每次扫描的静息态fMRI数据,每次时间序列的均值被去除。随后,静息态fMRI BOLD扫描按采集顺序连接(静息态fMRI扫描2-1-4-3,先右/左,后左/右),结果为每个受试者产生4000×718静息态fMRI数据数组。
CAP analysis
我们识别了全脑静息态fMRI BOLD信号在每个时间点的瞬时变化,并量化了跨个体的共激活空间模式(CAP)以及CAP时间组织的个体差异。本研究中提出的分析框架在 S1 Fig 中描述,并使用Python 3.6.15在耶鲁大学高性能计算资源上实现。在每次置换中,N=337名受试者被随机分为2个大小相等不重叠的受试者,每组n=168名。我们使用随机对分半割重采样策略有几个原因。首先,将整个样本的连接时间序列应用一次K-means聚类会导致每个受试者的神经测量值为单一值。使用这种简单的方法,无法量化来自不同样本群体的连接时间序列的CAP测量的个体可靠性。我们的方法允许估计每个受试者的神经测量的统计可重复性,当受试者被包含在不同的样本群体中时,从而减少潜在的抽样偏差。此外,我们可以使用相同的对分半割重采样方案进行神经行为关联分析的交叉验证,通过从对分半割1数据训练神经行为模型并在剩余的对分半割2数据上测试模型。
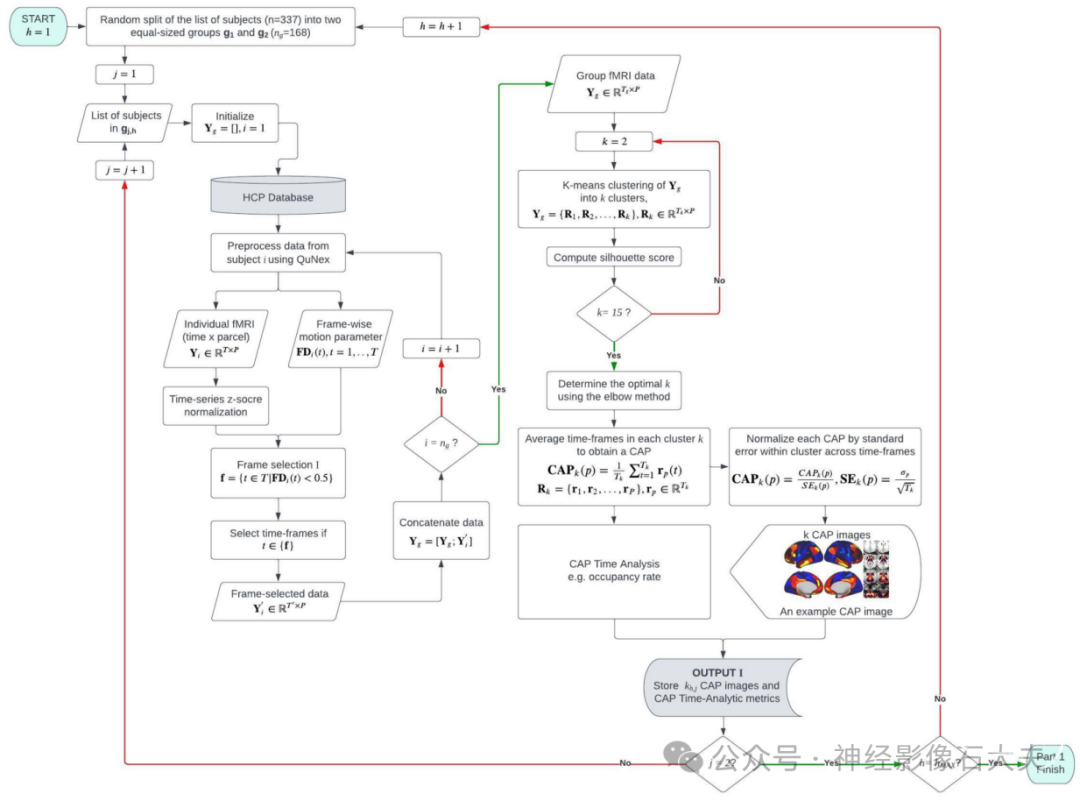
在每个数据分割中,预处理的静息态fMRI数据的4000×718数组在受试者之间进行时间连接。使用Python中的sci-kit-learn 1.3.2对每个分割数据执行以下步骤。(i)去除过度运动的时间帧(帧位移>0.5 mm)。HCP最小预处理流程包括运动校正;因此,我们避免使用过于保守的运动去除阈值,并在分析中保留尽可能多的潜在有用帧。(ii)剩余的时间帧基于空间相似性使用K-means聚类算法进行聚类,使用Lloyd算法,聚类数(k)从2到15变化。(iii)估计最佳聚类数k。(iv)使用最佳聚类数k的K-means解决方案,通过在每个聚类内对时间帧进行分区平均来定义CAP,CAP定义为聚类质心。
为了找到最佳聚类数,我们使用了一种考虑聚类数和聚类内相似性之间权衡的方法(例如,轮廓标准)。我们观察到,随着k的增加,轮廓分数单调递减(S2 Fig),与Yang及其同事的研究一致。在我们的研究中,为了确定最佳聚类数,我们将聚类数(k)从2到15变化。对于每个k,K-means聚类使用k-means++算法初始化,通过基于点的整体惯性贡献的经验概率分布选择随机生成的质心。惯性定义为样本到其最近聚类中心的平方距离之和。单次运行的最大迭代次数设置为1000,以避免算法在完全收敛之前停止。使用每个k估计K-means解决方案的轮廓系数。最后,通过应用肘部方法对估计的轮廓分数确定最佳聚类数k。肘点定义为当我们观察到随着k增加,轮廓分数递减率显著变化时,使用Python的kneed包中的KneeLocator类进行分析。
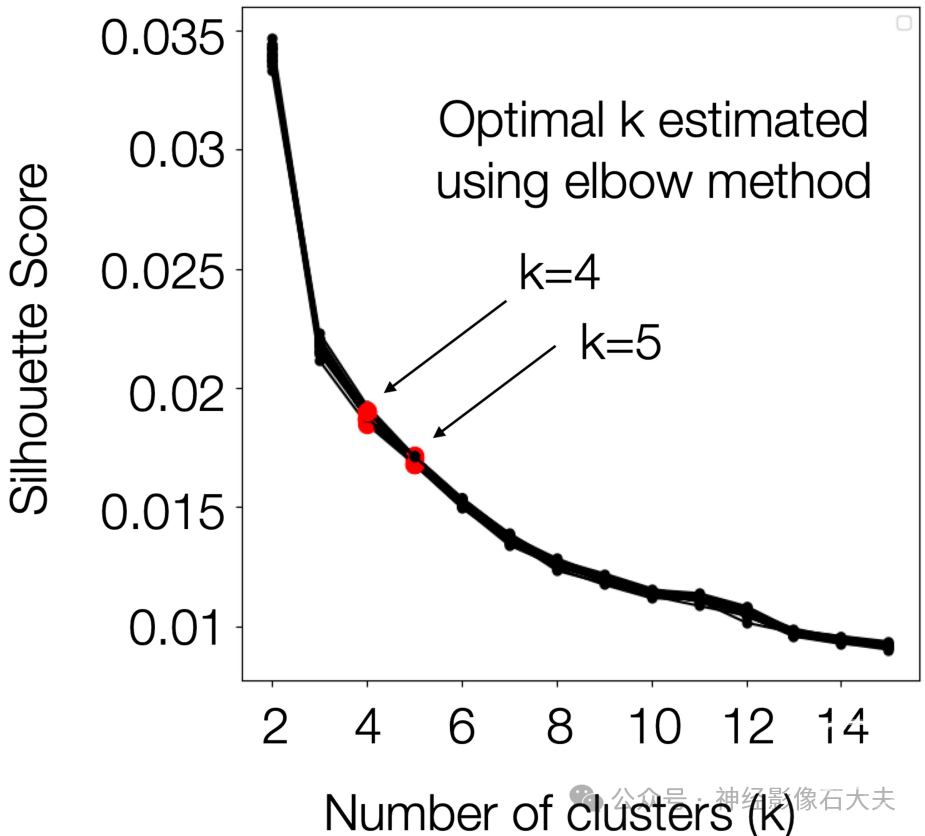
S2 Fig. Quality of the K means clustering solution in CAP analysis. Silhouette scores were estimated across different numbers of clusters (k) from the K-means clustering solution from a split data. Results from 10 permutations (2 split-halves in each permutation) are shown. Optimal k values were estimated using the elbow method for the Silhouette scores and are highlighted in red.
Basis CAP generation
k=a解决方案的出现率(%)通过导致a个聚类的置换数除以总置换数(1,000)计算。k=a解决方案在两次对半分割中的共现率(%)通过导致相同聚类数的置换数除以总置换数确定。参见 S4 Fig 中的程序图第(1)部分。
使用导致相同聚类数(k=a)的置换估计的CAP的凝聚分层聚类可以获得一组基础CAP,如下所示。对于每个对半分割,首先表示hMAX/1,000排列导致k=a解决方案。(1)我们收集k CAP(P×k)并在hMAX置换中连接它们,生成一个(P × khMAX)数组,其中P是分区数。(2)对该数组应用凝聚分层聚类,基于空间相似性识别^k聚类。(3)在每个聚类中,对分配到同一聚类的CAP的分区共激活值进行平均,生成平均(基础)CAP。(4)每个基础CAP的分区值使用全脑分区的均值和标准差归一化为Z分数。对所有k聚类重复步骤(3)和(4),生成k基础CAP。参见S2 Fig中的程序图第(2)部分。
 S4 Fig. Generation of basis CAP sets.
S4 Fig. Generation of basis CAP sets.
Individual preference for a specific CAP
CAP出现的概率,可以解释为个体对特定CAP的概率偏好,通过检查导致特定解决方案k的置换数来量化。为此,我们比较了涉及感兴趣的CAP的k CAP的出现概率和不涉及感兴趣的CAP的k-1 CAP的出现概率,假设k CAP的空间拓扑在置换中可重复估计类似于比较完整和简化模型的方法。具体来说,在1000次对半分割置换中,受试者在p1置换中涉及对半分割1数据,在对半分割2数据中p2=1,000–p1。然后,当仅考虑这些p1置换中的对半分割1数据时,我们可以计算导致k的置换数和导致k-1的置换数。在每个对半分割中,对于每个受试者,我们计算(k CAP的出现)减去(k-1 CAP的出现)以量化个体对特定CAP的偏好。为了将这些与行为变量(归一化)关联,我们使用Z变换对个体特定CAP的概率偏好进行归一化。
Quantification of neural measures and the impact of motion
分数占用率((FO(s, i)))定义为受试者s每天在CAP状态i中花费的时间帧总数(#TR),用受试者s每天在任何CAP状态中花费的时间帧总数进行归一化。驻留时间((DT(s, i, c)))定义为受试者s每天在相同CAP状态i中连续时间帧的数量(#TR)。驻留时间的受试者内均值和方差,Mean DT(s, i))和Var DT(s, i),计算为受试者s每天所有连续时间段的驻留时间的均值和标准差。这些CAP测量值在每次置换中为每个对半分割数据和每天分别估计。需要注意的是,在计算这些CAP测量值之前,去除头动过大的时间帧(FD>0.5 mm)。头动去除有助于最小化头动对CAP和CAP衍生测量的有害影响,但它可能影响这些CAP测量的量化。虽然头动相关时间帧期间的CAP状态未知,因为头动去除在CAP识别之前执行,但如果头动前后时间帧占据相同的CAP状态,它们将被合并为单个连续段。例如,如果一致的CAP状态(例如,[I,I,I],真实DT=3)被高头动容积M中断(例如,[I,M,I]),估计的DT将比真实值短([I,I],估计DT=2)。相反,如果头动期间的CAP状态与运动前后不同([I,II,I],每个三个段的真实DT=1),则在去除后合并分割[I,I],导致DT=2。为了验证我们的发现不受此影响,我们调查了头动量(去除的时间帧数)和头动持续时间(连续头动过大的时间帧数)。我们识别了fMRI时间序列涉及相对高头动的受试者,导致去除超过总时间帧的5%,排除这些受试者,并重复整个分析。
Neural dimension reduction
为了识别状态-特质神经特征空间的主要几何形状,为每个个体估计30个神经特征:3个神经测量值(FO,平均DT和方差DT)×5个CAP(I+,I-,II+,II-和III)×2天。这些神经特征在受试者之间收集以创建受试者×特征矩阵。对该受试者×特征矩阵执行两个分析。首先,使用scikit-learn 1.3.2对特征矩阵应用凝聚分层聚类。使用Ward链接标准和欧几里得度量来最小化被合并的聚类的方差。使用树状图中最终合并的距离截止值的70%确定聚类数。其次,对该受试者×特征矩阵应用PCA以估计识别亚组的状态-特质特征空间的主要几何形状。
Behavioral data analysis
使用先前文献中描述的方法进行行为数据分析。我们对来自HCP S1200无限制和限制行为数据的15个行为域的262个变量进行PCA(S14 Fig)。本分析中使用的行为变量名称和相应域与HCP数据字典中为S1200数据发布提供的变量名称相同。当年龄校正和未校正的数据都可用时,我们仅使用年龄校正的数据。为了研究第一个行为PC的个体得分与前3个神经PC的个体得分之间的关联,我们使用多元线性回归模型(behavioral PC1 ~ neural PC1 + neural PC2 + neural PC3 + age + sex)。通过计算偏R²、回归系数β和标准差(SE)来评估神经PC与行为PC1的关联。通过计算相应的t分数确定回归系数的显著性。偏R²定义为在引入感兴趣变量后,平方和的减少比例。使用Python 3.6.15和R Studio v.2022.12.0进行可视化和统计分析。
Results
Three brain co-activation patterns are reproducibily found in healthy subjects at rest
对共激活模式(CAP)的逐时刻变化分析假设每个fMRI时间帧对应一个单一的神经状态(即CAP状态),并通过fMRI时间帧的空间聚类识别出一组在时间和受试者之间重复出现的CAP。
我们从337名健康年轻成年人(年龄22至37岁,180名女性)的4次rs-fMRI数据(每次15分钟)中,使用随机对半分割重采样策略(1,000次置换)识别出一组可重复的CAP。在这里,我们使用了整个BOLD信号波动范围进行CAP估计,没有进行稀疏时间点采样。在每次置换中,我们将样本(N = 337)随机分为两组,每组包含相同数量的非重叠受试者(n = 168,随机排除一个受试者)(Figs 1A and S1)。为了在低维空间中分析CAP并减少将每个3D时间帧都纳入聚类过程的CAP分析的计算负担(例如,每个受试者有4000个时间帧),我们使用了Cole-Anticevic脑网络分区(CAB-NP),该分区包含718个皮层表面和皮层下体积分区。我们对属于每个分区的体素中的预处理BOLD信号进行平均。因此,在每个对半分割中,个体rs-fMRI数据的4000 x 718数组在受试者之间进行时间拼接。时间帧基于空间相似性使用K-means聚类进行聚类,其中每个对半分割的聚类数量(k)通过肘部法估计,k从2到15变化(见S2 Fig 中K-means聚类的估计轮廓分数)。最后,通过将每个聚类中的时间帧相对于每个分区进行平均,得到一个CAP。

Fig 1. A reproducible set of CAPs in the whole-brain rs-fMRI involve recurring mixed representations of canonical resting-state networks. (A) Analysis overview. In each permutation, 337 subjects are randomly split into 2 equal-sized groups. Within each split, a parcel-by-time array of rs-fMRI data is temporally concatenated across subjects. Time frames are clustered based on spatial similarity using K-means clustering. The number of clusters (k) is estimated for each split. Each CAP is obtained as the centroid of each cluster (S1 Fig). (B) Individual’s statistical preference toward a specific number of CAPs (k) is reproducible. In each split, an individual’s preference toward a specific number was quantified using the number of permutations that resulted in a specific solution (e.g., 4 CAPs or 5 CAPs) across 1,000 permutations. Specifically, we compute the difference (occurrence of k = 5)—(occurrence of k = 4) for each subject (Methods). (C) Spatial correlation of the 5-CAP basis set (left) and between the 4-CAP basis set and the 5-CAP basis set (right). r values were rounded to the nearest 2 decimal digits. (D) CAB-NP. (E) Spatial topography of 5 basis CAPs. (F) Spatial similarity of the 5 basis CAPs to canonical resting-state networks, predefined using the CAB-NP parcellation in (D). CAB-NP, Cole-Anticevic Brain Network Parcellation; CAP, co-activation pattern; rsfMRI, resting state functional Magnetic Resonance Imaging.
我们首先发现,可重复的大脑状态数量存在个体差异。具体来说,在两个对半分割中,估计的CAP数量为4或5,每种情况在置换中的出现率约为50%(S3A and S3B Fig)。然而,有趣的是,两个对半分割中出现相同数量的CAP的情况很少(<6%)(S3C Fig)。换句话说,一半的样本产生了5个CAP,而另一半产生了4个CAP。
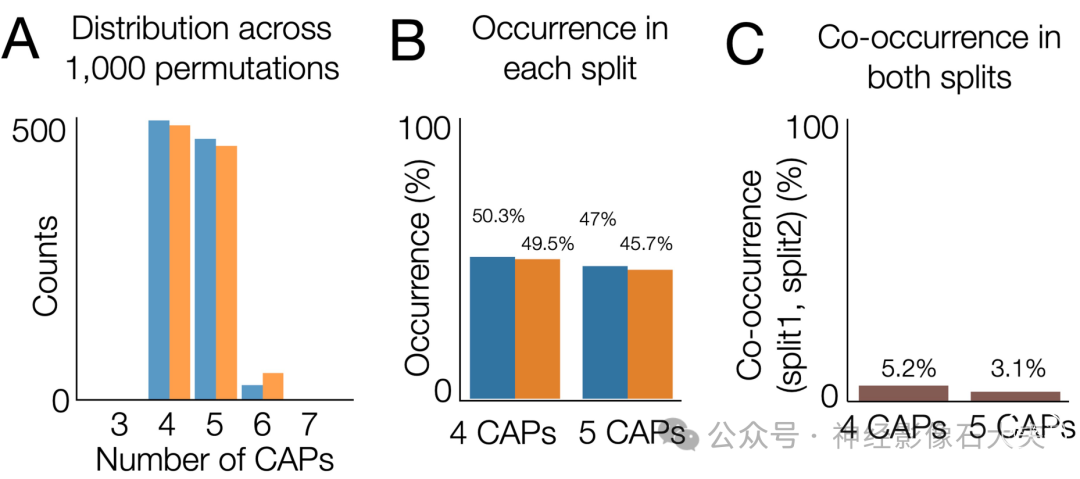
S3 Fig. Occurrence of CAPs across permutations.(A) The estimated number of CAPs (k) in each split across 1,000 permutations. (B) Occurrence rate (%) of k = 4 or k = 5 solutions in each split. (C) Co-occurrence rate (%) of k = 4 or k = 5 solutions in both splits.
由于每个非重叠对半分割包含不同的样本子集,我们假设可重复大脑状态数量的个体差异在观察到的对半分割差异中起作用。为了验证这一假设,我们通过比较估计4个CAP或5个CAP的概率,量化了个体对特定数量CAP的偏好。估计k个CAP的概率通过在一个对半分割中k解估计的出现次数来量化(见 Methods)。确实,个体受试者倾向于占据4个或5个CAP的趋势高度可重复(Fig 1B)。这些结果表明,存在一个在部分受试者中可重复发现但在其他受试者中不存在的CAP状态。
为了识别CAP可重复空间拓扑以进一步分析,我们独立生成了两组基础CAP:4-CAP和5-CAP基础集(S4 Fig)。4-CAP基础集通过仅对产生4-CAP解的置换中的CAP进行凝聚分层聚类得到。然后,通过平均属于每个聚类的CAP生成一个基础CAP,并使用718个分区的均值和标准差对基础CAP中每个分区的值进行z-score标准化(S4 Fig)。5-CAP基础集也通过产生5-CAP解的置换中的CAP得到。我们发现,4-CAP基础集由两对反相关的CAP(I+和I-,II+和II-)组成,而5-CAP基础集由相同的两对反相关CAPs和一个额外的CAP(III)组成(Fig 1C)。这些基础CAP的模式在两个对半分割数据集之间一致(S5 Fig)。CAP的编号(I、II和III)和符号(+和-)是任意标记的。总体而言,我们在rs-fMRI中发现了3个在健康受试者中重复出现的CAP。
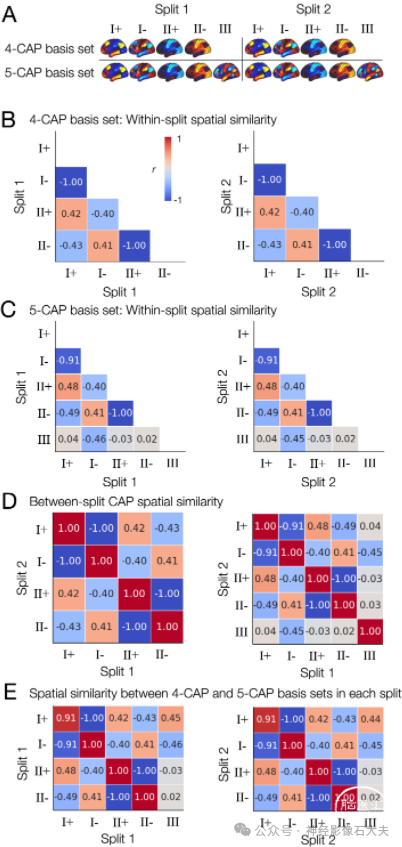
S5 Fig. Spatial patterns of the basis CAPs are distinct to each other and reproducible using the proposed shuffled split-half analysis. (A) Spatial patterns of the basis CAPs in each split-half data. The 4-CAP basis set and the 5-CAP basis set were generated independently from the same split-half data, using the hierarchical clustering across 1,000 shuffled split-half resampling, as described in S2 Fig. (B) Spatial similarity (r, correlation coefficient) of the 4-CAP basis set within the split 1 data (left) and within the split 2 data (right). r values were rounded to the nearest 2 decimal digits for visualization. (C) Spatial similarity of the 5-CAP basis set within the split 1 data (left) and within the split 2 data (right). (D) Spatial similarity of the 4-CAP basis set between the split 1 and 2 data (left) and of the 5-CAP basis set between the split 1 and 2 data (right). (E) Spatial similarity between the 4-CAP basis set and the 5-CAP basis set within the split 1 data (left) and within the split 2 data (right).
Patterns of whole-brain co-activation are recurrent snapshots of mixed resting-state networks
正如预期的那样,3个CAP的空间模式与已知的rs-fMRI网络相关(Fig 1E and 1F)。CAP I涉及默认模式和额顶网络与背侧注意、扣带-岛盖、躯体运动和次级视觉网络之间的强双极性。这里的双极性指的是每个CAP与不同静息态网络的正负余弦相似性(CAP+与CAP-)。CAP II表现出初级视觉、眶额-情感、默认模式和额顶网络与背侧注意、躯体运动和次级视觉网络之间的较弱双极性。CAP III显示出默认模式、躯体运动和次级视觉网络与额顶、背侧注意和扣带-盖网络之间的强双极性。考虑到静息态网络是基于分布式大脑区域信号的共波动识别的,我们的结果表明,这些CAP代表了不同功能网络区域之间在每个时间帧上多样信号共波动的重复快照。
CAP III is reproducibly found in some individuals but not in others
Fig 1B 中的结果表明,可重复大脑状态的数量存在个体差异。由于CAP是使用一组受试者的数据估计的,单个受试者对此估计的贡献相对较小。此外,尚不清楚估计的CAP的空间拓扑是否在置换之间可重复。为了解决这些问题,我们研究了三个问题:(i)当从一个对半分割数据中估计出4个CAP时,它们的空间模式在置换之间是否可重复;(ii)当从一个对半分割数据中估计出5个CAP时,它们的空间模式在置换之间是否可重复;(iii)与5-CAP解相比,4-CAP解中是否有一个特定的CAP状态可重复地缺失。所有718个皮层和皮层下分区都包含在此分析中。
首先,我们计算了从每个对半分割数据估计的CAP(估计CAP;ECi,i = 1,…,4或5)与给定基础CAP(基础CAP;BC)之间的空间相关值(r(ECi, BCj))的边际分布(Fig 2A)。请注意,这些预定义的基础CAP是通过对所有置换中的CAP进行凝聚分层聚类得到的组平均和置换平均CAP(Fig 1E)。在每次置换中,每个ECi根据与给定基础CAP的最大秩相关进行标记。结果,r值的边际分布显示,4-CAP解和5-CAP解的空间模式高度可重复(S6 Fig)。从每个对半分割估计的CAP与至少一个基础CAP高度相关,展示了所有CAP的一对一匹配。此外,CAP III在一个对半分割中可重复发现,但在另一个中不存在(Figs 2 and S7)。这一分析表明,CAP III的存在或缺失不是随机伪影,而是与个体的可重复神经动态相关。
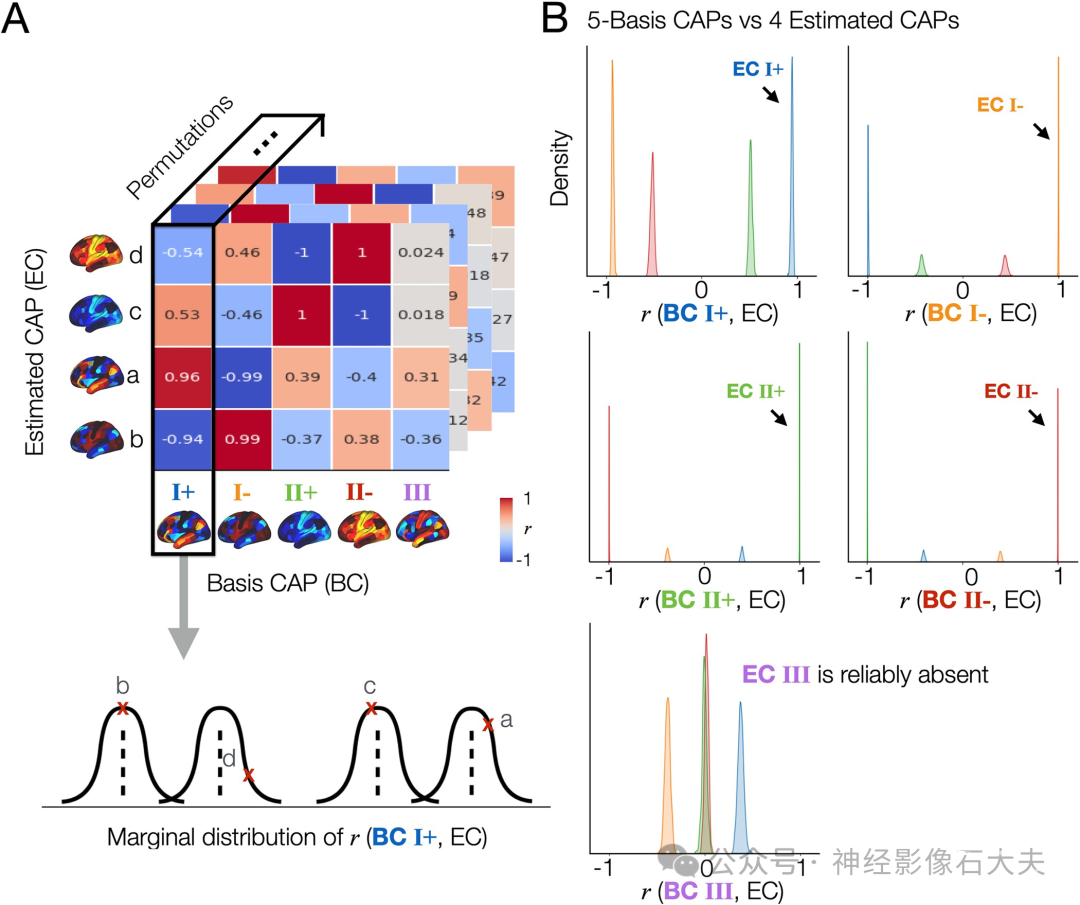
Fig 2. The spatial patterns of the CAPs estimated across split-half permutations are reproducible, demonstrating the consistent absence of a specific spatial pattern (CAP III) in one split but not in another split across permutations. (A) Proof of concept. In this figure, we demonstrate “whenever 4 CAPs are estimated from a split data, are their spatial patterns reproducible across the permutations,” and “if there is a specific CAP state that is reproducibly missing in 4-CAP solutions when compared to the 5-CAP solutions.” To address these, first, among 1,000 permutations, we only take permutations that resulted in 4-CAP solutions using the elbow method, which was 502 permutations in this data. The remaining 498 permutations mostly resulted in 5-CAP solutions, and rarely 6- or 7-CAP solutions as shown in (S3 Fig). Spatial similarity (r, correlation coefficient) is computed between each of the estimated CAPs (EC; denoted as a, b, c, and d) and a given basis CAP (BC). In this example, we select BC 1 from the 5-CAP basis set. r values were rounded to the nearest 2 decimal digits for visualization. Finally, we obtain the marginal distribution of r values between BC 1 and the estimated CAPs across 502 permutations. (B) The CAP III is reproducibly found in the 5-CAP solutions and not in the 4-CAP solutions across permutations. We repeated the spatial similarity analysis for the 4 CAPs estimated from each split-half data, when compared to the 5-CAP basis set. In each permutation, each estimated CAP was labeled according to the maximum rank correlation with the basis CAPs. Data-points (r-values) estimated from the CAPs with a same label were coded using the same color. The marginal distributions of r between all estimated CAPs and each BC from the 5-CAP basis set are illustrated using kernel density estimation. Results obtained from the split 1 data are shown in (B) and replicated in the split 2 data (see S7 Fig). Note that all 718 cortical and subcortical parcels were included in this analysis. For simplicity, subcortical regions of CAPs are not visualized. CAP, co-activation pattern.
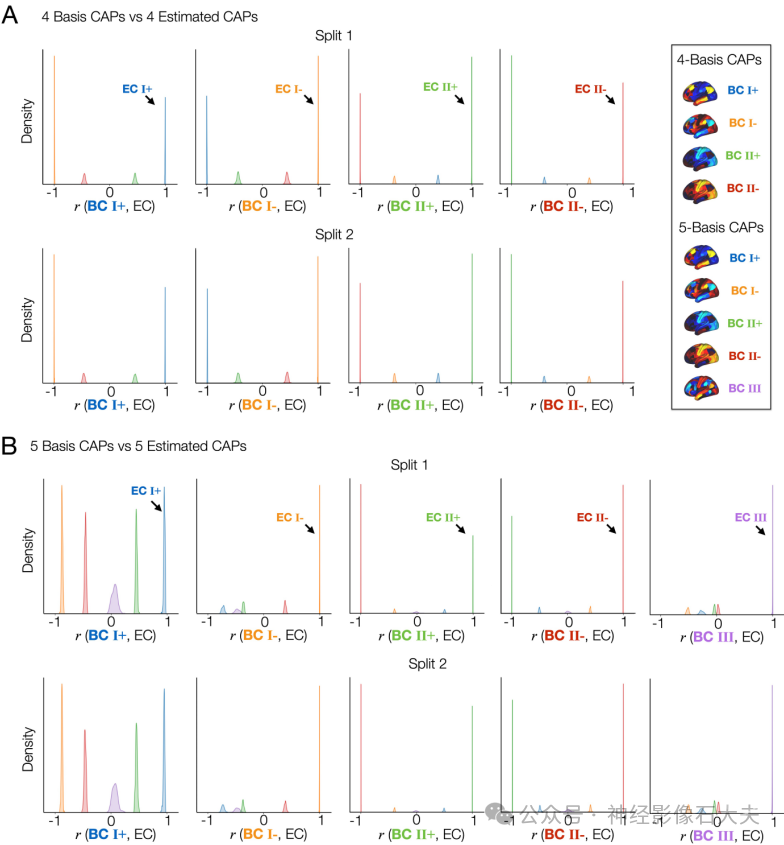
S6 Fig. Spatial patterns of the CAPs estimated from both splits are reproducible and strongly correlated with at least one of the basis CAPs. (A) From left to right, the marginal distributions of r between all estimated CAPs (ECs) and each basis CAP (BC) from the 4-CAP basis set are illustrated using kernel density estimation. Results were obtained from the split 1 data (top) and the split 2 data (bottom). Each r value is color-coded using a sorting algorithm to label the corresponding EC using the maximum spatial correlation with BCs. (B) From left to right, the marginal distributions of r between all estimated CAPs and each BC from the 5-CAP basis set are illustrated using kernel density estimation.

S7 Fig. The spatial topography of CAP state III is reproducible when it is found in one split and not in another across permutations.
Spatial alignment of individual time frames to basis CAPs
为了找到在个体之间常见的聚类或CAP的最佳数量,我们使用了一种考虑聚类数量与聚类内相似性之间权衡的方法,结合轮廓标准和肘部法(S2 Fig)。为了评估个体共激活模式对观察到的CAP变异性的贡献程度,我们分析了从337名受试者中获取的所有fMRI时间帧。对于每个对半分割,我们使用皮尔逊相关系数计算了个体3D fMRI时间帧与5个基础CAP(由K-means聚类估计的聚类中心)的空间对齐,识别出与每个时间帧相关性最高的基础CAP。结果,最大相关性的均值和标准差为0.22±0.11(S8 Fig),表明静息态人类大脑动态的显著变异性。值得注意的是,通过平均每个聚类内的时间帧估计的CAP的组水平空间拓扑在置换之间保持一致(Fig 2),使我们能够研究其时间动态的个体差异。
Reproducible state-trait neural features at the single-subject level
我们识别了反映全脑时间变化神经活动的3个CAP。在这里,我们展示了在单受试者水平上可重复估计的CAP空间特征。CAP分析涉及使用K-means聚类过程将个体时间帧分配到估计的CAP之一(Fig 3A)。在每个对半分割中估计的CAP使用与预识别的5-CAP基础集的最大秩相关进行标记(S6 Fig)。反过来,这种逐帧的CAP状态识别允许估计个体受试者的CAP状态的时间特征。我们展示了可以使用CAP时间特征的几个关键参数来量化神经动态的可重复状态和特质特征(见 Fig 3A)。

Fig 3. Resting state brain CAPs have distinct between and within-subject variance of temporal characteristics and test-retest reliability, as revealed by the 3-axes representation of neural trait variance space. (A) Analysis overview. In each split-half data from each permutation per day, FO, within-subject mean of dwell time (Mean DT) and within-subject standard deviation of dwell time (Var DT) are estimated for each CAP state. (B) Stability of individual mean DT of CAP I+ across permutations and across 2 days. Individual subjects were rank-ordered from top to bottom using the split 1 data from day 1. While the estimated mean DT values spanned from 0 to 6, the data set exhibited sparse occurrences in the distribution tails. To enhance visual clarity across rows (subjects), a saturated colormap was employed. For an alternative representation of the same data using an unsaturated colormap, refer to S9 Fig. We also found that individual Var DT and individual FO for these CAPs are reproducible across permutations and 2 days (S9 Fig). (C) Days 1 and 2 reliability of FO (top), Mean DT (middle), and Var DT (bottom) in each CAP state were quantified by the intraclass correlation coefficient using two-way random effect models (ICC(2,1)). When computing ICC for CAP III, permutations resulting in the absence of CAP III was not considered, because the values of temporal metrics are zero for both days. (D) Test-retest reliability of neural measures between 2 days of scan. (Top) For CAP I+ state, we show scatter plots of individual FO, withinsubject mean and variance of DT between days 1 and 2. Linear fitting line (red) is shown for each scatter plot. r-value is measured by Pearson’s correlation coefficient and considered significant when the corresponding two-sided p-value is less than 0.001. (Bottom) For the remaining 4 CAP states, the same scatter plot analysis was repeated (S10 Fig). We summarize the estimated r-values from all CAPs in the bar plot. (E) CAPs on the neural trait variance space. Relative variance (coefficient of variance) of each CAP measure was computed across subjects: individual FO (x-axis), Mean DT (y-axis), and Var DT (z-axis). The three-axes representation allows for unifying and optimizing the variations of temporal CAP characteristics and distinct patterns of temporal organizations of brain activity. Note that all 718 cortical and subcortical parcels were included in this analysis. See subcortical regions of CAPs in Fig 1E. The data used to generate the results can be found in S1 Data. CAP, co-activation pattern; DT, dwell time; FO, fractional occupancy.
Definitions
1. Fractional occupancy(FO(s,i)):受试者s每天在CAP状态i中花费的时间帧(或MRI重复时间;TR)总数,用受试者s每天在任何CAP状态中花费的时间帧总数进行归一化。FO是一个相对测量(%TR),因此受试者每天所有CAP状态的FO之和为1。FO反映了CAP动态的受试者间方差(特质方差)。
2. Dwell time(DT(s,i,c)):受试者s每天在相同CAP状态i中占据的时间连续段c的时间帧数(#TR)。
3. Within-subject mean of DT(Mean DT(s,i)):受试者s每天在CAP i中占据的所有时间连续段的DT估计值的均值。
4. Within-subject variance of DT(Var DT(s,i)):受试者s每天在CAP i中占据的所有时间连续段的DT估计值的标准差。DT测量涉及神经动态的特质(受试者间)和状态(受试者内)成分。
这些CAP测量的量化是针对每次置换中的每个分割数据完成的。为了评估CAP动态的日间变异性,我们分别对每一天的数据进行了这些测量的计算。总的来说,我们为每个受试者的每个CAP估计了FO、平均DT和DT的方差。这使得我们能够对每次置换中估计的神经测量值进行平均,从而为每个受试者每天的每个CAP提供了一个神经测量值的汇总统计。这些统计量在单个受试者水平上是可重复的,如Fig 3B所示。在解释这些结果时需要谨慎,因为像本研究中的平均DT这样的稳定个体特异性状态动态属性也可以被视为特质。
在本研究中,我们感兴趣于验证以下假设:在神经共激活动态中存在一种可重复的个体差异的普遍模式,个体在这种模式中表现出不同的占据(或映射)方式。尽管先前的研究通过应用静息态功能磁共振成像(rs-fMRI)信号容积的主成分分析(PCA),关注于时空神经活动的低维流形,我们的目标是识别一个低维特征空间,用以表征大脑状态时间组织的状态和特质属性。为此,我们首先证明了状态-特质共激活模式(CAP)动态在单个受试者水平上是可重复的,而同一受试者在不同天之间的可靠性低于同一天内不同置换之间的可靠性(见 Figs 3B, 3C and S10)。首先,我们使用线性回归测量了神经测量值的测试-重测信度(Fig 3D)。对于每个CAP,我们发现在第一天和第二天之间,个体神经测量值的平均相关系数较低(r ≤ 0.5)。CAP I+显示出最高的跨日可靠性,而CAP III的可靠性最低(见 Fig 3D)。其他4个CAP状态的散点图见S10 Fig。当我们计算所有CAP的相关系数的平均值和标准差时,跨日相关系数分别为:FO为0.41±0.07,平均DT为0.41±0.06,DT的方差为0.38±0.07。
其次,我们使用双向随机效应模型计算了每个置换中每个分割的内类相关系数(ICC(2,1))。因此,对于每个CAP,我们在1000次置换中测量了2000个ICC值。所有CAP的平均ICC值分别为:FO为0.39±0.06(均值±标准差),平均DT为0.39±0.05,DT的方差为0.34±0.06。这些状态-特质神经测量值显示出合理的测试-重测(日间)信度,与使用边水平功能连接报告的其他研究的元分析估计平均ICC(0.29±0.03,均值±标准误)相比。FO在5个CAP中的个体内方差在 S12 Fig中展示。总的来说,这些结果表明个体内部CAP动态的日间变异性(状态)以及每一天内高度可重复的个体间变异性(特质)。
Joint analysis of state and trait neural variations
我们提出了一个分析框架,用于联合分析状态和特质的神经变异,并考虑了神经特征的测试-重测(或日间)信度。重要的是,这个框架使我们能够可视化CAP属性在个体内部变化(状态),也能可视化个体之间变化(特质)。在 Fig 3E中,我们展示了时空CAP动态的状态和特质方差成分的三维表示。对于每个CAP,我们估计了三个神经特征的标准化个体间方差(方差系数)。然后,将五个CAP状态(CAP I+/−、II+/−和III)投影到这个空间中。有趣的是,我们发现CAP II在所有三个测量指标(FO、平均DT和DT方差)中表现出最高的相对个体间变异(即特质)。相反,CAP III表现出较低的个体间变异,但比CAP II更高的个体内变异(如在两天不同测量之间的距离所见;见 Fig 3E)。确实,这种提出的联合分析状态-特质神经变异的方法,为神经共激活的个体内和个体间的方差提供了一个丰富的景观。
Neural feature reduction captures general motifs of individual variation
一个重要且有趣的问题是,具有不同状态-特质变异模式的神经特征是否能够提供关于个体差异的重要信息。换句话说,我们感兴趣的是研究是否存在一组神经特征,可以在多个健康受试者中常见,这些受试者具有可重复的神经共激活特性,进而可以与行为表型相关联。为了解决这个问题,我们首先收集了每个个体的30个神经特征:3个神经度量(FO、平均 DT和 DT方差)×5个CAP(I+、I-、II+、II-和III)×2天。我们对受试者-特征(3.37×30)矩阵进行了凝聚分层聚类(Fig 4A)。我们使用树状图中最终合并的70%距离截止值确定了聚类数量(Fig 4B)。结果,我们发现了3个亚组(A、B和C),分别由163、127和47个个体组成(Fig 4C)。
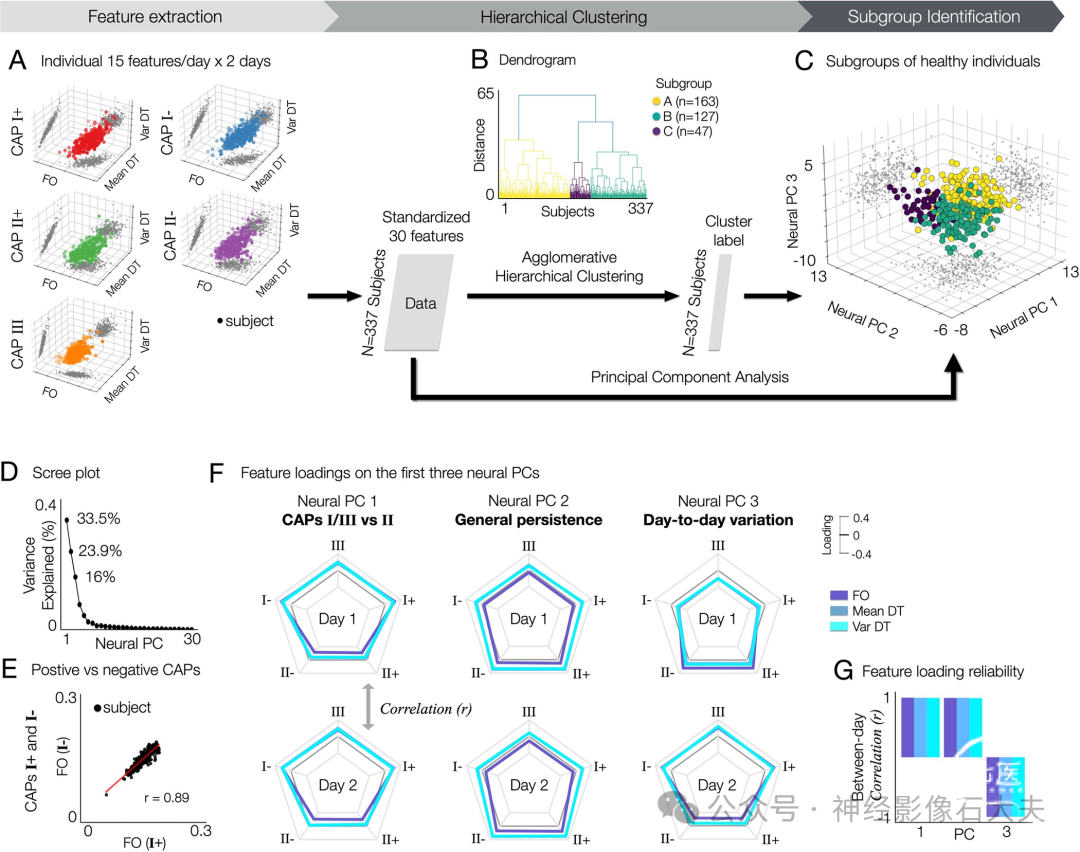
Fig 4. Identification of subgroups in healthy subjects exhibiting distinct neural state-trait variances. Three subgroups of healthy subjects in the HCP data (A, B, and C) are identified using the agglomerative hierarchical clustering of 30 individual neural state-trait features, which are estimated from temporal CAP characteristics (fractional occupancy, FO; within-subject mean of dwell time, mean DT; within-subject variance of dwell time, var DT). (A) For each subject, 30 neural features estimated from 5 CAPs and 2 days are collected. For each CAP, each neural feature was obtained by averaging the values estimated across permutations. Each data-point in the 3-axis scatter plots indicate a subject. Individual neural features were obtained by averaging the feature values across permutations within subject for each day. (B) Agglomerative hierarchical clustering is performed on the feature matrix. In the dendrogram, 3 clusters are found using a distance cut-off value of 7% of the final merge. In addition, to estimate the principal geometry of this state-trait feature space identifying subgroups, we applied PCA to the feature matrix. (C) Clustered subjects are embedded onto a 3D space using PCA. (D) Variance explained (%) by each neural PC. (E) Similarity of individual neural features between positive and negative CAPs. An example of CAPs I+ and I- are shown. See S11 Fig for all results (0.9±0.04,mean ± SD). (F) Loadings of each neural feature on the first 3 neural PCs. In each radar plot, 3 lines indicating FO (colored in slateblue), Mean DT (steelblue), and Var DT (turquoise) are shown for 5 CAPs. Feature loadings from days 1 (top) and 2 (bottom) are shown separately for an easier interpretation, while the neural PCs were obtained using neural features from both days as shown in (A). (G) The loadings of neural features on each PC are reliable between days. For each neural PC, Pearson’s correlation coefficient (r) was computed between 2 vectors of feature loadings collected from days 1 and 2. Neural PC 3 reflects the contribution of within-subject (between-day) variance in temporal CAP profiles. CAP, co-activation pattern; DT, dwell time; FO, fractional occupancy; HCP,Human Connectome Project; PCA, principal component analysis.
为了进一步研究是否存在捕捉个体差异的低维神经状态-特质变异几何特征,我们对受试者-特征矩阵进行了主成分分析(PCA)。显然,使用分层聚类识别的3个亚组分布在由前3个神经主成分(PC)表示的低维空间中,分别解释了33.5%、23.9%和16%的方差(Fig 4D)。值得注意的是,亚组A在神经PC1上的得分高于其他组,而亚组C在神经PC2上的得分高于亚组B(Fig 4C)。我们对这些PC上的特征载荷的进一步分析揭示了一个独特且简化的神经变异特征集,每个特征代表CAP特异性(PC1)和一般(PC2)神经状态-特质变异,这些变异也表现出日间变异性(PC3)。此外,我们发现每对正负CAP模式(状态I+和I-,状态II+和II-)表现出相似的时间CAP特征(Figs 4E and S11)。
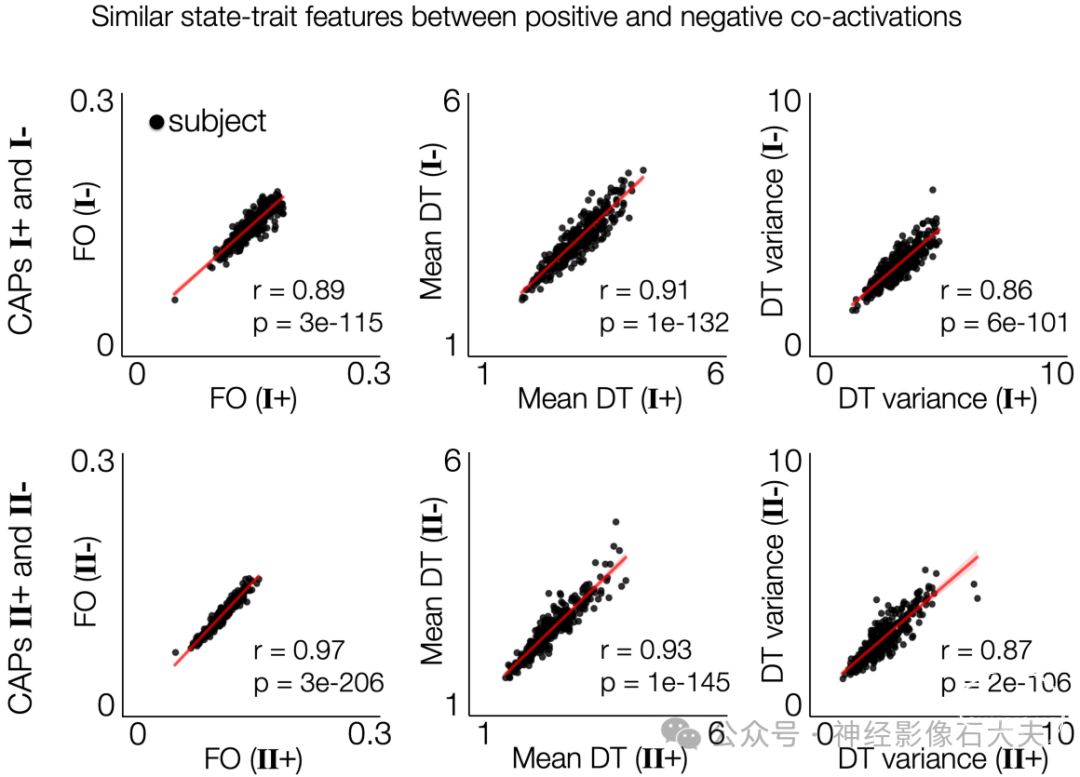
S11 Fig. Similarity of temporal organizations between positive and negative co-activation patterns.CAP states I and II have similar FO, mean DT and DT variance across the positive and negative co-activation states (I+ vs. I- and II+ vs. II-). Each data point indicate a subject. The temporal metric values across all permutations and 2 days were averaged within each subject.
具体来说,神经PC1以CAP I/III与CAP II的独特时间特征为特征。它包括CAP I/III的FO、平均DT和DT方差的较高载荷,以及CAP II的DT度量的较低载荷(Fig 4F)。请注意,FO是一个相对测量(#TR),因此所有CAP状态的FO之和为1,而DT度量是绝对的(#TR)。这表明,表现出高神经PC1得分的个体在CAP I和III中占据的时间相对较长,而低PC1得分的个体在CAP II状态中占据的时间较长。关于CAP II,FO在神经PC1上表现出比驻留时间度量(平均 DT和DT方差)更显著的负载荷。另一方面,神经PC2突出了状态持久性的一般模式(高受试者内平均DT和高受试者内DT方差),同时也在FO上表现出较弱的CAP特异性效应(CAP I/III的FO较低,CAP II的FO较高)(Fig 4F)。此外,在神经PC2中,CAP II的DT度量显示出比FO更高的载荷。较长的驻留时间表明个体在转换到另一个CAP之前占据一个状态的时间较长,表明状态持久性强。与表现出强日间可靠性的神经PC 1和2相比,神经PC3在两天之间表现出强负相关性(|r| > 0.9;Fig 4G)。特别是,神经PC3捕捉了日间变异性的特定成分:在神经PC1中观察到的CAP特异性模式可能在两天之间发生系统性变化(例如,Fig 4F中的特征载荷符号翻转)。
总之,我们的结果表明,时空CAP动态的状态和特质方差都涉及识别个体差异的关键信息。具体来说,我们识别了3个神经PC,它们建立了一个低维的、一般的神经共激活变异状态和特质模式。个体变异的第三个主成分涉及神经共激活的日间变异性信息,表明受试者内变异模式可以独特地个体化。这反过来可以被视为提供关于个体神经表型的额外信息的特质样模式。虽然特质变异(神经PC1和2)主要加载在个体差异的一般模式上,但观察到的日间状态方差(神经PC3)也贡献了这个低维特征空间,因此反映了神经表型。每个神经度量的个体分布评估支持了这些发现(S13 Fig)。此外,我们还发现CAP I和II的FO总体上相较于CAP III的FO具有更高的均值和变异性。在平均DT和DT方差中我们也观察到了相同的模式(见 S13 Fig)。事实上,我们通过结合层次聚类和PCA对个体神经特征集进行分析,揭示了3个亚组表现出不同的神经变异模式。
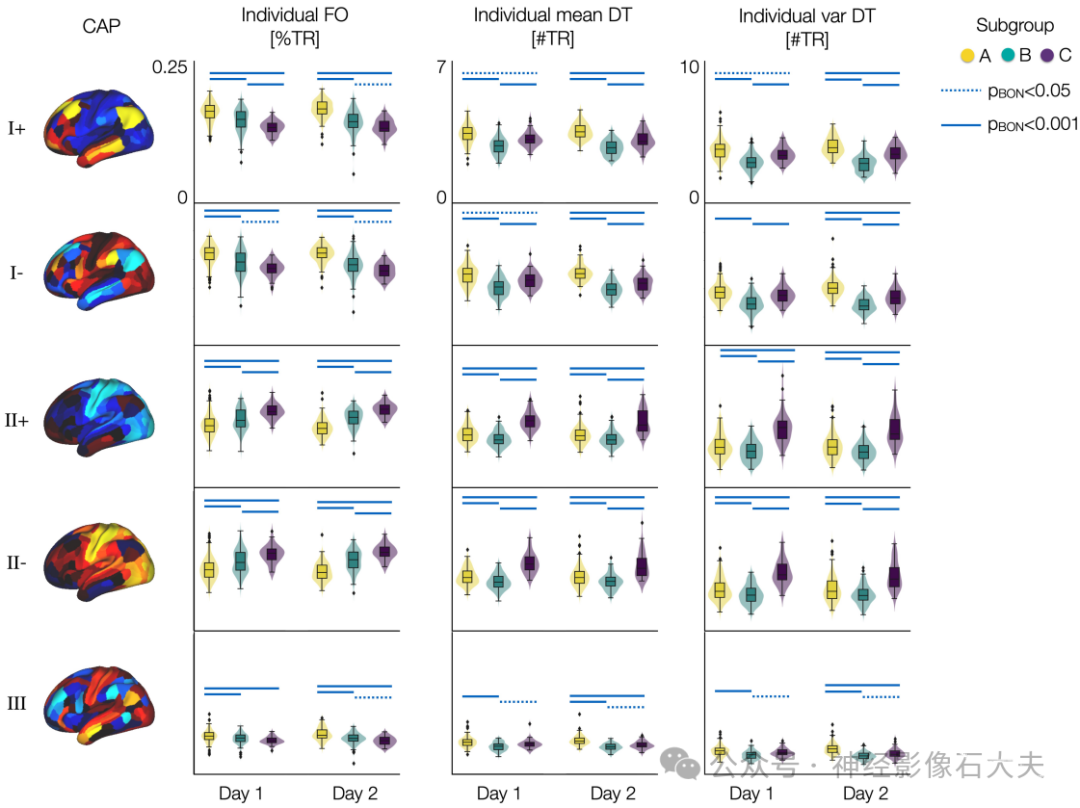
S13 Fig. Distribution of individual neural measures of spatiotemporal CAP dynamics differ between subgroups.The distributions of individual FO, mean DT, and var DT of each CAP state are color-coded by the 3 subgroups. Results from days 1 and 2 data are shown separately and compared between groups. Each data point indicates a subject. Blue lines: p-values with Bonferroni-correction across 5 CAPs are estimated using two-sided two-sample t tests between groups, pBON<.001 (bold) and pBON<.05 (dotted).
Principal variations of neural state-trait features co-vary with principal variations of behavioral phenotypes
接下来,我们感兴趣的是研究在这个低维神经特征空间上量化的个体变异在多大程度上与个体人类行为的变异相关联。我们采用了类似的降维策略来估计行为主成分(PC),这些PC提供了跨多个行为域的低维几何,人们在这领域中占据不同的位置。通过这种方式,我们可以将个体受试者分别在两个特征空间中的分布关联起来,并研究这些模式如何相互关联。
为了估计行为表型中主要变异的几何结构,我们在 HCP S1200数据集的无限制和限制行为数据中,对15个行为域的262个变量进行了PCA,这些领域包括:警觉性(1-2)、认知(3-39)、情绪(40-63)、人格(64-68)、情绪任务表现(69-74)、赌博任务表现(75-86)、语言任务表现(87-94)、关系任务表现(95-100)、社交任务表现(101-113)、工作记忆任务表现(114-167)、精神病学维度(168-189)、酒精使用(190-222)、烟草使用(223-252)、非法药物使用(253-258)以及大麻使用(259-262)(见 Fig 5A)。行为变量的完整列表见 S14 Fig。在进行PCA之前,我们将几个反映任务中反应时间(RT)的变量转换为1/RT,以便更好地解释主成分的几何结构。
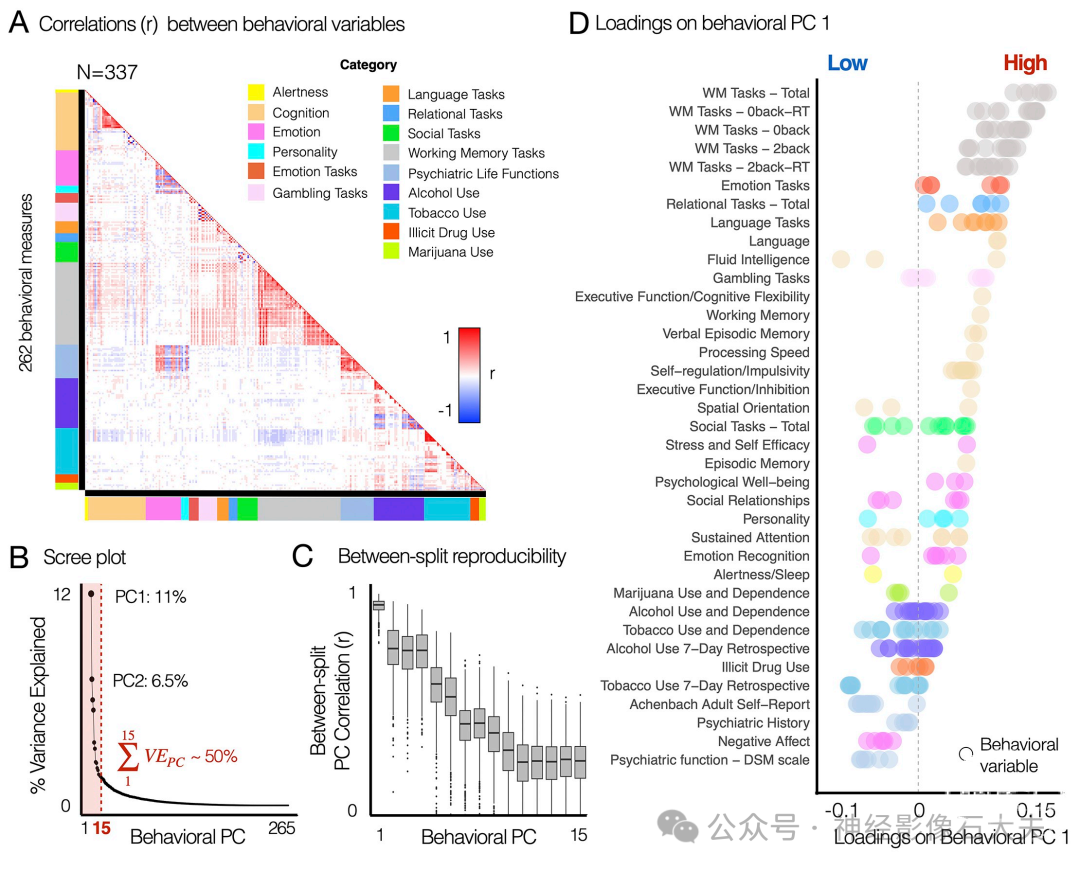
Fig 5. Principal variations of neural state-trait features co-vary with the principal variations of behavioral phenotypes, highlighting individual life function outcomes associated with emotion regulation, cognitive function, and alcohol and substance use. (A) Correlation structure between 262 behavioral variables, which were obtained from the HCP S1200 unrestricted and restricted data. Colorbars along each axis of the correlation matrix indicate color-codes for the category of each variable. Categories were defined from the HCP data dictionary available online (HCP_S1200_DataDictionary_April_20_2018.csv). Variables measuring RT from tasks were transformed into 1/RT to account for the fact that a shorter response time indicates better task performance. See S14 Fig for the list of all behavioral variables. (B) The first PC explained 11.2% of variance. The first 15 PCs explaining ~50% of variance were considered in further analysis. (C) Across 1,000 permutations for split-half resampling, we compared if the geometry of estimated PCs in 2 splits are consistent. Pearson’s correlation coefficient (r) was computed for each pair of behavioral PCs. (D) Rank-ordered loadings of each behavioral variable on the first principal component (PCA). Each data point indicates a behavioral variables. PCA was performed for all 262 variables in (A). 39 subcategories shown on the y-axis were also defined using the HCP data dictionary. Several subcategories belonging to the same category are coded using the same color as in (A). The data used to generate the results can be found in S2 Data. HCP, Human Connectome Project; PCA, principal component analysis; RT, reaction time.
在完成PCA后,我们通过置换检验来评估所得到的PC的显著性。具体来说,我们对每个置换进行PCA,其中受试者的顺序被随机打乱,从而提供了一个零模型。结果发现,有27个PC所解释的方差比例超过了偶然水平(在10000次置换中p < 0.05)。随后,我们考虑了前15个PC,它们共同解释了总方差的约50%,用于进一步分析。这15个PC的可重复性是通过对半分割置换方法来评估的,我们将337名受试者随机分成两个同等规模的组(每组n = 168),并对每个分组应用PCA。然后,对于每次置换,我们计算了从两个分组中估计出的第n个PC的几何结构之间的相似性(皮尔逊相关性),其中n是根据所解释的方差对每个主成分进行的排序。
结果表明,第一个行为PC(PC 1)解释了11.2%的方差(见 Fig 5B),具有很高的可重复性,表现为两个对半分割样本中估计的第一个PC之间的几何相似性(r = 0.9±0.03,均值±标准差,基于1000次置换(前后文不太一致))(见 Fig 5C)。行为PC 1(PC1)突出了与认知功能、情绪调节以及酒精和物质使用相关的生活功能结果(Figs 5D and 6A)。工作记忆任务表现的变量在行为PC1上具有最高的载荷,其次是情绪、关系、语言、赌博任务表现、流体智力、自我调节/冲动性以及情景记忆。相比之下,与酒精和物质使用相关(例如,短期烟草使用)以及精神病学维度相关(例如,积极和消极情绪、压力、焦虑、抑郁和社会支持的自我报告测量)的变量在行为PC1上表现出最低的、负的载荷。行为PC2突出了与情绪、人格和精神病学生活功能相关的项目(见 Fig 6B)。行为PC3突出了物质使用,特别是与饮酒消耗习惯相关的项目在这个PC上表现出显著的高载荷(见 Fig 6C)。

Fig 6. Principal variations of neural state-trait features co-vary with the principal variations of behavioral phenotypes, highlighting individual life function outcomes associated with emotion regulation, cognitive function, and alcohol and substance use. (A) The geometry of behavioral PC 1 (black, left circle) reflects the difference in group-average behavioral variables (standardized behavioral data, right circle) between subgroups A (yellow) and B (green). Subgroup C is not shown because no significant group differences are found in (D). (B) The geometry of behavioral PC 2. (C) The geometry of behavioral PC 3. (D) Comparison of individual PC 1 scores between subgroups identified using neural state-trait measures (Fig 4). Two-sample two-sided t tests were performed between subgroups for each behavioral PC. pBON: Bonferroni corrected p-values. (E) Multiple linear regression model of 3 neural PC 1 with 2 covariates (age and sex) showed that the neural PC 1 was associated with the behavioral PC 1 (Partial R² = 0.023, β1 = 0.26, SE = 0.09, t = 2.8, p = 0.006), where multiple R²= 0.041, adjusted R² = 0.026, F(5,331) = 2.814, p-value = 0.017 for the full model. (F–H) Reproducibility analysis of the prediction of individual behavioral PC scores from neural PCs. In each permutation, PCA was performed for the neural and behavioral data from subjects in a random half of the entire sample (N = 168). Parameters of multiple linear regression models with three neural PC 1 with 2 covariates (age and sex) were estimated to evaluate the predictability of each behavioral PC. pBON: Bonferroni corrected p-values from F-tests. The data used to generate the results can be found in S2 and S3 Data. PCA, principal component analysis.
为了评估行为变量的主要变异与神经特征的主要变异之间的关联,我们首先比较了使用神经特征(Fig 4)识别的亚组之间个体在15个行为PC上的得分分布。被归为亚组A(n = 163)的个体在行为PC1上的得分显著高于亚组B(n = 127)(pBON <0.05,t = 3.05,双样本双侧t检验)(见 Fig 6E)。在比较不同性别间行为PC1的个体得分时,我们没有发现两者之间存在关系。我们没有观察到神经状态-特质动态在识别亚组C(n = 47)时的行为相关性。此外,行为PC3表现出强烈的性别效应(pBON < 0.005)。
接下来,我们使用多元线性回归模型研究个体在行为PC1上的得分是否与个体在3个神经PC上的得分相关(behavioral PC 1 ~ neural PC 1 + neural PC 2 + neural PC 3 + age + sex)。结果显示,神经PC1与行为PC1相关(偏R² = 0.023,β1 = 0.26,SE = 0.09,t = 2.8,p = 0.005),其中用于预测行为PC1的完整模型的多重R² = 0.041,调整后R² = 0.026,F(5, 331) = 2.814,p = 0.017(见 Fig 6E)。神经PC2和PC3以及年龄均未显示出与行为PC1的相关性。性别与行为PC1表现出微弱的相关性(偏R² = 0.016,β1 = -1.44,标准误SE = 0.61,t = -2.34,p = 0.02)。
Reproducibility and cross-validation of low-dimensional neuro-behavioral association
为了进一步评估我们在Fig 6E中发现的低维空间中神经-行为关联的可重复性,我们首先在分割数据(随机N = 168)上对1000次置换进行了相同的多变量线性回归方法。通过随机打乱每个行为PC数据中的个体受试者生成了零数据(S15 Fig)。对于预测行为PC1,得到的偏R²值在置换中具有很强的可重复性(神经PC1的偏R² = 0.025 ± 0.017,pBON< e-10,F检验;整体R² = 0.056 ± 0.024),如Fig 6F所示。与使用整个数据的分析类似,性别也是行为PC1的可重复预测因子(偏R² = 0.02 ± 0.016,pBON < e-10,F检验)。其次,我们使用从每个分割1数据训练得到的多变量线性回归模型来预测分割2数据中个体的行为得分,并在置换分析中进行了重复(S16 Fig)。尽管整体预测性能相对较低,但其具有很高的可重复性,并且与零数据分析的结果显著不同(R² = 0.011 ± 0.013,p < e-10,F检验)。
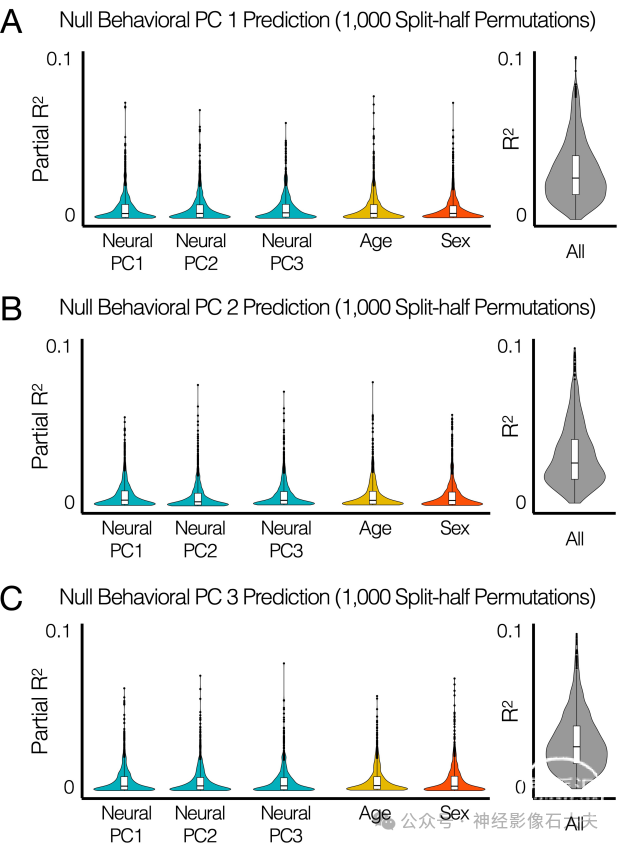
S15 Fig. Null data were generated by shuffling individual subjects in behavioral data.Null distributions of partial R² were estimated for each predictor in the neuro-behavioral association model trained from a split data across 1,000 split-half permutations.
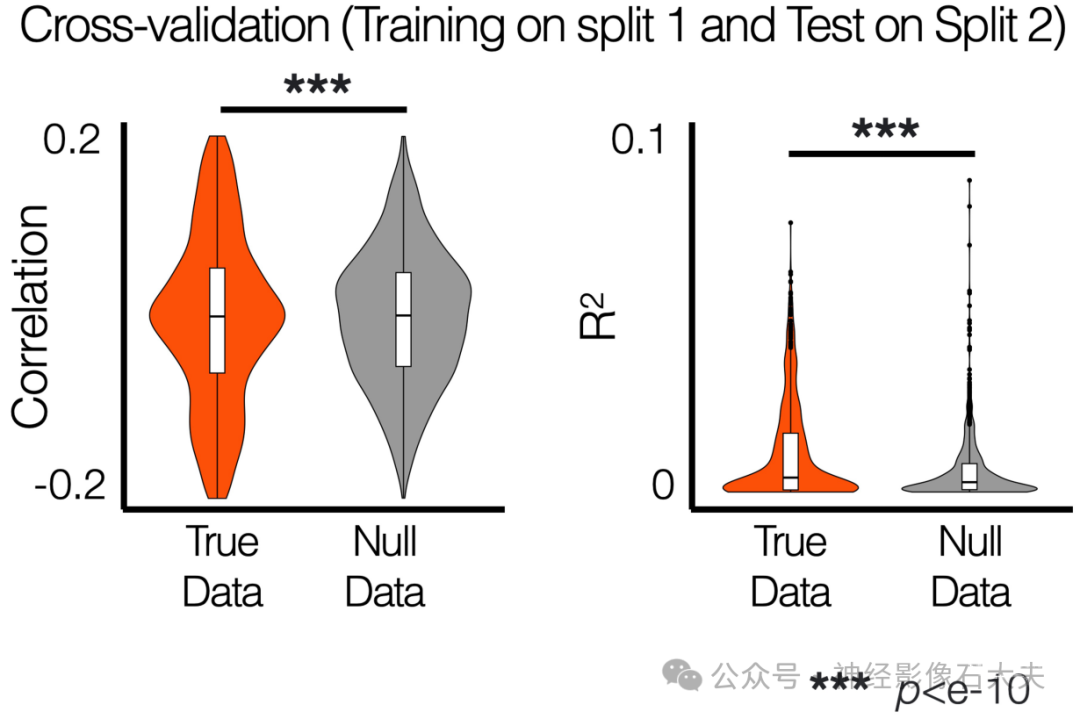
S16 Fig. Split-half permutation based cross-validation of the prediction model of predicting behavioral PC 1 from neural PCs.The multiple linear regression models were trained using split 1 data and tested on split 2 data in each permutation. Null data were generated by shuffling individual subjects in behavioral data. The data used to generate the results can be found in S3 Data.
接下来,我们对预测行为PC2和3重复了相同的分析。神经PC1和2显示出与行为PC2相关,该PC2突出了情绪、人格和精神病学生活功能,而年龄和性别显示出更大的预测能力(Fig 6G)。对于预测行为PC2,估计的偏R²:神经PC2为0.008 ± 0.010,年龄为0.018 ± 0.014,性别为0.013 ± 0.019(Fig 6G)。另一方面,神经PC2可预测行为PC3,该PC3突出了与酒精消费习惯和性别差异的强关联(Fig 6H)。对于预测行为PC3,估计的偏R²:神经PC2为0.016 ± 0.014,性别为0.059 ± 0.036,而完整模型的整体R²为0.098 ± 0.041(Fig 6H)。
Impact of CAP III on the principal neuro-behavioral relationships
目前尚不清楚CAP III的存在与否如何影响其他CAP的时间CAP特征,以及它与个体行为差异之间的关系。为了解决这些问题,我们研究了CAP III与3个神经PC(Fig 4)以及第一个行为PC(Fig 5)之间的关系。具体来说,为了量化CAP III的发生概率,我们比较了包含CAP III的5个CAP的概率以及不包含CAP III的4个CAP的概率。我们发现,与其他亚组相比,亚组C有更高的CAP III发生概率(Fig 7A)。具有高CAP III发生概率的个体在神经PC1上的得分较低(r = -0.26,p < 0.001),而在神经PC2上的得分较高(r = 0.24,p <0.001;Fig 7B and 7C)。与个体在神经PC3上的得分没有关系(Fig 7D)。CAP III的发生概率与行为PC1的个体得分之间存在微弱的负相关(r = -0.18,p < 0.005;Fig 7E)。我们没有发现CAP III的发生概率与行为PC 2和3之间存在相关性。这些结果共同表明,CAP III的时空特性与神经PC和行为PC1相关。
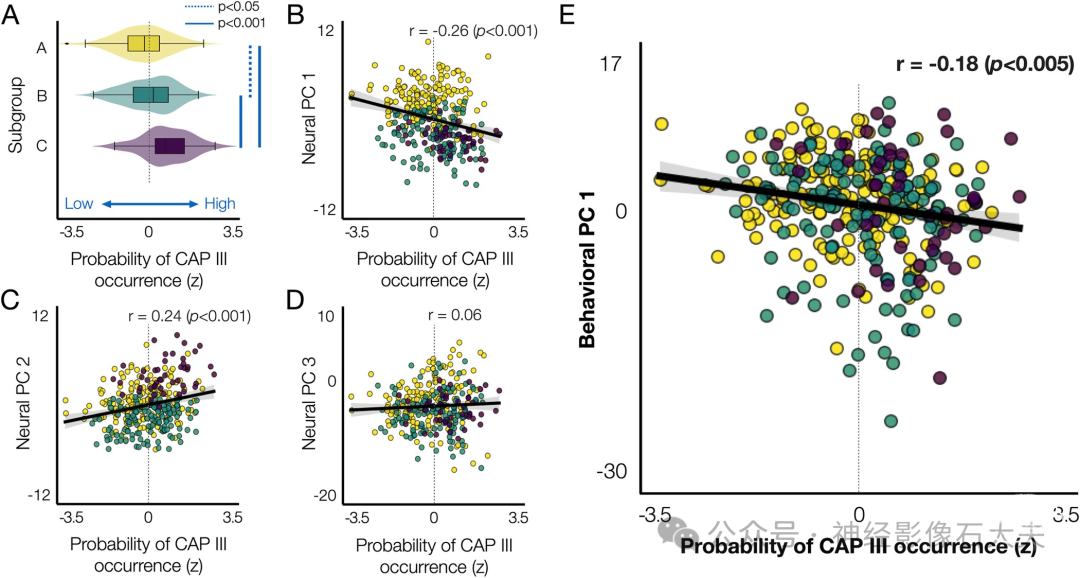
Fig 7. The probability of CAP III occurrence is associated with the neural and behavioral PCs. (A) The probability of CAP III occurrence (x-axis) for each individual, which can be interpreted as an individual’s preference to have CAP III, was evaluated by the difference in the occurrence of 4 CAPs versus 5 CAPs, as described in Fig 1B. For each subject, we computed the number of permutations (occurrence out of 1,000 permutations) when 4 CAPs were estimated and the number of permutations for the same subject to be involved when 5 CAPs were estimated. Then, for each subject, we compared the difference in the occurrence (Δ Occurrence = Occurrence (k = 5)–Occurrence (k = 4)) from each split. Then, for each individual, the Δ Occurrence was averaged over 2 splits. Finally, the within-subject average Δ Occurrence was normalized across subjects to z-scores. Individuals were color-coded by subgroups defined using the hierarchical clustering of 30 neural features (Fig 4). (B–D) Scatter plots of individuals’ preference to have CAP III with respect to the individual scores on the neural PC 1 (B), neural PC 2 (C), neural PC 3 (D), and behavioral PC 1 (E). The data used to generate the results can be found in S4 Data. CAP, co-activation pattern.
Impact of motion
为了评估运动的影响,我们计算了每个受试者在各个时间帧上的平均帧位移(FD)。估计的跨受试者(N = 337)平均FD为0.16 ± 0.58。注意,我们在估计CAP时去除了头动过大的时间帧(FD > 0.5 mm)(S1 Fig)。每个受试者平均去除的时间帧数量为76 ± 192.6(计数),占每个受试者总时间帧数(去除哑扫描前为4400/受试者)的1.73 ± 4.38%。在337名受试者中,有28名(8.3%)的受试者超过5%的总时间帧被去除。我们还测量了运动的持续时间(连续时间帧中头动过大的数量),以评估是否存在长时间段的头动,这可能会影响时间CAP特征的估计,特别是CAP状态转换和持续时间的分析。运动相关连续时间帧的平均长度为1.34 ± 0.38。排除这28名受试者后重复分析,并没有改变结果,包括神经测量的PCA和低维神经-行为关系(S17 Fig)。
S17 Fig. Repeating the analysis of neuro-behavioral association excluding subjects with high motion did not change the results. Among 337 subjects, 28 subjects with excessive motion (FD ˃ 0.5mm) were excluded. Across 1,000 permutations, a split of subjects (n = 154) was randomly selected, and PCA was performed on neural measures from these subjects. Multiple linear regression models for predicting behavioral PCs from these subjects were estimated. Null data were generated by shuffling individual subjects in behavioral data. The data used to generate the results can be found in S5 Data.
总之,我们假设存在一个可重复的CAP特征集,它反映了状态和特质大脑动态,并且这种联合特征集与多个行为域的个体表型相关。具体来说,行为PC1突出了与认知、情绪调节、酒精使用和物质使用相关的个体生活功能结果。在行为PC1得分较高的个体中发现:(i)在CAP I中花费的时间比在CAP II中长;(ii)相较于CAP II,在CAP I中表现出更高的个体间变异性和更低的个体内变异性;(iii)在所有CAP中表现出更高的全局持久性(更长的持续时间);(iv)更少的机会出现CAP III。这种神经-行为模式还与(v)性别差异相关。行为PC2突出了情绪调节、人格和精神病学生活功能。在行为PC2得分较高的个体中发现:(i)在所有CAP中表现出更长的持续时间;(ii)在CAP I中花费的时间比在CAP II中长;(iii)与年龄相关。行为PC3突出了酒精、尼古丁和物质使用。在行为PC3得分较高的个体被发现:(i) 在所有CAP中具有更长的驻留时间;(ii) 更有可能出现CAP III;(iii) 与性别差异相关。
Discussion
本研究提供了证据,强调了量化大脑动态的个体内(状态)和个体间(特质)变异成分及其与个体功能行为差异之间联系的重要性。在这里,我们展示了通过CAP分析可以量化rs-fMRI的动态性,并揭示可重复的神经特征,这些特征可以最大化状态变异、特质变异和测试-重测可靠性。我们发现,人类大脑表现出高度可重复的低维特征集,这些特征索引了全脑共激活模式。神经特征的降维捕捉了个体变异的一般模式,使得个体在这个低维状态-特质神经空间中占据不同的位置,进而预测生活和行为结果。状态变异(通过共激活动态的日间变异索引)也加载到这个低维个体变异模式中,因此反映了神经表型。
我们在健康年轻成年人中识别了三种CAP,它们代表了混合静息态网络的反复快照,表现出不同的时空特征,并在个体水平上具有可重复性。通过层次聚类分析时间CAP特征,我们识别了三个个体亚组,这些亚组映射到捕捉状态(即个体内)和特质(即个体间)变异成分的CAP动态的不同方面。我们发现,神经状态和特质CAP特征的主要变异与行为表型的主要变异共变。换句话说,我们识别了rs-fMRI动态的特定属性,这些属性映射到个体的生活结果特征。关键的是,个体占据特定CAP的概率高度可重复,并与神经和行为特征相关。总的来说,这些结果表明,可重复的神经动态模式可以捕捉个体内和个体间的变异,进而定量映射到个体的功能结果。
Identifying reproducible neural dynamics profiles in humans
在本研究(n = 337,Fig 1E)中,我们识别了三种可重复的CAP。这些CAP捕捉了与Bolt及其同事先前使用复杂PCA和多种潜在降维方法对HCP数据集(n = 50)分析结果相似的空间模式。Bolt及其同事识别的三种模式与我们在本研究中发现的CAP之间的空间对应关系有助于解释我们的结果。具体来说,CAP I+/I-的空间拓扑属性可能与BOLD信号的任务正/任务负动态相关,而CAP II+/II-可能与全局信号波动相关。然而,与大多数早期关于rs-fMRI中CAP的研究类似,Bolt及其同事采用了基于预定义区域时间序列高振幅信号的稀疏时间点采样策略(15%),并选择了任意的两聚类解决方案。稀疏时间点采样基于一个假设,即功能连接模式源于离散的神经事件,通常由皮层活动的高振幅共波动驱动。这些研究表明,估计的CAP与广泛研究的静息态功能连接模式(如默认模式网络)之间存在空间对应关系。
然而,据我们所知,尚未有研究探讨个体内和个体间CAP模式变异在整个BOLD信号范围内的联合属性。此外,也没有研究考察整个BOLD信号范围对CAP属性与行为之间关系的影响。在这里,我们提出了一种分析方法,通过使用整个BOLD信号范围来优化识别的CAP的个体内变异、个体间变异和测试-重测可靠性。关键的是,我们展示了每个个体的可重复时空CAP特征(Figs 2, 3, S9 and S10)。进而,我们展示了CAP神经表型的主要变异与行为表型的主要变异之间的关联(Fig 5)。
本研究未评估BOLD信号时间采样对CAP分析的影响。然而,先前的研究表明,仅关注特定时间点(如高BOLD信号振幅或与种子区域强信号相关的时间点),而忽略其余数据(如事件缺失时间点),可能会导致误导性结论。Iraji及其同事指出,事件缺失时间点可能捕捉到默认模式功能网络连接与精神分裂症症状之间的独特且稳健的关系。因此,未来针对这一特定问题的研究将有助于确定瞬态大脑共激活模式在多大程度上能够捕捉个体大脑动态的多样化特征。例如,可以从具有不同时间采样策略的数据中量化CAP衍生指标,如随机或基于特定信号标准变化分析时间点的比例。此外,还应进一步考虑fMRI BOLD采集的时间分辨率(如重复时间;TR)的影响。
最近的一项研究提出了一种通过最大化个体可识别性来检测个体水平CAP的方法。使用密集采样的Midnight Scan Club数据集,他们在组水平和个体水平上识别了四种CAP,其中两对CAP表现出相反的空间模式,与本研究的发现相似(Fig 1)。然而,他们的研究并未探讨个体化CAP及其时间特征如何与行为相关,而是专注于在组水平和个体水平上使用相同数量的聚类数。相比之下,我们专注于在组水平上识别可重复的神经共激活模式(CAP),并在个体水平上量化CAP时间特征的可重复特征集,从而提供了一个统一的框架来评估个体差异,使用神经共激活的状态和特质变异的联合分析。类似地,另一项动态功能连接方法估计了组水平的几种大脑状态,而他们可以识别状态活跃的时间点,从而估计每个状态和每个个体的FO。
总的来说,这些结果表明,状态-特质CAP动态在个体水平上具有可重复性(Figs 3 and S9)。本文报告的统计数据(Fig 3C)显示,其可重复性高于功能连接矩阵组水平可重复性的元分析估计。然而,观察到的ICC值相对较低,反映了日间变异的显著程度。这表明,虽然特质样特征是加载到个体变异一般模式上的最主要因素,但观察到的状态变异(日间)也贡献了这一一般模式。在这种情况下,相对较低的ICC范围反映了日间时间尺度上显著的个体内变异,并支持我们的状态-特质成分框架,这些成分共同识别神经表型。类似地,Yang及其同事发现,在个体水平上识别的CAP在10次扫描(约30分钟/次)中随时间不稳定,除了少数个体外,当整合更长时间的数据时,个体特异性CAP变得更加可靠和个体化。因此,我们认为,这种个体内的时间波动可以为个体特异性大脑组织带来关键见解。将神经特征减少为可重复的CAP集可能使得神经特征与行为之间的映射更加稳健和可重复。换句话说,我们假设进一步优化可重复的数据降维神经特征,是朝着将rs-fMRI信号映射到健康和临床相关行为变异并获得稳健的神经行为模型的关键一步。
Quantifying joint state and trait variance components of neural dynamics
Fig 3E 中展示的时空CAP动态的三轴表示,突出了一种考虑时间CAP特征的方法,这些特征可以为特征选择提供信息。换句话说,我们展示了通过将每个个体内衍生的CAP指标投射到特质变异空间中,可以可视化CAP属性在个体内(状态)和个体间(特质)的变异。
例如,我们发现CAP II在所有测量中表现出最高的相对个体间变异(即特质)。相反,相比CAP II,CAP III表现出较低的个体间变异但更高的个体内变异。这表明,尽管CAP III的个体间变异较少,但任何个体在该模式中的日间变异可能显著。这些观察结果高度可重复,并且与先前文献中报告的三种模式解释的变异一致。这引发了一个问题,即联合考虑状态和特质指标是否可以揭示神经特征的关键属性,进而为它们与行为的映射提供信息。例如,人们会预期,一个在个体间变异显著但在个体内变异较少的神经特征,可能作为跟踪纵向行为变化(如神经发育变化或某些精神病人群中观察到的快速情绪波动,但在正常人群中不发生)的可靠神经标记。相比之下,最大化个体内变异但仍表现出显著特质变异的神经特征,可能更适合检测随时间发生显著变化的神经行为关系。
事实上,使用识别的CAP的状态和特质变异成分揭示了健康个体的三个亚组。这一发现与使用具有不同状态变异模式的神经特征可以为个体差异提供关键信息的观点一致(Fig 4)。该聚类的目的不是对个体进行分类。相反,我们的目标是测试是否存在一组神经特征,这些特征在多个健康个体中常见,表现出可重复的神经共激活属性,并且可以与行为表型相关。我们首先发现,这三个亚组(n = 163、127和47)可以投射到一个数据降维的PCA模型中。神经PC1以CAP I/III与CAP II之间的FO和DT指标的显著差异为特征(CAP特异性),神经PC2代表所有CAP状态的一般持续性(一般性),神经PC3代表个体内的日间变异(Fig 4D-4F)。这种神经特征的进一步降维捕捉了个体在复杂神经共激活时间模式中变异的一般模式。
虽然本研究表明在研究个体差异的神经基础时考虑状态变异的重要性,但我们并未直接比较仅使用状态特征、仅使用特质特征以及同时使用状态和特质特征时神经行为映射的表现。未来的研究可以通过药理学神经影像或经颅磁刺激(TMS)等状态操纵的综合实验,帮助理解状态和特质神经特征如何响应这些操纵,以及状态和特质神经特征是否反映个体差异的独特或附加信息。
Linking neural patterns of co-activation to behavioral and life functioning
人类神经影像学的一个关键目标是识别与人类功能相关的特征。更具体地说,fMRI衍生的信号是否携带与成年人积极或消极生活功能结果相关的信息?先前的研究使用多变量典型相关分析(CCA)测试了这一假设。虽然这些初步发现令人信服,但广泛认为使用许多神经影像特征的CCA模型容易过拟合。为了解决这个问题,我们研究了通过神经动态的状态和特质变异成分识别的降维和可重复神经特征集,是否可以解释代表一般人群的成年人样本中的功能行为结果变异。在这里,我们对HCP样本中的262个行为特征进行了PCA模型计算,揭示了通过置换检验的27个PC。然而,我们发现第一个行为PC捕捉了所有行为变异比率>11%,并且高度可重复(行为PC1载荷的跨分割相关性为r > 0.9;Fig 5C)。因此,我们考察了第一个CAP衍生的神经PC(Fig 4)与第一个行为PC之间的关系,揭示了具有较高神经PC1分数的个体(亚组A,Fig 4F)也具有较高的行为PC1分数(Fig 6D and 6E)。
这些结果表明,优先占据CAP I并表现出强状态持久性的个体也表现出较高的认知和情感功能结果(Figs 4 and 5D)。相反,主要占据CAP II较长时间的个体往往表现出相对较低的认知分数,以及较高的酒精和物质使用水平。这与fMRI信号中的全脑共激活模式与个体功能水平相关的观点一致。值得注意的是,CAP II在所有测量中表现出最高的相对个体间变异(Fig 5D)。此外,CAP II表现出“全局”的空间模式。这与先前的研究结果一致,即包含额顶控制网络主要贡献的全局rs-fMRI信号拓扑属性与积极和消极生活结果及心理功能相关。有趣的是,我们发现观察CAP III可能与研究样本的组成有关。换句话说,有一组人具有较高的CAP III发生率(亚组C),如果在报告的置换检验中采样,将产生三CAP解决方案(I、II和III)。个体中CAP III存在的高概率与较低的行为PC1分数相关,表明功能生活结果较差(Figs 1, 2 and 6)。更具体地说,具有高概率CAP III神经信号模式的个体表现出相对较低的认知功能、较高的酒精使用和较高的物质使用。
我们的结果与使用其他动态功能连接方法的几项研究结果一致。Vidaurre及其同事使用隐马尔可夫模型识别了HCP-YA rs-fMRI数据集中的12种大脑状态,并衍生出两种元状态,每种元状态是一组更可能在彼此之间转换的大脑状态。他们发现,大脑状态及其相关元状态的FO具有个体特异性,并且与行为相关,突出了几种幸福感、智力和人格特质。有趣的是,使用本研究中相同的受试者,评估认知任务期间的大脑活动是否表现出与使用rs-fMRI估计的CAP特征和低维状态-特质变异相似的集合,以及它们如何与高阶元状态和跨多个认知任务发现的低维全局大脑活动相关。
这强烈支持了人类大脑中可重复的功能共激活模式可以映射到对心理健康有影响的行为结果的观点。在这里,我们通过仅考虑神经和行为特征空间的第一个PC发现了这种模式。目前尚不清楚CAP动态的进一步特征优化是否会揭示与更严重的精神健康症状相关的更强效应,这些症状可以在临床样本中检测到。事实上,CAP的空间和时间组织已在先前的研究中与精神症状相关联。然而,尚不清楚在健康一般成年人群中可重复的CAP衍生的神经特征是否也能预测严重的精神症状。换句话说,可能存在仅在经历一定症状严重程度的个体中可检测到的CAP(以及我们量化的相关状态-特质变异成分)。在这种情况下,考虑状态神经指标定义的可能性和时间尺度至关重要——即状态在个体中存在的可能性有多大,以及它持续多长时间与行为相关。相关地,关键是要考虑在给定CAP状态模式中个体间变异必须有多大,才能揭示临床样本中的个体症状变异——从而使其成为精神症状的特质样神经标记。本研究的结果强调了在临床应用中解析瞬态(状态)或持久(特质)CAP属性的重要性。
换句话说,精神健康症状可以被视为在个体间(即作为特质)或个体内(即作为状态)变异,可以被分别量化。例如,特质焦虑是一个人在广泛的背景中以及较长时间内体验焦虑情绪的倾向。相反,状态焦虑是临床上定义的当前时刻发生的焦虑。当前的研究结果表明,总体上表现出高焦虑的概率与在任何给定时刻焦虑的可能性可能与相同的潜在神经共激活模式发生相关。我们认为这可能是一个普遍现象,可以扩展到其他心理健康结果。因此,未来的研究将很有价值,研究状态和特质神经特征在预测心理健康结果的严重程度和发生可能性中的联合贡献。
我们在可重复的神经行为关联中的结果突出了行为PC 1、2和3的神经相关性。具有较高认知能力(行为PC 1)的个体在CAP I中花费的时间比在CAP II中更长。行为PC 2与神经PC 1和2以及年龄和性别相关。关于静息态功能连接,虽然CAP I和II在语言、初级视觉和扣带-岛盖网络区域表现出差异,但这些CAP状态的总体模式涉及默认模式和额顶网络与属于次级视觉、躯体运动和背侧注意网络的区域之间的相反活动模式。这表明与从单模态感觉运动皮层到跨模态联合皮层的皮层层次结构相关,并可能在儿童期到青春期的功能连接发展中发挥作用。最后,这里的一个重要考虑是我们没有评估样本量对CAP及其属性估计的影响。目前尚不清楚本研究中捕捉个体变异一般模式的低维特征集是否特定于HCP S1200数据集中的样本,或是否可以推广到更大、更多样化的一般人群样本。在密集采样数天、数月或数年的数据集中,我们可能会发现另一个个体内(状态)变异的维度,这些变异贡献了个体差异的一般模式。在较小的样本量或不同样本组成的情况下,可能会减少观察到特定CAP(如CAP III)的机会,甚至可能检测到新的CAP。这可能是因为特定CAP可能很罕见,特别是当它与一般人群中不常见的神经模式相关时,这可能是神经精神或神经症状的情况。另一个重要方面是将这项工作扩展到儿童和青少年样本,考虑到随着人类大脑的发育,CAP的配置可能会有显著不同。此外,在本研究中,我们专注于研究无家庭关系的健康年轻参与者的CAP模式。使用其他动态功能连接方法(如隐马尔可夫模型),有人提出大脑状态的FO具有个体特异性并且高度遗传。探索完整的HCP S1200数据集可能有助于解决这些问题,以及这些CAP和相关神经指标是否具有遗传性,并且在单卵或双卵双胞胎之间更相似。
Biological interpretation of CAPs
一般来说,从BOLD fMRI信号中衍生的CAP可以解释为不同大脑区域随时间同步和协调其活动的模式。本研究中识别的三种CAP代表了在全脑范围内可重复观察到的共激活模式,这些模式在给定的时间和空间分辨率下在一般人群中可重复观察到。尽管这三种CAP(带有正负符号)可能并不涵盖所有可能的大脑状态,但值得注意的是,我们的结果收敛于如此可重复的低数量。虽然CAP分析依赖于样本(受试者)数量和时间点,但在本研究中,通过确定可重复的CAP数量来平衡这一限制。然而,我们承认人类大脑中真实的CAP数量可能超过本分析中确定的数量。未来使用更大数据集的研究可能会揭示更多可重复的大脑状态,包括罕见但一致的CAP。rs-fMRI扫描期间个体变异的潜在因素,如静息态扫描期间的极端焦虑、高度情绪、持续认知或物理疼痛,可能会影响CAP的估计。详细研究这种变异可能有助于识别先前在较小样本中被认为罕见或不可重复的潜在模式,但在更大数据集中可能变得明显,如HCP-YA S1200数据集或UK Biobank的完整样本。
Conclusions
理解大脑如何随时间生成共激活的神经活动模式,对于推导人类大脑中发生的可重复的全脑神经动态模式至关重要。在这里,我们通过量化神经共激活的状态(个体内)和特质(个体间)变异成分,推进了这一目标。我们通过利用嵌入在整个rs-fMRI BOLD信号范围内的丰富时空信息来实现这一目标,揭示了反映时间变化神经活动的全脑模式的三种CAP。关键的是,我们展示了在群体水平上可重复的空间CAP特征估计,以及在个体水平上CAP状态时间特征的可重复性。我们发现,CAP时间特征的不同参数,如驻留时间和持久性,可以一起研究,并表征为状态或特质特征。进而,我们展示了一个低维神经特征空间捕捉了CAP参数的状态和特质变异,这些参数进而表现出行为相关的特征。具体来说,表现出在给定CAP中花费较长时间、在CAP内持续时间较长以及在所有CAP之间转换变异较大的个体,也表现出较高的认知功能、改善的情绪调节和较低的酒精和物质使用。关键的是,个体占据特定CAP的概率高度可重复,并与神经和行为特征相关。这强调了研究CAP衍生指标作为神经标记的重要性,这些标记可能随着精神健康症状的变化而改变,并可能在发育过程中发生变化。总的来说,这些结果表明了人类神经共激活动态的可重复模式,这些模式捕捉了个体内和个体间的变异,进而映射到个体的功能生活结果。
声明:脑医汇旗下神外资讯、神介资讯、神内资讯、脑医咨询、Ai Brain 所发表内容之知识产权为脑医汇及主办方、原作者等相关权利人所有。




