提示
前言
神经肿瘤是颅内常见病,主要包括神经上皮肿瘤、脑膜瘤、转移瘤及淋巴瘤等。从483期开始将刊发“第二轮神经肿瘤系列”,与同道共享,欢迎大家批评指正和交流讨论。
病史简介
患者,男性,42岁,因“视物重影半月余”入院。
患者半月余前无明显诱因下出现视物重影,伴左眼外视不能,无头痛呕吐,无肢体抽搐无力,无面部疼痛麻木,无听力下降,无声音嘶哑,无吞咽困难及饮水呛咳,无畏寒发热等其他不适。予休息后上述症状无明显好转,遂到当地医院就诊,查头颅MR平扫提示:左侧脑桥占位性病变。患者为进一步诊治,至我院就诊,拟“颅内占位性病变”收治入院。既往无殊。
入院查体:体温:36.5℃,呼吸:16次/分,脉搏:87次/分,血压:133/77mmHg,神志清楚,对答切题,眼球无突出,双侧瞳孔等大等圆,直径2mm,对光反应灵敏,左眼活动外展受限,额纹对称,面部感觉无异常,嘴角无歪斜,伸舌居中,听力粗测无殊。颈软,双肺听诊呼吸音清,心律齐,未闻及心脏杂音,腹软,四肢肌力V级,肌张力无亢进,双侧巴氏征阴性,洼田饮水试验1级,Romberg征阴性。
诊治经过
入院后行头颅CT检查提示:左侧脑桥占位,伴可疑周围骨质吸收(图1),完善头颅磁共振增强扫描+灌注成像(PWI)提示:左侧脑桥见片状长T1长T2异常信号,大小约19*26mm,增强后明显强化,灌注成像呈高灌注。考虑左侧脑桥占位伴出血,岩骨区骨质疑有受累(图2)。



排除手术禁忌后,于2024-03-19在全麻下行经乙状窦后入路左侧开颅探查+脑干病变切除术,术中见病变组织呈鱼肉样,起源于左侧脑桥,质地不均,血供丰富,部分组织呈出血样改变。病变组织与周围脑组织分界不清,并累及左侧三叉神经、外展神经、面神经、听神经及局部硬脑膜。术中取少许组织送检,冰冻病理提示:胶质瘤考虑。显微镜下小心分离并逐步切除肿瘤。手术顺利,术后患者安返病房。术后予减轻脑水肿及预防感染等对症处理。术后第1天复查头颅CT(图3)及头颅增强MRI(图4),结果提示病灶切除范围可,未及其他明显异常。患者术后恢复可,神志清楚,遵嘱活动,左侧面瘫,左眼外展受限,左侧听力减退,四肢肌力正常,余未及其他明显异常。术后1周,患者病情稳定,至其他医院继续康复治疗。术后常规病理提示:胶质母细胞瘤,IDH野生型。


病理结果
常规病理报告显示组织学特征:圆细胞肿瘤,胞浆透亮,核分裂约10/10HPF,未见坏死,见高内皮血管增生(图5)。

图5. 常规病理组织学显示:圆细胞肿瘤,胞浆透亮,核分裂约10/10HPF,未见坏死,见高内皮血管增生。
整合诊断:胶质母细胞瘤,IDH野生型。
组织病理学类型:高级别胶质瘤。CNS WHO级别:4级。
免疫组化:B1-01(2):GFAP(-), Olig2(+),ATRX(+),p53(-,突变型),Ki-67(20%,+),CD45(LCA)(-),IDH1(R132H)(-),S100(+),Vimentin(+),Synaptophysin(+),NFP(-),NeuN(-),Chromogranin A(-),H3 K27M(-),H3 K27me3(+),CD34(-),BRAF V600E(-),MLH1(+),MSH2(+),MSH6(+),PMS2(+),INI1/SMARCB1(+)。
分子病理:MGMT启动子甲基化状态为非甲基化;IDH1/IDH2基因突变检测结果为阴性;TERT基因启动子突变检测结果为阴性。
术后1月,患者一般情况可,神志清,左侧面瘫,左眼外展受限,左侧听力减退,开始接受同步放化疗。同步放化疗结束休息4周后,患者开始替莫唑胺辅助化疗,并定期复查头颅增强MRI,目前患者术后10月余,病情稳定,正在随访中。
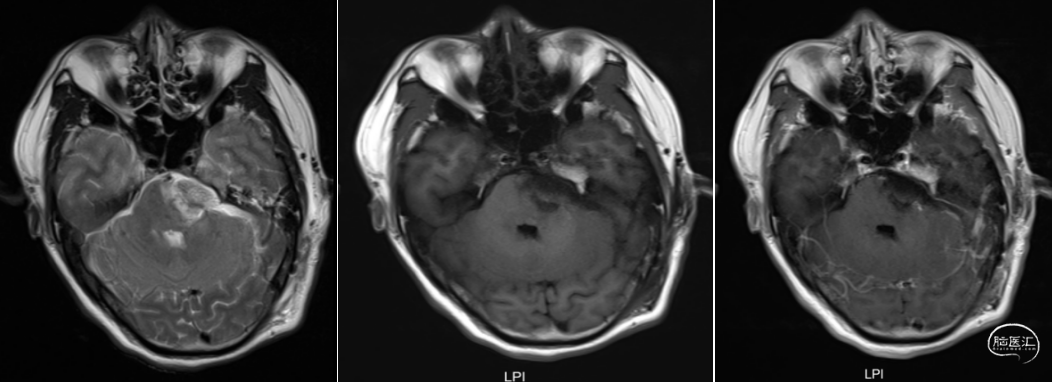
术后1、3、6月磁共振检查结果如下(图6-8)。
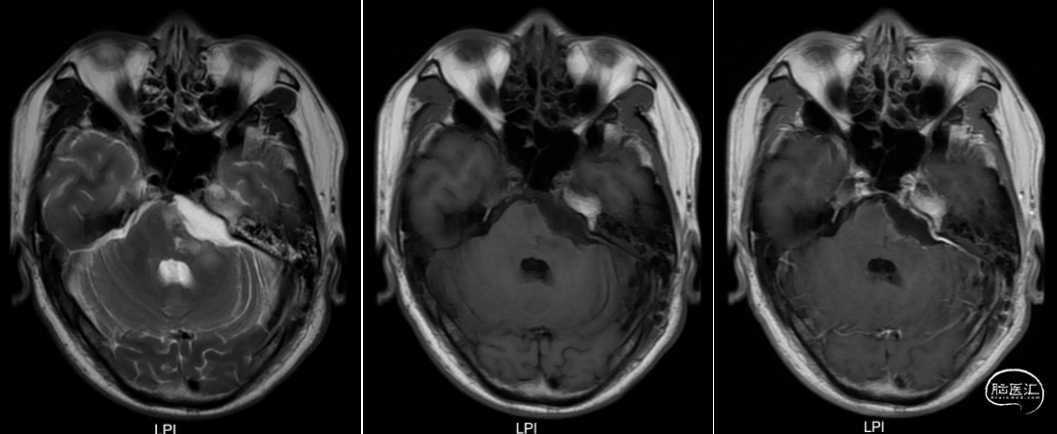

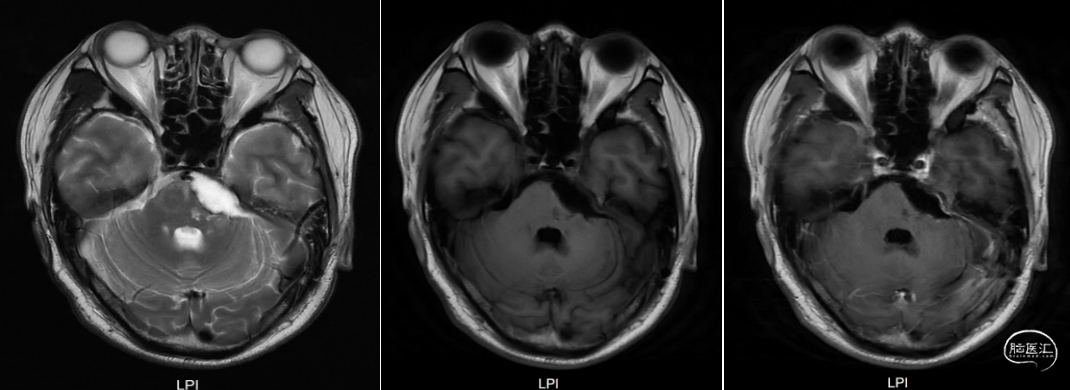

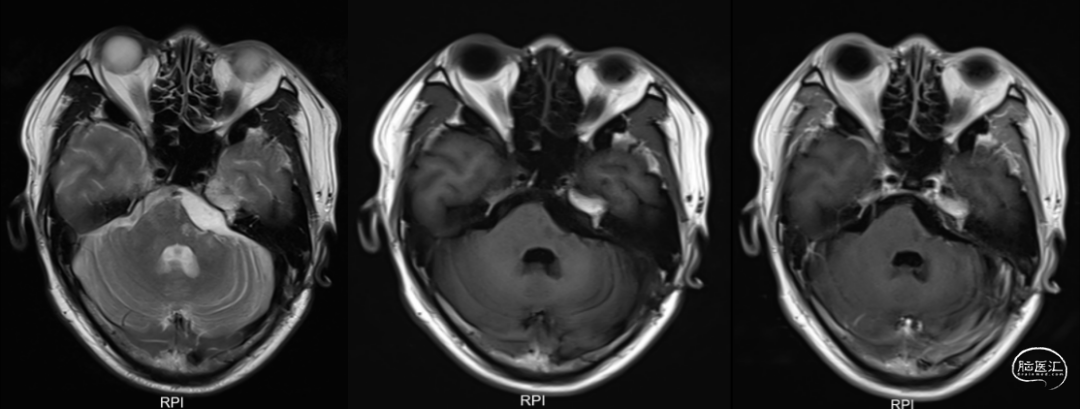

图8. 术后6月复查头颅增强MRI提示经乙状窦后入路左侧脑干病损切除术后,术区可见积液,周围脑组织见小片状长T2信号,增强扫描未见明显异常强化灶。
讨论
脑干胶质瘤(brainstem gliomas, BSG)是一类起源于中脑、脑桥和延髓的胶质瘤的总称。相较于儿童,成人BSG并不常见,仅约占所有原发性中枢神经系统恶性肿瘤的1%-2%[1]。由于其位置的特殊性和侵袭性,且对传统治疗手段(如放疗和化疗)反应有限,BSG的治疗仍具挑战性,需要多学科协作参与(图9)。

据研究统计,BSG发病高峰年龄呈双峰分布,儿童为5~10岁,成人为30~50岁[2]。目前,国内缺乏关于BSG的大规模、系统性流行病学研究数据。关于BSG的病因也尚不清楚,相关研究显示,H3F3A、IDH1、HIST1H3B/C、TP53、ACVR1、PPM1D、BRAF等基因突变与BSG的发病相关[3]。此外,部分BSG患者与Ⅰ型神经纤维瘤病(NF1)相关[4]。BSG常见的临床表现可包括脑神经功能障碍、长束征和共济失调等。而当病灶阻碍脑脊液循环通路后,可造成幕上脑积水,进而引起头痛、呕吐和视盘水肿等颅内压增高的表现。在影像学上,头颅CT缺乏特异性表现,头颅MRI是BSG影像学诊断的主要依据。PET-CT可以显示肿瘤的代谢情况,有助于鉴别和评估病变。
作为一类高度异质性的疾病,脑干胶质瘤有多种分类方法[5]:1)根据病变解剖部位,可分为中脑、桥脑、延髓以及累及多个部位的胶质瘤。2)根据生长方式特点,可分为弥漫性、局灶性、外生性(起源于四脑室室管膜下的胶质组织,多数向背侧和外侧生长)、颈延髓胶质瘤、顶盖胶质瘤等。3)根据病变恶性程度,可分为WHOⅠ-Ⅳ级。4)根据肿瘤细胞类型不同,可分为星形细胞瘤、毛细胞型星形细胞瘤、少突胶质细胞瘤、胶质母细胞瘤等。5)根据分子病理特点[6],可分为H3F3A K27M突变型(对放疗不敏感,易转移复发,预后较差)、HIST1H3B/CK27M突变型(常伴有ACVR1突变,较前一种预后好)、IDH1突变型(仅见于成人,预后较好)及其他类型(如无IDH1/2及H3.3/3.1突变的双阴型)等[7]。特别地,影像学分类在临床上具有重要意义,但目前分类分型标准也尚未统一。临床上较为常用的有[8]:1)基于MRI的BSG分型。Ⅰ型:外生型,肿瘤向外生长,主体位于脑干外部;Ⅱ型:内生型,可以分为Ⅱa型即局灶内生型和Ⅱb型即弥散内生型;Ⅲ型:为特殊类型,Ⅲa型为顶盖胶质瘤,Ⅲb型为导水管胶质瘤,其发生率较低,以梗阻性脑积水为首发症状;Ⅲc型为NF1相关的BSG,可以分布在脑干内任何部位。2)亦可根据DTI成像中皮质脊髓束和肿瘤的位置关系,将BSG分为3型[9]:A型:为推挤型,CST受到肿瘤推挤发生移位;B型:为推挤+破坏型,CST同时受到肿瘤的推挤和破坏;C型:为穿过型,CST从肿瘤内部穿过。上述影像分型有助于判断肿瘤是否适合外科治疗,预估手术风险及判断患者预后。
BSG的治疗以综合治疗为主,包括手术、放疗、化疗、靶向治疗及免疫治疗等。由于脑干不同部位的功能特点及部分肿瘤呈现弥漫性改变,手术治疗及其结果尚存争议[10]。是否采取手术治疗需结合病情的轻重、进展速度、患者的一般情况及意愿进行综合考虑。开颅手术的原则是在保护脑干重要功能的前提下最大程度地切除肿瘤,为放化疗等后续综合治疗提供较好的条件。因此,手术策略的选择至关重要。此外,术中可在多模态影像导航及术中神经电生理监测等引导下避开脑干内重要的传导束和核团,沿纤维束走行方向切开脑干,避免对纤维束过多的机械牵拉和损伤,有助于减轻手术带来的创伤。值得一提的是,尽管Hamisch等对脑干肿瘤立体定向活检术的研究发现,活检阳性率可达93.5%-98.1%,并发症发生率为4.2%-9.6%,活检死亡率为0.2%-1.3%,并认为脑干肿瘤立体定向活检术是安全可靠的,可为患者个体化、精准化治疗提供依据[11]。然而,鉴于脑干BSG的特殊性,是否行立体定向脑活检以获取病理信息也需综合考虑[12,13]。放疗无法延长多数患者的总生存期,只能在短时间内缓解症状,症状缓解期因病理级别而异。各种化疗方案亦未被证实能改善BSG的预后。针对成人BSG化疗的研究相对来说则更少,传统细胞毒药物、替莫唑胺、贝伐珠单抗等化疗方案的治疗效果仍有待评估。
特别地,在本病例中,患者诊断为左侧桥脑局灶性外生型胶质母细胞瘤,在临床中比较少见[14]。通常,成人BSG最常见于脑桥(~60%),也发生在延髓(~25%)和中脑(~15%),且多达80%的病例存在多个脑干区域受累[15]。而局灶性脑干胶质瘤大多位于中脑和延髓,常为毛细胞型星形细胞瘤。对于成人BSG,尽管手术和放疗等治疗方法有了新的进展,但预后仍然很差,中位总生存期约为24个月,5年总生存率约为10%[16]。对于部分合适的患者,合理的手术入路(图10),结合术中超声、术中电生理检测及多模态影像技术进行手术,可能有助于降低手术的相关并发症和改善患者的预后。

图10. 脑干胶质瘤的手术入路, Lus et al., Curr Oncol. 2023 Nov 7;30(11):9772-9785. doi: 10.3390/curroncol30110709.
参考文献
往期回顾
声明:脑医汇旗下神外资讯、神介资讯、神内资讯、脑医咨询、Ai Brain 所发表内容之知识产权为脑医汇及主办方、原作者等相关权利人所有。







