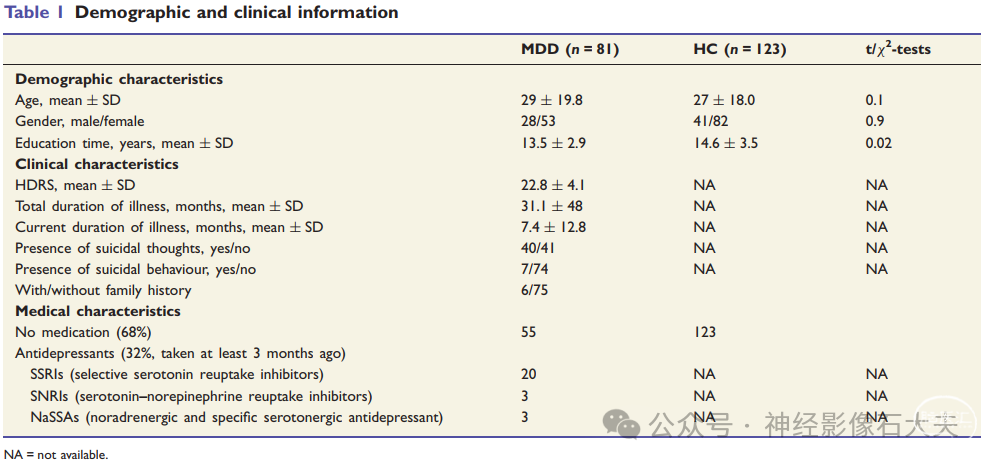
本文为 中科院 Sui Jing 教授和 华西医院 Ma Xiaohong 教授共同通讯作者发表于 Brain 的工作,题为“MicroRNA132 associated multimodal neuroimaging patterns in unmedicated major depressive disorder”。DOI:10.1093/brain/awx366。
Abstract
强有力的证据表明,表观遗传因素是抑郁症的症状致病因素,其中 microRNA132(miR-132) 被认为在抑郁症症状的发病机制和神经机制中起关键作用。此外,几个抑郁相关基因 [MECP2、ARHGAP32(p250GAP)、 CREB 和 period 基因] 被实验验证为 miR-132 靶标。然而,大多数关于 miR-132 在重度抑郁症中的研究都是基于尸检、动物模型或遗传比较。这项工作将首次尝试研究 miR-132 失调如何影响 81 名治疗重度抑郁症患者和 123 名人口统计学匹配的健康对照者以及未接受过药物治疗的重度抑郁症患者子集的多模态脑成像数据的协变。血液中的 MiR-132 值 (患者>对照) 用作指导三种 MRI 特征的融合: 分数低频振幅、灰质体积和分数各向异性。与 miR-132 相关的多模态成分也显示出显著的负荷组间差异。结果表明,(i) 重度抑郁症中较高的 miR-132 水平与额叶边缘网络中低分数频振幅和灰质体积较低有关;(ii)与 miR-132 水平升高相关的脑区也与注意力和执行功能较差的认知表现有关。使用数据驱动的监督学习方法,我们确定重度抑郁症中的 miR-132 失调与额叶边缘网络(情绪调节和记忆的关键网络)中大脑功能和结构的多个方面有关,这加深了我们对重度抑郁症中 miR-132 失调如何导致特定大脑区域功能丧失并与相关认知障碍相关的理解。
Keywords: major depressive disorder; microRNA132; supervised multimodal fusion; fronto-limbic network; unmedicated
Introduction
重度抑郁(MDD) 的特征是情感、认知、神经形态学和分子异常,这些异常可能起源于神经发育。据世界卫生组织数据,到 2020 年,MDD 患者将成为仅次于心血管疾病的世界第二大致残病因。与精神分裂症和自闭症障碍(高遗传性精神疾病)相比,抑郁症的遗传性相对较低,估计为 30-40%,而越来越多的研究表明表观遗传学在 MDD 中起着重要作用。MicroRNA (miRNA) 是重要的表观遗传调节因子,可以调节 >50% 的人类基因,并在精神性疾病研究中受到深入的研究兴趣。由于高水平的潜在调节影响,某些 miRNA 可能会强烈影响基因表达,并在遗传基础难以捉摸的疾病的病理生理学或病因学中发挥作用。
先前的实验证据表明,miR-132 是一种大脑富集的 miRNA,在成体神经发生的早期和晚期都起关键作用,包括成体神经干细胞的增殖和分化、树突形态发生的调节和突触可塑性。此外,预计 miR-132 可调节神经元、活动特异性生物通路的多个成员,包括长期抑郁通路。最近的一项研究表明,与健康对照受试者相比,MDD 患者的血清 miR-132 水平升高,与自我评价抑郁量表评分之间存在显著的正相关。另一项研究还表明,与健康对照受试者相比,MDD 外周血样本中 miR-132 的表达增加。此外,在慢性应激诱导的抑郁症动物模型中,在海马体中检测到 miR-132 表达水平增加。此外,几个抑郁症相关基因 [MECP2, ARHGAP32(p250GAP)、CREB 和 period 基因] 被实验验证为 miR-132 靶标。以上所有证据表明,miR-132 可能在抑郁症症状的发病机制和神经元机制中起重要作用。基于这些 MDD 中异常的 miR-132 表达水平发现,我们假设 miR-132 可能与负责情绪调节的大脑网络的改变有关,并且在 MDD 中持续受损,例如额叶边缘网络。多项 MDD 研究集中在典型的大脑受损脑区,例如前额叶皮层、海马和杏仁核,因为它们在情绪处理和抗抑郁作用中的作用。然而,大多数研究要么使用单模态分析,要么在每种模态内进行单独分析后进行多模态比较。在这种情况下,经常会错过多种模态之间的交叉信息。 这项工作的一个主要动机是利用现有数据中的交叉信息,从而揭示与兴趣测量特别相关且无法使用单一模式检测的重要关系。
强有力的证据证实,MDD 患者反映了大脑结构和功能的根本差异。此外,大多数关于 miR-132 在抑郁症中作用的现有研究都是基于死后组织学分析、动物模型或遗传比较。迄今为止,还没有研究在联合分析中将 miR-132 与多模态脑成像数据直接联系起来,以研究成像-表观遗传关联和重度抑郁症的潜在神经机制。在这项工作中,我们旨在应用一种新的、有监督的、多模式融合与参考方法,以确定在一个表观遗传参考点 (miR-132) 的指导下,未治疗 MDD 患者的 miR-132 水平与三种 MRI 测量之间的关联。与无监督融合相比,这种监督学习模型可以更加以目标为导向,因为它利用特定的先验知识来指导融合分析,从而使研究人员能够从大型复杂数据集中精确定位感兴趣的特定成分。由于难以从脑组织获得 miR-132,这里我们使用从外周血中提取的 miR-132 作为参考。正如之前报道的,在血液中测量的表观遗传特征(如 miR-132)可以作为大脑的替代标志物,尤其是情绪障碍。
据我们所知,这是首次尝试在特定 miRNA (miR-132) 的指导下联合挖掘三种类型的 MRI 数据来估计多模式生物标志物,该 miRNA 用于研究 81 名未用药的 MDD 患者和 123 名健康对照受试者的影像学-表观遗传协方差。以受试者的 miR-132 水平为参考,共同分解了三种 MRI 特征 [静息态功能 MRI (rs-fMRI) 的分数低频振幅 (fALFF)、结构 MRI 的灰质体积和弥散 MRI 的分数各向异性]。此外,还进行了与多个认知域 [由剑桥神经心理学测试自动组(CANTAB) 测量] 和抑郁症状的相关性分析,以研究与受 miR-132 调节识别脑网络的潜在认知和症状关系。
Materials and methods
Participants
在本研究中,我们从四川大学华西医院心理健康中心招募了 81 名未用药 MDD 患者和 123 名人口统计学匹配的健康对照受试者,这些受试者的年龄和性别进行了匹配。所有受试者的人口统计数据如 Table 1 所示。所有 MDD 患者均根据重度抑郁的 DSM-IV 的结构化临床访谈(SCID)进行纳入,汉密尔顿抑郁量表 (HDRS) 评分 > 17 分,年龄在 18-60 岁之间。排除标准包括并发神经系统疾病、智力低下、心血管疾病、双相情感障碍、精神分裂症、焦虑症、酒精或药物滥用以及意识丧失病史的患者。为避免药物的影响,我们确保所有参加我们研究的患者在扫描前至少 3 个月停止服用任何抗抑郁药(即 未服用药物的 MDD),而一部分 MDD 患者(26/81, 32%)之前接受过抗抑郁药物治疗。详细的临床信息见 Table 1。所有患者均应尽快 (通常在 3 天内) 进行评估和扫描,以防止延误治疗。从人口统计学上看,类似的健康志愿者是通过当地社区内的海报广告招募的。专业精神病学家还使用 SCID 非患者版(SCIDI/NP),以确保他们现在或过去都没有抑郁症、其他重大身体或神经系统疾病或任何药物滥用史。所有参与者在参与研究前都签署了知情同意书。本研究经四川大学伦理委员会批准,根据赫尔辛基宣言进行。来自 CANTAB 的测试、成像参数和预处理细节见 Supplementary material。
MiR-132 expression measurement in peripheral blood
使用 Tempus™ Blood RNA 管从每个受试者收集全血(3 ml)。立即将血液剧烈混合至少 10 秒,并在 -80°C 下冷冻直至使用。根据制造商的方案,使用用于稳定血液管 RNA 分离试剂盒的 MagMAX™ 分离总 RNA。使用 NanoDrop ND-2000 检测 RNA 的质量。使用 RevertAid™ 第一链 cDNA 合成试剂盒和 miRNA 特异性茎环引物进行逆转录反应。将逆转录反应产物立即储存在 −20°C 下以供进一步分析。qPCR(定量实时 PCR)反应在实时循环仪中完成。反应混合物由 5 μl 2×SYBR® Green 超混合液 、200 nM miRNA 特异性引物和 200 nM 通用引物(0.8 μl 逆转录产物)组成;用水将体积调节至 10 μl。PCR 反应在 95°C 下孵育 3 分钟,然后在 95°C 下循环 10 秒,在 60°C 下循环 60 秒。在 PCR 运行结束时,在 66–99°C 的范围内绘制熔解曲线,温度每 2 秒逐步升高 0.5°C。如上所述,所有实验一式三份进行。使用比较 ΔCt (ΔΔCt) 方法计算 miR-132 的相对水平,使用小 RNA U6 作为归一化对照(http://www.mirbase.org/)。
Feature extraction and correction
提取三个代表性的 MRI 特征(fALFF、灰质体积和分数各向异性),然后将每种模式简化为一个特征矩阵,每行代表一个被试(有关详细信息,请参阅Supplementary material)。然后将这三个矩阵标准化为具有相同的平均平方和(针对每种模态的所有受试者和所有体素计算),以确保所有模态具有相同的范围。接下来对每个归一化特征矩阵进行协方差多变量分析 (MANCOVA)。性别、年龄和教育程度以及它们的交互作用被设置为协变量,并且回归掉所有这些效应,以尽量减少它们对影像数据的潜在影响。融合前三个 MRI 特征的统计功效分别为 fALFF 为 0.89、分数各向异性为 0.85 和灰质为 0.94,miR-132 水平为 0.90,这些都足够高,可以确保对检测到的组效应得出准确和可靠的结论。详细的统计分析见Supplementary material。
Fusion with reference
所得数据通过称为“MCCAR+jICA”(多站点典型相关分析与参考 + 联合独立成分分析)的融合与参考模型进行联合分析,如 Fig.1 所示,其中 miR-132 被设置为参考,以指导基于监督学习的三个 MRI 特征的联合分解。
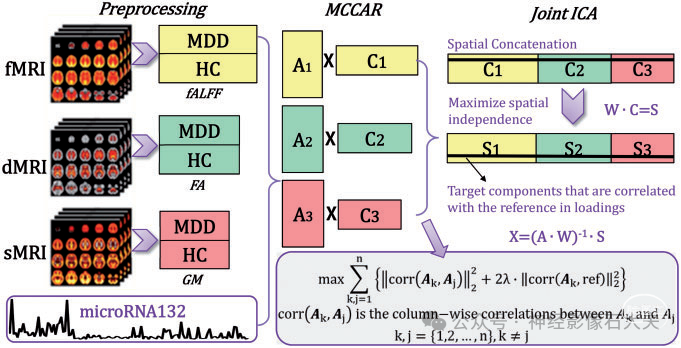
Figure 1 Flowchart of the supervised data fusion strategy (MCCAR + jICA). The strategy simultaneously maximizes the inter-modality covariation and correlations between loadings of certain components and the reference (i.e. the miR-132 levels).
该模型可以同时最大化某些影像成分与 miR-132 水平的模态协变和相关性。因此,它能够识别与 miR-132 和它们之间(模态间相关性)具有稳健相关性的联合多模态成分,而盲(无监督)N 路多模态融合方法可能无法检测到(Supplementary Fig.3)。采用交叉验证方法确定 miR-132 定向融合分析中的参数;详细信息见 Supplementary Fig.1,使用 λ = 0.95(应为0.9?)。根据改进的最小描述长度标准为每个特征估计了 24 个组成成分。进一步对每种模态的每个成分的混合系数进行双样本 t 检验。我们旨在研究联合独立成分 (IC)在模式之间协变和组间判别能力,这些成分与 miR-132 水平显著相关。

Figure S1. Correlation of the identified components and miR-132 across multiple cross-validations. When λ is 0.9, the mean correlation between estimated target IC and miR-132 of all modalities reaches its maximum value. The black line, yellow patch and blue line represent mean, standard error of the mean (SEM) and the standard deviation (SD) of correlations between target IC and miR-132.
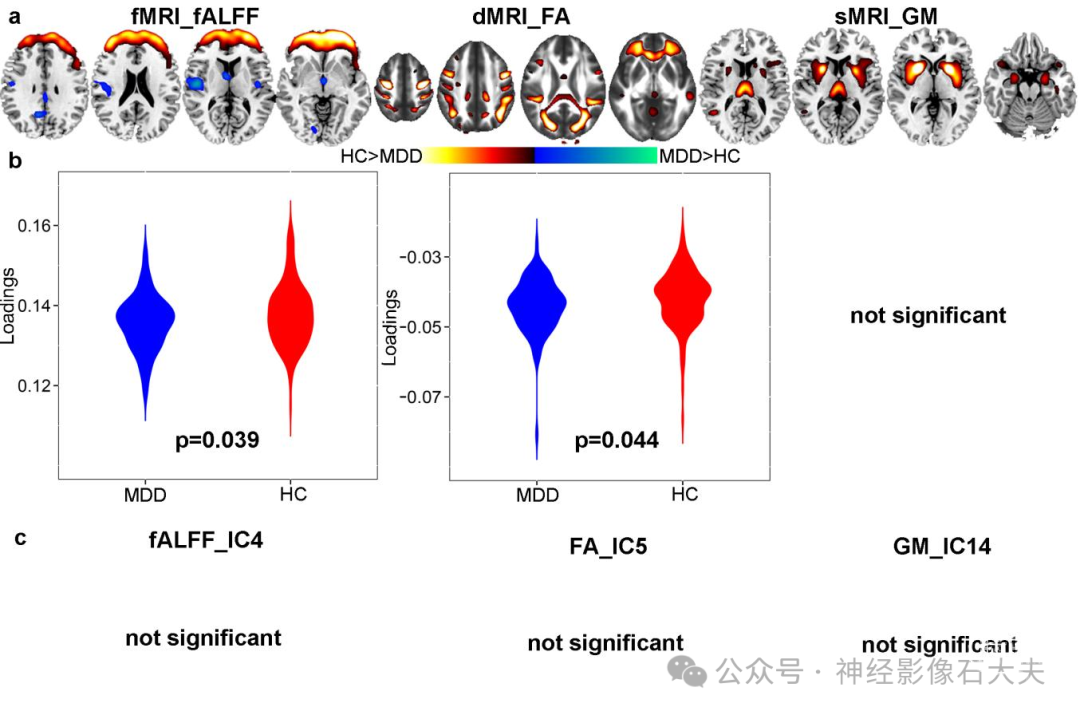
Figure S3. MiR-132 associated multimodal components generated by unsupervised fusion method: MCCA+jICA. (a) The spatial maps visualized at |Z|>2, where the positive Z-values (red regions) means HC>MDD and the negative Z-values (blue regions) means HC<MDD. For fMRI, only prefrontal regions are extracted, but without the limbic system (hippocampus and amygdala). (b) Boxplot of the loading parameters of ICref that were adjusted as HC>MDD on the mean of loadings. Note that for sMRI there is no components to be group discriminating. (c) Correlation analysis of loadings of ICref and miR-132 levels. It is clear that correlations of loadings of all three modalities with miR-132 are not significant.
为避免药物影响,我们还对未接受过药物治疗的 MDD 患者子集 (n = 55,不包括 32% >3 个月前接受过抗抑郁药治疗的 MDD 患者) 和人口统计学匹配的健康对照受试者(n = 65)进行了相同的 miR-132 定向融合,人口统计信息见Supplementary Table 1。
Results
Expression levels of miR-132 in peripheral blood
由于很难直接从患者的大脑中确定 miR-132 水平,因此越来越多的努力集中在检测血液中的 miR-132 水平上;具体来说,情绪障碍患者大脑中的 miR-132 水平可以通过他们血液中测量的水平来反映。我们发现,根据以前的研究,未用药的 MDD 患者 miR-132 的表达水平高于健康对照受试者 (P = 0.0136)。在未接受过药物治疗的 MDD 亚组和人口统计学匹配的健康对照受试者之间仍然存在这种组间差异 (P = 0.0167)。此外,未用药的 MDD 患者和未接受过药物治疗的 MDD 患者之间 miR-132 的表达水平没有组间差异 (P = 0.803)。有关更多详细信息,请参见 Supplementary Fig. 2 中的亚组间箱线图。
MiR-132 associated multimodal covarying imaging patterns
对于功能 MRI、弥散 MRI 和结构 MRI ,发现一个联合成分(表示为 ICref,在所有三种模态中具有相同的 IC 顺序)分别 与miR-132 (r = −0.342*、−0.335*、−0.376*(*表示多重比较FDR 校正)相关(详见 Supplementary material),并且具有显著的组间区分度(功能 MRI、弥散 MRI 和结构 MRI 分别为 P = 0.0003*、0.001*、0.036)。将空间图转换为 Z 分数,|Z| > 2 如 Fig.2A 所示,并作为健康对照受试者> MDD 针对负荷参数的平均值进行所有模态的校正(Fig.2B 中的箱线图)。因此,正 Z 值(红脑区域)表明健康对照受试者的贡献高于 MDD 患者,负 Z 值(蓝脑区域)表明 MDD 患者的贡献高于健康对照受试者。Supplementary Table 2 分别总结了 fALFF (Talairach 标签)、分数各向异性 (白质束,来自约翰霍普金斯图谱) 和灰质 (蒙特利尔神经学研究所标签) 的 ICref 中识别的脑区。Fig.2C 显示了 ICref 负荷与 miR-132 水平之间的相关性(健康对照受试者:红点,MDD:蓝点);较低的 IC 负载对应于 MDD 患者较高的 miR-132 水平。请注意,即使排除两个 miR-132 水平远高于其他 MDD 受试者(如 Fig.2C 所示),miR-132 与联合成分之间的相关性仍然显著(功能MRI_ICref:r = 0.269,P = 0.002*;DTI_ICref:r = 0.283,P = 0.001*;结构MRI_ICref:r = 0.287,P = 0.001*)。此外,即使在回归组效应后,miR-132 水平与脑成分负荷之间的偏相关仍然显著(Supplementary Table 3)。
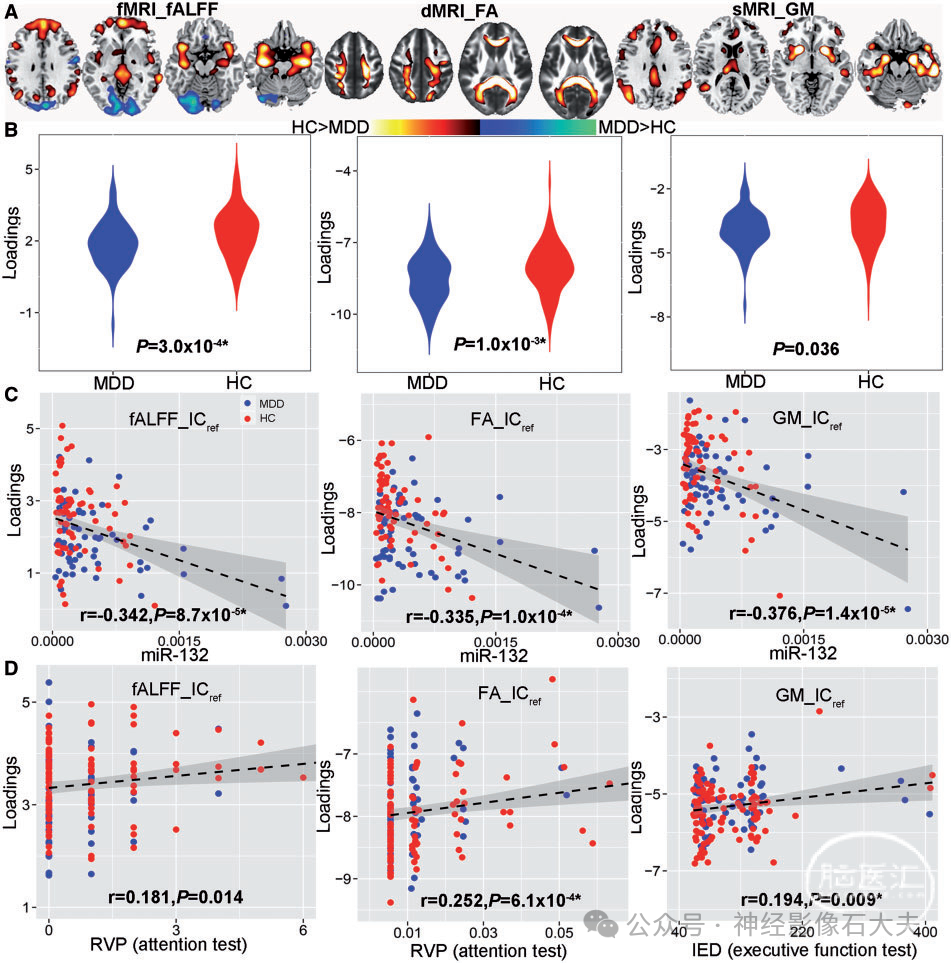
Figure 2 The identified joint components that are not only correlated with miR-132 levels, but also show significant group differences in all modalities. (A) The spatial maps visualized at |Z|> 2, where the positive Z-values (red regions) means healthy control subjects > MDD and the negative Z-values (blue regions) means healthy control subjects5 MDD. (B) Boxplot of the loading parameters of ICref that were adjusted as healthy control subjects 4MDD on the mean of loadings. (C) Loadings of ICref and miR-132 levels were negatively correlated (healthy control subjects: red dots, MDD: blue dots); thus MDD correspond to higher miR-132 expression levels and lower loading weights compared to healthy control subjects. (D) Correlation between loadings of ICref and CANTAB cognitive domain scores. The higher Rapid Visual Information Processing score (RVP attention test) corresponds to better attention, which is linked with higher fractional anisotropy and fALFF in the identified red regions. Similarly, a higher IED score (Intra-Extra Dimensional Set Shift, executive function test) is associated with higher grey matter volume in the identified grey matter regions, suggesting better executive function. *Significance passed FDR correction for multiple comparisons. The grey regions in C and D indicate a 95% confidence interval. dMRI = diffusion MRI; FA = fractional anisotropy;fMRI = functional MRI; GM = grey matter; sMRI = structural MRI. |
如 Fig. 2 所示,MDD 中 miR-132 的较高表达水平与海马、海马旁、杏仁核、背外侧前额叶皮层(DLPFC)[Brodmann 区 (BA) 9、46] 和岛叶(由额叶边缘神经回路组成)的 fALFF 和灰质值降低有关。仅对于功能 MRI,较高的 miR-132 水平与前扣带皮层和下顶叶的较低 fALFF 相关,但与视觉皮层较高的 fALFF 相关。仅对于灰质,miR-132 增加与丘脑、尾状核和前扣带皮层灰质体积减少相关。MiR-132 还与丘脑前放射、上纵束、大钳、小钳等中同时发生的减少的分数各向异性有关。
MiR-132 association with cognitive measures and symptoms
对注意和执行功能 (通过 CANTAB 测量) 等多个认知领域进行了相关性分析,因为这两个认知域在 MDD 患者中通常受损。如 Fig.2D 所示,miR-132 水平的增加与注意网络中较低的 fALFF 相关,对应于较差的注意表现 [r = 0.181,P = 0.014,快速视觉信息处理 (RVP)注意测试]。此外,主要白质束中较低的各向异性分数值也与注意测试中较差的表现有关 (r = 0.252,P = 6.1 × 10e−4*)。前额叶和海马体区域的灰质减少与执行功能较差相关,通过额外维度内设置偏移 (IED) 测量,其中 r = 0.194 和 P = 0.009*。最后,关于与抑郁症状的关联,在我们的结果中,只有分数各向异性 ICref 与 HDRS 显著相关(r = −0.223,P = 0.04),表明胼胝体中较低的分数各向异性值与更严重的抑郁症状相关),如 Supplementary Fig. 4 所示;灰质 ICref 和 fALFF ICref 与 HDRS 无关。这可能是由于胼胝体的结构变化已被证明会导致半球连接改变以及情绪和认知控制受损,这可能使个体容易出现更严重的抑郁症状。另一个原因可能在于 miR-132 水平与 HDRS 之间的原始相关性,由于 MDD 患者的样本量有限 (n = 81),因此相关性不显著;因此,识别的 miR-132 相关成分不一定与抑郁症状相关,因为参考引导的融合将导致联合成像成分与 miR-132 水平显著相关。相反,HDRS 与其他成分之间的相关性分析(我们估计监督融合中每种模态有 24 个成分)确定了另一个与 HDRS显著反相关的灰质成分(GM_12)(r = -0.242,P = 0.029),如 Supplementary Fig. 5 所示。突出显示区域(包括海马体、前扣带皮层和左丘脑)的灰质体积越低,未接受药物治疗的 MDD 患者表现出的抑郁症状就越严重,这与以前的发现一致。
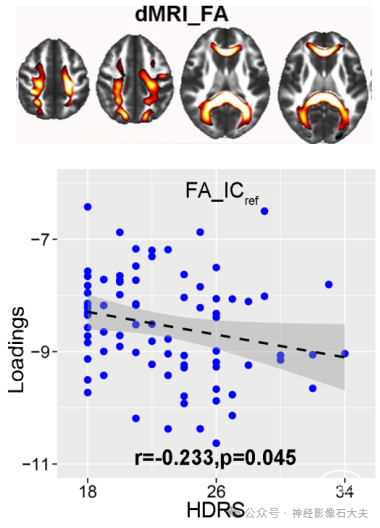
Figure S4. Correlation between FA_ICref and HDRS.
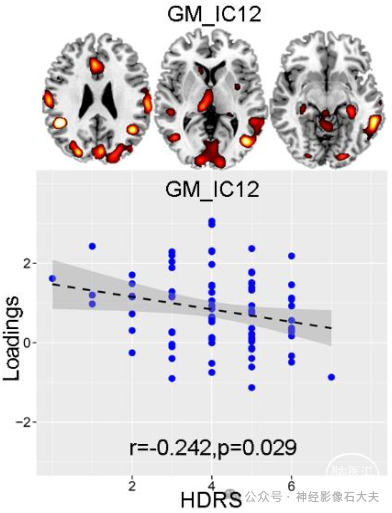
Figure S5. Correlation between loadings of GM_IC12 and HDRS.
Subset replication
为了测试先前使用药物的影响,我们还对一个子集进行了相同的 miR-132 定向融合分析,包括 55 名未接受过药物治疗的 MDD 患者和 65 名匹配的健康对照受试者(Supplementary Fig. 6)。Fig.3 比较了整个未用药的 MDD 患者组和未接受过药物治疗亚组之间 miR-132 相关的多模态协变模式。显然,两个数据集之间的空间相似性很高,灰质、分数各向异性和 fALFF 分别为 r = 0.76、0.62 和 0.55(Fig.3,蓝色箭头),表明先前使用药物对与 miR-132 失调相关的大脑模式影响不大。此外,miR-132 相关成分(Fig.3,绿色箭头)在模态之间也呈成对相关(Fig.3,橙色箭头),这意味着受试者之间存在显著的多模态协变。
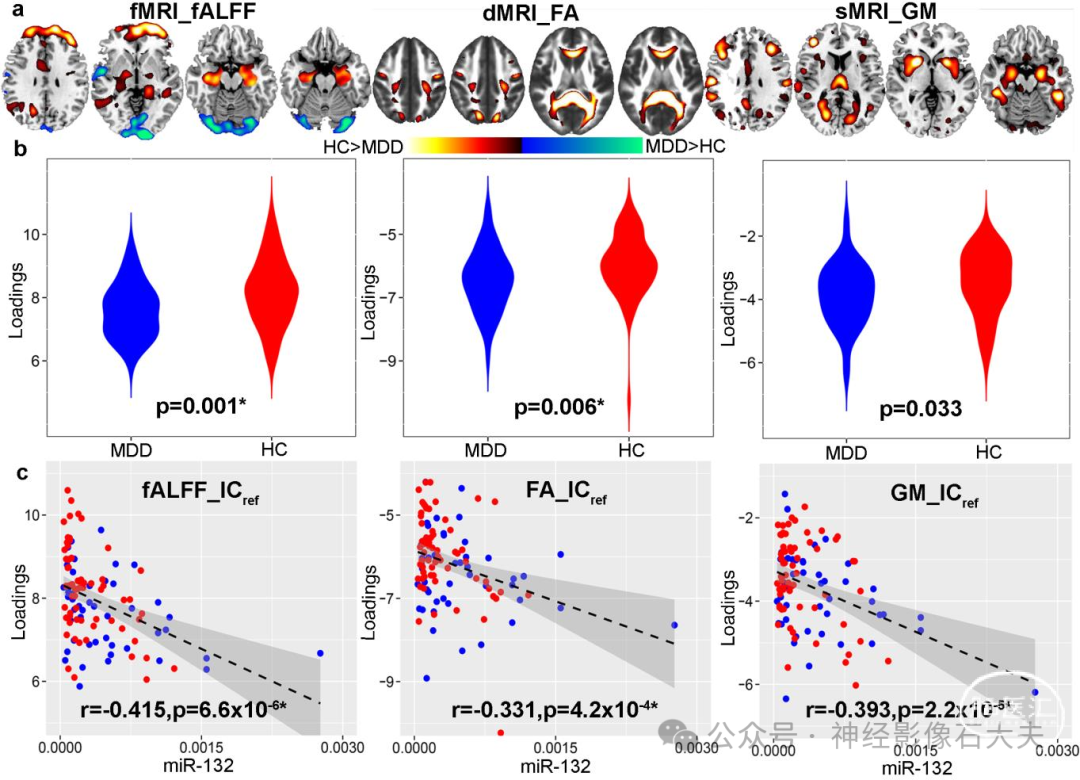
Figure S6. The identified joint components of the medication-naïve MDDs and matched HCs. (a) The spatial maps visualized at |Z|>2, where the positive Z-values (red regions) means HC>MDD and the negative Z-values (blue regions) means HC<MDD. (b) Boxplot of the loading parameters of ICref that were adjusted as HC>MDD on the mean of loadings. (c) Loadings of ICref and miR-132 levels were negatively correlated (HC: red dots, MDD: blue dots); thus MDD correspond to higher miR-132 expression levels and lower loading weights as compared to HC. Note that * means significance passed FDR correction for multiple comparisons.
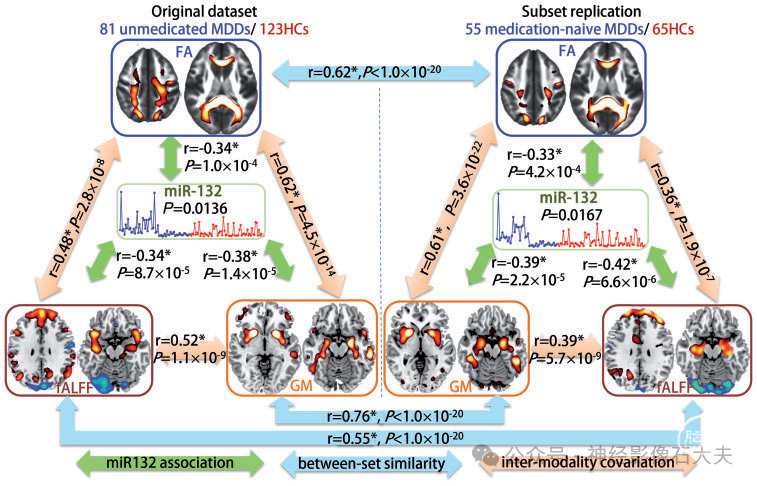
Figure 3 Comparison of miR-132 associated multimodal covarying patterns between unmedicated patients with MDD and medication-naïve patients with MDD. The orange arrows represent inter-modality covariation between different modalities; the blue arrows represent intra-modality similarity cross different datasets and the green arrows denote the correlations between miR-132 and the target joint components. *Denotes the correlations passing FDR correction for multiple comparisons.
Discussion
据我们所知,这是第一项将 miR-132 与抑郁症多模态人脑成像联系起来的研究。我们试图揭示异常表观遗传因素(如 miR-132 水平)如何导致多模态神经影像学损伤,从而为抑郁症的病理生理学提供见解。结果表明,miR-132 影响未用药 MDD 患者的多个功能和结构脑区,尤其是额叶边缘回路(前额叶皮层和边缘系统),这是情绪调节、记忆和学习的关键网络。Fig.4 总结了与未接受药物治疗的 MDD 患者和健康对照受试者的 miR-132 水平密切相关的识别的多模态协变模式。
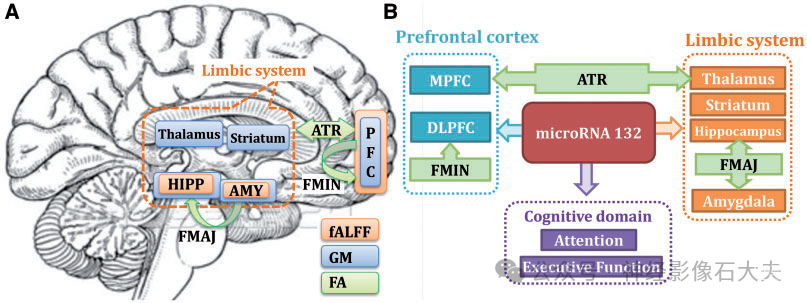
Figure 4 Summary of our findings about miR-132 dysregulation in unmedicated depression. (A) Mapping of three MRI components in the same brain with three colours. Note that prefrontal cortex, hippocampus and amygdala are all identified in both fALFF and grey matter,constituting the fronto-limbic system that has been implicated in mediating emotional processing and the pathophysiology of MDD in adults. Note that these regions were also touched or linked by the identified white matter tracts such as the anterior thalamic radiation (ATR), superior longitudinal fasciculus (SLF), forceps minor (FMIN) and forceps major (FMAJ) (green arrows); while this is all data-driven, it further validates the effectiveness of multimodal fusion. (B) Inference and summary based on our results. Here higher miR-132 expression levels are related with lower fALFF and grey matter in the fronto-limbic circuits and result in poorer attention and executive functions in MDD. Note that forceps minor interconnects the left and right prefrontal cortex across hemispheres (detected in both fALFF and grey matter), anterior thalamic radiation links prefrontal cortex (PFC) with the thalamus, providing evidence for disrupted anatomical connections in fronto-limbic circuitry. Our results clearly support that key depression-associated brain areas, previously implicated in functional, anatomical and structural brain-imaging studies, may be affected by miR-132 dysregulation. AMY = amygdala; DLPFC = dorsolateral prefrontal cortex;FA = fractional anisotropy; GM = grey matter; HIPP = hippocampus; MPFC = medial prefrontal cortex.
如 Fig.4A 所示,我们成功提取了 fALFF 和灰质中的 DLPFC 和内侧前额叶皮层以及边缘系统。这两个隔室构成了额叶边缘系统,这是 MDD 现有分析中最常见被识别的网络。特别是,额叶边缘神经网络介导情绪处理,该系统与成人和青年 MDD 的病理生理学有关。这种基线和变化相关激活的模式似乎与先前提出的边缘-丘脑-皮质回路参与抑郁症一致。如 Fig.4B 所示,在分数各向异性中由大钳连接的边缘系统与 PFC(均在 fALFF 和灰质中检测到)连接,PFC 在分数各向异性中被小钳区穿过,以及在分数各向异性中通过丘脑前辐射连接的丘脑-前额叶回路。请注意,上述所有识别的白质束都连接了边缘系统和前额叶脑区(Fig.4,绿色箭头)。这都是数据驱动的,这进一步验证了多模式融合的有效性,并支持 miR-132 失调可能会影响额叶边缘回路的功能和结构。此外,这种 miR-132 相关的额叶边缘网络在未接受过药物治疗的 MDD 子集中复制(Fig.3),表明这种关联不受 3 个月前服用抗抑郁药的影响。
关于不同组织的表达模式,根据人类基因数据库在正常人体组织中的基线条件下,在大脑、垂体、卵巢和胫神经的正常组织中检测到 miR-132 基因表达。请注意,miR-132 受 CREB 调节,其水平在神经元活动后显著增加。关于 miR-132 在不同大脑区域的表达,以前的实验结果表明,miR-132 是一种大脑富集 miRNA,在成体神经发生的早期和晚期都起着关键作用。此外,根据动物模型研究,与其他大脑区域相比,前额叶区域的 miR-132 表达水平更高。具体来说,正如我们的结果一样,miR-132 表达谱的增加导致前额叶脑区 (包括 DLPFC 和内侧 PFC) 的 fALFF 降低和灰质体积减少。此外,在慢性压力诱导的抑郁症大鼠模型中,在海马中也检测到 miR-132 表达水平增加。MiR-132 还被证明可以控制树突和棘的发育,以及培养的海马神经元和新生海马神经元的突触整合。相应地,在我们的结果中确定了两个大脑区域 (PFC 和海马)。
此外,如 Figs 2 and 4 所示,MDD 中 miR-132 的增加也与边缘系统(尤其是海马和杏仁核)中 fALFF 和灰质值的降低有关。在慢性应激诱导的抑郁症动物模型中,发现 miR-132 表达在 CUS (慢性不可预测的应激源) 暴露大鼠的海马中上调。MiR-132 还被证明可以控制树突和棘的发育,并刺激培养的海马神经元和新生海马神经元的突触整合。此外,BDNF 、 CREB 和糖皮质激素也是海马神经发生的关键成分,所有这些都与 miR-132 直接相关。上述发现支持了我们的推测,即海马 miR-132 的增加可能在抑郁症的病因学中起重要作用,这也与两项荟萃分析研究一致,这些研究表明 MDD 患者海马灰质体积显著减少。杏仁核是边缘系统的另一个组成部分,是参与情绪反应和情绪相关记忆的最显著的大脑结构。在我们的研究中观察到的杏仁核体积减少与基于感兴趣区的未用药 MDD 患者杏仁核分析得出的证据一致,并被单相抑郁症患者死后大脑的发现证实。
请注意,杏仁核和海马体之间的相互作用也是情绪学习的关键参与者。海马和杏仁核是边缘系统的核心脑区,与不同的皮质区域有广泛的连接,例如额叶皮层、丘脑前核、基底神经节和下丘脑,所有这些区域都是已知构成情绪调节神经解剖网络的区域。杏仁核改变海马反应,反之亦然。正如之前报道的那样,杏仁核和海马的这种双重相互作用以及它们之间的动态可能支持基于情感的记忆独特性。这也与我们的结果一致,即较高的 miR-132 表达水平与海马-杏仁核中较低的 fALFF 和灰质体积以及 MDD 中较差的执行功能相关。上述提取的额叶边缘系统是情绪调节和记忆的关键网络,这可能与未用药的 MDD 患者的认知障碍有关。这些改变涉及由前额叶皮层的多个部分组成的分布式神经回路与边缘区域(海马、杏仁核和丘脑)相互作用。
本研究的另一个有趣发现是,发现单个 miR-132 影响认知能力主要集中在注意力(RVP) 和执行功能 (IED)领域,而最近的荟萃分析也表明,这两个领域是 MDD 患者受影响最严重的认知域。正如我们的结果所示,MDD 患者 miR-132 的表达水平高于健康对照受试者,这与 miR-132 过表达导致严重认知缺陷的报道一致。miR-132 的较高表达水平导致 PFC、岛叶和前扣带皮层 (突显网络的关键部分)内的 fALFF 降低,但视觉皮层(BA17、BA18、BA19) 中的 fALFF 增加。有证据表明,对 miR-132 的抑制会改变树突棘的成熟,并阻止视觉皮层内神经元的眼优势可塑性,这支持我们的发现。因此,提到的所有 fALFF 脑区都与抑郁症有关,并且与注意力缺陷有关,这与fMRI_ICref 与注意力域 (RVP) 相关一致。此外,在许多神经认知障碍中,miR-132 的失调也被认为在海马依赖性学习和记忆中很重要。这些 miR-132 表达水平被发现在一个狭窄的范围内受到严格调节,以确保正常的学习和记忆形成,这与与结构 MRI_ICref 相关的执行功能域 (IED) 相对应。根据我们的结果,我们可以推测 MDD 患者外周血 miR-132 水平升高可能与他们的注意力和执行功能功能障碍密切相关,这提供了有希望的证据,表明 miR-132 失调可能影响 MDD 患者的神经认知障碍。
这项工作的一个可能的局限性是,我们只测试了一种与抑郁症研究有关的 miRNA,而可能存在大量的 MDD 相关 microRNA 及其靶基因库;这些将留给未来的研究。其次,我们测量了外周血中的 miR-132 水平,而不是直接从大脑中提取。鉴于从脑组织获得 miR-132 的难度,在更容易获取的组织(如血液)中测量的表观遗传特征可以作为大脑的替代标志物。根据以前的观察,情绪障碍中大脑中 miR-132 的总体水平可以通过其在血液中的水平来反映。因此,有人提出表观遗传过程(未用药 MDD 中 miR-132 表达水平增加)可能通过调节基因表达影响大脑的功能和结构变化(额叶边缘系统)。另一个局限性是目前的研究主要是描述性的。尽管据报道 miR-132 与大脑中的神经元活动有直接关联,miR-132 与大脑改变之间的内在因果关系有待对抑郁症病理学的进一步专门研究。此外,我们选择这些未用药的患者样本的原因是为了最大限度地减少药物对 miR-132 表达和脑成像数据的影响。然而,在未来的研究中,我们可能会对未接受过药物治疗的 MDD 患者和复发性抑郁症患者进行类似的比较。此外,我们可以将时间特征(例如动态状态或功能网络连接矩阵)作为功能 MRI 的融合输入,以捕获时间和空间变化之间的联系。
综上所述,使用数据驱动的监督学习方法,我们揭示了 MDD 中 miR-132 失调可能会影响额叶边缘环路上大脑功能和结构的多个方面,这是确定未用药抑郁症多模态神经影像学上 miR-132 变异的第一步。这项工作加深了我们对 MDD 中 miR-132 失调如何导致特定大脑区域丧失的理解,并提供了对表观遗传因素如何影响抑郁症病理生理学的见解。总的来说,如 Fig.4 所示,我们的结果表明(i) MDD 中较高的 miR-132 水平与额叶边缘网络中较低的 fALFF 和较低的灰质相关;(ii) 与 miR-132 水平升高相关的脑区也与注意力和执行功能领域的认知表现较差相关。所有这些关联在未用药或未经药物治疗患者中均一致。这些发现支持先前在功能、解剖学和结构脑成像研究中与重度抑郁症有关的额叶边缘系统与 miR-132 失调有关,而 miR-132 与大脑改变之间的内在因果关系需要进一步调查和验证。
声明:脑医汇旗下神外资讯、神介资讯、神内资讯、脑医咨询、Ai Brain 所发表内容之知识产权为脑医汇及主办方、原作者等相关权利人所有。




