本文为丹麦哥本哈根大学医院临床生理学和核医学科功能影像单元 Mark Bitsch Vestergaard 教授一作兼通讯作者25年1月发表于 Alzheimer’s Research & Therapy 的工作,题为“The cerebral blood flow response to neuroactivation is reduced in cognitively normal men with β‑amyloid accumulation”。DOI:10.1186/s13195-024-01652-z。
Background β-淀粉样蛋白(Aβ)在大脑中的沉积是阿尔茨海默病(AD) 的一个标志。Aβ的脑沉积会启动恶化通路,最终导致 AD。然而,确切的机制尚不清楚。一种可能的通路是 Aβ影响脑血管,导致脑血管功能不足。在本研究中,我们检查了来自丹麦大都会男性出生队列的认知正常受试者的 Aβ 沉积是否与对视觉刺激神经元激活的脑血流反应 (CBF) 降低 (ΔCBFVis.Act.) 相关。
Methods 64 名受试者参与了本研究。使用动脉自旋标记 (ASL) 结合血氧水平依赖性 (BOLD) MRI 测量 ΔCBFVis.Act.。神经元激活是通过 MRI 扫描仪屏幕上显示的闪烁棋盘的视觉刺激获得的。分别使用放射性示踪剂 [11C]匹兹堡化合物-B(PiB)和 [18F] 氟脱氧葡萄糖(FDG) 通过 PET 成像评估脑 Aβ积累和脑葡萄糖代谢。通过结构 MRI 测量皮质厚度。
Results ΔCBFVis.Act.与视觉刺激激活的大脑区域的 PiB 标准化摄取值比 (SUVr)负相关(β = -32.1[95% CI: -60.2; -4.1],r = -0.30, p = 0.025)。ΔCBFVis.Act.与激活脑区 FDG SUVr (β = 1.9 [95% CI: -23.8; 27.6], r = 0.02, p = 0.88) 或皮层厚度 (β = 10.3 [95% CI: -8.4; 29.0], r = 0.15, p = 0.27)不存在相关性。静息态CBF与视觉激活脑区(β = -17.8 [95%CI:-71.9; 36.2], r =- 0.09, p = 0.51) 或剩余皮层 (β = 5.2 [CI:-3.9; 14.2], r = 0.15, p = 0.26) PiB SUVr 都不存在相关性。
Conclusion 我们发现高 PiB SUVr 与 CBF 对神经元激活的反应降低之间存在相关性,表明 Aβ 积累与脑血管功能受损之间存在联系。这种损伤与皮质变薄或代谢减退无关,表明影响脑血管功能的 Aβ 沉积可能是导致神经退行性疾病的非常早期的病理。
Keywords β-amyloid, Cerebral blood flow, Cerebrovascular function, Cerebrovascular reactivity, Neurovascular coupling, Aging, Alzheimer’s disease, PiB PET
Introduction
阿尔茨海默病(AD)的特征是 β-淀粉样蛋白(Aβ)在大脑中沉积。这种沉积在临床症状出现前数年甚至数十年就开始了,因此假设 Aβ沉积引发了一系列级联通路,最终导致神经退行性变和痴呆。根据 Aβ 级联假说,大脑中的 Aβ 会导致 tau 沉积,从而破坏细胞通讯,导致细胞死亡和神经退化,最终导致 AD。然而,除了 tau 蛋白沉积之外,AD 发展的病理生理学也可能存在血管成分。脑血管疾病是 AD 患者的常见合并症,AD 与心血管疾病有许多相同的危险因素。这导致了血管成分导致 AD 发展的假设。该假说假设血管功能障碍在 AD 的发生和发展中起着至关重要的作用,此外,还与 tau 和 Aβ 蛋白沉积一起起着至关重要的作用。脑血管功能受损可能导致疾病的早期发展和 Aβ 的沉积。脑灌注减少可能导致大脑中氧供应或能量产生不足,从而导致神经退化,这是 AD 病理的一部分。 动物模型表明,脑灌注不足会导致痴呆。在 AD 和痴呆前期,例如轻度认知障碍 (MCI),在人类中也观察到广泛的灌注不足,包括海马、后扣带回皮层、楔前叶和额叶等区域。人群研究表明,脑灌注不足先于认知问题和痴呆的发展。在 AD 患者中,不仅静息灌注,而且脑血管对血管舒张刺激(如 CO2)的反应性以及神经血管耦合也降低。研究还表明,破坏毛细血管血流的分布,而不仅仅是破坏毛细血管中的血流总量是重要的。微血管系统中分布不均会导致毛细血管通过时间异质性 (CTH),这可能会阻碍能量物质(如葡萄糖的氧)向脑组织的扩散和输送,从而导致脑组织中氧供应或能量产生不足。
除了为大脑提供氧气和能量基质外,脑灌注对于清除大脑中的废物和有害分子也非常重要。Aβ可以通过血脑屏障内皮细胞上的特定转运蛋白从大脑中去除,例如低密度脂蛋白受体相关蛋白1(LRP1),主动将 Aβ从大脑转运到血液中,在那里它可以被降解或去除。对血管和内皮细胞的损伤可能会阻碍这种去除。去除 Aβ的另一种途径可能是通过最近提出的类淋巴系统。类淋巴系统理论假设 Aβ可以通过脑脊液(CSF)流入间质间隙从大脑中去除。这种液体流动是由心动周期血流变化引起的动脉搏动驱动的,也是由神经元激活引起的血管扩张和收缩驱动的。因此,血管舒缩技能的降低和血管损伤引起的脑血管硬化也可能损害通过间质间隙的液体流动。总体而言,对脑血管的损伤可能导致正反馈回路,其中 Aβ沉积会损害血管功能,进而阻碍清除 Aβ沉积的能力,从而导致更多的沉积。
Aβ 沉积可能是脑血管损伤的原因,从而导致脑灌注不足、脑血管反应性或微血管紊乱。在 AD 患者中,大多数 Aβ 沉积位于神经元周围脑实质的斑块中,然而,Aβ也可以积聚在动脉血管壁中,严重时会导致脑淀粉样血管病 (CAA)。在 CAA 中,Aβ 沉积在大脑小动脉的血管平滑肌细胞和外膜中,严重损害血管功能,包括血管舒缩能力的降低和血脑屏障功能障碍,并导致脑出血、微出血和痴呆症状。在 AD 患者中,经常观察到这两种病理,根据尸检研究,近 50% 的 AD 患者表现出 CAA 病理,而在严重 Aβ 沉积的患者中高达 80%。
由于脑血管功能障碍是 AD 发展的一个可能组成部分,并且由于 Aβ可以在脑血管壁中沉积,阻碍血管舒张,因此我们在目前的研究中假设在 CAA 或 AD 之前观察到的 Aβ的早期沉积会导致脑血管功能的细微损害。我们检查了早期 Aβ积累是否与 66-69 岁认知正常男性的脑灌注不足或脑血流量(CBF) 对神经激活的反应减少(ΔCBFVis.Act.)有关,该队列是 1953 丹麦男性出生队列研究神经生理学检查的一部分。这种损伤可能是由 Aβ沉积开始的早期有害通路,随着时间的推移会导致神经退行性变和 AD。确定最终导致 AD 漫长级联机制的早期步骤对于提出预防和治疗目标至关重要。
Methods and materials
参与者是从丹麦男性出生队列中招募的。该队列包括 都会1953 年出生于哥本哈根都会区的所有男性(n = 12270),并且在 1968 年仍然健在。参与者从童年开始就被追踪,并使用各种问卷、测试进行评估,数据来自出生证明、学校调查和征兵委员会检查。该队列的最初目的是调查社会流动性,尤其是代际流动性。2001 年,该队列被恢复,以研究早期生活环境对晚年健康的影响。2009 年,大约有 400 名队列成员被选中接受纵向神经心理学和神经生理学检查以及神经影像学检查。当前研究的参与者是从以前接受过这些神经生理学检查的个体中选出的。共有 107 名受试者参与,其中 64 名最终选择参加。患有严重持续性疾病的被试,包括神经退行性疾病、严重的精神疾病、成瘾或其他导致无法参与的情况被排除在外,否则,选择是随机的。
参与者接受了 MRI 以检查脑血管功能,并使用 [11C]匹兹堡化合物 B(PiB)放射性示踪剂进行 PET 扫描以评估 Aβ 沉积。所有受试者还使用 [18F] 氟脱氧葡萄糖(FDG)放射性示踪剂进行 PET 扫描,以测量相对脑葡萄糖代谢。扫描于2020年8月至2022年7月期间在丹麦临床生理学和核医学科进行。MRI 扫描和 FDG PET 扫描之间平均间隔 198 ± 110 天,MRI 扫描和 PiB 扫描之间平均间隔 269 ± 136 天。其他评估在 MRI 扫描当天进行。患者接受了认知测试,从中可以排除所有参与者的痴呆或轻度认知障碍(MCI) (Intelligenz-Struktur 测试(IST)、简易精神状态检查(MMSE) 和 Addenbrooke 认知检查 (ACE))。
关于同一受试者认知功能和 Aβ 沉积、脑葡萄糖消耗或血脑屏障通透性与年龄相关的变化的研究已在其他地方发表。基于 都会 1953 丹麦男性出生队列的其他子样本的研究检查了与年龄相关的大脑结构和电活动的变化。
MRI protocol
所有 MRI 扫描均在飞利浦 3 T dSTREAM Achieva MRI 扫描仪上使用 32 通道相控阵头线圈采集。参与者在 MRI 扫描仪中使用 Tracoline 系统进行监测。该系统向扫描操作员提供参与者在扫描仪中面部的实时视频反馈。这用于确保参与者的状态良好,并确保他们在扫描过程中保持清醒。
Structural images
通过 3D T1 加权涡轮场回波序列((echo time (TE) = 5.11 ms; repetition time (TR) = 11.2 ms; flip angle = 8°, field of view (FOV) = 240×256×180 mm³; voxel size = 0.70×0.76×0.70 mm³)。使用 FreeSurfer 软件包基于 Desikan-Killiany 图谱对大脑进行分割。皮质厚度通过识别白质到灰质边界和软脑膜表面来确定。
使用液体衰减反转恢复 (FLAIR) 获取的 T2 加权脑图像评估白质高信号和 Fazekas 评分(TE = 125 ms, TR = 11,000 ms, flip angle = 90°,FOV = 230×142×182 mm³, voxel size = 0.60×0.60 mm², 31 slices, slice thickness = 3.5 mm)。
Cerebrovascular function
使用 2D 梯度回波双回波伪连续动脉自旋标记(pCASL)序列(16 slices, FOV = 240×140×95 mm³; acquired voxel size = 2.75×2.75×5 mm³; reconstructed voxel size = 1.875×1.875×5 mm³; TR=4550 ms; TE1 = 13 ms;TE2 = 31.7 ms; flip angle = 90°; label distance = 90 mm; label duration = 1800 ms; post label delay = 1800 ms,background suppression with two auto pulses, 45 dynamics, total duration = 6 min 30 s; SENSE factor = 2.3)来测量来自神经激活的CBF改变(ΔCBFVis.Act.)。通过减去血液标记和未标记的图像来计算 CBF 加权图像。通过使用从第二个回声获取的未标记图像来获取血氧水平依赖性 (BOLD)加权图。Fig.1B + D 中提供了 BOLD 加权和 CBF 图像的示例。对于神经元激活,受试者受到 MRI 扫描仪屏幕上显示的闪烁(8Hz)黑白棋盘的视觉刺激。使用区块范式,四个激活区块持续 45 秒,每个激活块间隔一个黑屏也持续 45 秒(Fig.1A)。通过使用参与者面部的视频监控,我们确保参与者在整个测量过程中保持清醒并睁开眼睛。此外,所有参与者都通过通信系统询问他们在序列之前和之后立即看屏幕时是否清醒,所有参与者都证实了这一点。

Fig. 1 Demonstration of the neuroimaging methods applied in the study. The displayed data is from two representative subjects, one PiB negative and one PiB positive participant. The cerebral blood flow response to neuroactivation was measured using arterial spin labelling (ASL) MRI and PiB PET imaging assessed β-amyloid (Aβ) accumulation. The subjects were visually stimulated by a flickering checkerboard like pattern in a block paradigm (A) with each block lasting 45 s. A combined BOLD and ASL MRI-sequence was used to concurrently measure BOLD signal and CBF. By voxel-vise linear regressions using the block paradigm as the regressor the regional change in BOLD-signal was found (B). The Z-score statistic from the voxel-vise regressions were used to find the most significantly activated area (ROIVis.Act.) defined as voxels with Z-score in the upper 90th percentile (C). Activation in visual cortex is clearly visible. The change in CBF (D) from the visual stimulation (ΔCBFVis.Act.) in the most activated brain region was found by applying the ROIVis.Act. on the CBF map. Panel (E) demonstrate how CBF changes in accordance with the visual stimulation paradigm (yellow blocks). For this subject, CBF increased with an average of 61.6% from the stimulation. The ROIVis.Act. was applied to the FDG and PiB PET images to measure glucose consumption and the Aβ accumulation, respectively, in the region activated by visual stimulation, shown in panel (F) and (G). Similarly, the structural brain images were used to measure the cortical thickness in the region activated by visual stimulation (H). The panels (B-H) demonstrate data from a PiB negative participant. The panels (I) and (J) show FDG and PiB SUVr images and panel (K) anatomical images with indication of cortical thickness from a representative PiB positive participant.
通过使用 FSL 软件包的线性回归模型对 BOLD 图像进行voxel-wise分析,找到由视觉刺激激活的大脑区域。该模型的回归器被创建为区块范式,限定在血流动力学响应函数模型作为 γ 分布函数 (平均滞后 = 6 s,SD = 3 s) 解算。在进入建模之前,使用 5 mm 高斯滤波器对 BOLD 图像进行空间滤波。在 Z 分数图中发现显著激活的区域体素值高于 3.1(Fig.1C)。激活区域 Z 分数前 10 个百分位的体素用于生成描述具有最大激活的大脑区域的感兴趣功能区域 (ROI)(ROIVis.Act.)。
ROIVis.Act.此后应用于 CBF 图,并计算了该脑区体素的中位时间序列。然后通过线性回归模型对中位 CBF 时间序列进行建模,使用区块范式刺激作为回归器,类似于用于定位激活大脑区域的回归器(Fig.1E)。该模型的回归系数描述了视觉刺激引起的 CBF 变化百分比(ΔCBFVis.Act.)。使用类似的 ASL MRI 技术测量视觉刺激引起的 CBF 变化已与使用放射性标记水作为示踪剂的公认参考标准正电子发射断层扫描 (PET) 成像相验证。
通过在区块范式中没有视觉刺激的情况下对 ASL 采集的帧进行平均来额外计算静息区域 CBF 图。然后,通过标准化进入大脑的血液总量,将区域图量化为 ml/100g/min,其使用速度敏感相位对比映射(PCM) MRI 技术(速度编码涡轮场梯度回波序列;1 slice;voxel size = 0.75×0.75×8 mm³; TE = 7.33 ms; TR = 27.63 ms; flip angle = 10°; velocity encoding = 100 cm/s; without cardiac gating)测量。流向大脑的血液总量的计算方法是:将来自每条动脉的血流量相加,除以从解剖MRI获得的脑质量,假设脑密度为1.05g/ml,以达到以ml/100g/min为单位的CBF值。CBF 数据的计算和后处理已在前面研究中详细描述过。
PET Image acquisition
参与者使用 Siemens Biograph Vision 600 PET/CT 扫描仪进行扫描。参与者在不同的日期接受了两次 PET 扫描。使用 [11C] 匹兹堡化合物 B(PiB) 放射性示踪剂评估脑 Aβ 沉积。通过在注射放射性示踪剂后 40 分钟开始 20 分钟静态采集来测量 PiB 放射性示踪剂浓度。放射性示踪剂的活性约为 250 MBq PiB。根据最近的指南,在另一天,使用[18F] 氟脱氧葡萄糖(FDG)放射性示踪剂测量相对脑葡萄糖消耗量。通过在注射 FDG 后 45 分钟开始静态 10 分钟采集来测量 FDG 放射性示踪剂组织浓度。注射活性约为 200 MBq。
PET 数据使用 3D 有序子集期望最大化(OSEM)算法进行重建,其中 PiB 数据应用 4 次迭代、5 个子集和 5 mm 高斯重建滤波器,FDG 数据应用 12 次迭代、5 个子集和 3 mm 高斯重建滤波器。重建图像的层面内矩阵大小为 440 × 440,159 层,最终体素大小为 0.825 × 0.825 × 1.6 mm³。PET 数据还针对随机性、散射、死时间和衰减进行了校正。此外,还采集了低剂量辐射 CT 扫描(120kV, 30 mAs, 3-mm slice thickness, 512×512 matrix size, voxel size 0.59×0.59×3 mm³, H19s convolution kernel)用于每个 PET 扫描的衰减校正。
Statistical analysis
影像数据后处理对受试者不知情。使用 FreeSurfer 根据 Desikan-Killany 图谱将解剖 MRI 图像分割成皮质区域。同样使用 FreeSurfer 将 PET 图像与解剖 MRI 图像共配准。同样,来自 ASL 分析的 BOLD 图像和 CBF 加权图像被共同配准到解剖图像。从fMRI 建模的 ROIVis.Act.转移到 CBF 图像和 PET 图像。使用 FreeSurfer 提取ROIVis.Act 中的平均 CBF 和皮质厚度。同样,ROIVis.Act 中皮质区域的平均 FDG 和 PiB 值被提取并采用无小脑蚓的小脑皮层作为参考区域计算标准化摄取值比 (SUVr)。如前所述,由经验丰富的核医学专家通过视觉读取将 PiB PET 扫描分类为 Aβ 阳性或阴性,以体 PiB SUVr 值高于 1.4 作为补充标准。
使用线性回归模型和 Pearson 相关系数 (r) 检查激活区域(ROIVis.Act.)中的ΔCBFVis.Act 和 PiB SUVr 之间的相关性(Fig. 2A)。在激活区域内ΔCBFVis.Act 和 ROI Vis.Act 内FDG SUVr 或皮质厚度之间的相关性也进行类似的检查,以测试脑血管反应降低是否可能是脑萎缩的结果(Fig.2B-C)。将 ROIVis.Act 中静息 CBF 作为协变量包含在回归模型中,以校正已知的 BOLD 和 CBF 对神经激活反应的负相关。
最后,通过线性回归模型评估激活区、整个枕叶和总皮层中 PiB SUVr 与静息 CBF 之间的相关性,以测试 Aβ 沉积是否影响静息脑灌注(Fig.3)。

Fig. 2 Correlations between cerebral blood flow response to neuroactivation (ΔCBFVis.Act.) and SUVr values of PiB and FDG PET imaging and cortical thickness in the activated brain region. The regression coefficient (β) with 95% confidence interval (CI), r-score and p-value from the regression models are noted in the panel. A High PiB SUVr correlated significantly with a small ΔCBFVis.Act., suggesting that Aβ accumulation is linked to hindered cerebrovascular function. ΔCBFVis.Act. did not correlate with FDG SUVr (B) or cortical thickness (C) in the area activated by visual stimulation.

Fig. 3 Correlations between resting CBF and PiB SUVr in the brain area activated by visual stimulation (ΔROIVis.Act.), in the whole occipital lobe and in global cortex. The regression coefficient (β) with 95% confidence interval (CI), r-score and p-value from the regressions models are noted in the figure. We did not observe a correlation between resting CBF and PiB SUVr in the brain region activated by visual stimulation (red circles).Similarly, there we no correlation between resting CBF and PiB SUVr in the whole occipital lobe or globally in cortex.
Results
共有 64 名年龄在 66-69 岁之间的受试者参与了这项研究。Table 1 提供了参与者特征。在三名受试者中,无法从基于 BOLD 建模的视觉刺激中获得显著的激活模式 (p > 0.28),这可能是这些受试者闭上眼睛或没有正确看屏幕的结果。在另一个受试者中,ASL 数据的质量不足以计算可靠的 CBF 图像。这 4 个对象被从进一步分析中删除(最终 n = 60)。两名受试者未进行 FDG PET 扫描,因为 2 型糖尿病导致血糖升高,导致测量不可靠。
根据认知测试 IST、MMSE 和 ACE ,所有参与者都没有痴呆或 MCI(Table 2)。15 名(23.1%)参与者被归类为 Aβ 阳性(Table 2)。我们观察到 Fazekas 评分几乎没有变化,其中 92.2% 的参与者的深白质高信号评分为 1,82.3% 的参与者脑室周围高信号评分为 1(Table 2)。
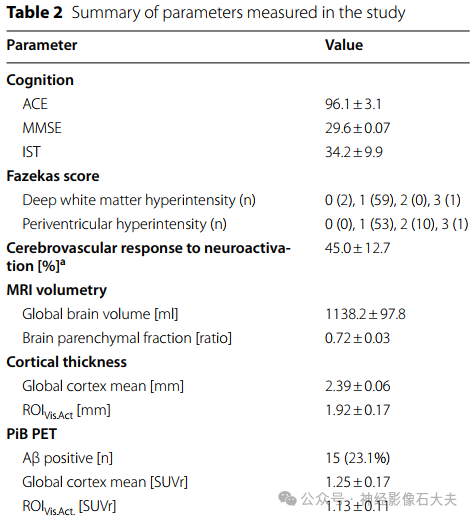

视觉刺激激活的脑区的ΔCBFVis.Act. 与PiB SUVr、FDG SUVr 和皮层厚度之间的相关性如 Fig.2 所示。 ΔCBFVis.Act. 与 PiB SUVr 负相关 (β = −32.1 [CI: −60.2; −4.1],r=−0.30, p=0.025) 表明 Aβ 沉积被试对神经激活的 CBF 反应降低。ΔCBFVis.Act.与 FDG SUVr (β = 1.9 [CI: −23.8; 27.6],r=0.02, p=0.88) 和皮层厚度 (β = 10.3 [CI: −8.4;29.0], r =0.15, p=0.27) 表明 CBF 响应降低不是脑萎缩的结果。
PiB SUVr 与基线 CBF 不存在相关性,不管是在ROIVis.Act.(β = −17.8 [CI: −71.9; 36.2], r=−0.09,p=0.51)区,还是在整个枕叶 (β = −2.4 [CI: −12.7;17.5], r=0.04, p=0.75) 或整个脑皮层 (β = 5.2 [CI: −3.9; 14.2], r=0.15, p=0.26),表明本研究观察到的 Aβ沉积与静息灌注相关。采集图像参数的平均值见 Table 2。
Discussion
我们观察到认知正常男性对神经激活的低 CBF 反应与大脑激活区域中 PiB SUVr 升高之间存在相关性。这种关联不能用皮质异常变薄或静息脑葡萄糖代谢减少来解释。这些发现表明,脑 Aβ 沉积也可能在沉积的早期阶段对脑血管功能产生负面影响。
先前的研究表明,AD 或 MCI 患者表现出灌注不足、脑血管反应性降低、脑动脉硬化和神经血管耦合受损,表明脑血管功能受损是 AD 的一个组成部分。然而,根据这些研究,无法确定脑血管功能障碍是导致 AD 的早期病理生理学的一部分,还是主要是晚期神经退行性疾病的结果。在本研究中,我们反而检查了神经退行性疾病前认知正常男性队列的脑血管功能和 Aβ 沉积。使用这种设置,我们可以证明早期 Aβ 沉积与脑血管功能减退之间的关联,在认知能力下降或进展性脑萎缩之前观察到,这表明导致痴呆的长期级联反应存在潜在的早期机制。在之前使用同一队列的另一个子样本的研究中,我们发现 CBF 对神经激活的反应降低与细微的认知缺陷相关,这表明早期脑血管功能障碍可能是年龄相关神经退行性疾病的驱动因素。然而,该研究并未检查Aβ沉积。
Aβ 与脑血管功能降低之间的关联可能是由于 Aβ 在脑血管壁中的沉积。在许多 AD 患者中,Aβ 严重积聚在小动脉壁中,导致 CAA,导致脑微出血和出血。CAA、MCI 或 AD 患者对血管舒张性 CO2 暴露的 CVR 反应降低,提示脑血管舒张受到直接阻碍。CAA 小鼠模型同样显示 CBF 对高碳酸血症的反应降低,并且对触须刺激的反应降低。使用人脑组织和动物模型的研究表明,Aβ诱导周细胞收缩,损害毛细血管扩张,从而损害神经血管耦合,进一步表明 Aβ 直接降低了脑血管舒张能力。CBF 反应降低的另一种解释可能是脑实质 Aβ 导致神经元激活较少的间接影响。 然而,一项针对 CAA 患者的研究表明,与对照组相比,视觉诱发电位没有降低,这表明神经元激活相似。由于前面提到的研究表明 CAA 中 CBF 反应减少,因此类似的神经元激活意味着血管功能障碍,而不是神经元功能障碍,是导致 CBF 反应降低的原因。此外,一项使用 Aβ 沉积小鼠的研究发现 CBF 反应降低,但 NO 信号传导未改变,这是 NVC 级联反应的关键部分,并得出结论,NVC 降低可能是直接的血管功能障碍。相反,最近对 AD 小鼠模型的另一项研究表明,Aβ 的沉积不会影响血管对神经激活的反应。研究中使用的小鼠模型的差异可以解释这种差异。Aβ 降低 CBF 反应的间接作用也可能是通过抑制 NVC 中信号级联反应的部分。例如,Aβ已被证明可以抑制星形胶质细胞血管扩张剂的释放,血管扩张剂是NVC信号通路的关键组成部分。尽管 Aβ 可能直接损害血管扩张,但很明显,大脑 Aβ 沉积最终将与功能障碍和萎缩导致的神经元激活减少有关。如果本研究中的受试者是这种情况,我们预计 FDG PET 或皮质厚度之间存在相关性作为萎缩的衡量标准,但我们没有观察到这一点。然而,至少在本研究中,与检测细微的异常葡萄糖代谢或萎缩相比,可能更容易识别脑血管功能障碍。
CBF 对激活的反应降低也可能是毛细血管血流不均匀的结果,其特征是高 CTH,可能是由 Aβ 在血管中沉积引起的。当血液在毛细血管网络中均匀分布时,氧摄取效果最佳。如果某些毛细血管中的通过时间过快,则氧气没有足够的时间完全扩散到周围组织中,从而导致氧气利用不足。相反,如果其他毛细血管中的通过时间太慢,已经卸载了大部分氧气的血液会继续流经这些区域,而无法有效输送新鲜氧气,从而导致血流浪费。两项小型研究发现 AD 和 MCI 患者的 CTH 增加,后一项研究表明 Aβ 沉积与 CTH 升高相关 。如果在认知能力下降之前观察到微血管血流不均匀,并且与灌注对激活的反应受损相关,则应在将来的研究中进行研究。
在 CAA 和 AD 中,静息灌注也经常受到影响。其他研究也发现了阿尔茨海默病前静息 CBF 降低的证据。然而,这在当前研究中研究的参与者中没有看到,这表明观察到的脑血管损伤并不严重到足以影响静息灌注,而只影响这些受试者对血管舒张刺激的反应。与健康个体相比,尚不确定 Aβ 沉积受试者的 CBF 在病理系列事件的哪个时间点变得明显降低。研究还表明,在参与者认知仍然正常的早期阶段,CBF 和脑葡萄糖消耗甚至可能因 Aβ 积累而增加,这可能是一种早期代偿机制,最终失败。本研究中的受试者没有痴呆,认知正常,Aβ过量的参与者可能没有受到足够的影响以减少静息灌注。脑血管系统的缺陷在影响静息系统之前可能会导致对生理应激的反应(例如激活)减弱。
最后,Aβ 沉积与脑血管损伤之间的关联也可能与 Aβ清除率降低有关。血管损伤可能会阻碍 Aβ 通过血脑屏障的清除。假设的类淋巴系统的功能也可能降低,血管舒缩能力降低和 Aβ在血管壁中积聚导致动脉硬化,这将损害 CSF 通过类淋巴系统的流动,并减少 Aβ的清除,促进进一步沉积。这可能会导致一个正反馈回路,其中 Aβ沉积会损害血管功能,进而阻碍 Aβ的清除,从而导致更多的沉积。
Limitations
当使用 PET 成像测量 Aβ时,与脑实质相比,我们无法区分 Aβ 在血管壁中的沉积程度。然而,正如对 AD 患者的尸检研究中观察到的那样,预计有 Aβ 沉积的参与者也会在一定程度上在血管壁中沉积。
另一个限制是研究中没有解决 tau 沉积。Aβ 促进 tau 沉积,这是导致 AD 的级联反应的一部分。最近的动物研究表明,小鼠脑血流对神经激活的反应降低,这可能是由于神经血管耦联中一氧化氮合酶途径的破坏。是否也可以在人类受试者中观察到这一点,以及 tau 沉积与 Aβ 同时存在的影响程度,这在未来的研究中进行检查。
该研究的另一个局限性是在从大脑中的灰质中获取 CBF 和 PET 值时可能存在部分容积效应污染。如果萎缩程度较大的参与者表现出更多的部分体积污染,则结果可能会有偏差。然而,在这种情况下,我们预计 ΔCBFVis.Act. 和皮质厚度之间存在正相关关系,但我们没有观察到(Fig.3C)。PET 图像相对较低的空间分辨率本身限制了区分灰质和白质的准确性,这也可能导致 PET 结果的体积偏差。然而,我们试图通过使用高分辨率解剖 MRI 图像的分割来仅提取灰质值来限制白质的污染。尽管如此,可能仍然存在不同程度的溢出放射性影响灰质信号。
该研究的另一个局限性是使用单个标签后延迟 ASL 序列,在动脉通过时间 (ATT) 变化的情况下可能会影响 ASL 信号。然而,由于需要双回波序列来捕获 BOLD 加权图像,并且需要高时间分辨率来测量神经元激活的快速动态变化,因此只有一个标签后延迟 ASL 序列是可行的。此外,当我们检查相对于基线的百分比变化和激活过程中,ATT 的微小变化只会对这一结果产生很小的影响。对于完全定量的值,我们使用全脑 PCM 值进行量化,进一步最小化 ATT 变化的影响。
PiB PET 方法的一个局限性是示踪剂在一定程度上与白质中的髓鞘非特异性结合。这种摄取独立于与 Aβ 沉积。为了克服这一限制,高分辨率结构 MRI 图像仅用于从灰质中提取 PET 信号。
该研究的横断面性质也是一个限制,只允许我们观察相关性。队列参与者将在接下来的几年中接受重新检查,以便对因果关系进行更全面的研究。
Conclusion
我们观察到,从人群队列中招募的 66-69 岁认知正常参与者的 Aβ 积累与 CBF 对神经激活的反应降低相关。这一发现表明,脑血管功能因早期脑 Aβ 沉积而受损,因此可能是最终导致 AD 的 Aβ 级联反应的初始步骤。因此,不应将 Aβ 沉积的通路和脑血管功能障碍的通路视为单独的病理,而更可能是交织在一起的机制。
声明:脑医汇旗下神外资讯、神介资讯、神内资讯、脑医咨询、Ai Brain 所发表内容之知识产权为脑医汇及主办方、原作者等相关权利人所有。




