一名 55 岁女性出现反复发作的头痛、视力改变和语言障碍。头颅 MRI 显示多灶性白质病变、微出血和血管周围空间扩大。在进行了广泛且无揭示的检查后,她接受了脑和脑膜活检,发现软脑膜和皮质血管壁厚且透明化,免疫组织化学染色显示β淀粉样蛋白呈强烈阳性,提示脑淀粉样血管病 (CAA)。CAA 可以表现为对淀粉样蛋白在血管壁中沉积的一系列炎症反应β。她的临床表现、放射学和组织病理学发现支持疑似 CAA 相关炎症 (CAA-ri) 的诊断。虽然这是一种不常见的疾病,但识别它很重要,因为大多数患者对免疫抑制治疗有反应。一名 55 岁女性出现急性头痛、无法触及她能清楚地看到的物体、视力改变(刺激消失后物体仍留在视野中)和语言障碍。她的血压在 120/60 到 150/90 之间。她无发热,心率正常。神经系统检查明显存在命名和阅读困难,理解和重复受影响较小,为右同向偏盲。她的运动、感觉和协调功能正常。初步实验室数据无明显异常,包括HIV阴性状态。她所描述的视觉现象被称为回视现象,这是一种视觉幻觉现象,其特征是在视觉刺激被移除后图像的持续存在。它通常发生在非优势的顶枕病变中,并与视野缺损有关,但可见于显性或双侧病变,被认为是由于视觉信息合成异常所致,偶尔与局灶性癫痫发作有关。此外,他描述了视觉引导下的触达障碍(称为视神经共济失调),通常与双侧后顶叶病变相关。鉴于视野缺损和以运动为主的失语症,在没有偏瘫的情况下,我们怀疑存在多灶性过程,可能累及左枕部或枕顶部和额叶区域。鉴于急性表现,多灶性缺血性或出血性卒中属于鉴别诊断。鉴于她的表现具有多焦点性,炎症性疾病是一种可能性。她接受了脑部 MRI 检查,显示双侧皮质不对称和皮质下 T2/液体衰减反转恢复 (FLAIR) 高信号异常在后部区域最为突出(图 1,A),没有增强,以及左颞枕区域的皮质弥散受限,具有提示血管源性水肿的特征(图 1,B),右顶叶内有 2 个点状微出血。图 1 (A) 流体衰减反转恢复 (FLAIR) 显示多种皮质和皮质下白质 FLAIR 高信号变化,累及皮质下 U 纤维,最突出地位于右额顶叶、左颞枕叶和左枕叶大于右枕叶。(B) 弥散加权成像(DWI,左)和表观扩散系数序列(ADC,右)分别显示左侧颞枕区皮质弥散受限和血管源性水肿。(C) 梯度回声序列 (GRE) 显示右顶叶有点状微出血。供考虑的问题:
第二部分
影像学检查提示后部可逆性脑病综合征 (posterior reversible encephalopathy syndrome, PRES),该综合征与双侧顶枕叶皮质下白质 (WM) 不对称 T2/FLAIR 高信号有关,偶尔与血液制品相关。虽然在某些情况下可以看到皮质下限制性弥散,但它通常是异质性的,点状病变被血管源性水肿包围。限制扩散的皮质模式引起了对癫痫发作的担忧,这促使连续脑电图 (cEEG) 显示大量的左后颞叶侧向周期性放电。她开始服用左乙拉西坦,失语症有所改善。缺乏增强使炎症和肿瘤疾病的可能性降低。尽管无造影后增强的广泛 WM 高信号 (WMH) 增加了进行性多灶性脑白质病的可能性,但鉴于她的免疫功能状态以及 DWI 序列上没有低信号核心和高信号边缘,这被认为不太可能。在我们的鉴别诊断中,PRES最高,缺乏明确的触发因素导致了广泛的病情检查。尿液药物筛查阴性。脑脊液分析显示 1 个白细胞、6 个红细胞、蛋白48 mg/dL(正常 15-45)和血糖正常。脑脊液细胞学检查显示恶性肿瘤阴性,培养无菌。血清和脑脊液的广泛感染性检查结果为阴性。未检测到寡克隆条带。她的红细胞沉降率(51 mm/hr,正常 <30)和 C 反应蛋白(12.0 mg/L,正常 <10)轻度升高。她的抗核抗体呈核仁模式阳性(滴度 1:160),但没有狼疮、硬皮病或其他结缔组织病的临床证据。可提取核抗原、双链DNA和抗中性粒细胞胞浆抗体阴性,补体水平正常。虽然没有明确的诱因,但除了轻度高血压外,她还是被推定诊断为PRES出院。在 2 个月的随访中,她的神经系统检查结果正常,包括语言、注意力和记忆力。不久之后,她因类似的头痛、视力和语言困难而再次入院。重复 MRI(eFigure 1,links.lww.com/WNL/B709)显示新的皮质下病灶 FLAIR 信号异常,伴有部分先前病变的间隔改善、不对称的厚脑膜和软脑膜增强以及新发点状微出血。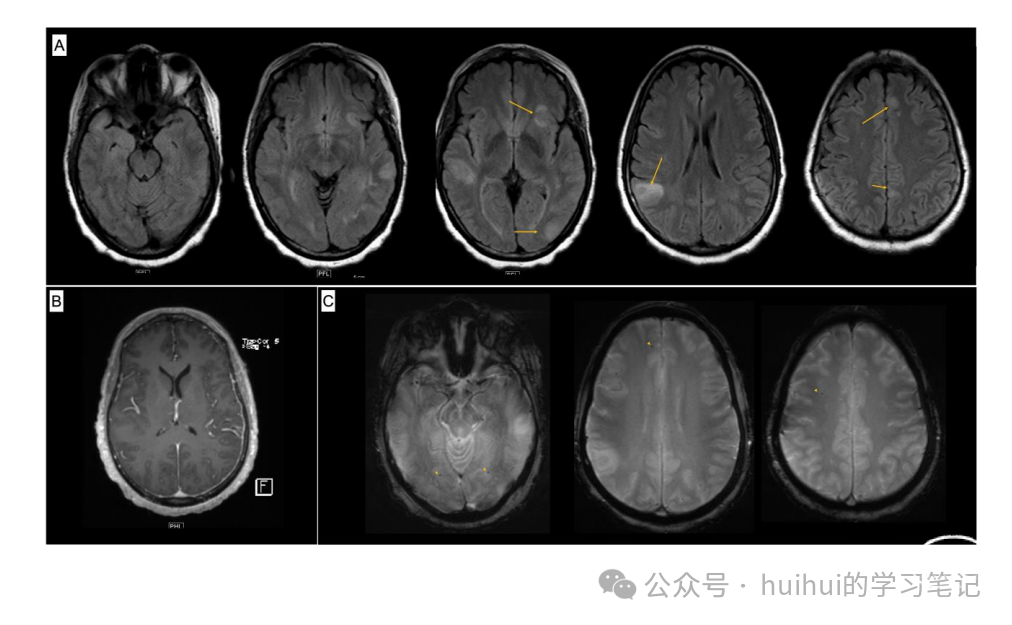
e图1:(A)FLAIR信号异常的再现,其中部分有增大,而其他尺寸减小,其中有新的FLAIR信号异常(箭头)右、左顶叶,左颞叶,左上、下额叶。(B)不对称的左硬脑膜和软脑膜强化。(C) GRE 枕叶和右侧额叶出现新的点状微出血灶(箭头)。
供考虑的问题:
第三部分
PRES 可在 5%-10% 的病例中复发;然而,它通常发生在高血压控制不佳的情况下。我们的病人血压正常。鉴于反复发作的头痛和局灶性神经系统症状,我们考虑了中枢神经系统血管炎,尽管存在没有梗死证据的 T2 高信号汇合区域是不寻常的。还考虑了可逆性脑血管收缩综合征 (RCVS)。已经描述了PRES和RCVS之间的相似性,据报道,17%-38% 的 RCVS 患者出现 PRES 样可逆性脑水肿。初次就诊时,她的 MRI 血管造影结果正常,这次就诊时头部 CT 血管造影和造影剂血管造影结果也正常,因此不太可能发生 RCVS 等血管病变。
考虑自身免疫性和炎症性疾病,如复发性 ADEM 或自身免疫性脑病。重复脑脊液分析显示无细胞增多,葡萄糖和蛋白质正常。包括血清和脑脊液自身免疫性脑病、血清抗水通道蛋白-4 IgG 和髓鞘少突胶质细胞糖蛋白抗体在内的抗体筛查呈阴性。鉴于一些先前看到的病变未经治疗得到改善,恶性肿瘤和感染被认为不太可能。临床上,几天后病情好转,出院回家。随后,她又住院了 2 次,表现相似。鉴于反复发作且没有明确诊断,她接受了左侧额叶病变附近的脑和脑膜活检,结果显示软脑膜和皮质血管壁厚且透明化,通过免疫组织化学染色,β-淀粉样蛋白强烈呈阳性(图 2)。此外,皮质下血管表现出血管周围空间增宽和血管周围炎症细胞稀疏。根据她的临床表现以及影像学检查和活检结果,她被诊断为脑淀粉样血管病相关炎症 (CAA-ri)。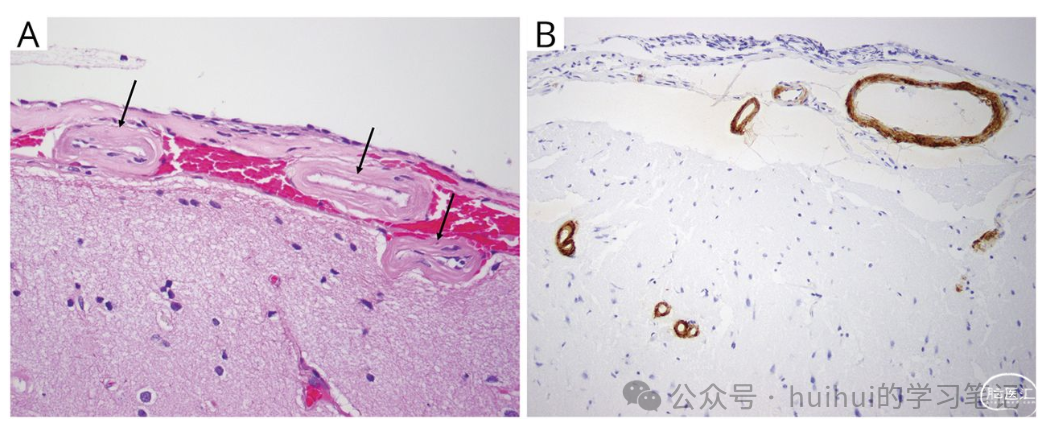
图2 软脑膜、皮质和皮质下白质活检显示 (A) 苏木精和伊红染色 ×400(见箭头)上有小动脉壁增厚和透明化,含有嗜酸性粒细胞物质,免疫组织化学染色 (B) ×200 对 β淀粉样蛋白呈阳性。供考虑的问题:
1.这会改变您的鉴别诊断吗?
2.您将获得哪些进一步的检查?
第四部分
她每天接受 1 g 静脉注射 Solu-Medrol,持续 5 天,然后每天服用 60 mg泼尼松龙,在 12 周内逐渐减量直至停药。她开始服用麦考酚酯 1,000 mg,每日两次,继续服用左乙拉西坦 2000 mg 和拉考沙胺 200 mg,均每日两次。
除了主观的找词困难外,她恢复到基线水平,并且保持无癫痫发作。开始治疗 3 个月后,脑部 MRI 显示明显改善(图 2,links.lww.com/WNL/B709)。
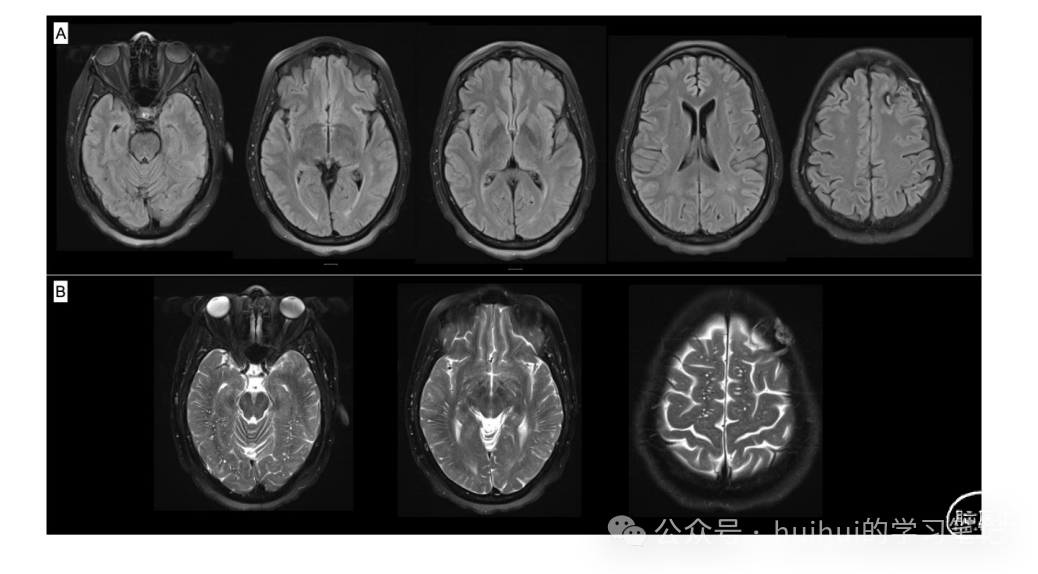
e图2:(A)先前观察到的皮质和皮质下FLAIR信号明显改善异常,未发现新的或恶化的病变。(B) T2序列表现突出双侧半球白质的血管周围间隙扩大。

讨论
CAA 是一种见于老年人的疾病,其特征是在中小皮质动脉和软脑膜动脉中沉积淀粉样蛋白β。患者表现为自发性症状性脑叶出血、认知障碍和短暂性局灶性神经系统发作。影像学特征包括脑叶微出血、皮质浅表铁沉着症 (cSS)、WMH、皮质微梗死、皮质萎缩和中央半卵圆 MRI 可见血管周围间隙。
不太常见的是,CAA 可以表现为对淀粉样蛋白在血管壁中沉积的一系列炎症反应。炎症形式包括伴有血管周围炎症的 CAA-ri 和伴有血管壁透壁性炎症的淀粉样蛋白 β 相关血管炎。CAA 的病理生理学被认为与血管周围引流通路中的蛋白质消除失败有关,淀粉样蛋白β沉积沿基底膜沉积触发免疫反应。
与传统 CAA 患者相比,CAA-ri 的发病年龄更年轻,平均发病年龄为 67 岁。女性和男性受到的影响是平等的。CAA-ri 表现为急性或亚急性认知和行为改变、头痛、局灶性神经功能缺损或癫痫发作。MRI 显示 WMH,主要位于后部,通常不对称,并延伸至皮质下 WM,并伴有相关的水肿。微出血经常出现,通常在WM异常区域和脑叶位置达到最多,而高血压动脉病患者的深度位置则相反。有时可见软脑膜或实质增强。另一个放射学特征是血管周围空间扩大,这是由于淀粉样蛋白β沉积对血管周围引流的损害所致,见于中央半卵圆中心,而在高血压动脉病患者中见于基底神经节。患者血清中的炎症标志物可能增加,脑脊液中轻度至中度的细胞增多和蛋白质升高。
明确诊断需要组织病理学确认; 然而,可能或可能的 CAA-ri 的诊断是使用诊断标准做出的(eTable) 基于临床(≥40 岁,存在 ≥1 种临床特征:头痛、意识障碍、行为改变、局灶性神经系统体征或癫痫发作)和放射学表现(累及 U 纤维和 ≥1 脑叶出血或微出血或 cSS),并排除其他原因。这些标准对很可能的 CAA-ri 的敏感性和特异性分别为 82% 和 97%,对可能的 CAA-ri 的敏感性和特异性分别为 82% 和 68%。立体定向脑活检通常是安全的;然而,平衡脑活检与经验性免疫抑制的风险是很重要的。有人建议,在服用免疫抑制剂 3 周后,仅在临床放射学无改善后才考虑活检。一项回顾性研究研究发现,免疫抑制采用多种方案,包括皮质类固醇、环磷酰胺和麦考酚酯,可改善 CAA-ri 患者的临床、影像学和复发率。
我们患者的临床特征,包括头痛、局灶性神经功能缺损和癫痫发作,以及多灶性 WMH、微出血和血管周围空间扩大的放射学表现,支持疑似 CAA-ri 的诊断。虽然组织学血管周围炎症变化并不明显,但由于炎症变化的局灶性和节段性,这可能归因于取样。免疫抑制开始后临床和影像学的显著改善进一步支持诊断。尽管不常见,但 CAA-ri 是在适当的临床环境中考虑的重要诊断,因为大多数患者对免疫抑制治疗有反应。
声明:脑医汇旗下神外资讯、神介资讯、神内资讯、脑医咨询、Ai Brain 所发表内容之知识产权为脑医汇及主办方、原作者等相关权利人所有。
投稿邮箱:NAOYIHUI@163.com
未经许可,禁止进行转载、摘编、复制、裁切、录制等。经许可授权使用,亦须注明来源。欢迎转发、分享。






![]()




