中国卒中患者高血压管理专家共识
北京高血压防治协会,中国卒中学会高血压预防与管理分会
通信作者单位:
北京 100037 国家心血管病中心,中国医学科学院阜外医院
通信作者:
王增武wangzengwu@foxmail.com
【摘要】卒中后血压升高与患者死亡和神经功能恢复不良相关,积极有效地控制血压对改善预后非常重要。《中国卒中患者高血压管理专家共识》基于现有循证医学证据,对出血性卒中和缺血性卒中早期降压治疗的时机、目标和用药措施进行了推荐;考虑到临床实际中多病共存的现状,还对合并心力衰竭、颈部大血管狭窄、主动脉夹层、肾功能衰竭、心房颤动、肺部感染等特殊病情卒中患者的降压时机、目标和用药措施进行了推荐;同时就卒中一级、二级预防中的血压管理进行了介绍。《中国卒中患者高血压管理专家共识》的发布有利于临床实践中卒中患者高血压的规范化管理。
【关键词】卒中;高血压;降压;治疗
【中图分类号】R74
【DOI】10.3969/j.issn.1673-5765.2024.06.009

卒中是危害我国国民健康的重大疾病之一,具有高发病率、高致残率、高死亡率及高复发率的特点。高血压是导致卒中的首位原因,也是可控的危险因素之一。因此,积极有效地控制血压对改善卒中患者的预后非常重要。为推动心脑血管领域从业人员对卒中患者的血压管理更加规范合理,北京高血压防治协会与中国卒中学会高血压预防与管理分会共同发起了《中国卒中患者高血压管理专家共识》(以下简称共识)的制定工作,组织国内神经内科与心血管内科专家,以循证医学为基础,结合国内外最新研究以及临床实践证据,形成对卒中患者高血压临床诊疗和管理的专业建议。
共识专家组由32位神经内科和心血管内科专家组成,分为审定专家和执笔专家。2023年3月共识制定工作启动,专家组成员讨论了共识的总体框架,并进行了具体任务分工;2023年5月专家组完成共识初稿;2023年9月专家组对共识初稿进行交流沟通,逐条讨论、修改和完善;2023年12月专家组对共识进行最终审阅,形成终稿。
本共识采用的推荐分类及证据水平参照中国卒中学会的指南推荐意见分类和证据等级级别(表1)。
表1 推荐分类和证据级别

一、卒中急性期血压管理
1.1 出血性卒中降压治疗时机及血压靶目标 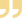
>>>> 1.1.1 出血性卒中降压治疗时机
1.1.1 出血性卒中降压治疗时机
脑出血和蛛网膜下腔出血(subarachnoid hemorrhage,SAH)是最主要的出血性卒中类型。在脑血管病中,脑出血的发病率仅次于脑梗死,但致死率和致残率高居所有脑血管病首位。脑出血发病后3 h内血肿扩大的发生率高达36%,随着发病时间的延长,血肿扩大的发生率逐渐下降,发病24 h后较少出现血肿扩大[1]。脑出血早期血压升高与血肿扩大、死亡和神经系统功能恢复不良相关,降压时间开始越早,越有可能临床获益[2]。
急性脑出血积极降压试验(intensive blood pressure reduction in acute cerebral hemorrhage trial,INTERACT)2启动降压治疗的时间为发病后6 h内,研究者将入组的急性脑出血患者随机分为强化降压组[目标收缩压<140 mmHg(1 mmHg=0.133 kPa)]和标准降压组(目标收缩压<180 mmHg)[3]。研究结果显示,强化降压组的90 d mRS评分显著低于标准降压组(OR 0.87,95%CI 0.77~1.00,P=0.04)。INTERACT 2亚组分析显示,发病60 min内将收缩压降低≥20 mmHg并维持7 d,可以降低患者的死亡率和严重致残率[4]。急性脑出血抗高血压治疗(antihypertensive treatment of acute cerebral hemorrhage,ATACH)2研究评价了与常规降压(收缩压控制在140~179 mmHg)相比,在发病后4.5 h内实施强效降压(收缩压控制在110~139 mmHg,并维持24 h)能否改善脑出血患者的预后,研究结果显示,两组3个月的死亡率和mRS评分差异无统计学意义[5]。ATACH 2研究的事后分析显示,发病2 h内接受强化降压治疗的脑出血患者,90 d mRS评分0~2分的比例更高[6]。ATACH 2研究事后探索分析显示,脑出血发病2 h内开始控制血压,并在1 h内达到目标血压值,有助于改善神经功能,发病6 h内启动降压干预,并在强化降压后24 h内达到收缩压目标是安全的[7]。一项关于早期降压的荟萃分析纳入16项研究,共6221例脑出血患者,发病至开始随机的中位时间为3.8 h,结果显示2~4 h内开始降压治疗可减少血肿扩大,与采用口服固定剂量药物降压方案的患者相比,采用静脉滴定降压药物强化降压的患者收缩压降低幅度更大,神经功能恢复更好[8]。
>>>> 1.1.2 出血性卒中降压治疗靶目标
1.1.2 出血性卒中降压治疗靶目标
INTERACT 2中强化降压组和标准降压组脑出血患者的基线收缩压均为(179±17)mmHg,结果显示早期强化降压治疗将收缩压降至<140 mmHg是安全的[3]。ATACH 2研究强化降压组与标准治疗组患者的基线收缩压分别为(200±27.1)mmHg和(201.1±36.9)mmHg,治疗后,强化降压组的收缩压显著低于标准治疗组[(128.9±16)mmHg vs.(141.1±14.8)mmHg],但7 d肾脏不良事件发生率显著增加[5]。INTERACT 2的事后分析发现,收缩压与脑出血患者预后呈“U”形关系[4],收缩压在130~139 mmHg可能是理想的血压控制范围。INTERACT 2和ATACH 2研究的事后二次分析显示,患者收缩压每降低10 mmHg,90 d mRS评分评估神经功能改善10%,在最初24 h内实现早期稳定的目标血压与更好的预后相关[6]。INTERACT 3共纳入包括中国在内的9个中低收入和1个高收入国家/地区的121家医院、7036例发病6 h内确诊的脑出血患者[9]。研究结果显示,与对照组患者相比,应用包括早期强化降压(治疗开始后1 h内控制收缩压<140 mmHg)、控制血糖、控制体温、纠正抗凝的综合管理的患者7 d内出院可能性更高,6个月死亡率更低、mRS评分更优,同时,生活质量也显著提高。
目前,针对基线收缩压>220 mmHg的脑出血患者的降压相关随机对照试验证据有限。INTERACT 2和荟萃分析显示,收缩压降至<180 mmHg可改善患者的功能预后[3,10]。ATACH 2研究的事后分析发现,在初始收缩压≥220 mmHg的脑出血患者中,强化降压组(目标值110~139 mmHg)与常规治疗组(目标值140~179 mmHg)相比,24 h内神经功能恶化的发生率更高,且在24 h内血肿扩大、90 d死亡及mRS评分等方面也无获益[11]。对于轻中度脑出血患者,如果收缩压>220 mmHg,在持续血压监测下积极降压至<180 mmHg是合理的,但应避免将血压降至<140 mmHg。
INTERACT 2的后续研究提示,收缩压的变异性可以预测脑出血患者的预后,收缩压变异性越大,90 d死亡和mRS评分≥3分的患者比例越高[12]。INTERACT 2和ATACH 2研究的汇总分析显示,如果发病1 h内收缩压下降幅度超过60 mmHg,患者功能恢复差,且血肿扩大、神经功能恶化、死亡等不良事件增加[13]。一项回顾性研究提示,与发病1 h内收缩压下降幅度不超过20 mmHg的脑出血患者相比,收缩压下降幅度超过60 mmHg或在40~60 mmHg的患者90 d mRS评分>3分的比例更高[14]。对于脑出血患者的血压控制,应制订个体化的早期强化降压方案,并注意监测血压,避免在治疗中收缩压绝对降低>60 mmHg,血压波动过大、下降过快而导致不良预后的发生。
对于收缩压<220 mmHg的脑出血患者,在发病>6 h后开始降压治疗,应该达到的靶目标血压水平的研究较少。脑出血急性降低动脉压试验(intracerebral hemorrhage acutely decreasing aterial pressure trial,ICH ADAPT)共纳入75例发病24 h内的脑出血患者,从发病到随机的平均时间为9.3 h[15]。研究结果显示,靶目标收缩压<150 mmHg组与<180 mmHg组的血肿周围相对脑血流量差异没有统计学意义(P=0.19),且血压变化幅度与血肿周围的相对脑血流量无关。对于收缩压<220 mmHg、需要急性降压的脑出血患者,在降压治疗期间应监测血压,谨慎滴定降压药物剂量,持续、平稳地控制血压有助于改善功能预后。
对于出血量≥30 mL的中重度脑出血患者,因血肿体积较大、病情严重,常需要手术减压治疗。ATACH 2研究的事后分析纳入了682例GCS评分<13分或NIHSS评分≥10分或脑实质内出血量≥30 mL或存在脑室出血的中重度脑出血患者,结果显示,早期强化降压治疗降低了血肿扩大的发生率,但未能降低90 d死亡率和致残率[16]。INTERACT 3入组了1520例出血量≥30 mL的脑出血患者,结果显示,应用包括强化降压在内的综合治疗措施可以改善患者预后[9]。
再发出血和迟发性脑缺血是导致SAH致死率和致残率高的重要原因。高血压与SAH再出血风险呈正相关,收缩压>160 mmHg是动脉瘤性SAH再出血的独立危险因素,血压不稳定同样会增加再出血的风险,且与患者预后差有关[17]。因此,平稳地将SAH患者的收缩压维持在<160 mmHg是合理的[18]。目前尚不明确降低动脉瘤性SAH患者再出血及迟发性脑缺血风险的最佳血压水平。有观察性研究显示,平均动脉压(mean arterial pressure,MAP)<100 mmHg与再出血风险降低相关,MAP<60 mmg与迟发性脑缺血风险增加相关,SAH住院死亡患者的入院时MAP显著低于存活的患者[(102.3±16.4)mmHg vs.(106.4±15.3)mmHg,P=0.026)][19]。因此,对SAH患者进行降压治疗的同时,应避免血压过低造成缺血性损害。在颅内动脉瘤被处理后,主要的干预目标不再是再发出血,而是脑水肿、颅内压增高及脑血管痉挛等临床问题,因此血压管理应以保持脑组织灌注、防止缺血性损伤为目标。
脑出血血压管理推荐意见(图1)
(1)对于需要降压治疗的脑出血患者,发病后2 h内开始降压治疗,并在1 h时内达到目标血压值,有助于降低血肿扩大风险并改善功能预后(Ⅱa类推荐,B级证据)。
(2)对于收缩压>220 mmHg的脑出血患者,在持续血压监测下积极降压是合理的(Ⅱa类推荐,B级证据)。
(3)对于收缩压在150~220 mmHg、发病6 h内的脑出血患者,将收缩压降至<140 mmHg是安全的(Ⅰ类推荐,A级证据),降至<130 mmHg会增加肾脏等器官缺血风险(Ⅱb类推荐,A级证据)。
(4)对于需要降压治疗的脑出血患者,确保持续、平稳地控制血压,避免快速降压和收缩压大幅波动,有利于改善功能结局(Ⅱa类推荐,B级证据)。
(5)脑出血早期综合管理(包括早期强化降压、控制血糖、控制体温、纠正抗凝)可以降低脑出血患者的死亡率并改善神经功能恢复(Ⅱa类推荐,B级证据)。

图1 出血性卒中的血压控制
Figure 1 Blood pressure control in hemorrhagic stroke
SAH血压管理推荐意见(图1)
(1)避免用力及过度搬动,保持排便通畅,可能减少患者的血压波动(Ⅰ类推荐,B级证据)。
(2)平稳地将收缩压维持在<160 mmHg是合理的(Ⅱa类推荐,B级证据),但降至<130 mmHg可能是有害的(Ⅱb类推荐,B级证据)。
1.2 缺血性卒中治疗时机及血压治疗靶目标 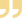
>>>> 1.2.1 缺血性卒中降压治疗时机
1.2.1 缺血性卒中降压治疗时机
多数缺血性卒中患者发病时血压明显升高,病前存在的高血压、疼痛、呕吐、躁动等均可能是血压升高的原因,多数患者可在发病后48~72 h内血压逐渐下降至其病前水平,但急性期过度降压有时会进一步加重患者病情[20]。因此,急性缺血性卒中患者应在发病48 h内密切监测血压,纠正低血压和低血容量,维持器官功能所需的全身灌注水平。
目前对急性缺血性卒中患者的降压时机尚无定论。一项荟萃分析显示,早期降压不能降低缺血性卒中患者3个月死亡或残疾风险[21]。中国急性缺血性卒中降压试验(China antihypertensive trial in acute ischemic stroke,CATIS)针对发病48 h内的急性缺血性卒中患者,在发病24 h内启动降压治疗,结果显示,与住院期间未给予抗高血压治疗的患者相比,发病24 h内启动降压治疗的患者14 d死亡和残疾主要复合终点事件发生率的差异无统计学意义[22]。CATIS亚组分析提示,在症状出现24~48 h进行降压治疗,能降低急性缺血性卒中患者3个月时的死亡或严重残疾、卒中复发和血管事件的风险[23]。CATIS 2纳入了4810例伴有血压升高的发病24~48 h内的急性缺血性卒中患者,发现早期(24~48 h)启动降压治疗与延迟(发病后第8天)启动降压治疗相比,未能降低患者90 d死亡和严重残疾复合事件的风险[24]。一项随机对照试验显示,24 h内基线血压高或血压变异大与急性缺血性卒中不良预后相关,24 h内降压治疗可改善预后[25]。不同分型的缺血性卒中,降压治疗对预后的影响可能不一致[26]。总之,在缺血性卒中患者中启动或恢复降压治疗的时机需要个体化评估。
>>>> 1.2.2 缺血性卒中降压治疗靶目标
1.2.2 缺血性卒中降压治疗靶目标
患者的年龄,是否有高血压、心力衰竭、肾功能不全等病史,卒中类型,以及发病最初几个小时内自发血压增高的幅度,脑梗死面积和颅内压等因素均对降压疗效有明显影响。对于未接受rt-PA静脉溶栓或血管内治疗,且没有并发症的急性缺血性卒中患者,在需要紧急降压治疗的情况下,如血压≥220/120 mmHg,在最初的24 h内将血压降低15%可能是合理的,应避免快速或过度降低血压并密切监测神经功能变化情况;如血压<220/120 mmHg,在最初的48~72 h内启动或重新启动降压治疗对降低死亡率或重度残疾率无效[27]。有研究入组了3020例腔隙性脑梗死患者,结果显示,与收缩压目标130~149 mmHg组相比,收缩压目标<130 mmHg组的脑出血发生率降低,但两组卒中复发风险及治疗相关严重不良事件发生率差异无统计学意义[28]。该研究结果提示,对小血管病导致的腔隙性脑梗死,收缩压目标<130 mmHg可能更为合适。在缺血性卒中患者病情稳定或发病72 h后,若收缩压≥140 mmHg或舒张压≥90 mmHg,恢复使用发病前的降压药物或开始启动降压治疗可能是合理的[27]。
一项随机对照试验的事后分析显示,对于症状性颅内动脉狭窄患者,将收缩压控制在140 mmHg以下是安全的,并可降低卒中复发风险[29-31]。不过该研究没有分析更低的血压目标值是否会有进一步获益。基于目前证据有限,此类患者是否要达到更低的血压目标值,需要保持谨慎[26]。
目前对于接受静脉溶栓治疗的缺血性卒中患者,血压控制目标相对一致,即在溶栓前谨慎降低血压,使收缩压<180 mmHg,舒张压<105 mmHg[27,32],但接受血管内治疗的急性缺血性卒中患者的基线血压及术后血压管理目标尚有争议。西班牙和法国8 h内前循环卒中Solitaire取栓与标准药物治疗比较(endovascular revascularization with Solitaire device versus best medical therapy,REVASCAT)、美国和澳大利亚Solitaire支架取栓治疗急性缺血性卒中(Solitaire FR with the intention for thrombectomy as primary endovascular treatment foracute ischemic stroke,SWIFT PRIME)、荷兰急性神经功能缺损患者扩展时间窗溶栓后联合动脉治疗(extending the time for thrombolysis in emergency neurological deficits intraarterial,EXTENDIA)、法国卒中后阿替普酶静脉溶栓桥接机械取栓与单独阿替普酶治疗比较(mechanical thrombectomy after intravenous alteplase versus alteplasealone after stroke,THRACE)、荷兰急性缺血性卒中血管内治疗多中心随机临床试验(multicenter randomized clinical trial of endovascular treatment for acute ischemic stroke in the Netherlands,MR CLEAN)等多项机械取栓术研究均参照静脉溶栓的标准,将血压>185/110 mmHg作为取栓治疗的排除标准[33-37]。法国和荷兰的研究结果显示,早期血管内治疗患者的基线血压与3个月全因死亡率呈“U”形关系,即较高或较低的基线血压均不利于患者的预后,且高基线血压与症状性颅内出血显著相关[38-39]。来自德国的一项研究对纳入的250例有颈内动脉和大脑中动脉狭窄的急性前循环缺血性卒中患者进行了血管内治疗,发现术中个体化血压管理策略(将术前基线收缩压作为术中血压目标)与标准方案(收缩压控制在140~180 mmHg)相比,对患者的90 d良好功能结局无显著影响[40]。一项纳入了5874例进行了机械取栓的急性缺血性卒中患者的荟萃分析显示,机械取栓术后前24 h平均收缩压水平升高与症状性颅内出血、早期神经功能恶化、3个月死亡和3个月功能结局恶化的风险独立相关,血压每升高10 mmHg,颅内出血风险增加20%[41]。急性缺血性卒中血管内取栓后强化血压控制(intensive blood pressure control after endovascular thrombectomy for acute ischaemic stroke,ENCHANTED2/MT)研究对血管内治疗后血压管理(术后1~72 h)进行了探索,结果显示,相较于收缩压目标140~180 mmHg组,收缩压目标<120 mmHg组的预后更差,且早期神经功能恶化的风险更高,两种降压策略组间脑出血、死亡率差异无统计学意义[42]。来自韩国的一项研究纳入了306例机械取栓术后mTICI≥2b级的急性缺血性卒中患者,发现与常规降压(收缩压目标140~180 mmHg)相比,24 h内接受强化降压治疗(收缩压目标<140 mmHg)后3个月后达到功能独立的可能性更低[43]。以机械取栓术后血管完全再通的急性缺血性卒中患者为研究对象的两项多中心登记研究结果显示,术后高血压与患者3个月不良预后显著相关,研究指出,对于早期完全血管再通患者,术后平均血压或血压峰值<160 mmHg可能较为适宜[44-45]。
推荐意见(图2)
(1)急性缺血性卒中后应进行血压评估并严格监测血压(Ⅰ类推荐,A级证据)。急性缺血性卒中后24 h内因紧张、焦虑、疼痛、恶心、呕吐、尿潴留等原因导致的血压升高,立刻去除诱因(Ⅰ类推荐,B级证据)。
(2)对于未接受静脉溶栓治疗或血管内治疗且没有合并症,需要紧急降压治疗的患者:
①如血压≥220/120 mmHg,在最初的24 h内将血压降低15%可能是合理的(Ⅱb类推荐,B级证据)。
②如血压<220/120 mmHg,在最初的48~72 h内启动或重新启动降压治疗对于预防死亡或重度残疾无效(Ⅱb类推荐,A级证据)。
(3)对于接受静脉溶栓治疗的患者,应当在溶栓前、治疗期间和治疗后24 h内使收缩压<180 mmHg,舒张压<105 mmHg(Ⅰ类推荐,B级证据)。
(4)对于接受血管内治疗的患者,手术前、术中保持血压≤180/105 mmHg可能是合理的(Ⅱb类推荐,B级证据)。在血管内治疗术后,应根据患者的血管再通状态对血压进行管理(Ⅱb类推荐,B级证据)。
①对于术后血管完全再通的患者,维持术后收缩压<140 mmHg可能是合理的,但具体的血压控制目标须参照患者的基线血压制订(Ⅱ类推荐,B级证据)。
②对于术后血管未完全再通的患者,不建议将血压控制至较低水平(Ⅱa类推荐,B级证据)。
(5)缺血性卒中后病情稳定或72 h后,若收缩压≥140 mmHg或舒张压≥90 mmHg,无禁忌证者,可于发病数天后恢复使用发病前的降压药物或开始启动降压治疗(Ⅰ类推荐,A级证据)。
(6)对于病情稳定或发病 3~5 d后,由颅内大动脉狭窄(狭窄率70%~99%)导致的缺血性卒中,如患者能耐受,推荐收缩压降至<140 mmHg,舒张压降至<90 mmHg(Ⅱa类推荐,B级证据);由小血管病导致的皮质下小梗死,如患者能耐受,推荐收缩压降至<130 mmHg,舒张压降至<80 mmHg(Ⅰ类推荐,B级证据)。
(7)对于病情稳定或发病3~5 d后低血流动力学原因导致的卒中患者,应权衡降压速度与幅度对患者耐受性及血流动力学的影响(Ⅲ类推荐,C级证据)。

图2 急性缺血性卒中的血压管理
Figure 2 Blood pressure management in acute ischemic stroke
1.3 药物治疗 
>>>> 1.3.1 急性出血性卒中降压治疗
1.3.1 急性出血性卒中降压治疗
脑出血的诊疗关键在于预防,其中控制高血压是预防的核心。在自发性脑出血和SAH急性期中,降压治疗发挥着关键作用,其目的是控制颅内压增高以防止脑疝形成,控制血压以防止血肿扩大并保证脑灌注,以及减少与高血压相关的脑损伤。脑出血和SAH的降压治疗策略,应根据患者的血压水平和出血的严重程度,制订个性化的降压方案。
1.3.1.1 脑出血降压药物选择
脑出血患者血压过高可加重脑水肿、诱发再出血,故可在发病2 h内启动降压治疗。血压降低程度应视患者具体情况而定。首先推荐静脉使用降压药物[46-47]。尼卡地平,5~15 mg/h静脉输注;拉贝洛尔,2 mg/min(最大剂量300 m g/d)静脉输注;硝普钠,0.1~10 μg/(kg·min)静脉输注;硝酸甘油,20~400 μg/min静脉输注。然后根据患者病情变化,待血压控制至目标水平时,适当改为口服药物,可选用钙通道阻滞剂(calcium channel blocker,CCB)、血管紧张素受体拮抗剂(angiotensin receptor blocker,ARB)、β1受体阻滞剂等(表2)[48]。
表2 自发性脑出血降压药物选择
Table 2 Selection of antihypertensive drugs for spontaneous cerebral hemorrhage

1.3.1.2 蛛网膜下腔出血降压药物选择
SAH患者应避免用力及过度搬动,保持排便通畅,以减少血压波动。另一方面,平稳地将血压维持在<160 mmHg是合理的,但血压<130 mmHg可能是有害的。对于动脉瘤性SAH患者,建议处理动脉瘤前将收缩压控制在140~160 mmHg[49]。
尼莫地平是控制血压和改善血管痉挛的有效药物,按0.5~1.0 mg/h剂量静脉缓慢滴注,2~3 h内如血压未降低,可增至1~2 mg/h[50]。建议采用微量注射泵控制静脉输液速度,维持24 h。通常情况下,将50 mL(10 mg)尼莫地平通过三通阀与250~500 mL的5%~10%葡萄糖溶液同时输注。由于尼莫地平易被聚氯乙烯吸收,因此应采用聚乙烯输液管。静脉用药7~14 d,病情平稳后改用尼莫地平口服7 d(剂量60 mg,3次/d)。尼莫地平也是目前预防SAH复发和死亡的最有效药物[51]。
此外,《盐酸乌拉地尔注射液临床应用多学科专家共识》建议乌拉地尔可作为一线降压药物,建议在发病后2 h内开始使用乌拉地尔,且在1 h内使血压达标[52]。患者血压达到目标水平后,可考虑使用口服药物控制血压,如尼莫地平片等(表3)。
表3 蛛网膜下腔出血降压药物选择
Table 3 Selection of antihypertensive drugs for subarachnoid hemorrhage

>>>> 1.3.2 急性缺血性卒中降压治疗
1.3.2 急性缺血性卒中降压治疗
降压治疗降低缺血性卒中发病风险的获益来自降压本身。在急性缺血性卒中的治疗过程中,血压管理是至关重要的一环,尤其是对接受再灌注治疗的患者。再灌注治疗(包括静脉溶栓和血管内治疗)旨在恢复大脑受损区域的血流,降低神经损伤并改善患者的预后。然而,这些治疗策略是否成功很大程度上取决于疾病的具体情况,因此选择合适的降压策略非常重要。不适当的血压控制可能增加出血风险,降低治疗效果,甚至导致其他并发症。
1.3.2.1 再灌注治疗患者的血压管理
静脉溶栓患者:静脉溶栓前、溶栓时和溶栓后24 h内应使收缩压<180/105 mmHg。如溶栓前及溶栓后收缩压>180~230 mmHg或者舒张压>105~120 mmHg,需要进一步降压治疗。如果溶栓前血压不能维持在≤180/105 mmHg,不推荐用阿替普酶等药物静脉溶栓。
溶栓后24 h内应加强血压监测,开始每5 min 1次,持续2 h;之后每30 min 1次,持续6 h;再之后1次/h,持续16 h[32]。
推荐使用药物:拉贝洛尔,10 mg静脉注射,之后2~8 mg/min持续静脉泵入;或尼卡地平,5 mg/h静脉注射,可滴定加量,每5~15 min加量2.5 mg/h至达到目标血压,最大剂量15 mg/h;或氯维地平,1~2 m g静脉注射,可滴定加量,每2~5 min剂量加倍至达到目标血压,最大剂量21 mg/h。如果血压仍不能控制或舒张压>140 mmHg,可考虑静脉注射硝普钠,同时应密切监测患者的颅内压变化(表3)。
血管内治疗患者:血管内治疗包括血管成形术、支架术和动脉溶栓等。血管内治疗术前、术中建议保持血压≤180/105 mmHg,术后根据患者的血管再通状态对血压进行管理。如血压>180/105 mmHg推荐如下降压方案:拉贝洛尔10~20 mg,于1~2 min内静脉注射,可重复1次;或尼卡地平,5 mg静脉注射,可每5~15 min滴定加量2.5 mg/h,最大剂量15 mg/h,达到目标血压后调整药物剂量以维持血压在合适范围;或氯维地平1~2 mg/h静脉注射,可滴定加量,每2~5 min加量1倍,直至达到目标血压,最大剂量21 mg/h。也可考虑使用其他药物(如肼屈嗪、依那普利)(表4)。
表4 再灌注治疗缺血性卒中患者的静脉降压药物选择
Table 4 Selection of intravenous antihypertensive drugs for reperfusion therapy in patients with ischemic stroke

机械取栓患者:对于因大血管闭塞行机械取栓的患者(伴或不伴静脉溶栓),建议血管内治疗前血压控制在180/105 mmHg以下,术中收缩压控制在140~160 mmHg。对于术后血管完全再通的患者,维持术后收缩压在140 mmHg以下可能是合理的,但不低于120 mmHg[42,53]。
乌拉地尔作为一线降压药物,单次、重复静脉注射及长时间静脉输注均可以维持血压的稳定。对于需要快速降压的患者,先给予负荷剂量乌拉地尔(静脉注射2 mg/min)使血压达标,之后静脉注射泵泵入药液维持治疗,输入速度视患者血压情况调整,也可缓慢静脉注射25 mg。如无明显降压效果,2 min可重复给药25 mg,总量可达100 mg;待基础舒张压降低20%和(或)舒张压<100 mmHg后,采用静脉注射泵泵入药液[54]。初始输入速度可达2 mg/min,血压达标后维持给药速度为5~60 mg/h,输入速度根据患者的血压进行调整。对于需要缓慢降压的患者,推荐缓慢静脉注射或注射泵泵入乌拉地尔12.5~25.0 mg,初始输入速度可达2 mg/min,血压达标后维持给药速度为5~60 mg/h(表5)。如给予乌拉地尔100 mg负荷剂量后血压仍未明显下降者,可联用其他静脉降压药物治疗。
表5 机械取栓治疗患者静脉使用乌拉地尔的方法及注意事项
Table 5 Method and precautions for intravenous use of urapidil in patients with mechanical thrombectomy

1.3.2.2 未再灌注治疗患者的血压管理
未进行再灌注治疗的缺血性卒中患者启动或恢复降压治疗时机需个体化评估。当血压<220/120 mmHg,最初72 h内监测血压,不需要降压治疗;当血压≥220/120 mmHg,在最初的24 h内将血压降低15%可能是合理的。此时可考虑使用拉贝洛尔静脉注射,起始剂量为10~20 mg,每1~2 min给予1次,直至达到目标血压;或尼卡地平以5 mg/h开始静脉滴注,每15 min增加2.5 mg/h,最大剂量不超过15 mg/h(表6)。
表6 未再灌注治疗急性缺血性卒中患者的静脉降压药物选择
Table 6 Selection of intravenous antihypertensive drugs for patients with acute ischemic stroke without reperfusion therapy

1.3.2.3 急性缺血性卒中病情稳定或发病72 h后血压管理
对于急性缺血性卒中病情稳定或发病72 h后的血压管理,首先推荐静脉用药,待控制至目标血压后,无禁忌证者可恢复使用发病前的降压药物或开始启动口服降压治疗。可考虑单独或联合使用苯磺酸氨氯地平、培哚普利、厄贝沙坦或沙库巴曲缬沙坦[55-57],建议从小剂量开始,逐步加量,长期维持使血压达标。需要强调的是,应根据急性缺血性卒中患者的个体情况恰当地选择降压药物。
二、特殊人群血压管理
2.1 心力衰竭患者的血压管理 
心力衰竭是由心脏结构或功能异常导致心室收缩或充盈障碍,继而引起症状和体征的复杂临床综合征。根据左心室射血分数,将心力衰竭分为射血分数降低的心力衰竭(heart failure with reduced ejection fraction,HFrEF)、射血分数保留的心力衰竭(heart failure with preserved ejection fraction,HFpEF)、射血分数轻度降低的心力衰竭(heart failure with reduced ejection fraction,HFrEF)和射血分数中间值的心力衰竭(heart failure with mid-range ejection fraction,HFmrEF)。目前,针对卒中合并心力衰竭患者血压管理的研究较少[58]。有研究显示,缺血性卒中患者伴有HFpEF和HFrEF的比例分别为2.97%和3.69%[59]。对于出血性卒中合并心力衰竭的情况,目前尚未有确切的数据可供参考。多数心力衰竭患者在发病前患有高血压。在缺血性卒中发病的诸多原因中,心力衰竭所致占9%[60]。合理降压治疗可大幅度降低卒中患者心力衰竭的发生率,降低死亡率,并改善预后。
由于共同危险因素的叠加效应,合并心力衰竭会对卒中患者的预后产生不利影响。急性卒中可使心力衰竭患者自我管理更加困难。2022年,美国心脏学会(American Heart Association,AHA)发布专家建议,提出了实现理想心血管健康的“生命8要素”概念,即血压管理、胆固醇控制、降低空腹血糖、饮食和身体活动优化、体重管理、戒烟和充足的睡眠[61]。
收缩压和舒张压升高是引发症状性心力衰竭的重要危险因素,目前尚无评估卒中共病高血压和心力衰竭的降压策略和血压目标的临床研究。《中国心力衰竭诊断和治疗指南2024》中推荐的心力衰竭患者降压目标为<130/80 mmHg[62],2022年AHA/美国心脏病学会(American College of Cardiology,ACC)/美国心力衰竭协会(Heart Failure Society of America,HFSA)发布的心力衰竭管理指南中,对10年动脉粥样硬化心血管疾病(atherosclerotic cardiovascular disease,ASCVD)风险>10%的患者,建议血压治疗目标为<130/80 mmHg,从而降低血压相关心力衰竭事件的风险[63-64]。因此,卒中合并心力衰竭患者目标血压值应<130/80 mmHg(但应>120/70 mmHg)。卒中病情稳定后,若血压持续≥140/90 mmHg,无明显禁忌证,可于卒中数天后恢复使用发病前的抗高血压药物或开始启动降压治疗[65]。
不同降压药物在降低心力衰竭发病或进展风险方面的疗效存在明显差异,部分药物还可能引起或加重心力衰竭,应尽量避免使用。推荐采用不同机制的药物联合治疗。对于伴有HFrEF的患者,推荐采用联合治疗方案,包括血管紧张素受体脑啡肽酶抑制剂(angiotensin receptor-neprilysin inhibitor,ARNI)或血管紧张素转化酶抑制剂(angiotensin converting enzyme inhibitor,ACEI)或ARB、β受体阻滞剂、醛固酮拮抗剂[估测的肾小球滤过率(estimated glomerular filtration rat e,eGFR)>30 mL/(min·1.73 m2),且血清钾<5.0 mmol/L]以及钠-葡萄糖共转运蛋白2抑制剂(sodium-glucose transporter 2 inhibitors,SGLT2i)。
联合治疗可降低心力衰竭患者的死亡率,改善预后,还具有良好的降压作用。对于心力衰竭患者,往往还需常规应用袢利尿剂或噻嗪类利尿剂,这两种药物也有良好的降压作用[66-69]。如高血压情况仍未得到控制,推荐应用CCB类药物,如氨氯地平、非洛地平等。
初步根据卒中合并心力衰竭患者的症状、体征判断容量状态,待相关检查和实验室检查结果回报后辅助判断容量状态,必要时进行有创监测评估。急性失代偿性心力衰竭的主要治疗目标是纠正容量超负荷。利尿剂是唯一能充分控制液体潴留的药物,急性心力衰竭患者需静脉给予高剂量的利尿剂[70],首选静脉应用呋塞米。静脉应用利尿剂治疗结束后,如已达到理想干体质量,且血肌酐水平稳定无进行性升高,在无禁忌证的情况下,尽早启动“新四联”降压治疗:ARNI/ACEI/ARB+SGLT2i+β受体阻滞剂+盐皮质激素受体拮抗剂。如无容量超负荷情况,患者血肌酐升高、血流动力学不稳定,则建议以下治疗:①暂停利尿剂,直至血肌酐水平稳定至少12 h后开始口服利尿剂治疗;②如果血肌酐水平持续升高或血流动力学持续不稳定,则可考虑适当补液治疗[71]。
总之,对于卒中合并心力衰竭的患者,应密切监测降压效果,从生活方式、药物治疗、康复、护理等多方面、多层次进行综合管理。需要强调的是,在紧急状况下,必须高度重视并优先处理直接危及患者生命的疾病,审慎权衡各种利弊因素,以确保患者能够迅速且有效地获得救治。
2.2 颈部大血管狭窄患者的降压策略 
颈部大血管狭窄的主要病因是动脉粥样硬化,25%~30%的颈动脉狭窄与缺血性卒中关系密切[72]。卒中高风险人群中,颈动脉粥样硬化性疾病的患病率可高达74.7%[73]。
目前对颈部大血管狭窄患者的降压治疗策略仍存在争议。华法林-阿司匹林治疗症状性颅内动脉狭窄(warfarin aspirin symptomatic intracranial disease,WASID)研究、支架置入和积极药物治疗预防颅内动脉狭窄卒中复发(stenting and aggressive medical management for preventing recurrent stroke in intracranial stenosis,SAMMPRIS)研究均提示将血压控制在<140/90 mmHg是合理的[74-75]。SAMMPRIS研究将合并糖尿病的颅内动脉粥样硬化性狭窄患者的血压目标值定为130/80 mmHg,后期随访分析显示血压未达标者的卒中复发风险更高。
颈动脉闭塞外科研究(carotid occlusion surgery study,COSS)对91例症状性颈动脉闭塞和低血流动力性脑缺血且未接受手术治疗的患者进行了分析,比较平均血压≤130/85 mmHg或血压更高组之间同侧缺血性卒中的复发风险,结果显示,血压>130/80 mmHg患者同侧脑缺血复发比例更高,提示降低血压可能会降低此类患者脑缺血复发的风险[76]。椎动脉血流评估TIA和卒中风险(vertebrobasilar flow evaluation and risk of transient ischemic attack and stroke,VERiTAS)研究是一项多中心队列研究,入组对象为发病60 d内、伴有颅内外椎动脉或基底动脉狭窄(狭窄率≥50%)或闭塞的TIA或缺血性卒中患者,研究结果发现,椎基底动脉脑血流量下降患者的卒中复发风险升高,且对于低血流量患者,降低血压可能会增加缺血风险[77]。英国牛津的一项研究显示,TIA/非致残性卒中后立即降压治疗的中/重度颈动脉狭窄患者与非中/重度颈动脉狭窄患者相比,TCD血流动力学指标无恶化趋势,提示TIA/非致残性卒中合并中/重度颈动脉闭塞患者早期抗高血压治疗是安全的[78]。国内的一项单中心队列研究表明,在合并高血压和颈动脉狭窄的急性缺血性卒中早期阶段,血压变异性低可能改善预后,而较低的血压水平(收缩压/舒张压<140/90 mmHg)是有害的,尤其是对于颈动脉狭窄程度≥50%的患者[79]。
对于合并颈动脉狭窄的TIA或卒中患者,建议加强抗血小板治疗、降脂治疗和高血压治疗以降低卒中复发风险[80]。症状性颈动脉狭窄患者卒中后快速降压可能会增加梗死面积、加重神经功能缺损,推荐遵循个体化、慎重及适度的原则对其进行血压调控[81]。《症状性颅内外动脉粥样硬化性大动脉狭窄管理规范——中国卒中学会科学声明》推荐:对于症状性颅内外动脉粥样硬化性狭窄患者,进行降压治疗可能降低脑缺血风险,但对于发病机制为低血流动力学的人群,需制订个体化的降压方案(B级证据,Ⅱb类推荐)[82]。对症状性颅内外大动脉严重狭窄的高血压患者,建议先进行重要器官(脑、心脏和肾脏)血流灌注状态评估,对于不伴有明显脑灌注受损的患者,推荐收缩压目标<130 mmHg;对于伴有明显脑灌注受损的患者,建议收缩压降压目标为<140 mmHg[74];对于严重双侧颈动脉狭窄(狭窄率>70%)的患者,需警惕较低血压可能增加卒中风险。
降压药物治疗应从小剂量开始,优先选择长效制剂,联合应用并遵循个体化原则[72]。常用的降压药物包括CCB、ACEI、ARB、β受体阻滞剂、利尿剂等,以及由上述药物组成的固定配比复方制剂。CCB和ACEI在延缓动脉粥样硬化进展及控制血压方面有肯定疗效[83]。
2.3 主动脉夹层患者的血压管理 
主动脉夹层(aortic dissection,AD)是一种严重威胁健康的危重症心血管疾病。未经手术治疗的急性Stanford A型AD发病24 h内死亡率每小时增加1%~2%,发病1周死亡率超过70%。即使是慢性Stanford A型AD,仍存在因主动脉破裂、器官衰竭死亡的风险。急性Stanford B型AD发病2周内的死亡率为6.4%,药物治疗的5年生存率约为60%[84]。
发生AD时降低动脉壁受到的剪应力是控制夹层发展的基础,而主动脉壁剪应力受心室内压力变化率和血压的影响,因此在AD时应控制血压和心率[84]。多个国家的主动脉疾病诊断与治疗相关指南指出,对于急性AD患者,应迅速将血压降至维持重要器官灌注所需的最低水平(Ⅰ类推荐,C级证据)[27,85-89]。有研究者认为,对于急性缺血性卒中患者,如伴有急性AD亦可早期启动降压治疗[27,89]。
关于卒中合并主动脉夹层患者的血压和心率控制目标,目前仍缺乏高质量的临床研究,国内外相关指南的推荐仍以专家意见为主,基本原则是降至保证重要器官灌注的最低血压和较低的心率水平。对于卒中患者,应重点关注其脑灌注状况并进行个性化处理。2022年ACC/AHA发布的主动脉疾病诊断与治疗指南和我国发布的《中国急诊高血压诊疗专家共识(2017修订版)》指出,急性AD患者的目标心率和收缩压分别为<60次/min和<120 mmHg(Ⅰ类推荐,C级证据)[86,88]。《中国脑血管病临床管理指南(第2版)》建议急性缺血性卒中合并急性AD患者较初始血压水平降低15%可能是安全的(Ⅰ类推荐,C级证据)[89]。2023年欧洲高血压学会(European Society of Hypertension,ESH)的血压管理指南中,对于稳定期的AD患者,建议按心血管风险高危患者进行高血压控制目标(<130/80 mmHg)管理[87]。
急性AD以降低主动脉壁剪应力为主要目标,因此控制心率和降压同等重要。推荐优先静脉使用β受体阻滞剂,如艾司洛尔、美托洛尔或拉贝洛尔,以短效药物为宜;如存在β受体阻滞剂使用禁忌证,可选用非二氢吡啶类CCB,如地尔硫卓;如降压不理想,可联合使用乌拉地尔等强效静脉降压药。需要注意的是,在心率未充分控制的情况下,应避免使用乌拉地尔等药物[84,86-87]。对于稳定期AD患者,推荐β受体阻滞剂、ACEI/ARB、CCB作为一线降压药物选择,需兼顾心率和血压的控制。在心率较快的情况下,不建议单独使用二氢吡啶类CCB[87-88]。
2.4 慢性肾脏病患者的血压管理 
慢性肾脏病(chronic kidney disease,CKD)与高血压密切相关,高血压可增加CKD患者心脑血管事件的发生风险。此外,CKD患者也是卒中的高危人群,特别是中晚期CKD患者的卒中风险显著增加。CKD 3~5期和透析患者的卒中风险与一般人群相比,分别增加了3.0、4.1、5.4和7.1倍[90],研究显示,eGFR每降低10 mL/(min·1.73 m2),卒中的相对风险增加7%[91]。通过有效控制血压,预防和延缓肾功能恶化,降低卒中复发、致残和死亡风险,可提高患者的生存率和生活质量。
根据有无蛋白尿,逐步强化CKD患者的降压目标。CKD患者收缩压≥140 mmHg和(或)舒张压≥90 mmHg,推荐在生活方式干预的同时启动降压药物治疗。尿白蛋白<30 mg/24 h的CKD患者,持续收缩压≥140 mmHg和(或)舒张压≥90 mmHg,推荐降压治疗;尿白蛋白≥30 mg/24 h的CKD患者,持续收缩压≥130 mmHg和(或)舒张压≥80 mmHg,需降压治疗。
推荐CKD患者降压总体目标为血压<140/90 mmHg。对于尿白蛋白<30 mg/24 h的 CKD患者,推荐血压控制目标为血压<140/90 mmHg;对于尿白蛋白≥30 mg/24 h的CKD患者,推荐在可耐受的前提下,血压控制目标为血压<130/80 mmHg。
一项纳入11项随机对照试验,共1860例CKD患者的meta分析显示,对于CKD患者,收缩压降至<120 mmHg并无肾脏保护作用,收缩压降至<110 mmHg甚至可能加速CKD的进展[92]。因此,临床应评估患者血压达标的获益及风险,并在治疗过程中根据实际情况及时调整降压目标。
CCB、ACEI、ARB、α受体阻滞剂、β受体阻滞剂、利尿剂均可作为CKD合并高血压患者的初始降压选择。CKD合并高血压的成年患者(CKD 3~5期或伴有蛋白尿的CKD 1~2期),使用ACEI/ARB可以延缓肾病进展[93]。对于CKD合并高血压,伴或不伴糖尿病的中重度蛋白尿的患者,在排除禁忌证后,ACEI/ARB可以作为降压治疗的优先选择[94]。
多项小样本研究表明,ARNI对CKD患者具有良好的降压和心肾保护作用,目前正逐步用于CKD合并高血压,特别是心功能不全患者的治疗[95]。值得注意的是,ARNI与ACEI联用会增加血管神经性水肿的风险,故禁忌二者合用,停用ACEI 36 h后方可使用ARNI。在使用过程中要注意监测血肌酐、eGFR和血钾水平等指标,用药2~4周后血肌酐水平较基础值升高<30%时仍可谨慎使用,超过30%时可考虑减量或停药。
CCB分为二氢吡啶和非二氢吡啶类,在CKD合并高血压中被广泛应用,其肾脏保护作用主要依赖于其降压作用。此外,对于eGFR>30 mL/(min·1.73 m2)(CKD 1~3期)患者,噻嗪类利尿剂有效;eGFR<30 mL/(min·1.73 m2)(CKD 4~5期)患者可用袢利尿剂。利尿剂应低剂量使用,因利尿过快可导致血容量不足出现低血压或eGFR下降。
醛固酮受体拮抗剂与ACEI或ARB联用可能加速肾脏功能恶化和增加高钾血症风险。β受体阻滞剂可对抗交感神经系统的过度激活而发挥降压作用,保护心脏和肾脏功能,可应用于不同时期CKD患者的降压治疗。
其他降压药,如α1受体阻滞剂、中枢α受体激动剂,均可酌情与其他降压药物联用。
血液透析患者血压升高可能是由钠负荷、容量负荷过重引起,尽管使用了有效超滤,血压仍难以控制,部分患者表现为难治性高血压,需要多种药物联合应用[96-97]。建议根据患者长期血压监测和合并症情况,选择个体化、相对安全的血压控制范围。透析前或诊室血压并不能很好地反映透析患者的平均血压,推荐进行家庭血压测量。透析患者血压变异不宜过大,透析后收缩压理想目标为120~140 mmHg[98]。在选择降压药物时,同时需要考虑降压药物的血液透析清除率。对于透析中血压升高的患者,不应选择可被透析清除的降压药物。
2.5 心房颤动患者的血压管理 
心房颤动是最常见的心律失常类型,是缺血性卒中的独立危险因素。对不明原因缺血性卒中患者,增加心律监测强度可提高心房颤动的检出率。高血压是心房颤动患者的独立危险因素,与没有高血压的患者相比,心房颤动患者的缺血性卒中风险增加了1.8~2.0倍。血压管理是心房颤动综合管理中重要的干预靶点。
目前关于卒中急性期合并心房颤动患者血压控制目标的文献较少。临床实践中,对于急性卒中合并心房颤动患者,降压治疗一般遵循卒中急性期的降压原则与方案。
心房颤动患者的血压水平与不良结局之间呈明显的“U”形或“J”形曲线。韩国的一项研究分析了158 145例心房颤动合并高血压患者的资料,发现理想的血压范围是120~129/<80 mmHg[99]。相比血压控制在此范围的患者,收缩压≥130 mmHg或<120 mmHg的患者主要心血管事件(卒中、出血、心肌梗死、心力衰竭、全因死亡)发生风险明显升高[100]。收缩压干预试验(systolic blood pressure intervention trial,SPRINT)的事后分析也发现,将血压控制在120/80 mmHg以下时,合并心房颤动高血压患者的预后反而更差[100]。这说明,合并心房颤动的高血压患者进行强化降压治疗可能不仅不能进一步降低心血管事件风险,还会引起结局恶化。对于接受抗凝治疗的心房颤动患者,维持合理的血压水平对预防卒中和出血等事件也是至关重要的。
在预防新发心房颤动及阵发性心房颤动复发方面,ARB/ACEI类降压药物相比β受体阻滞剂、利尿剂等药物更有优势。推荐应用ACEI/ARB降压以预防新发心房颤动及心律转复后复发,从而减少患者的心房颤动负荷。值得注意的是,ACEI/ARB降压药物减少心房颤动复发的作用机制是改善患者的心脏功能,对于无心功能障碍或心力衰竭的患者,应用ARB类药物并不能有效预防心房颤动的复发。当患者因心房颤动或高血压发生心脏重构而导致功能障碍时,选用ACEI/ARB药物控制血压,能有效预防心房颤动复发,并延缓心房颤动的进展。此外,为防止继发心律失常,应避免在高血压伴肾功能受损患者中使用索他洛尔。
对于心房颤动合并顽固性高血压的患者,在导管消融治疗的同时施行肾脏去神经治疗可以有效降低心房颤动的复发率,并具有良好的安全性[101]。肾脏去神经治疗联合导管消融消除心房颤动(evaluate renal denervation in addition to catheter ablation to eliminate atrial fibrillation,ERADICATE-AF)研究发现,对于阵发性心房颤动合并顽固性高血压的患者,与单纯导管消融相比,行肺静脉隔离术同时行肾动脉消融去交感神经术不仅可以使收缩压下降10 mmHg以上,还可降低1年心房颤动的复发风险,同时不增加操作相关并发症的发生率[102]。
2.6 肺部感染患者的血压管理 
肺部感染是卒中后最常见的并发症之一,流行病学数据显示卒中相关性肺炎的发生率为7%~38%[103-109]。卒中可抑制外周免疫系统,即卒中诱导免疫抑制,可导致患者更易发生细菌感染[110]。此外,吞咽困难、年龄、性别、吸烟史、卒中严重程度、意识水平、喂养方式、抑酸剂应用、入住重症医学科、合并高血压、糖尿病、慢性呼吸道疾病、心房颤动等也是卒中患者肺部感染的危险因素[103,111-112]。同时,卒中后发生肺部感染也会加重患者的脑损伤,并导致致死率上升。
对于卒中合并肺部感染患者的高血压管理,同急性卒中患者的血压管理,建议在行抗高血压治疗的同时兼顾肺部感染的发展。
卒中合并肺部感染患者的降压药物选择有CCB、ACEI和ARB,非必要情况下尽量避免使用β受体阻滞剂及利尿剂。
CCB可降低肺部感染患者发展为败血症的风险[113]。ACEI可通过增加局部P物质水平,预防卒中后吞咽困难的发生,进而降低高血压卒中患者吸入性肺炎的风险,且这种作用强于ARB[114-115]。卒中合并高血压患者使用β受体阻滞剂抑制交感神经兴奋的效果有限,β受体阻滞剂甚至会增加卒中后肺部感染的发生[116]。β受体阻滞剂还可能增加卒中后尿路感染的发生率[117]。对于高血压合并慢性阻塞性肺疾病的患者,β受体阻滞剂可能对基础肺功能产生不利影响:利尿剂可能降低血钾水平,加重二氧化碳潴留,干扰黏液分泌,导致痰液不易咳出,从而加重病情[118-119]。因此,建议将CCB、ARB/ACEI或CCB/肾素血管紧张素阻滞剂联合作为合并慢性阻塞性肺疾病患者高血压管理的首选药物[118]。
三、卒中二级预防中的降压策略
我国≥18岁人群高血压的粗患病率为27.9%,高血压是卒中和TIA发生和复发重要的危险因素之一,控制血压能够降低卒中复发风险[26]。在缺血性卒中患者中,高血压的诊断率约为70%[120-122],然而,高血压的患病知晓率、治疗率和控制率较低,分别为46.9%、40.7%和15.3%[122]。
3.1 降压预防卒中复发的循证证据 
卒中后降压治疗研究(poststroke antihypertensive treatment study,PATS)是由我国开展的在国际上第一个证实二级预防降压治疗有效的随机对照试验。PATS结果表明,吲达帕胺(2.5 mg/d)治疗组与安慰剂组相比,血压降低了5/2 mmHg,卒中复发相对风险降低了29%[123]。培哚普利预防卒中复发研究(perindopril protection against recurrent stroke study,PROGRESS)是一项包括中国受试者在内的国际多中心卒中二级预防试验,其结果证实降压治疗可以显著降低卒中复发风险,且这种风险降低与收缩压下降幅度相关[56]。一项荟萃分析纳入8项试验,共有35000例既往发生过卒中或TIA的患者,结果提示降压药物治疗可降低卒中复发率(8.7% vs. 10.1%)和心血管疾病死亡率(4.0% vs. 4.7%)[83]。预防复发性卒中临床结局研究(recurrent stroke prevention clinical outcome study,RESPECT)、卒中或TIA不同收缩压目标(prevention after stroke -blood pressure,PAST-BP)研究、皮质下小卒中的二级预防(secondary prevention of small subcortical strokes,SPS3)研究以及预防卒中后认知下降试验(prevention of decline in cognition after stroke trial,PODCAST)都在有脑血管病病史的患者中比较了强化降压(收缩压目标<120~130 mmHg)和标准降压(收缩压目标<140~150 mmHg)预防卒中复发的效果,均显示强化降压有降低脑血管病患者卒中复发风险的趋势[124-127]。纳入这4项随机对照试验的荟萃分析显示,强化降压可显著降低卒中的复发风险[124]。但是上述4项随机对照试验的纳入人群存在较大的异质性,其中PAST-BP、RESPECT与PODCAST均纳入了脑出血患者;另外,单个研究的样本量较小,以及卒中复发不是所有试验的主要研究终点。老年高血压患者血压干预策略(strategy of blood pressure intervention in the elderly hypertensive patients,STEP)研究提示,对于老年高血压患者(其中6.3%有心血管疾病病史),相较标准降压(收缩压目标130~150 mmHg),强化降压(收缩压目标110~130 mmHg)能够相对降低26%的复合心血管事件风险和33%的卒中风险[128]。
SPS3研究入组了3020例腔隙性梗死患者,比较收缩压目标<130 mmHg与130~149 mmHg对卒中复发和认知的影响,结果显示,尽管两组的卒中复发风险差异无统计学意义,且两组治疗相关严重不良事件的发生率相似,但收缩压目标<130 mmHg组中脑出血的发生率明显较低[126]。该研究提示,对小血管病导致的皮质下小梗死,收缩压目标<130 mmHg可能更为合适。
目前症状性颅内动脉狭窄患者适宜血压目标值证据主要来自随机对照试验的事后分析。WASID和SAMMPRIS研究证实,对于多数症状性颅内动脉狭窄患者,将收缩压控制在140 mmHg以下是安全的,且与较低的卒中复发风险相关[29-31]。上述研究并没有分析更低的血压目标值是否有进一步获益,因此目前有限的证据提示,对更低的血压目标值应保持谨慎。
3.2 降压药物选择的循证证据 
缺血性卒中或TIA患者降压药物种类的选择与其他高血压患者相似,PROGRESS、卒中二级预防有效性(prevention regimen for effectively avoiding second strokes,PRoFESS)和PATS这3项大型研究的荟萃分析评估了ACEI、ARB和利尿剂在中国缺血性卒中人群中预防卒中复发的作用,结果表明药物种类不影响复发风险[129]。ACEI和利尿剂单片复方制剂(如赖诺普利氢氯噻嗪片等)可增加疗效、改善依从性。CCB用于缺血性卒中预防的数据有限,但对伴有需要使用CCB的合并疾病(如心绞痛等)的患者,可以同时采用CCB进行降压治疗。有临床研究表明,与ACEI、CCB及安慰剂相比,β受体阻滞剂可能不会降低卒中风险[130-131]。因此,除非有强适应证,否则不应使用β受体阻滞剂单药预防卒中复发。ARNI是一种新型降压药,可用于合并心力衰竭、左心室肥厚、CKD(1~3期)等患者[132-133],其对卒中二级预防的疗效需要进一步研究证实。此外,养血清脑颗粒可以改善脑循环,治疗慢性脑供血不足引起的头晕、头昏、失眠等症状,脉络通颗粒/胶囊具有多靶点抗动脉粥样硬化的作用,可改善脑供血不足引起的头痛、眩晕等症状。
推荐意见
(1)既往未接受降压治疗的缺血性卒中或TIA患者,发病数天且病情稳定后若收缩压≥140 mmHg和(或)舒张压≥90 mmHg,如无绝对禁忌,可启动降压治疗(Ⅰ类推荐,A级证据)。
(2)既往有高血压病史且长期服药的缺血性卒中或TIA患者,如无绝对禁忌,发病数天且病情稳定后可以重新启动降压治疗(Ⅰ类推荐,A级证据);对于血压<140/90 mmHg的患者,启动降压治疗的获益并不明确(Ⅱa类推荐,B级证据)。
(3)对于降压目标,如患者能耐受,推荐收缩压降至<130 mmHg,舒张压降至<80 mmHg(Ⅰ类推荐,B级证据)。
(4)对于由颅内大动脉狭窄(狭窄率70%~99%)导致的缺血性卒中或TIA,如患者能耐受,推荐收缩压降至<140 mmHg,舒张压降至<90 mmHg(Ⅱ类推荐,B级证据);对于低血流动力学原因导致的卒中或TIA,应权衡降压速度与幅度对患者耐受性及血流动力学的影响(Ⅲ类推荐,C级证据)。
(5)降压的幅度比降压药的种类对降低卒中风险更重要。降压药物的种类和剂量以及降压目标值应个体化,应全面考虑药物、卒中特点和患者个体情况3方面的因素(Ⅱa类推荐,B 级证据)。
四、卒中一级预防中的降压策略
高血压是卒中最主要的危险因素。血压与卒中风险之间的关系是连续、独立、可预测的。血压越高,卒中风险越大[134-135]。在我国,73%的卒中负担与高血压有关[136]。在控制其他危险因素后,收缩压每升高10 mmHg,卒中的相对发病危险增加30%[137]。
4.1 我国高血压的防治现状 
血压随着年龄的增长而升高。超过2/3的老年人患有高血压[138]。目前我国居民的高血压患病率呈升高趋势,18岁以上成人高血压患病率为23.2%,以此推算,全国高血压患者数达2.45亿;正常高值血压检出率为41.3%,人数达4.35亿[121]。近年来高血压患者的知晓率、治疗率和控制率分别为51.5%、46.1%和16.9%,虽较以前有明显提升,但总体仍处于较低水平,高钠、低钾膳食、超重和肥胖是导致我国高血压患者增多的重要原因[121]。
4.2 降压预防卒中的循证证据 
一项来自19个队列,共纳入了177 025例研究对象的研究显示,低盐摄入量与卒中和其他心血管结局的风险降低相关,提倡将全民减少盐摄入量(每日盐摄入量<6 g)作为降低卒中风险的一种干预措施[139]。成丽娟等[140]的研究认为,对正常高值血压人群进行健康教育干预,能够帮助其建立科学、良好的生活方式,从而达到促进和维护健康的目的。国内外大量研究结果提示,居民对卒中危险因素及预警症状认知水平较低,且卒中发生后的急救意识严重缺乏。Sun等[141]对我国城市居民的调查结果显示,将近50%的居民不知道高血脂、高血压、糖尿病、吸烟是卒中危险因素,对卒中预警症状的识别率也较低。多项大型心脑血管疾病队列研究发现,缺乏体育活动是卒中的重要危险因素。多中心荟萃分析显示,中至剧烈强度的规律有氧运动对减少缺血性与出血性卒中的发病率与死亡率均有独立保护作用[142],运动疗法适用于任何年龄层人群预防卒中,且年轻人群受益程度更多。为达到运动疗法降低卒中发病率及死亡率的有效水平,建议每次运动时间不少于30 min,每周总时间不少于150 min,运动强度中度及以上。可选择慢走、慢跑、游泳等项目,如果辅以肌肉强化(抗阻)训练,效果更佳。
降压治疗能够降低20%~30%的卒中风险,减少因高血压导致的器官损害或死亡[143],但强化降压能否降低卒中的风险仍存争议。在有高心血管疾病风险的糖尿病患者参加的控制糖尿病患者心血管疾病风险性行动(action to control cardiovascular risk in diabetes,ACCORD)研究中,强化血压控制(收缩压<120 mmHg)较标准控制(收缩压<140 mmHg)可降低卒中风险(HR 0.59,95%CI 0.39~0.89),但两组主要结局(非致死性卒中或心血管性死亡)之间的差异无统计学意义[14 4]。SPRINT结果显示,与标准降压治疗组(收缩压目标值<140 mmHg)相比,强化降压治疗组(收缩压目标值<120 mmHg)降低了25%的心血管事件和27%的全因死亡,但强化降压治疗组和标准降压治疗组的卒中风险差异无统计学意义(HR 0.89,95%CI 0.63~1.25,P=0.500)[145]。对强化降压治疗研究的荟萃分析发现,强化降压治疗可降低卒中和心血管复合事件的发生率,但是增加了包括CKD等严重不良事件的发生率;在颈动脉或颅内动脉狭窄患者亚组中,强化降压的疗效未达统计学意义[146-148]。
早期或轻度高血压患者应首先采用改变生活方式治疗,3个月效果仍不佳者,应加用抗高血压药物治疗,具体方法及要求参考世界卫生组织公布的成人高血压药物治疗指南[149]。同时可以参考10年心血管风险的评估结果,制订高血压治疗方案[150]。
各类抗高血压药物均可应用以降低卒中风险。β受体阻滞剂能够进一步降低近期心肌梗死患者的复合心血管事件的风险(RR 0.29,95%CI 0.22~0.34);CCB在预防卒中方面有一定的优势(RR 0.92,95%CI 0.85~0.98),其在降低血压变异性方面比β受体阻滞剂的益处更大[149]。ACEI或ARB对糖尿病患者降压治疗可能额外获益[151-153]。血压降低的目标因患者特点及并发症不同有所差异。基于药物基因组学制定个体化降压治疗方案等领域尚有待进一步研究。为了提高依从性,可以使用单片复方制剂药物,如赖诺普利氢氯噻嗪片、氨氯地平贝那普利片。复方利血平氨苯蝶啶片具有长效、平稳降压的特点,能减少血压波动所致的卒中风险,氨氯地平贝那普利片(Ⅰ)可有效控制患者血压,提高治疗的依从性,且能够显著降低心血管事件的发生。中药制剂如松龄血脉康胶囊、心脉通胶囊等,有降低血压、调节血脂、改善症状的功效,可单独或联合降压药物使用。
推荐意见
(1)推荐进行卒中发病的心血管疾病风险评估,有助于选择启动药物治疗高血压的时机(Ⅰ类推荐,A级证据)。
(2)对正常血压高值者(收缩压120~139 mmHg或舒张压80~89 mmHg),应促进健康生活方式并每年筛查高血压(Ⅰ类推荐,A级证据);对伴有充血性心力衰竭、心肌梗死、糖尿病或CKD者,应给予抗高血压药物治疗(Ⅰ类推荐,A级证据)。
(3)早期或轻度高血压患者首先采用改变
生活方式治疗,提倡减少盐摄入量(每日盐摄入量<6 g),3个月效果仍不佳者,应加用抗高血压药物治疗。中度以上高血压患者除改进饮食习惯和不良生活方式外,应进行持续、合理的药物治疗(Ⅰ类推荐,A级证据)。
(4)降压目标:普通高血压患者应将血压降至<140/90 mmHg(Ⅰ类推荐,A级证据);伴糖尿病或有蛋白尿的肾病的高血压患者应进一步将血压降低至130/80 mmHg(Ⅱa类推荐,B级证据)。65~79岁老年患者可根据具体情况,将血压降至<150/90 mmHg,如能耐受,还应进一步降低至<140/90 mmHg(Ⅱ类推荐,B级证据);≥80岁的老年患者血压一般降至<150/90 mmHg(Ⅱa类推荐,B级证据)。
(5)若能有效降压,各类抗高血压药物均可使用,以降低卒中风险。具体药物选择应基于患者特点和药物耐受性进行个体化治疗(Ⅰ类推荐,A级证据)。
利益冲突 所有作者均声明不存在利益冲突。
审定专家
冯颖青 广东省人民医院
洪 桢 四川大学华西医院上锦医院
牟建军 西安交通大学第一附属医院
龚 涛 北京医院
魏述军 宁夏回族自治区人民医院
胡立群 中国科学技术大学附属第一医院(安徽省立医院)
姜一农 大连医科大学附属第一医院
余 静 兰州大学第二医院
王文志 首都医科大学附属北京天坛医院
张德莲 新疆维吾尔自治区人民医院
崔兆强 复旦大学附属中山医院
江 滨 首都医科大学附属北京天坛医院
执笔专家
王增武 国家心血管病中心 中国医学科学院阜外医院
王 圣 海南省人民医院
冯彩霞 包头医学院第二附属医院
郑昆文 云南省第一人民医院
黄荣杰 广西医科大学第一附属医院
郭 宏 哈尔滨医科大学附属第一医院
任 明 青海大学附属医院
边 波 天津医科大学总医院
段丽琴 山西医科大学第一医院
鲍慧慧 南昌大学第二附属医院
廖晓阳 四川大学华西医院
韩 英 福建医科大学附属第一医院
唐艳红 武汉大学人民医院
俞 蔚 浙江医院
李 亮 河北医科大学第二医院
梁静静 武汉大学人民医院
吴 忧 浙江中医药大学附属第二医院
田 甜 贵州省人民医院
朱余友 中国科学技术大学附属第一医院(安徽省立医院)
刘新通 广东省第二人民医院
声明:脑医汇旗下神外资讯、神介资讯、脑医咨询、Ai Brain 所发表内容之知识产权为脑医汇及主办方、原作者等相关权利人所有。
投稿邮箱:NAOYIHUI@163.com
未经许可,禁止进行转载、摘编、复制、裁切、录制等。经许可授权使用,亦须注明来源。欢迎转发、分享。
投稿/会议发布,请联系400-888-2526转3。














