文献来源:Wang J, Zhou C, Yao W, Wang Q, Min X, Chen G, Xu X, Li X, Xu F, Fang Y, Yang R, Yu G, Gong Y, Zhao J, Fan Y, Liu Q, Cao L, Yao Y, Liu Y, Li X, Wu J, He Z, Lu K, Jiang L, Hu C, Zhao W, Zhang B, Shi W, Zhang X, Cheng Y; CAPSTONE-1 Study Group. Adebrelimab or placebo plus carboplatin and etoposide as first-line treatment for extensive-stage small-cell lung cancer (CAPSTONE-1): a multicentre, randomised, double-blind, placebo-controlled, phase 3 trial. Lancet Oncol. 2022 Jun;23(6):739-747. doi: 10.1016/S1470-2045(22)00224-8. Epub 2022 May 13. PMID: 35576956.
研究背景
全球范围内,肺癌导致的死亡居癌症之首,同时也是排名第二的最常见癌症。小细胞肺癌(SCLC)约占所有肺癌的15%,是一种侵袭性神经内分泌恶性肿瘤。SCLC的特征是快速生长和早期发生转移,大约70%的患者在首次诊断时即处于广泛期。尽管在开发了许多新的治疗方案,数十年来,以铂类药物为基础的化疗(联合依托泊苷或伊立替康)仍然是广泛期小细胞肺癌(ES-SCLC)的标准一线治疗,中位总生存期为9-11个月。
由于PD-1/PD-L1阻断在其他肿瘤类型中表现出显著疗效,并且在SCLC中发现高频率的体细胞突变,这增加了肿瘤的免疫原性,有利于引发适应性免疫应答。目前已经有研究在SCLC中探索PD-1/PD-L1通路的免疫检查点抑制剂。两项3期试验评估了PD-L1抑制剂atezolizumab(IMpower 133)和durvalumab(CASPIAN),第三项试验评估了PD-1抑制剂pembrolizumab(KEYNOTE-604)与化疗联合作为ES-SCLC的一线治疗,并显示出不同的疗效结果。只有在化疗中加入atezolizumab或durvalumab才能显著改善总生存期。这些组合随后被批准作为新的一线治疗选择,并改变了ES-SCLC的治疗方案。阿德贝利单抗(SHR-1316)是一种新型抗PD-L1人源化IgG4单克隆抗体。在进行的I期实验中,阿德贝利单抗显示出初步的抗肿瘤活性和可接受的安全性,高达20 mg/kg每3周一次的剂量下未报告剂量相关毒性;此外,在3-20 mg/kg每3周一次的剂量范围内观察到与剂量相关的不良反应暴露。在食管鳞状细胞癌的II期试验中,阿德贝利单抗联合化疗显示了临床疗效和耐受性。在这项III期试验中,我们旨在评估阿德贝利单抗与安慰剂联合卡铂和依托泊苷作为ES-SCLC的一线治疗的疗效和安全性。
研究方法
CAPSTONE-1研究是一项多中心、随机、双盲、安慰剂对照的3期试验,在中国47家三级医院进行。符合条件的患者年龄为18-75岁,病理证实为ES-SCLC;既往未接受过ES-SCLC的系统治疗;东部肿瘤合作组(ECOG)表现状态评分为0或1分;根据实体肿瘤反应评价标准(RECIST);至少有3个月的预期寿命;并且有足够的血液学指标(白细胞计数≥3 ×10⁹/L,绝对中性粒细胞计数≥1.5 ×10⁹/L,血小板≥100 ×10⁹/L,血红蛋白≥9.0 g/dL,14天内未输血或使用造血刺激因子);无肝转移患者肝酶(天冬氨酸氨基转移酶、丙氨酸氨基转移酶)≤2.5倍正常上限,有肝转移患者≤5倍正常上限;血清总胆红素≤1.5倍;肾功能(血清肌酐≤1.5倍或血清肌酐清除率(Cockcroft-Gault评估≥50ml/min);凝血功能(活化部分凝血活素时间和国际标准化比值≤1.5倍)。脑转移患者如果无症状,疾病局限于幕上区和小脑,在立体定向治疗或全脑放疗(治疗至少在第一次给药前14天完成)后无中枢神经系统进展的证据,并且在停用类固醇后稳定。主要排除标准包括活动性或既往自身免疫性疾病、活动性严重感染、首次研究用药前14天内使用皮质类固醇,以及既往使用T细胞共刺激抑制剂或免疫检查点抑制剂治疗。
随机化和盲法:患者被随机分配(1:1)接受阿德贝利单抗加化疗(阿德贝利组)或安慰剂加化疗(安慰剂组),通过一个集中的交互式网络反应系统,块大小为4。根据当地基准值,随机分配肝转移(是vs否)、脑转移(是vs否)和基线乳酸脱氢酶浓度(正常vs升高)的存在进行分层。
主要终点是总生存期,即从随机化开始到全因死亡的时间。次要终点包括无进展生存期(从随机化开始至RECIST定义的疾病进展或死亡的时间,以先发生者为准)、客观缓解率(确认完全或部分缓解的患者比例)、缓解持续时间(从首次完全或部分缓解至首次疾病进展或死亡的时间)、疾病控制率(完全或部分疾病或疾病稳定持续至少4周的患者比例)、6个月和12个月时的无进展生存期(均由BICR和研究者评估)、12个月和24个月时的总生存期以及安全性。
结果
在2018年12月26日至2020年9月4日期间,对659名患者进行了入选筛选,其中462名(70%)符合入选条件:230名(50%)被随机分配到阿德贝利单抗组,232名(50%)被分配到安慰剂组。所有随机分配的患者均接受至少一剂研究治疗,并纳入疗效和安全性分析(图1)。
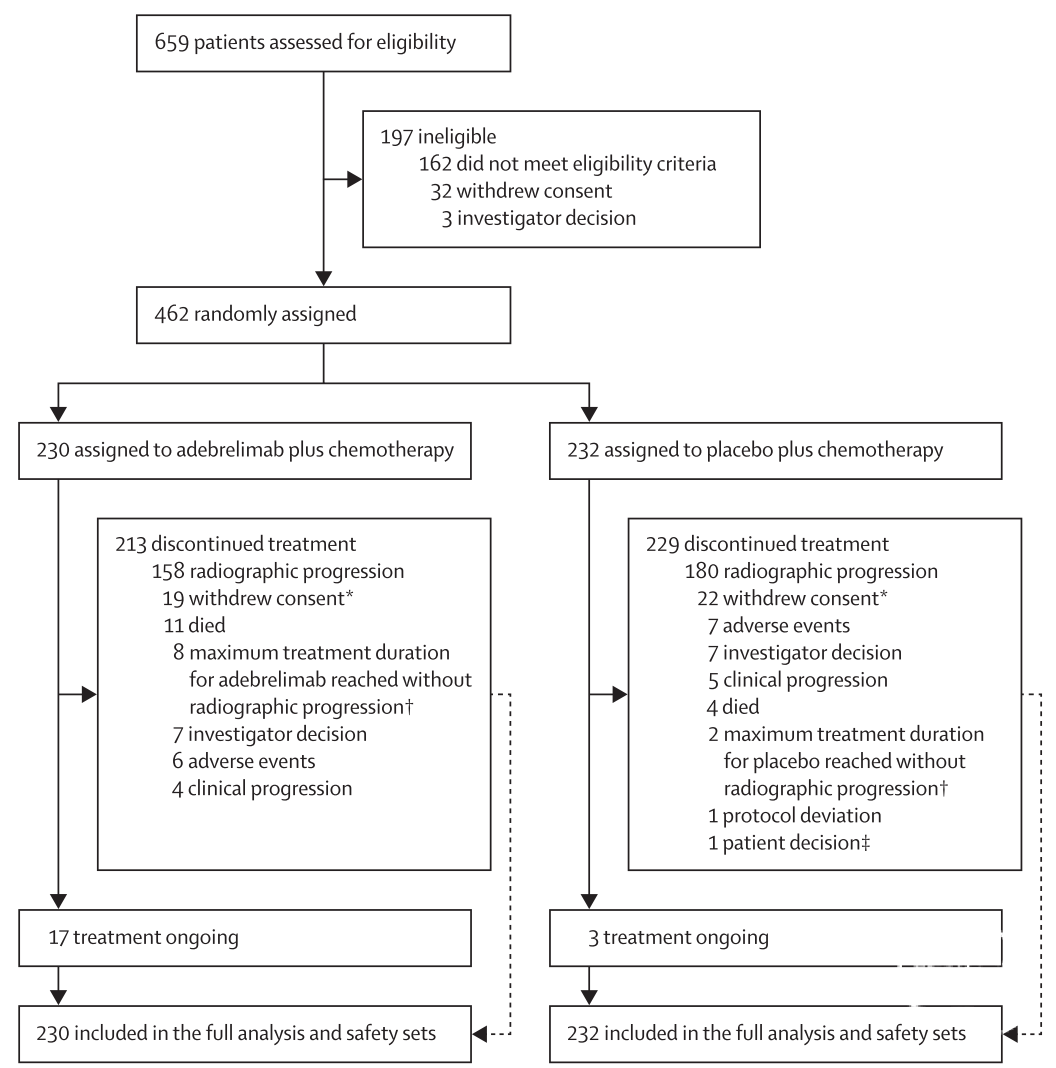
图1.病例筛选流程图
在2018年12月26日至2020年9月4日期间,462名符合条件的患者入组并随机分配,230名(50%)患者接受阿德贝利单抗加化疗(阿德贝利单抗组),232名(50%)患者接受安慰剂加化疗(安慰剂组)。中位随访时间为13.5个月(IQR 8.9 - 20.1)。与安慰剂组(12.8个月[11.3 - 13.7])相比,阿德贝利单抗组的中位总生存期显著提高(中位15.3个月[95% CI 13.2 - 17.5]);风险比0.72 [95% CI 0.58 - 0.90];单侧p= 0.0017)。(图2)在PFS中也观察到同样的生存期延长趋势。
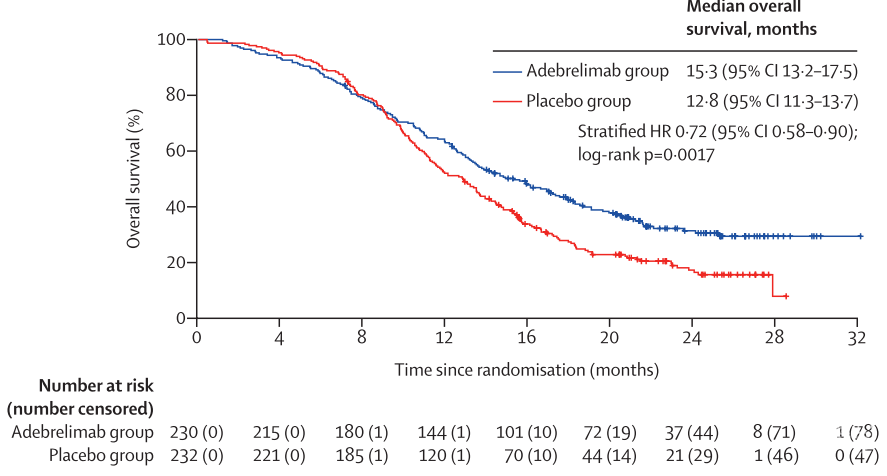
图2. 根据OS绘制的Kaplan-Meier曲线
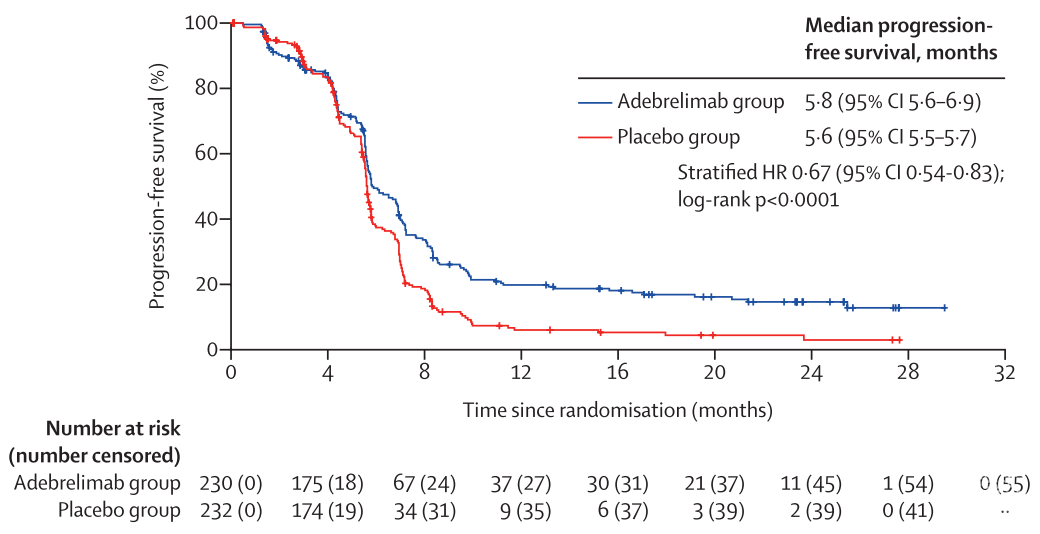
图3. 根据PFS绘制的Kaplan-Meier曲线
结论
研究结果表明,与安慰剂加化疗相比,阿德福雷单抗加化疗显著改善了既往未经治疗的患者的总生存期。
研究局限性
本研究的主要局限性在于所有患者均来自中国,因此阿德贝利单抗联合化疗在其他种族患者中的疗效和安全性特征仍需进一步证实。此外,诊断时脑转移患者的招募率较低(仅为2%)。在IMpower133、CASPIAN和KEYNOTE—604试验中,入组时脑转移瘤的患病率范围为9%至12%。通常情况下,这些研究表明,脑转移瘤患者在临床试验中代表性不足,需要进行更多的研究,可能需要在真实临床环境中进行。此外,仅将PD-L1表达作为生物标志物进行评估。与既往PD-L1抑制剂加化疗作为ES-SCLC一线治疗的试验一致,PD-L1表达似乎不是该研究中治疗结局的预测性生物标志物。鉴于在ES-SCLC患者亚组中观察到阿德贝利单抗+化疗的明确长期临床获益,有必要进行额外的研究以探索生存和持久缓解的潜在生物标志物。

科室文化:一切以病人为中心,团队协作,为病人提供的最终的健康,不是一个疾病的治疗方案。
科训:团结,求是,创新,奉献。
科室服务理念:尽职尽责;尽心尽力,尽善尽美
![]()
声明:脑医汇旗下神外资讯、神介资讯、神内资讯、脑医咨询、Ai Brain 所发表内容之知识产权为脑医汇及主办方、原作者等相关权利人所有。
投稿邮箱:NAOYIHUI@163.com
未经许可,禁止进行转载、摘编、复制、裁切、录制等。经许可授权使用,亦须注明来源。欢迎转发、分享。




