文章来源:中国脑血管病杂志, 2023, 20(6):409-414.
作者:葛晗明 张静 马浩钧 王少朋 范潇男 韩楠楠 张格娟 高燕军 常明则
基金项目:陕西省自然科学基础研究计划(2022JM-452);西安市科技计划项目(21YXYJ0004)
通信作者:常明则,Email:changmingze191 @163. com
脑医汇
摘要:机械取栓术被越来越多地应用于大血管闭塞性急性缺血性卒中的治疗。隐藏动脉瘤破裂是急性缺血性卒中机械取栓术中较为少见的并发症之一。该文报道1例急性缺血性卒中机械取栓术中隐藏动脉瘤破裂的病例,结合文献分析了出现该术中并发症的原因及危险因素,并提出预防及处理该并发症的方法,以供临床医师参考。
机械取栓术(mechanical thrombectomy, MT)被越来越多地应用于大血管闭塞(large vessel occlusion,LVO)性急性缺血性卒中(acute ischemic stroke,AIS)的治疗。隐藏动脉瘤破裂是AIS-LVO血管内治疗术中较为少见的并发症之一,目前尚缺乏相关处理流程的共识或推荐意见。本文报道1例MT术中隐藏动脉瘤破裂的病例,并分析了术中出现该并发症的原因及危险因素,提出预防及处理此类并发症的方法,以供临床医师参考。
患者
女,73 岁,以“言语不清、左侧肢体活动不灵活1. 5 h”于2021年4月3日9 ∶ 29入西安市第三医院急诊科。既往高血压病史5年,血压最高150 / 90 mmHg,规律服用苯磺酸氨氯地平片5 mg / d,血压控制在110 ~ 130 / 60 ~ 70 mmHg。体格检查:体温36. 4 ℃,脉搏75 次/ min,呼吸18 次/ min,血压153 / 80 mmHg。神经系统体格检查:嗜睡,构音障碍,双瞳孔正大等圆,直径3 mm,直接及间接对光反射灵敏,双眼向右侧完全性凝视,双侧额纹对称,左侧鼻唇沟浅,左上肢肌力0 级,左下肢肌力Ⅲ级,左侧Babinski征阳性。美国国立卫生研究院卒中量表(NIHSS)评分13 分,发病前改良Rankin量表(mRS)评分0分。立即启动卒中绿色通道,急查头部CT未见出血(时间为9∶ 43),Alberta卒中项目早期CT评分(Alberta stroke program early CT score,ASPECTS)8分,9∶ 50患者家属签署知情同意书后予注射用重组人TNK组织型纤溶酶原激活剂16 mg。10 ∶ 17 完善头部多模态磁共振成像,时间飞跃法磁共振血管成像(MRA)示右侧颈内动脉闭塞(图1a);扩散加权成像(DWI)示右侧尾状核头、壳核、侧脑室旁片状弥散受限(图1b);磁敏感加权成像(susceptibility weighted imaging,SWI)示左侧大脑中动脉走行区磁敏感血管征(susceptibility vessel sign,SVS;图1c)、髓静脉扩张后的“刷”征及皮质不对称突出静脉征。11 ∶ 09 家属商议后同意行全脑血管造影及MT。术前实验室检查:血常规、肝肾功能、肌酸激酶同工酶、肌红蛋白、电解质、红细胞沉降率均大致正常;高敏肌钙蛋白:0. 0246 mg/ L(正常范围:0 ~ 0. 0175 mg/ L);凝血检查:D-二聚体982 mg/ L(正常范围:0 ~ 500 mg/ L),活化部分凝血活酶时间、凝血酶时间、纤维蛋白原、纤维蛋白原降解产物均正常。11∶ 32 局部麻醉下行右侧股动脉穿刺置入5 F单弯造影管,造影可见右侧颈内动脉闭塞(图1d,1e),顺向对比剂缓慢充盈至C3,左侧颈总动脉造影可见前交通动脉开放,右侧大脑前动脉软膜支向右侧大脑中动脉分布区代偿供血,左侧椎动脉造影可见右侧大脑后动脉软膜支向右侧前颞及顶后代偿供血。7 F导引导管置于右侧颈总动脉末端,6 mm × 3 mm Solitair FR(EV3,美国)支架覆盖右侧大脑中动脉M1 段及颈内动脉C7 段,支架释放后造影可见血栓前移至大脑中动脉M1 段,支架有效段完整覆盖血栓(图1f),使用支架取栓器辅助真空锁定取栓技术[1]将Catalyst 6(Stryker,美国)远端通路导管推送至血栓近端,保持负压抽吸,同时匀速撤出6 mm × 30 mm Solitaire FR取栓支架和远端通路导管。患者突发明显躁动,血压骤升至230 /120 mmHg,导引导管手推造影见右侧大脑中动脉及远端分支显影,右侧大脑中动脉M1段分叉处类圆形结构顶端对比剂喷射状外渗(图1g,1h),考虑隐藏动脉瘤破裂后蛛网膜下腔出血(SAH),迅速徒手压迫右侧颈总动脉降低血流量。急予乌拉地尔25 mg静脉推注后持续静脉泵入控制性降压(目标平均动脉压<65 mmHg),尼莫地平5 ml/ h(规格:10 mg/ 50 ml)静脉泵入缓解血管痉挛,甘露醇50 g静脉滴注脱水降颅压,丙戊酸钠0.4 g静脉滴注预防痫性发作,通知麻醉科插管行全身麻醉。同时Synchro 2微导丝(Stryker,美国)同轴Catalyst6远端通路导管至右侧大脑中动脉,沿微导丝将Maverick 22. 0 mm × 15. 0 mm球囊(Boston Scientific,美国)置于M1段,覆盖分叉处瘤颈,6 个标准大气压充盈球囊,手推造影M1段球囊覆盖区无对比剂通过。Headway 17微导管蒸汽熏蒸塑形,准备各型号Prime弹簧圈(EV3,美国)。5 min 后卸载球囊,手推造影可见对比剂仍喷射状外渗,再次充盈球囊5 min后卸载,手推造影示出血停止。Dyna CT示全蛛网膜下腔及三四脑室、双侧侧脑室后角高密度影。13∶ 10全身麻醉下三维DSA测量右侧大脑中动脉分叉处动脉瘤,瘤颈宽度1. 9 mm,瘤体最大直径3. 9 mm,瘤体高度3. 2 mm,载瘤动脉及瘤体内壁光滑未见残留血栓。将已塑形Headway 17 微导管沿微导丝送入瘤腔,3. 0 mm × 6. 0 mm Prime弹簧圈成篮后,依次填入2. 0mm ×3. 0 mm、1. 5 mm × 3. 0 mm、1. 5 mm ×2. 0 mm、1.5 mm × 2.0 mm、1. 0 mm × 2. 0 mm 弹簧圈。推入第2 枚1. 5 mm × 2. 0 mm 弹簧圈时襻状结构突出于右侧大脑中动脉下干并迅速血栓形成(图1i),推入1. 0 mm ×2. 0 mm弹簧圈收尾后,将Headway 17 微导管推至下干血栓附近,替罗非班5 ml(5∶ 5与0. 9%氯化钠溶液稀释,1 min/ ml)缓慢推注,同时静脉泵入(4 ml/ h)。推注完毕观察30 min,造影见血栓较前明显减少,改良脑梗死溶栓分级3 级。16∶ 37结束手术转入神经重症监护病房术后管理。20∶ 11 复查头部CT,示右侧外侧裂池、右侧颞顶及双侧枕叶脑沟线样高密度影及栓塞后弹簧圈金属伪影(图1j,1k)。术后替罗非班注射液4 ml/ h泵入持续24 h。术后第2 天(4月4日)11∶ 39神经系统体格检查:嗜睡,左侧肢体肌力Ⅳ级,双下肢静脉超声示左下肢肌间静脉血栓,那曲肝素2050 IU,2 次/ d预防下肢静脉血栓症。术后第3 天(4月5日)19∶ 07心电监护示快速心室率,复查心电图示心率144 次/ min,心房颤动伴心室率过速。患者无不适,未予特殊处理,约5 min后恢复窦性心律,考虑为阵发性心房颤动。4 月9日9∶ 15复查头部CT,示出血已明显吸收,右侧尾状核头、壳核低密度影。术后第7 天(4 月10 日)停用那曲肝素,予利伐沙班15 mg(1次/ d)抗凝,预防心房颤动所致栓塞。4月11日16∶ 22复查头部MRA,右侧大脑中动脉下干未显影,DWI示右侧颞前、岛叶皮质及尾状核头、壳核信号略增高。T2 液体衰减反转恢复(FLAIR)序列示双侧颞后、枕叶沟回内高信号影。术后磁共振动脉自旋标记成像示右侧额顶颞叶脑血流量正常。4 月21 日予以出院,神经系统体格检查:血压120 / 63 mmHg,心率77 次/ min,意识清醒,轻度构音障碍,无凝视,左侧中枢性面舌瘫,左侧肢体肌力Ⅳ 级,左侧Babinski征(+),NIHSS 评分2 分(面瘫1 分+构音1 分)。术后90 d随访mRS评分0分,NIHSS评分1分(构音1分)。术后12个月(2022 年5 月18 日)随访mRS 评分0 分,NIHSS评分0 分,复查DSA示右侧颈内动脉及远端分支显影良好,右侧大脑中动脉下干通畅,分叉部动脉瘤栓塞完全,瘤颈无残留(图1l),复查MR T2 及SWI示基底节区梗死周围及双侧顶枕叶含铁血黄素沉积(图1m,1n)。
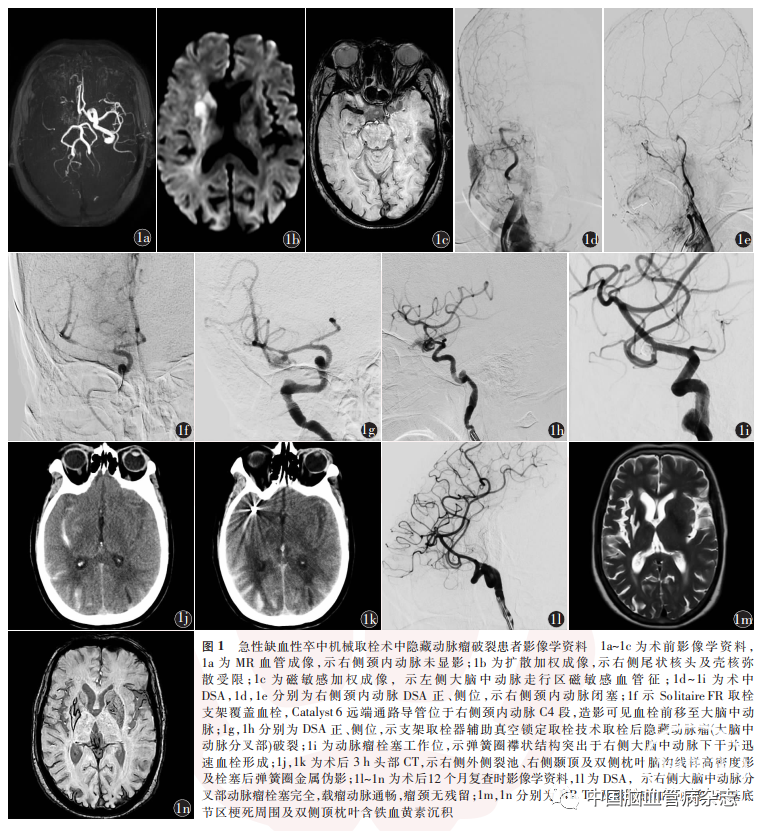
讨论
颅内动脉瘤是颅内动脉壁的局限性、病理性扩张,是一种潜在的致命性脑血管病。偶发未破裂颅内动脉瘤(unruptured intracranial aneurysm,UIA)在AIS患者中的患病率为3. 6% ~ 9.3% [2-4],而以健康成人为参考人群进行计算的全球患病率为3. 2% [5]。AIS患者UIA发病率相对较高可能与卒中和动脉瘤具有相似的危险因素,如高龄、动脉粥样硬化、高血压病史和吸烟等[2]有关。值得注意的是,女性UIA的患病率明显高于男性,一项纳入了83项研究共94 912名平均年龄50岁、无合并症的成年人群的荟萃分析结果显示,女性UIA的检出率比男性高1.61倍[5]。颅内动脉瘤和颅内血管狭窄的高共病性可能是由于动脉粥样硬化引起的纤维组织沉积的形态学变化和血流模式的改变,导致血管失去弹性、扩张和动脉瘤形成,而抗血小板聚集药物在缺血性脑血管病中的应用也降低了颅内动脉瘤的破裂率[6]。随着神经影像学技术的发展,UIA的检出率还在进一步增加[7]。
AIS-LVO闭塞动脉远端或闭塞段内部的UIA在术前影像学检查中多不能被很好地识别,故被称为“隐藏动脉瘤”[2],MT血管内器械操作可能会导致隐藏动脉瘤破裂。Zibold等[2]连续纳入300 例行MT的AIS病例,闭塞部位远端或闭塞段内部的隐藏动脉瘤数量均为5例(1. 7%),术中动脉瘤破裂导致SAH 1 例(0. 3%)。Yilmaz 等[8]的研究显示,支架MT导致SAH发生率为5.5%(12 / 217),推测隐藏动脉瘤的破裂是MT期间发生SAH的原因之一,但由于靶血管未成功再通、瘤体小且被血栓填充、血管痉挛、周围血肿压迫、投射角度等原因未在SAH后发现隐藏动脉瘤。
我们以“蛛网膜下腔出血或颅内动脉瘤”和“血管内治疗或机械血栓切除术”为主题词,在中国知网、万方医学数据库中检索中国科技核心期刊数据库中的中文文献;以“subarachnoid hemorrhage or intracranial aneurysm”and “endovascular treatment / therapy or mechanical thrombectomy”为检索式在PubMed 数据库中检索英文文献,检索日期为1990年1月1 日至2023 年5 月20 日。充分阅读检索到的病例系列研究、病例报告及其参考文献,手工检索其中初始检索公式未捕获的论文,提取并总结相关信息。文献中的病例需涉及闭塞动脉位置、隐藏动脉瘤位置、手术方式、术中动脉瘤是否破裂、患者预后等。共筛选出17篇文献报道的19例隐藏颅内动脉瘤[9-25],2例患者未标明性别,其余17例中,女性11例。其中大脑中动脉闭塞9例,隐藏动脉瘤均位于大脑中动脉M1分叉部;颈内动脉颅内段闭塞6例,其中3例隐藏动脉瘤位于大脑中动脉M1 分叉部,3 例位于颈内动脉C7 段(后交通段);颈内动脉C1串联病变2例,隐藏动脉瘤均位于大脑中动脉M1分叉部;基底动脉闭塞2 例,隐藏动脉瘤均位于基底动脉尖。14例病因明确,其中4例的发病机制是动脉至动脉栓塞,7例为心源性栓塞,3例为血栓性颅内动脉瘤血栓延伸导致载瘤动脉闭塞,其中2例位于大脑中动脉分叉部,1 例位于颈内动脉C7 段。MT过程中隐藏动脉瘤破裂7 例(7 / 19),其中支架取栓导致破裂4例,动脉溶栓导致破裂2例,1 例为通过充盈的球囊导引导管造影(共注入6 ml对比剂)导致破裂;其中4例(4 / 7)死亡,3 例术后30 d预后良好(mRS评分≤2分)。19 例患者中有2 例未进行急诊血管内治疗,而在病情加重后行颞浅动脉-大脑中动脉旁路移植术,并进行动脉瘤夹闭,术后90 d患者均仍存在偏瘫[9]。文献报道的AIS-LVO 合并隐藏动脉瘤包括3 种模式:栓塞(动脉至动脉栓塞及心源性栓塞)远端存在UIA;隐藏动脉瘤内血栓延伸至载瘤动脉导致载瘤动脉闭塞(血栓性颅内动脉瘤);隐藏动脉瘤中自发性血栓延伸导致的载瘤动脉闭塞。UIA引起AIS的比率较低,约为0. 5%(15/ 3 202)[26]。Nurminen等[27]认为大脑中动脉是最常见的血栓性动脉瘤发生部位之一,占比32%(41 / 129),血栓形成的大脑中动脉瘤主要位于大脑中动脉分叉处(25 / 41)。我们通过检索文献,共检索到3 例血栓性颅内动脉瘤导致载瘤动脉闭塞病例,2 例位于大脑中动脉分叉部。动脉瘤自发性血栓的形成机制[28]:动脉瘤体积与瘤颈横截面积的高比值(相对于瘤颈横截面积,动脉瘤囊的体积越大,基底部血流越缓慢,增加了血栓形成的可能性);动脉瘤穹顶内的湍流导致内皮损伤(内皮下基质的暴露有利于血小板沉积和血栓形成);壁内血栓的阻碍导致O2 和代谢物无法向动脉瘤壁扩散;脆弱动脉瘤滋养血管引起的复发性壁内出血;动脉瘤壁重塑(可能导致囊内血栓形成、血栓迁移和继发性破裂)。48%(52/ 108)的直径为20 ~ 25 mm 的动脉瘤和76%(91 / 119)的直径超过25 mm的动脉瘤可检测到血栓形成,发生缺血性症状的UIA(9 例)的平均直径为12. 5 mm(直径5 ~ 45 mm)[29]。Kühn等[10]报道了1例大脑中动脉分叉部动脉瘤,瘤体大小为5 mm × 4 mm,瘤颈为3 mm,动脉瘤内血栓完全阻塞了整个动脉瘤囊,并延伸至载瘤动脉近侧和远侧,导致血管完全闭塞,提示小动脉瘤(直径≤5 mm)[7]也可能是血栓形成的来源。Yasuda等[30]认为,小动脉瘤血栓形成导致载瘤动脉闭塞的患者可能合并易栓症,如抗DNA、抗核和抗心磷脂抗体水平增高,狼疮抗凝物阳性,蛋白C和S活性降低等;血栓栓塞载瘤动脉导致闭塞血管远端动脉瘤不显影,多见于心房颤动等引起的心源性栓塞(7 / 14)。本例患者考虑为心源性栓塞合并隐藏动脉瘤:MT过程中栓子发生移位(栓子自颈内动脉T部移动至大脑中动脉),SVS征阳性提示心源性栓塞的可能性大[31];载瘤动脉再通后其管腔及动脉瘤瘤体内壁光滑未见残留血栓,术前术后影像学未显示任何血栓性颅内动脉瘤的证据;患者为突发起病,阵发性心房颤动。
AIS-LVO的靶血管隐藏动脉瘤在MT中具有致命性破裂风险。MT包括桥接或非桥接的单独抽吸或与Solitaire等支架取栓装置联合取栓。Aketa等[11]认为,支架取栓装置操作中的3个关键步骤均可能会造成隐藏动脉瘤破裂:在支架置入之前,微导丝和微导管须穿过血栓远端不可见的血管段,可能无意中进入并刺穿隐藏动脉瘤;回撤支架过程中,牵引力转化为对血管壁的剪应力,可能撕裂脆弱的动脉瘤壁;再灌注导致血流量突然增加,UIA瘤内的压力增加导致破裂。
直接抽吸首次通过技术(a direct aspiration first pass technique, ADAPT)将抽吸力施加到血栓的基底近端,可在血管壁上施加比支架取栓装置更低的剪应力,对载瘤动脉的内皮细胞产生更少的损伤,并且可以在不穿过血栓和动脉瘤的情况下实现再通[31]。故ADAPT可能是存在隐藏动脉瘤的AIS-LVO行MT的首选。为满足抽吸效力,抽吸导管直径逐渐增大,当大直径抽吸导管穿过分叉部的动脉瘤时,对动脉瘤壁的应力也可能会导致动脉瘤破裂,尤其在路径迂曲的时候,Brehm等[32]认为,在此情况下蒸汽熏蒸重塑抽吸导管头端可以有效地将导管推送至靶血管并可到达顺应血管的平直部位,避免对动脉瘤颈的干扰。
Oshikata等[12]报道了2 例存在隐藏动脉瘤的AIS-LVO患者,其中1例为颈内动脉闭塞,在颈内动脉末端,应用近端球囊导引导管阻断下降取栓支架回撤入抽吸导管(a stent-retrieving into an aspiration catheter with a proximal balloon, ASAP)技术[33],穿刺至血管成功再通(改良脑梗死溶栓分级3级)时间为35 min,隐藏动脉瘤未破裂。该研究指出,支架取栓装置的展开及锚定可能会导致血管走行更为平直,使抽吸导管前行时对动脉瘤壁产生更小的应力;由于支架取栓装置回撤时的牵引力可产生剪应力并作用在血管壁上,因此通过将抽吸导管越过动脉瘤颈,支架取栓装置回撤入抽吸导管,即ASAP技术,可以避免支架对隐藏动脉瘤的干扰。
目前尚无指南或专家共识推荐的对AIS-LVO伴隐藏动脉瘤在MT过程中破裂的程序化处理方案。若隐藏动脉瘤在术中发生破裂,可参考择期UIA弹簧圈栓塞术中破裂的处理方案:如控制性降压(平均动脉压≤ 65 mmHg),鱼精蛋白中和肝素,临时输注血小板等;如术中使用球囊导引导管,可充盈球囊导引导管阻断血流;无近端阻流装置且导丝导管未到位情况下可以徒手压迫颈动脉,减少血流量;使用颅内顺应性球囊,如Scepter球囊(Microvention,美国)临时阻断(充盈封堵瘤颈)[13]。若无法封堵瘤颈、瘤颈撕裂、瘤体破口过大或侧支循环丰富时,弹簧圈或胶闭塞载瘤动脉(或同时闭塞载瘤动脉远近端)应被视为阻止继续出血的优先选择之一。然而,这种方法可能导致完全的动脉供血区梗死或梗死范围明显增加,必要时需开颅减压。
AIS-LVO介入治疗前影像学识别或预测隐藏动脉瘤较为困难,但仍需仔细判读术前、术中影像隐藏UIA存在的可能,特别是颈内动脉C4 ~ C7段、大脑中动脉分叉部、前交通动脉、基底动脉尖等隐藏动脉瘤好发位置。多发动脉瘤占总体UIA的20% ~ 30%,应警惕该类患者存在隐藏动脉瘤的可能,尤其在具有遗传性疾病(如常染色体显性遗传多囊肾病、埃勒斯-当洛综合征、马方综合征等)、动脉瘤家族史等特殊人群中[34]。CT可显示相对较大、血栓形成、闭塞或钙化的UIA,术前CT上的高密度结节征象[14]与动脉瘤中的血栓或动脉瘤腔的动脉粥样硬化变化一致,但是相对较小的动脉瘤中高密度结节结构的放射学征象不易被识别。CT显示的血管内血栓的高密度影不应超过母血管的预期直径,超过母血管预期直径的高密度影应怀疑存在动脉瘤的可能[28]。在应用多模态MR进行AIS-LVO评估时,T1、T2序列可清晰地显示隐藏动脉瘤,T1 可观察到类圆形结构(T2 呈流空影),T2 FLAIR序列可显示高信号的瘤体内血栓[35]。本病例中,术后回顾影像学,SWI序列SVS征远端存在膨大的半圆形结构(图1c),也预示着隐藏动脉瘤的存在,该大脑中动脉分叉部动脉瘤直径为3. 9 mm,属于小动脉瘤,故仅在SWI被显示出,可能与SWI 2 mm层厚及SVS征可以大致勾勒出闭塞血管形态有关,所以回顾术前SWI影像学可能对隐藏动脉瘤的判定有一定的提示所用。
在延迟的CT血管成像(CTA)轴位或冠状位图像或CTA最大密度投影图(maximum intensity projection,MIP)上存在丰富的一级或二级侧支循环也可以清晰地显示隐藏动脉瘤,对比剂可能通过侧支循环充满动脉瘤[9]。闭塞部位远端的血管可以通过血管造影套件中的对比增强平板探测器CT血管造影检测到[36]。进而有助于识别闭塞血管内或远端的隐藏动脉瘤。平板探测器CT血管造影成像是通过动脉内稀释对比剂注射后采集DSA图像,可显示AIS-LVO闭塞部位远端的血管,但需要侧支血流分数大于1[37]。
术中也可以通过穿越闭塞段后的微导管造影来确定闭塞血管远端是否存在隐藏动脉瘤[27]。Swarnkar等[16]报道了1例基底动脉尖闭塞行血管内治疗的病例,微导丝在近基底动脉尖的中线位置成环状,无法进入大脑后动脉,怀疑为基底动脉尖隐藏动脉瘤导致,重组组织型纤溶酶原激活剂从近端溶解血栓后证实了隐藏动脉瘤的存在。Hayashi 等[38]也指出UIA较多出现的血管分叉部,若微导丝前行时突然成U形转弯,需要怀疑隐藏动脉瘤的存在。
综上所述,对于AIS-LVO患者,术前均应仔细进行神经影像学判读,评估隐藏动脉瘤存在的可能性,术中可根据微导管造影、导丝异常走行进一步判断,并采取合理的措施进行治疗,降低致命性动脉瘤破裂的可能性。
声明:脑医汇旗下神外资讯、神介资讯、脑医咨询、Ai Brain 所发表内容之知识产权为脑医汇及主办方、原作者等相关权利人所有。
投稿邮箱:NAOYIHUI@163.com
未经许可,禁止进行转载、摘编、复制、裁切、录制等。经许可授权使用,亦须注明来源。欢迎转发、分享。
投稿/会议发布,请联系400-888-2526转3。







