
有许多种类电极可用于记录和刺激神经组织,其中大多数需要与目标组织直接接触。这些电极的范围从大型头皮电极,用于无创地记录来自大脑大面积/体积的平均低频电信号,到直接植入组织并与一个或几个神经元连接的植入式电极。除了头皮电极(提供非常低分辨率的记录)外,每个电极都需要高度侵入性的脑外科手术植入,这对患者带有显著的风险。为了减轻这种风险,可以使用微创血管内电极。多种血管内电极已经被开发出来,通过标准的导管进入大脑的血管。本文就血管内电极的发展和应用进行了综述。

本文首先简要回顾了传统的、用于神经记录和刺激的非血管内设备,如头皮脑电(EEG)、硬膜外和硬膜下(ECoG)和深度电极(立体脑电图:SEEG、深部脑刺激:DBS和植入式电极)。本文综述的其余部分重点是血管内记录和刺激,讨论目前血管内电极的研究,血管内手术和进展,现有和潜在的临床应用。
1.2.1. 非血管检测方法
大脑中的神经元可以通过多种方式被检测。有几种不同类型的设备用于记录或刺激神经组织,可以根据它们的位置和放置位置进行分类。用这些设备可以记录的信号的类型和性质取决于电极的大小以及电极和目标组织之间的距离和偏移量。头皮电极被无创地放置在头皮表面,记录脑电图信号。硬膜外和硬膜下电极被植入颅骨下(需要开颅手术放置),用ECoG记录和刺激浅层脑区。硬膜外电极也可以放置在脊髓表面,用于脊髓刺激(SCS)和记录,深度电极通过手术插入脑深部区(DBSs)。植入式电极(微线、多位点探针等)用于记录和刺激具有单细胞分辨率的小群神经元(主要是在研究环境中),但也需要一个高度侵入性的术式。
电极尺寸对可记录的信号频率的影响最大。大电极记录的是大脑容量上的平均低频电位,而小电极记录在局部区域,可以以较低的空间平均检测更高的频率信号(如局部场电位(LFPs)和单一活动)。信号频率也受到电极和目标之间组织的数量和类型的影响。记录的振幅与电极与目标神经元之间距离的平方成反比,因此放置在更靠近目标区域的电极可以以更少的噪声干扰记录更高的振幅(从而记录更高的信噪比-信噪比)信号。因此,小电极必须非常精确地放置,与目标相邻,以记录局部的、高分辨率的信号,而大电极在放置精度上有更大的公差,但将以更多的空间和时间平均记录信号。
刺激电极表现出与记录电极相似的比表面积/大小和距离趋势:比表面积更大的电极可以提供更高的电流,但会刺激更大的神经元群,需要更高的刺激振幅来激活与电极的距离或偏移量更大的神经元。在大多数情况下,表面积增加的小电极是首选,因为它们可以调节局部和专门的神经元群,这通常比刺激大的大脑区域有更多的临床效益。
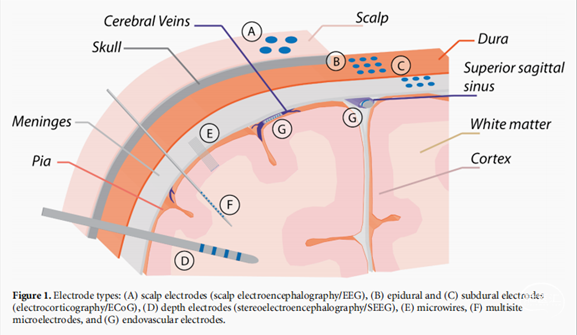
1.2.2. 头皮电极(头皮脑电图)
头皮脑电图(通常称为EEG)是在头皮表面记录大电极(直径4-10mm)的电信号(图1(A)和2(A))。这种非侵入性的方法通常用于解释大脑状态和神经系统疾病,如癫痫。脑电图信号根据不同大脑活动的频率将脑电图信号分为不同的频段,通常使用10-128个头皮电极来覆盖整个头部。
1.2.3. 硬膜外和硬膜下电极(ECoG)
ECoG是将较小的电极(直径0.5-4mm)放置在硬脑膜表面(硬膜外图1(B)和2(B))或硬脑膜下(硬膜下图1(C)和2(B))记录电信号。微电极(∼40µm直径)也可用于更高分辨率的记录。电极通常被放置在一个多电极网格中,以覆盖大脑表面感兴趣的区域。植入过程是侵入性的,由于电极网格的大小,需要开颅(硬膜下电极,硬膜切开术),但这种采集方式为癫痫灶的定位和其他临床方法无法获得的其他神经系统疾病的诊断提供了有用的信息。
ECoG旨在记录频率小于300赫兹的信号。电极更接近目标组织(与脑电图相比),因此它们能够以较少的空间平均量记录较小的神经元种群——硬膜下ECoG的空间分布可以局部分布到约0.5-5mm。ECoG记录的振幅比脑电图大得多,从数百微伏到几毫伏。
硬膜下电极也常用于刺激皮质表面附近的区域,与神经刺激器结合使用,这些电极可用于治疗神经系统疾病,如癫痫、帕金森氏症和其他运动障碍,或慢性疼痛。硬膜下电极也被用于闭环脑机接口(BMI),以在控制机器人肢体时提供用户反馈。

1.2.4. 深部电极(SEEG和DBS)
SEEG是用小电极(围绕直径0.86-1.27毫米,长1.3-3毫米的探针)在放置深脑组织的长探针上记录电信号(图1(D)和2(D),(E))。SEEG探针沿其长度包含多个(4-10)个电极,有时将微电极放置在较大的接触点之间,或将微线插入轴的核心,以记录单一的活动(图2(C))。该装置的植入需要在颅骨上有一个钻孔,每个导线都要立体定位。每一次放置导联都会导致局部组织损伤,进而触发沿着探针路径的炎症反应。与ECoG的情况一样,SEEG被用于定位癫痫灶或诊断其他现有临床方法无法准确诊断的神经系统疾病。
SEEG电极记录了频率小于300 Hz 的LFP(来自一小群局部神经元的信号)。在正常情况下,SEEG记录的振幅在数百微伏的量级上。当癫痫发作发生时,振幅可显著增加到1 mV以上。如果放置正确,电极与目标组织非常接近,因此可以记录一个小的局部神经元群,空间平均低于脑电图。由于电极尺寸小,电极必须在目标组织约500µm内才能记录LFP,并记录从直径约1 mm的组织区域收集的信号。
DBS电极连接到植入式神经刺激器,刺激大脑的不同区域,以治疗神经疾病,如癫痫、帕金森症和其他运动障碍,或各种精神疾病,包括重度抑郁症(MDD)和强迫症(OCD)。
1.2.5. 植入式电极
获得神经记录的分辨率单个细胞或小群神经元(多个单位),小直径微电极必须位于接近目标组织,因为它们只能记录来自电极表面约50µm范围内高达200µm直径区域的信号。这些微电极可以被放置在大脑表面(硬膜下微电极),但更常见的是穿透大脑,因此它们可以被放置在更靠近目标神经元的地方。微线(图1(E)和2(F),(G))是薄的绝缘导线(直径25-80µm),具有暴露的尖端(尖端长度0-20µm),提供一个单一的记录位置。几根微线可以排列成一个微线阵列,以实现记录从一个组织体积内的多个神经元的单一活动。碳纤维具有类似于微线的结构,具有绝缘长度的碳纤维(3.5-40µm直径)和一个暴露的尖端(0-250µm尖端长度)形成一个单一的电极。另一种常见的类型是硅基的针状阵列。例如,Utah阵列是一个直径为80µm的绝缘硅柄阵列,锥形到一个暴露的尖端(50µm尖端长度)。为了实现沿着植入柄的不同深度的记录,我们开发了多位点电极阵列(图1(F)和图2(H))。多位点电极阵列是平面探针(10-550µm,1-50µm横截面),在硅或聚合物主干上有多个电极(直径10-55µm)。植入式电极需要一个侵入性的植入手术,通过钻孔或开颅手术来进入脑组织。大多数时候,其中的一小部分硬脑膜也需要被切除。微电极阵列的横截面积通常被最小化,以减少对周围组织的损伤。它们非常精细,由于插入限制(探针在机械上不够坚固,通常用于大脑的深部区域)。植入式电极能够记录单个或多单元(从1个到几个神经元的信号),具有最高的空间分辨率,并覆盖非常宽的频率范围(高达数千Hz)。使用微电极在细胞外记录的峰值活动的典型振幅为数十到数百微伏]。微电极也被用于刺激临床和研究环境中的小组神经元。一些例子是应用,如视觉和听觉皮层刺激产生人工视觉和听觉,治疗运动障碍,如帕金森病和BMI。
1.3. 血管内神经检测
虽然传统的神经记录和刺激方法已经有重大的临床进展和研究结果,但在许多情况下是不可取的。血管内电极是一种比植入表面和深度电极更少的侵入性方法,并且可以提供类似的记录和刺激能力,即使可以间接地(通过血管壁)进入目标组织。血管内外科手术技术和设备的最新进展使更多的大脑区域可以通过血管内通路进入,并提供了安全措施来降低患者的风险。
支持鞘和远端导管现在可以提供同轴系统所需的刚度,以及通过曲折的血管解剖到达目标区域所需的灵活性。同样,微导管越来越能够安全地到达脑血管系统的远端。新型的气球安装的微导管,如微型导管(Aliso Viejo,CA),正在将现有的气球技术小型化,可以增加血液流动。微型导丝,如同步导丝(斯特莱克,卡拉马祖,MI),强调材料柔软,在精细的解剖中操作,而不影响精确操纵性所需的扭矩效率。除了导管和导丝外,血管内植入物已经从根本上改变了许多脑血管疾病的管理策略。颅内和颅外支架越来越灵活地导航曲折的解剖到远端目标,同时保持足够的径向力,以保持血管通畅。此外,血流分流支架,如管道栓塞装置(美敦力公司)优先保持血流在血管内,远离病变节段。这种分流支架的小型化,如FREDJr.(微干预,Aliso Viejo,CA)允许这些设备比以往任何时候都放置在更多的远端区域。药物洗脱涂层目前正被应用于支架,以减少即时血栓形成和远端栓塞,从而提高了这些管理策略的安全性。
这些血管内技术的进步使操作者能够提高其安全性和有效性。将这些血管内设备,如支架和导丝与神经记录和刺激技术相结合,创造了微创设备传递到以前挑战到的中枢神经系统(CNS)区域的潜力。皮层表面的硬膜下和硬膜外电极无法到达更深的皮层区域,如可能代表信息丰富区域的沟状褶皱,穿透深度导线和微电极会对其路径中的任何组织造成损伤,包括血管系统。血管内电极是访问位于这些自然褶皱内的脑静脉结构的路线图,这些区域以前无法到达或有并发症的高风险。研究人员已经检查了潜在的血管靶点,包括动脉的和静脉的,它们位于靠近传统上用于记录和调节治疗的大脑区域。实例包括以脑膜中动脉为目标的颞侧结构,大脑前动脉A1分裂为伏隔核,运动条和感觉条为皮质静脉。目前有多种类型和配置的血管内记录和刺激设备用于研究设置。由于血管壁的厚度有限,血管内电极通常记录来自距离电极几毫米内的组织的LFPs(<300 Hz)或其他低频局部信号(而不是单个或多个单位)。这种类型的记录被称为EV脑电图,并对癫痫映射和BMI等应用很有用。
1.3.1. 血管内植入技术
植入技术首先是直接进入血管内空间,最常见的是通过直接针穿刺血管壁。选择动脉切开术或静脉切开术包括方便操作者如表面血管靠近皮肤表面,最大化手术安全如选择可压缩的支架在血肿的发展,和增加病人或主题舒适包括选择适当的血管直径以适应所需的引入鞘。一旦进行了最初的血管通路,导管可以通过导管鞘引入血管内空间。使用同轴可操纵的导丝可以改善输送导管在曲折的血管解剖结构中的导航,有时甚至不利于血液的方向。在输送导管推进到目标血管后,可以进行实际输送装置的实际输送,通常安装在推线上。例如,采用支架形式的装置可以通过脱套技术推出导管的远端,在这样做时,支架装置内的径向力将允许其扩张并实现与血管内膜的接触。血管内空间是与中枢神经系统到达深层和浅表目标的自然途径,同时提供了一条可以最小化组织损伤或炎症反应的途径。
1.3.2. 血管内记录和刺激装置的类型
1.3.2.1. 导丝/导管电极:1973年至今
最早的血管内记录设备是基于现有的导丝和导管。在许多情况下,一个标准金属导丝被推进到记录位置,并使用一个标准导管,将整根管子绝缘,除了末端的几毫米,在尖端产生一个电极。在某些情况下,具有暴露金属电极的定制绝缘导丝或具有嵌入电极的导管是专门为记录目的而建造的(而不是使用现有的,没有绝缘的导丝,或现有的导管,不包含电极位置)。用于血管内记录的导丝和导管样设备通常直径在0.2-0.6mm之间,暴露的尖端(电极)长度为1.5-60mm。虽然有一些研究报道了刺激,但在大多数导丝或导管电极的研究主要焦点是记录。
1.3.2.2. POD导管
1969年,Hilalet开发了小型磁引导导管,可以导航到人的颅内血管。Penn等对导管进行了修改,以记录麻醉狒狒尖端的电活动。一个为1.5 mm长,直径为0.6 mm的钴磁铁被嵌入导管的尖端,其中心是一根不锈钢导线。第二导线连接在柔性弹簧结构上,暴露在尖端附近,作为双极记录中的第二电极。
钴尖端作为EV脑电图电极电阻范围从70到100 Ω。自发脑电图(-50µV)记录当电极位于远端颈动脉虹吸从一只狒狒和声音诱发脑电图活动在内侧颞叶记录从另一个狒狒电极位于大脑中动脉。从血管内电极(-200µV)获得的记录中,可以观察到头皮电极(∼50µV)记录的幅度较高的神经信号。将一个较长的脑电图探针送到轻度镇静的人类患者的大脑中动脉,记录阿尔法活动(主要是14-16Hz),而头皮记录主要显示8-9Hz的活动。
1.3.2.3. 导引线
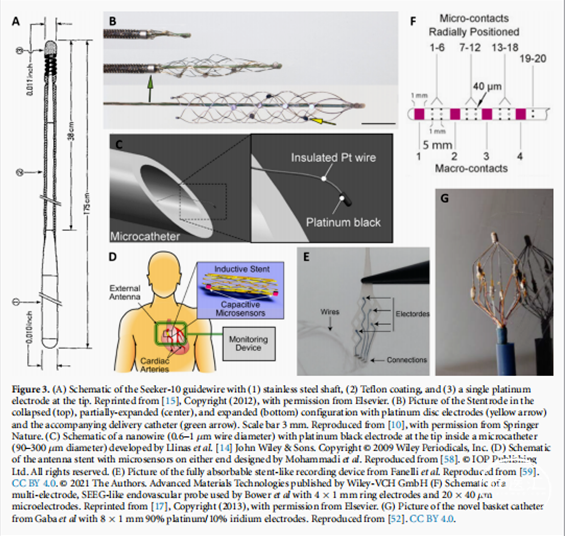
在早期血管内记录研究中,最常用的导丝是Seeker导丝——一种聚四氟乙烯涂层的不锈钢导丝,其尖端有一个单铂电极(直径275-310µm,长度3-60mm),如图3(A) 所示。该装置在1993年至2002年间经常被用于研究人类癫痫患者的颅内脑电图和诱发电位。Stoeter等使用Seeker-10导丝(直径0.010’)作为中脑膜动脉(颞叶外表面)的动脉内电极。11例患者中有8例记录的慢alpha波和theteta波的振幅比头皮脑电图电极(∼70µV)大2-4倍。Nakase等[发现类似的结果是,脑中动脉的标准头皮脑电图。在所有14例患者中,2-5倍高压电动脑电图高于头皮脑电图(∼100µV)。而在脑干中,EV脑电图与头皮脑电图相比,幅度和频率无明显差异。
1.3.2.4.其他导丝/导管电极
其他商业导丝已经在一些人类和动物研究中用于脑电图。在大多数情况下,金属导丝尖端被用作电极,导丝的长度(尖端除外)可以用聚合物涂层或非导电导管绝缘。与Seeker导丝的情况一样,使用其他导丝的EV脑电图记录对脑电活动比头皮脑电图更敏感。
Ishida等人和荷兰人收集了颞叶癫痫患者或动脉瘤治疗期间的Wada测试(检查语言和记忆)期间的EV脑电图记录。血管内电极定期记录发作间期的峰值,而头皮脑电图电极未检测到,其振幅比头皮脑电图电极高2-3倍(∼5-20µV)。这一趋势得到了几项动物研究的支持,包括He等的研究,该研究表明,兔脑电图的振幅更大,频带更宽,信噪比高100倍。Fujimoto等发现,在猪上矢状窦中,有97%也被猪上矢状窦(SSS)的血管内电极捕获。
1.3.2.5.多电极,SEEG样探针:1998-2013年
为了获得更高分辨率的记录,我们开发了沿其长度有多个电极的血管内装置。这些设备具有与深度探针非常相似或相同的配置,在导管的末端有几个环形电极(1-3mm长)(直径∼1mm),在较大的触点之间有可选的微电极(直径∼40µm)(图3(F))。导管的中心持有电气导线,以连接体外的记录设备。
Thomke等在1998年首次引入多电极血管内记录,并简要报告了常规导管期间人类受试者的电动脑电图,然而Bower等在2013年首次发表了使用这种设备的详细研究。为了更好地量化血管内记录的特征,Bower等将静脉记录与硬膜下电极网格收集的颅内记录进行了比较(大电极:直径2mm,5×6阵列分离5 mm,微电极:直径40µm,4×4阵列分离1mm)。采用标准的临床深度电极,包括4个大电极(环形电极,1 mm长度,5 mm分离)和16个微电极(直径40µm,分离0.5mm)作为血管内记录装置,并插入SSS。在麻醉猪的SSS的静脉电极上记录癫痫样峰值和对皮质表面电刺激的反应。血管内记录的癫痫样棘突与从硬膜下网格中获得的振幅大致相同(-500mV)。
1.3.2.6.微/纳米线电极:2005-2009年
微线(带有暴露的金属或导电聚合物尖端的薄绝缘线)也被用于外周和中枢神经系统的血管内记录。用于血管内使用的微丝的直径范围为0.6-20µm,有时尖端直径较大,以产生更大的记录电极面积。与传统的导丝或导管相比,微丝相对较小,可以单独用于小静脉或动脉(包括小动物模型),也可以作为多根微丝束(允许多通道记录)。
Llinas等用4个直径为20µm的铂/铱微丝组成了一个电极系统,并使用这些电极记录了青蛙坐骨动脉内坐骨神经刺激产生的诱发活动。血管内记录的平均噪声水平约为20µV,诱发活动的信噪比大于30。与使用300µm银球电极从神经表面记录的信号相比,血管内记录显示,噪声的水平和频率特征是相似的。功率差与电极尺寸相一致。另一种由2-4根直径为0.6-1µm的绝缘导线组成的电极阵列被开发出来,用于中枢神经系统的记录(图3(C))。阵列内的每根导线末端是一个小的、裸露的杯状放大,覆盖铂黑色,以减少阻抗(阻抗值未提及)。用电极阵列在体外记录了脊髓的诱发活动。血管内信号具有较高的振幅场电位(-0.5-2 mV,响应随着刺激强度的增加而增加)和与表面记录相似的噪声水平。Llinas组随后评估了电极的力学性能,以确保在脊髓中进行正确的放置,并证实了血管内和表面记录的相似性。该小组还开发了一种15×15µm、可操纵的导电聚合物条,并证明了导电聚合物电极的性能可与银微丝相当。
1.3.2.7.支架电极:2016年至今
Oxley等人于2016年开发了另一种血管内记录设备。铂/钨引线(直径25-33µm,聚酰亚胺绝缘)焊接在铂盘电极的背面(直径500或750µm,厚度50µm)。电极被连接到一个商业化的自膨胀支架(塌陷直径为1.33 mm,膨胀到3-4mm,31.1mm-32mm长度)上。导线被包裹在一个不锈钢阀柱(直径310-410µm)上,并连接在支架上以帮助插入(见图3(B))。完整的骑马装配的大小是针对SSS的。
Stentrode组对绵羊SSS进行了几项长期研究,植入持续190 d,目标是产生等BMI侵入性设备。在整个植入期间进行电性能评估,以确定支架支架是否适合BMI。在整个植入期间进行电化学阻抗谱(EIS),以评估电极-组织界面。1和10 kHz的阻抗比植入后立即进行的台式测试增加了一倍。低频阻抗(<1 kHz)在8d内逐渐下降,然后在13周的测试期的剩余时间内保持稳定。100 Hz的相位角在前7d内增加,然后保持稳定。这可能是由于电极掺入血管壁,这增加了电去组织界面的电容。
植入后进行的EIS显示,表面蛋白在电极表面的吸收和致密化可能导致电极的低频(<1 kHz)相位和阻抗变化。对不同电极尺寸的进一步研究发现,低频(<10 kHz)的阻抗和相位主要由电极组织界面决定,而高频特性主要由电极尺寸决定。
植入期开始时的电化学变化主要是由于蛋白质吸附在电极表面和电极并入血管壁。这个过程发生了6-30天。植入较长时间的支架有更大比例的电极和支架支柱并入管腔壁和更厚的组织覆盖(支柱-管腔距离)。超过190 d时,管腔面积略有减少(由于组织生长在支架壁上),但未观察到血管闭塞。
在一项单独的研究中,当动物休息但清醒时,测量了支架与硬膜外和硬膜下电极相比的空间分辨率。在8-24hz的频段内,硬膜下电极的空间分辨率最高,而硬膜外阵列的空间分辨率最低。在24 Hz以上没有观察到差异。在一个月(0.51 ± 0.07)时,通过记录更大的突发抑制比来验证记录的灵敏度。SSEP记录也被用于预测在按下按钮任务(触摸照明按钮)训练的绵羊的运动高于机会水平,尽管对运动方向(左对右)的预测仅为58%-65%,这表明耐力可能适用于简单的BMI任务。
与硬膜外和硬膜下(ECoG)电极相比,采用急性实验来评估支架的功率谱和记录带宽。与ECoG记录一样,Stentrode记录也显示出振幅的频率依赖性(1/f)降低。功率谱显示,斯登罗德记录和硬膜外记录具有相似的绝对功率、最大带宽(∼190Hz)和振幅(∼20µV),而硬膜下记录具有更高的功率、更高的最大带宽(∼230Hz)和更高的振幅。在绵羊中,SSS被硬脑膜覆盖,因此植入这个位置的支架电极在解剖学上与硬膜外电极相似。研究了电极类型、大小和位置对信号带宽和功率的影响。同时将硬膜外电极(500、750和750µm)、硬膜下电极(500、750、1000µm)和血管内电极(500和750µm)同时植入并进行评估。硬膜外电极的功率最高,硬膜下电极的功率最低。对于直径为500µm的硬膜外、血管内和硬膜下电极,最大电极带宽分别为216、234和226 Hz。双向方差分析(ANOVA)显示,阵列位置和电极大小对带宽都没有显著影响。三种电极记录的信号的信噪比相似(-1.5-2.5)。然而,硬膜下电极显示了广泛的值范围,这表明一些硬膜下电极优于血管内和硬膜外电极。血管内电极的信噪比在30 dB以上保持稳定。研究发现,所有电极类型之间的解码精度都是相似的。总的来说,支架电极的表现类似于硬膜外阵列,且略低于硬膜下阵列。通过测量190天的带宽来评估支架支架的慢性性能。最大带宽在197.4 ± 42.0 Hz下稳定到190 d,持续0-2周,196.4 ± 20.7 Hz 。58%的血管内,96%的深度电极产生运动反应。这种变化可能是由于植入的位置靠近或远离运动皮层。只有23%的血管内电极放置在十字沟静脉后面(离运动皮层最远)产生了反应。不同电极类型之间的刺激阈值无显著性差异。一项早期的可行性研究目前正在进行中,将两名肌萎缩侧索硬化症患者植入内部遥测装置。患者接受了鼠标点击动作的训练(结合BMI光标控制的眼球跟踪),以允许发送短信、网上购物和管理财务状况。两名患者都能够在植入后71-86天开始无监督的家庭使用,打字/点击准确率为93%。
1.3.2.8. 其他设备
除了传统的电极系统外,一些具有更具体功能的设备已经被开发出来。其中一种设备是由高田等人开发的天线支架——一种用作天线将传感器数据从血流传输到体外的支架(图3(D))。最早关于天线支架的报道是2003年的斯坦,这是一种可以使用气球导管膨胀的微加工箔。斯坦蒂纳号长20毫米,部署时宽2.8毫米(平),膨胀时直径3.5毫米,一端安装了一个微机械压力传感器。斯坦坦纳能够成功地读取模拟动脉生理范围内的压力,但没有体内数据发表。穆罕默迪等人后来开发了其他螺旋支架设计,以解决平面设计的机械问题,可用于附加的各种传感器的相同目的。Chow等人[测试了商用螺旋支架用作压力读数检测猪心衰的天线,并在读取组织时发现了一些功率降低。
另一种已开发的设备是完全可吸收的支架样记录装置(图3(E))。Fanelli等人开发了这种建立在可吸收聚合物主干(数月至数年降解时间)上的装置。该设备已经进行了工作台测试,以验证电气性能(通过EIS)、部署和降解时间,但没有公布的体内数据。
1.4. 临床应用
1.4.1. 记录
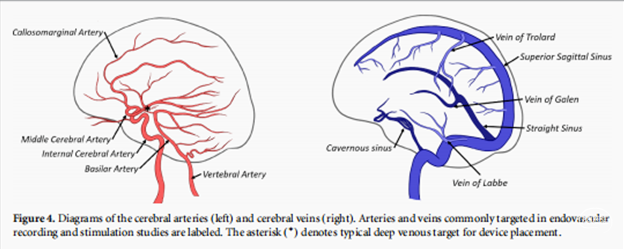
神经记录在研究和临床环境中提供了有用的信息,无论是深入了解神经网络或诊断病理条件。大多数已发表的关于血管内装置的研究都集中在记录功能上,并涉及记录背景活动或诱发电位,但没有列出特定的应用,种植体位置如图4所示。这些研究提供的信息对BMI的应用很有用,因为研究总体上显示,与头皮电极相比,血管内设备的记录质量更好。一些研究已经直接测试了耐力疗法对BMI的疗效,并在绵羊和人类中显示出了良好的结果。这些简单的BMI的成功显示了使用相同的电极来控制假肢的前景。
1.4.2. 神经刺激
也许没有其他领域的神经疾病比癫痫更受到神经刺激进展的影响。颅外刺激器,如迷走神经刺激器(VNS),和皮层下刺激器,如DBS,通过降低耐药癫痫(DRE)患者癫痫发作活动的频率和严重程度,是一种非常宝贵的治疗选择。
开环皮质刺激器也被证明可以减少癫痫活动时,电刺激运动皮层或小脑的区域。反应性神经刺激器(RNSs)作为闭环DBS,信号检测电网可以放置在皮层表面,允许慢性遥测,通过足够的电活动,穿透深度探针可以将致癫痫焦点的部位提供预先确定的刺激。虽然这些传统的(非血管内)设备已被证明在临床上治疗癫痫是有效的,但血管内设备提供了微创和更灵活的植入程序的优势。一些研究已经评估了血管内电极作为神经刺激剂的使用,但还需要更多的研究来确定其疗效。
血管内电极也为周围神经刺激提供了另一种选择。Liu等对人类盆腔内脏神经刺激进行了建模,发现可达到的刺激阈值取决于神经和附近血管之间的距离和相对方向。Opie和O’Brien在模拟迷走神经刺激时也报告了相同的结果。
1.5. 结论
最近的研究表明,血管内电极是一种很有前途的微创神经记录和神经调节的选择。血管内装置可以安全、更准确地到达深度电极无法到达的大脑深度。深度电极的放置受到患者在计算机断层扫描(CT)扫描之间的移动或立体定向框架的移动的固有误差。然而,血管内电极被放置在相对于目标区域的固定位置的血管中,以确保可重复和可靠的放置。使用各种不同的血管内电极的EV脑电图比头皮脑电图产生了更高质量的记录,并且与硬膜外和硬膜下ECoG的质量相似(通过振幅、带宽、信噪比、功率和空间分辨率进行评估)。这些记录研究涵盖了广泛的记录应用,主要集中于BMI和/或癫痫监测的诱发电位(视觉、体感和听觉)的记录。
虽然只有一小部分工作研究了使用血管内电极进行神经刺激,但一些研究已经成功地刺激神经组织并通过血管壁消融病变的脑组织。这些结果表明,血管内记录和刺激具有许多临床应用的潜力,最显著的是作为一种治疗或诊断工具,以取代使用深度(SEEG或DBS)探针或硬膜下/硬膜外(ECoG)电极。目前,SEEG、DBS和ECoG电极被用于治疗多种神经系统疾病,但这些设备的植入对患者有显著的风险。当目标组织靠近足够大的血管时,使用血管内电极可能会显著降低对患者的风险,并产生类似的临床结果。
尽管血管内电极在目前的工作中已被证明是一个有前途的选择,但还需要更多的研究来改进现有的血管内设备,确定设备的寿命,并在临床应用前评估慢性植入的长期安全性。必须开发更小的具有较高电极计数的血管内设备(用于高分辨率的记录和刺激),以安全地到达大脑中较小的血管,同时防止血管闭塞或损伤。现有的工作也主要集中于记录,很少发表的刺激研究。
此外,必须进行长期的植入研究,以评估长期植入血管内电极的安全性,并确保植入时的设备寿命。长期植入的设备必须安全地固定在原地,并必须包括一个植入的遥测单元或天线,用于数据和功率传输。
![]()
声明:脑医汇旗下神外资讯、神介资讯、神内资讯、脑医咨询、Ai Brain 所发表内容之知识产权为脑医汇及主办方、原作者等相关权利人所有。
投稿邮箱:NAOYIHUI@163.com
未经许可,禁止进行转载、摘编、复制、裁切、录制等。经许可授权使用,亦须注明来源。欢迎转发、分享。




