
脑海绵状血管畸形(cerebral cavernous malformations, CCMs)是一种主要发生在中枢神经系统颅内血管异常病变,在人群中的患病率约为0.16–0.5%,其特点是紧密聚集、异常扩张和渗漏的毛细血管和静脉。病理学上,这种病变由具有缺陷的紧密连接和局部抗凝分子失调的异常单层内皮组织构成。内皮组织中紧密连接的丧失和抗凝分子水平的升高可能导致自发性颅内出血(intracerebral hemorrhage, ICH),从而导致癫痫发作、头痛、局灶性神经功能缺陷或危及生命的出血性卒中。根据患者是否存在CCMs阳性家族历史,CCMs患者被分为散发性(约占80-85%的病例)或家族性(约占15-20%的病例)。在磁共振(magnetic resonance imaging, MRI)上,家族性CCMs的多发病变可以分为两种类型:表现为急性或亚急性ICH病灶,以及多个含铁血黄素沉着为特征的点状病变。在散发性CCMs中,由于单个症状性ICH病变通常可以切除后进行基因研究,因此它的基因型-表型的相关性得到了很好的研究。然而,在家族性CCMs中,由于无法获得点状病变的手术样本,因此家族CCMs中多发病变的基因型、表型和发病机制仍然不清楚。最近,首都医科大学附属北京天坛医院神经外科曹勇教授团队联合香港科技大学王吉光教授团队,在《Clinical and Translational Medicine》(IF:10.6)上发表了题为《Genotype-phenotype correlations in multiple lesions of familial cerebral cavernous malformations concerning phosphatidylinositol 3-kinase catalytic subunit alpha mutations》的研究论文。此项研究通过对家族性多发CCMs病灶临床自然观察、手术标本基因测序、体内体外实验,证明ICH病变和多发点状病变的基因型和自然史截然不同,这不仅将加强我们对家族性CCMs发病机制的理解,还将为两种亚型病变的差异化管理策略提供宝贵的见解。首都医科大学附属北京天坛医院神经外科曹勇教授和香港科技大学王吉光教授为本文的共同通讯作者,首都医科大学附属北京天坛医院神经外科王杰博士为本文的独立第一作者。如前所述,CCMs患者被分为散发性或家族性。其中,散发性CCMs可能由CCM基因(即CCM1/KRIT1、CCM2/MGC4607和CCM3/PDCD10)的体细胞功能缺失性突变,或MAP3K3 p.I441M的体细胞激活性突变而产生,通常表现为单个孤立病变且无明显家族病史;而家族性病例通常由KRIT1、CCM2或PDCD10的生殖细胞水平上的缺失性突变引起,其特点是脑内多发病灶且伴有阳性家族史。家族性CCMs的多发病变又可以分为两种类型,表现为急性或亚急性ICH病灶,以及多个含铁血黄素沉着为特征的点状病变。由于无法获得足够的点状病变的手术样本,家族CCMs中多发病变的基因型、表型和发病机制仍然不清楚。在目前的研究中,首先,我们通过长期随访研究了家族性CCMs中两种病变的自然史。随后,我们收集了症状性ICH病变和相邻的点状病变的手术标本,并通过DNA测序检测了它们的基因型。接下来,我们使用脑血管内皮细胞特异性过表达突变的腺相关病毒和内皮细胞特异性Krit1条件敲除小鼠(Krit1iECKO)来研究突变的作用,并探索潜在的治疗靶点。
本研究方法包括研究设计和纳入患者、数据收集和结局、海绵状血管畸形样本准备、DNA提取、海绵状血管畸形组织和外周血样本的全外显子测序、基因突变的检测、突变位点的ddPCR验证、细胞培养及传代、siRNA转染、RNA提取和逆转录定量PCR、蛋白质样品的制备、蛋白质免疫印迹、实验动物、腺相关病毒的合成和注射、小鼠磁共振成像、小鼠脑组织取材、HE染色、石蜡包埋及免疫荧光染色、贝伐单抗治疗和统计分析。
家族性CCMs中症状性ICH病变和点状病变具有不同的自然史
家族性CCMs的主要影像学表现为脑内多发性病变。根据之前的研究,家族性多发性CCMs病变可分为两种类型:症状性ICH病变和多灶性点状病变(图1A)。既往研究表明,症状性ICH的病变易于发生复发性颅内出血事件。然而,与ICH病变相比,多发点状病变的自然史尚不清楚。从2008年到2021年,本研究连续纳入10例携带CCM基因生殖细胞突变的多病变家族性CCMs患者。纳入患者的平均年龄是28.3岁,其中50.0%(5/10)的患者是男性,50.0%(5/10)的患者有CCMs阳性家族史,40.0%(4/10)的患者以局灶功能障碍就诊,而60.0%(6/10)的患者以头痛就诊。10例患者中,有12个ICH病变(首次入院时切除了ICH病变)和505个点状病变(图1B)。在总随访时间为3230.7病变年中,11个病变(10例发生在ICH组,1例发生在点状病变组)发生了新的临床出血事件,随访时间中位数为69.7个月(范围24.4至170月),所有病变的年累积出血事件发生率为0.34(95%CI,0.19-0.61)每100病变年。如图1C所示,Kaplan-Meier生存分析显示ICH病变的症状性出血事件的年累积发生率(每100病变年22.0)明显高于点状病变的年累积发生率(每100病变年0.03)(log-rank检验,p<0.001)。图1D显示了ICH和点状病变的随访MRI的代表性图像,而在切除ICH病变后,剩余的多个点状病变仍然保持稳定(图1E)。我们的结果表明,通过长期随访,家族性CCM点状病变始终保持稳定,而ICH病变则表现出侵袭性病史。
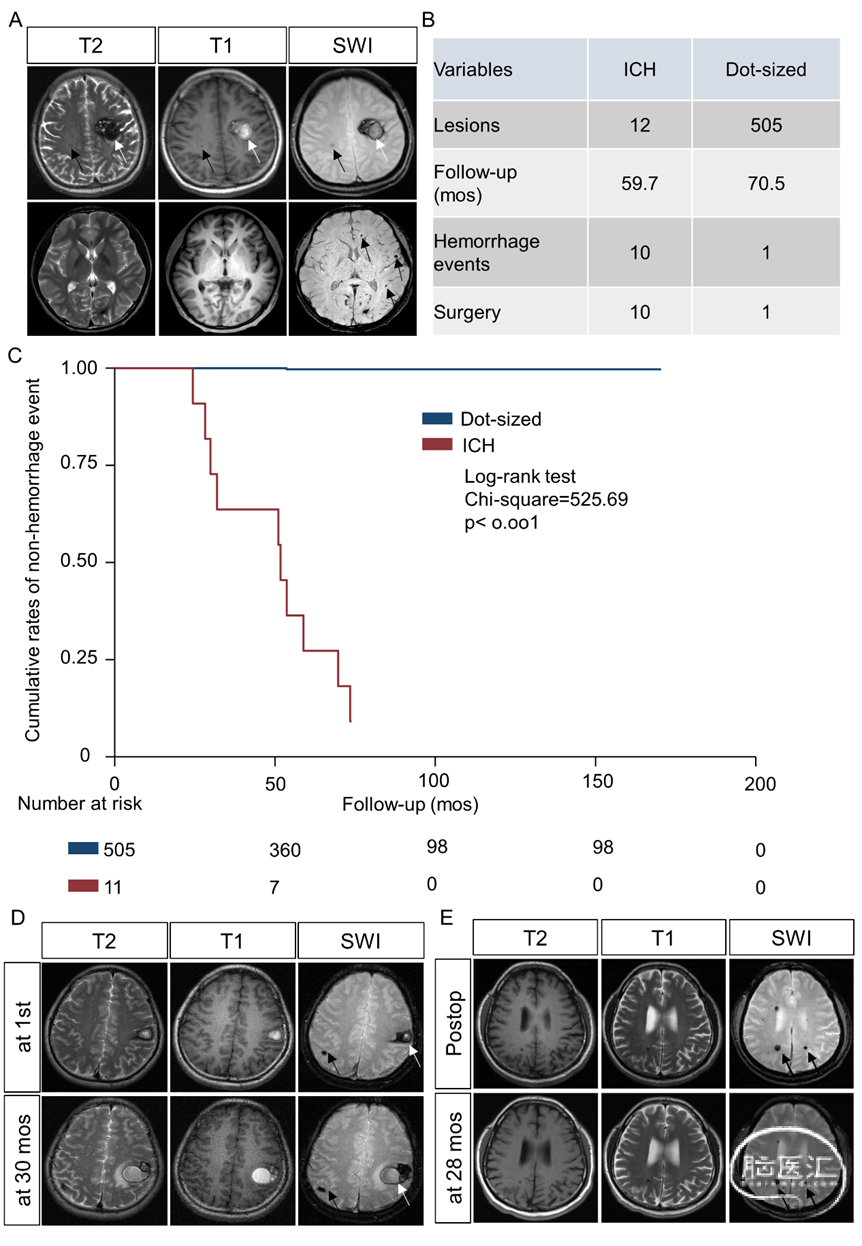
图1. 家族性CCMs中的症状性ICH病变和点状病变具有不同的自然史。A、家族性CCM中多发性病变的分类。白色箭头(ICH病变):T1加权图像(T1WI)上呈高信号,而在T2加权图像(T2WI)序列上呈高或低信号核心,黑色箭头(点状病变):T1WI和T2WI上的等或低信号,或在T1WI和T2WI上不显,但SWI或GRE序列上可见点状低信号病变。B、纳入影像随访患者的总病变、亚组病变、随访月数、出血事件和手术切除情况。一名患者在第一次入院时切除了两个ICH病变中的一个。在总随访时间为3230.7病变年中,11个病变发生了新的临床出血事件(10例发生在ICH组,1例发生在点状病变组),随访时间中位数为69.7个月(范围24.4至170个月),所有病变的年累积出血事件发生率为0.34每100病变年。C、Kaplan-Meier曲线显示了ICH病变和点状病变(黑色箭头)出血事件的累积发生率(Log-rank test, p<0.001)。D、一例患者首次入院时显示脑内ICH病变(白色箭头),30月后随访MRI显示同位置复发性脑内ICH病变,而点状病变(黑色箭头)始终保持稳定。E、在切除ICH病变后,随访MRI显示点状病变(黑色箭头)的保持稳定。
家族性CCMs中ICH病变和点状病变具有不同的基因型
我们最近的研究报道在手术CCMs样本中检测到的KRIT1、CCM2、MAP3K3和PIK3CA突变,并且PIK3CA突变与MAP3K3突变或CCM基因突变的共存率为75%。但对于家族性CCMs患者,两类病灶的基因型目前尚未有报道。首先,我们通过WES数据分析了3名多发CCMs患者的3对症状性ICH病变及其相邻的或手术入路上的点状病变新鲜冰冻标本的基因型,在这3名患者的配对外周血中,WES分别检测到KRIT1、CCM2、PDCD10的生殖细胞突变;结合WES和ddPCR,我们发现3个症状性ICH病变携带了CCM生殖细胞突变和PIK3CA体细胞突变,而3个点状病变仅具有CCM生殖系突变,不伴任何PIK3CA突变(图3A)。然后,通过对纳入的10名患者手术的12例ICH的FFPE样本进行WES分析,检测到KRIT1(n=6,50.0%)、CCM2(n=4,33.3%)和PDCD10(n=2,16.7%)的生殖细胞突变。然而,由于从FFPE样本提取的总DNA量有限,无法通过WES检测PIK3CA突变,因此本研究应用更敏感的ddPCR来检测常见的PIK3CA突变(H1047R、E542K、E545K和C420R)。本研究在10个ICH石蜡样本中发现了PIK3CA突变,其中E545K(4, 40.0%)和E542K(3, 30.0%)是最常见的两种变异,其次是H1047R(2, 20.0%)和C420R(1, 10.0%)(图2A-B)。ICH病变中PIK3CA突变与CCM基因突变的共存率为83.3%(10/12),与我们之前和其他研究报道的一致。总的来说,13个ICH病变携带了PIK3CA体细胞突变,平均突变等位基因频率为2.53%(范围从0.57%到6.33%,图2B)。总之,我们发现86.6%(13/15)的ICH病变携带了体细胞PIK3CA加生殖细胞CCM基因突变,而100%(3/3)的点状病变仅具有CCM基因生殖系突变,这具有统计学意义(Fisher精确检验,p=0.012)(图2C)。
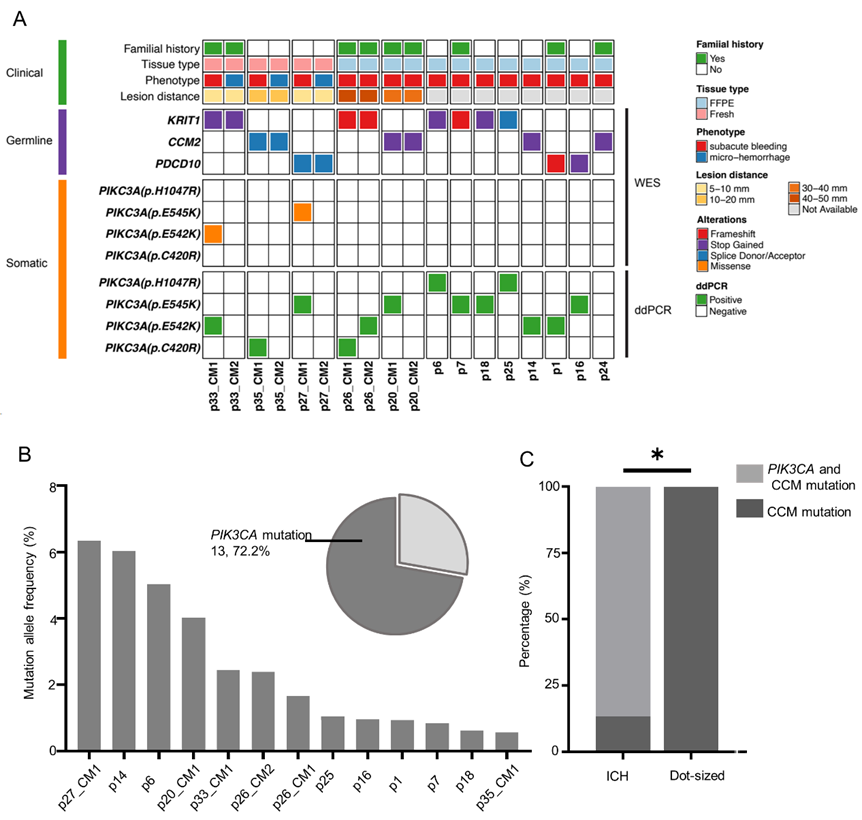
图2. 家族性CCMs症状性ICH病灶和点状病灶的突变谱。A、结合WES和/或ddPCR分析,CCMs的18个亚组病变(3个点状病变和15个ICH病变)的基因突变的总结。B、ddPCR结果显示在13/18(72.2%)的CCMs标本中检测出突变,平均等位基因突变频率为2.53%(范围从0.57%到6.33%)。C、86.6%(13/15)的ICH病变携带了体细胞突变加CCM基因生殖细胞突变,而100%(3/3)的点状病变仅具有CCM基因生殖细胞突变(Fisher exact test, p=0.012)。
PIK3CA突变激活VEGF信号通路,加重Krit1iECKO小鼠的出血
症状性ICH病变富集了生殖细胞CCM基因突变以及体细胞PIK3CA突变,而稳定的点状病变仅具有生殖系CCM基因突变,这暗示着两个亚组病变中有不同的分子机制。为了研究家族性CCMs中多发病变的基因型与表型的相关性,我们进行了体内和体外的分子机制探索。最近的研究表明PIK3CA突变可能与出血事件的风险较高有关,而另一项研究报道PIK3CA突变能够增强CCM模型小鼠的CCM形成。先前的研究表明PIK3CA增加功能突变导致PI3K活性的激活,增加HIF-1a及其下游VEGF的表达。高水平的血管生成因子VEGF可能通过ROCK2途径增加抗凝分子thrombomodulin(TM)的表达,而TM是血管内抗凝途径的关键分子,TM升高被认为与CCMs出血的关键原因。为了确认PI3K通路激活对内皮细胞的影响,基于先前的工作,在正常HUVECs中通过转染siRNA靶向PTEN来激活PI3K信号通路。与对照相比,我们观察到蛋白印迹中PTEN敲除HUVECs中磷酸化AKT水平升高,这证实了PI3K通路的激活。接下来,我们检查PI3K激活是否能够激活VEGF通路。我们发现敲除PTEN增加了VEGFA、磷酸化ROCK2和TM的表达。TM的表达被MK-2206(PI3K信号通路的抑制剂)和Fasudil(ROCK信号通路的抑制剂)逆转(图3A)。此外,我们还研究了PI3K通路激活对Krit1敲除内皮细胞的影响,这些细胞通过转染siRNA靶向Krit1来敲除Krit1。我们发现在Krit1敲除内皮细胞中,PI3K通路的激活也增加了磷酸化AKT、VEGFA、磷酸化ROCK2和TM的表达。TM的表达也被MK-2206和Fasudil逆转(图3A)。总的来说,这些结果揭示了PI3K信号通路的激活能够在在正常HUVECs和Krit1敲除的HUVECs中都促进了VEGF通路的激活。
然后,我们在Krit1敲除小鼠中验证PIK3CA突变的作用。正如先前的研究所报道的,我们对出生后第一天的Cdh5-CreERT2; Krit1fl/fl小鼠胃内注射4-羟基他莫昔芬,诱导Krit1的血管内皮细胞特异性敲除小鼠(Krit1iECKO)。在小鼠30日龄时,通过MRI观察到了位于小脑的CCM病变。然后,在60龄时,通过眶后静脉给Krit1iECKO或Krit1fl/fl小鼠注射AAV-control或AAV-PIK3CAH1047R,90日龄时进行小鼠的脑MRI和组织学检查(图3B)。有趣的是,在MRI上,与AAV-control+Krit1fl/fl, AAV-PIK3CA+Krit1fl/fl和AAV-control+Krit1iECKO组相比,我们在AAV-PIK3CAH1047R+Krit1iECKO组观察到了较大的亚急性ICH病变(图3C-D)。然后,我们通过HE染色比较了四组小鼠中CCM病变的数量和大小,90日龄时,AAV-PIK3CA+Krit1iECKO组和AAV-control+Krit1iECKO组的平均病变数量分别为98.2和44.5个(图3D)。此外,根据先前的研究,我们对不同大小的病变进行了数量统计,我们发现与AAV-control+Krit1iECKO组相比,AAV-PIK3CAH1047R+Krit1iECKO组中有更多较大的病变(>10000um²)(45.0与11.0),这有显著差异(图3E)。为了验证AKT/VEGF信号通路的激活和TM的表达升高,我们进一步在四组小鼠的脑组织切片上进行了磷酸化AKT、VEGFA和TM的免疫荧光染色。在90日龄时,与AAV-PIK3CAH1047R+Krit1fl/fl或AAV-control+Krit1iECKO组小鼠相比,AAV-PIK3CAH1047R+Krit1iECKO小鼠的脑血管内皮细胞中VEGFA和TM的表达水平明显升高(图3F)。总之,这些证据表明PIK3CA激活性突变促进VEGF信号通路的激活,促进了Krit1iECKO CCM小鼠的亚急性出血病灶形成。
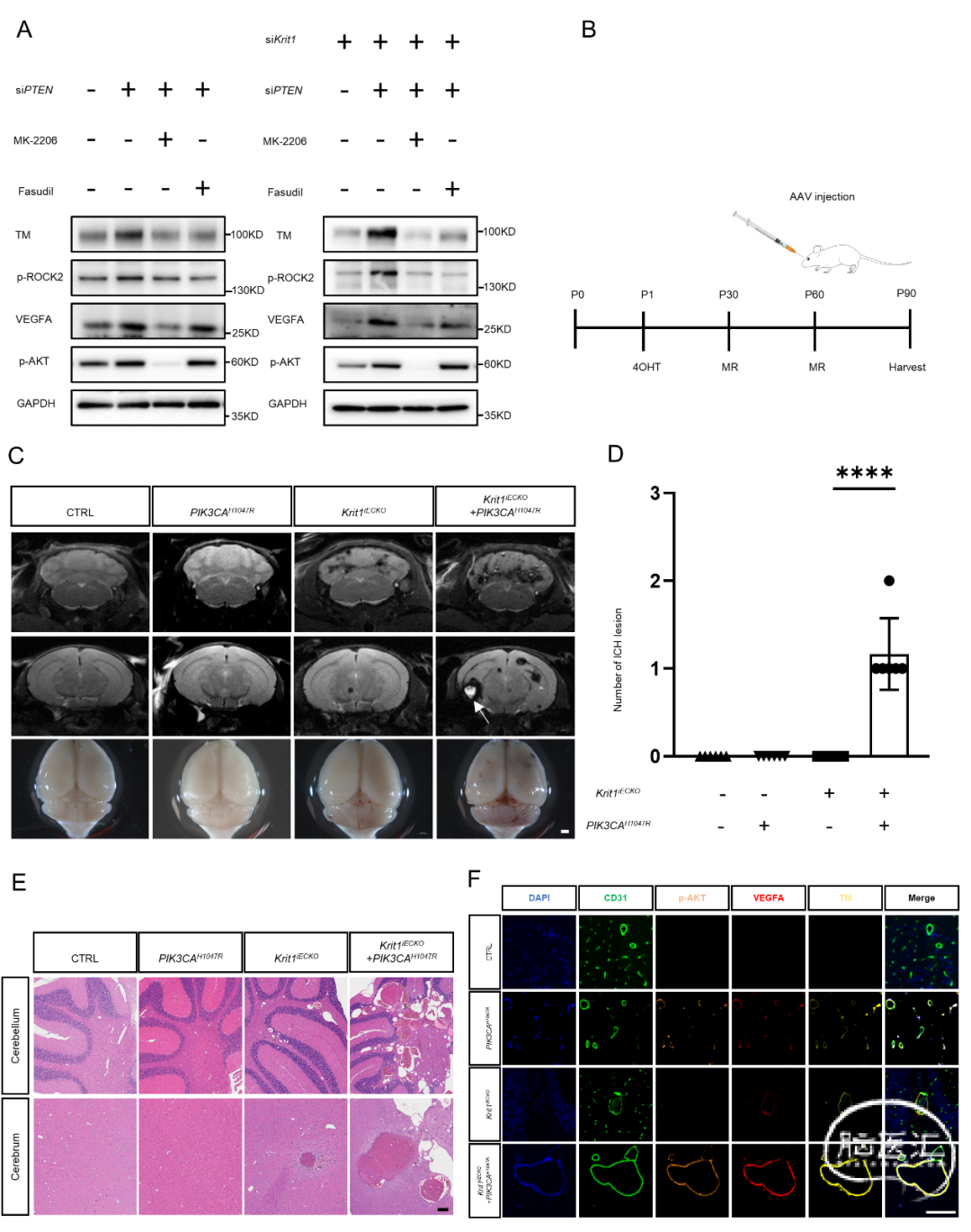
图3. 内皮细胞PI3K通路激活,促进AKT/VEGF/TM表达,导致加重CCM模型小鼠出血。A、人脐静脉内皮细胞(HUVECs)分别转染siPTEN(左图)和HUVECs转染siPTEN和siKrit1(右图)后,蛋白免疫印迹结果提示,与siNC组相比,siPTEN组的phospho-AKT、VEGFA、phospho-ROCK2和TM的表达明显升高,且TM的表达被MK-2206(PI3K通路抑制剂)和Fasudil(ROCK通路抑制剂)所逆转。B、实验方法的示意图。1日龄新生鼠时通过4-羟基他莫昔芬(4OHT)胃内注射诱导全身血管内皮细胞中Krit1敲除,并在30日龄和60日龄时对小鼠进行7T核磁共振成像(MRI),同时在60日龄完成MRI检查后,通过眶后静脉窦注射AAV-control和AAV-PIK3CAH1047R。最后,在90日龄时对小鼠进行MRI检查和组织学检查。C、四个组的代表性的MRI和大体病理图像(CTRL:AAV-control+Krit1fl/fl, PIK3CAH1047R: AAV-PIK3CAH1047R+Krit1fl/fl, Krit1iECKO: AAV-control+Krit1iECKO, PIK3CAH1047R+Krit1iECKO: AAV-PIK3CAH1047R+Krit1iECKO, 每组n=6),****,P<0.0001。E、四组小鼠大脑和小脑的CCM病变比较(每组n=6),条形=200um。F、90日龄时,免疫荧光染色显示四组小鼠脑内血管内皮细胞的phosphor-AKT、VEGFA和TM的表达情况,标尺=100um。
贝伐单抗抑制了AAV-PIK3CAH1047R+Krit1iECKO小鼠ICH形成
我们体内体外研究表明PI3K通路激活可增加VEGF分子表达,导致抗凝分子TM表达上升,诱导ICH病变。因此,我们设想VEGF抑制剂贝伐单抗能够抑制AAV-+Krit1iECKO CCM模型小鼠的亚急性ICH病变。为了验证此猜想,60日龄的Krit1iECKO CCM模型小鼠通过眶后静脉注射AAV-PIK3CAH1047R,同时,该小鼠被随机分为实验组和安慰剂组,实验组小鼠通过尾静脉注射贝伐单抗,剂量为2mg/kg,安慰剂组通过尾静脉注射等体积PBS,每周两次,共三周,然后在小鼠90日龄时进行MRI和组织学检查(图4A)。令人惊讶的是,与安慰剂组小鼠相比,实验组小鼠MRI未见明显亚急性ICH病变(图4B-C)。此外,HE染色显示贝伐单抗治疗显著减少了AAV-PIK3CAH1047R+Krit1iECKO CCM模型小鼠CCM病变的数量,并预防了较大的病灶形成(图4D-F)。这些发现支持VEGF信号通路在家族性海绵状血管畸形发病机制中的关键作用,并确定了贝伐单抗可作为治疗CCM疾病的潜在有效药物。
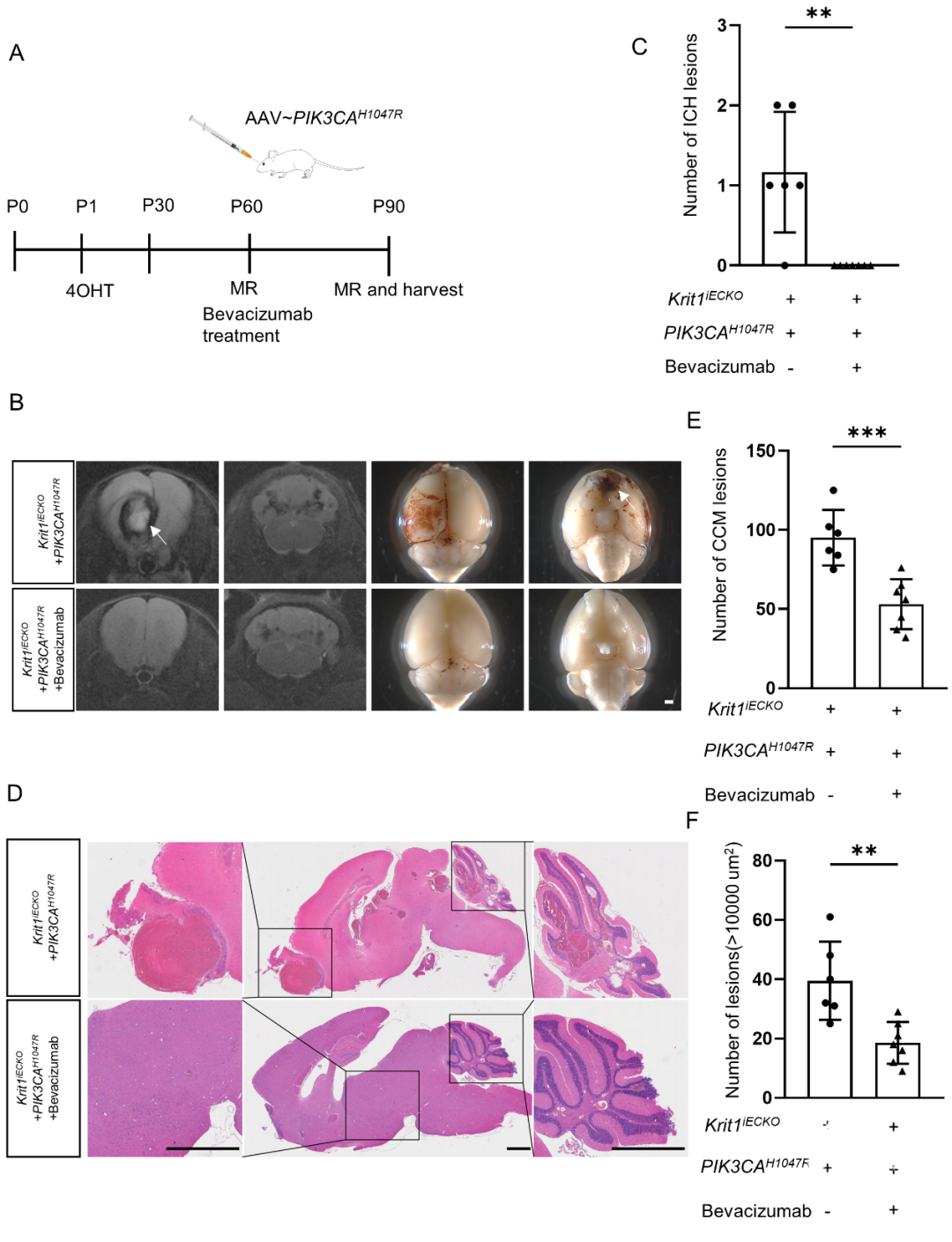
图4. 贝伐单抗抑制+Krit1iECKO CCM模型小鼠中的病灶形成。A、实验方法的示意图。1日龄新生鼠时通过4-羟基他莫昔芬(4OHT)胃内注射诱导全身血管内皮细胞中Krit1敲除,并在60日龄时对小鼠进行7T核磁共振成像(MRI),同时在60日龄完成MRI检查后,通过眶后静脉窦注射AAV-,同时,小鼠通过尾静脉注射贝伐单抗(剂量为2mg/kg)或PBS,每周注射两次,共三周。最后,小鼠在90日龄时进行MRI检查并组织学检查。B、两组的代表性MRI和大体病理图像(AAV-+Krit1iECKO+贝伐单抗,n=7,AAV-+Krit1iECKO+PBS,n=6)。白色箭头显示小鼠中的ICH病变,标尺,1000um。C、两组小鼠90日龄时MRI上ICH病变的数量(AAV-PIK3CAH1047R+Krit1iECKO+贝伐单抗,n=7,AAV-PIK3CAH1047R+Krit1iECKO+PBS,n=6),**P<0.01。D、组织学检查比较两组中位于大脑和小脑中的CCM病变(AAV-PIK3CAH1047R+Krit1iECKO+贝伐单抗,n=7,AAV-PIK3CAH1047R+Krit1iECKO+PBS,n=6),标尺,2000um。E和F、在90日龄时,两组小鼠总CCM病变数量和病变面积大于10000um²的数量比较(AAV-PIK3CAH1047R+Krit1iECKO+贝伐单抗,n=7,AAV-PIK3CAH1047R+Krit1iECKO+PBS,n=6),**,P<0.01,***,P<0.001。在家族性CCMs中,多发性病变可分为两种类型:症状型ICH病变和点状病变;这两种病变具有截然不同的基因型和自然史;PIK3CA突变可能通过激活VEGF信号通路诱导临床症状性ICH形成;VEGF靶向抑制剂贝伐单抗可能是家族性CCMs的有效药物。
•首都医科大学附属北京天坛医院神经外科2021级博士研究生,师从曹勇教授
•从事蛛网膜下腔出血、颅内动脉瘤及脑血管畸形的临床基础研究
•近3年以第一作者在Clin Transl Med、Stroke Vasc Neurol、J Neurosurg、Ther Adv Neurol Disord发表5篇SCI论文,累计IF 29.9分,5年IF 32.0分
•神经外科主任医师、教授、博士生导师
•长期从事神经外科脑血管疾病诊疗工作,在脑血管疾病精准手术治疗、复合手术治疗复杂脑血管病、脑血管疾病精准医学基础研究等方面做出突出贡献:创建基于个体化脑功能保护的脑血管疾病精准外科治疗体系,保护大脑重要功能,预防严重并发症;建立显微外科手术与血管内介入治疗相融合的神外复合手术平台,创建复合手术治疗复杂性脑血管病的新模式,降低了复杂性脑血管疾病手术致残率和死亡率,达到国内领先、国际先进的治疗水平;在国际上率先开展脑血管外科疾病多组学基础研究,探索和发现脑血管疾病新的致病机制,为精准治疗脑血管病提供候选靶向药物
•目前兼任中国卒中学会复合介入神经外科分会主任委员、首都医科大学脑重大疾病研究院副院长
•先后承担国家“十三五”、“十四五”重点研发计划,国家自然科学基金等十余项科研课题。近五年,以最后通讯作者于Circulation Research、Neurology、AJHG、Angiogenesis等高水平期刊发表SCI论文30篇,封面论文2篇。获自主知识产权8项,临床转化3项
•2019年荣获人民日报社、人民网、健康时报主办第三届国之名医·优秀风范荣誉称号。以第一完成人获教育部2022年度高等学校科学研究优秀成果奖(科学技术)一等奖,入选北京市科委科技新星计划、北京市医管局登峰人才计划和北京学者
•香港科技大学夏利萊夫人冠名副教授
•主要研究领域为计算与网络生物学、功能基因组学与癌症演化、人工智能数据整合与计算病理学。开发多套生物信息学软件,如NOA、SAVI2、TEDG、CELLO等,在脑胶质瘤中发现METex14突变、MGMT基因融合,在脑血管瘤中发现MEKK3-I441M突变、GJA4突变等
•曾获2019年度国家优秀青年基金(港澳)支持,荣获首届钟南山青年科技创新奖、哥伦比亚大学欧文研究所精准医学奖、香港科技大学工学院青年学者研究奖、香港科技大学理学院优秀研究奖、中国科学院院长奖学金特别奖、中国科学院优秀博士学位论文奖等
声明:脑医汇旗下神外资讯、神介资讯、神内资讯、脑医咨询、Ai Brain 所发表内容之知识产权为脑医汇及主办方、原作者等相关权利人所有。
投稿邮箱:NAOYIHUI@163.com
未经许可,禁止进行转载、摘编、复制、裁切、录制等。经许可授权使用,亦须注明来源。欢迎转发、分享。






![]()









