
![]()
天津市环湖医院(天津市脑系科中心医院,天津市神经外科研究所,天津医科大学神经内外科及神经康复临床学院)
神经外科 王轩 著述,佟小光 审校
作者按:
联合经岩入路在现代颅底入路体系中具有重要地位。在采用联合经岩入路处理岩斜区内或部分累及海绵窦区的岩斜区病变时,深入理解颅底静脉结构与硬膜切开方法至关重要。大脑中浅静脉(SMCV)是大脑半球血流的“闸门”,涉及海绵窦、翼静脉丛、岩上窦三大颅底引流渠道。其中蝶基底静脉、蝶岩静脉和岩上静脉这三种颅底通路性静脉与经岩手术入路的选择及静脉保护策略密切相关。硬膜切开技术不断发展,旨在尽可能保护重要静脉结构的同时,增加显露空间。本文所提出的叙述体系梳理并囊括了上述学理流变与技术改良的脉络。本文作为“专家论坛”发表在2023年第12期《中华神经外科杂志》,本次将因杂志篇幅所限的内容适当恢复,包括笔者团队的4例岩斜区脑膜瘤手术患者的静脉引流途径分析。同时,笔者将文中所涉及文献的重要图片与手术视频整合加入,以便于读者更好地理解。

1. 导论
![]()
![]()
1.1. 联合经岩入路的地位
笔者依据自己的颅底外科经验与实践思考,将具有代表性的现代颅底入手术路整合后划分为3个范畴,由前至后分别是:
Dolenc-Kawase前外侧入路(Anterolateral Dolenc-Kawase approach)
联合经岩入路(Combined petrosal approach)
髁旁迷路下经颈静脉孔入路(Paracondylar-infralabyrinthine-transjugular approach)
联合经岩入路主要处理岩斜区的肿瘤,前方可涉及海绵窦和Meckel腔(这是与Dolenc-Kawase前外侧入路的交叉之处),后下方可涉及到颈静脉孔、小脑桥脑角(CPA)区及枕大孔前外侧区域(这是与髁旁迷路下经颈静脉孔入路的交叉之处)[Cho 2002, Grossi 2012,Vigo 2022]。
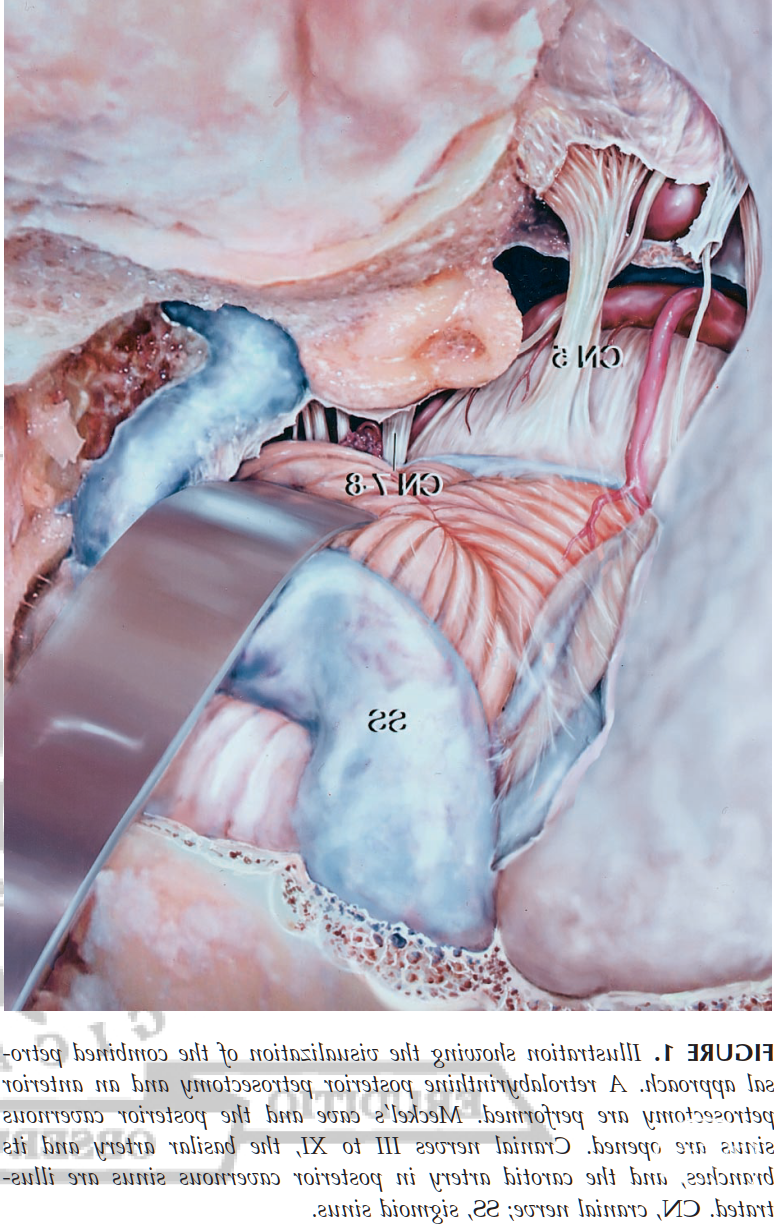
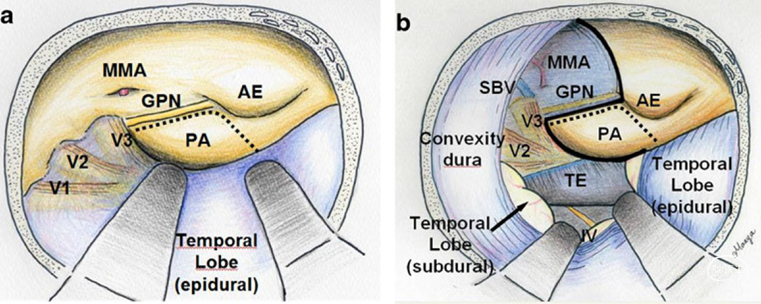
图1-1. 联合经岩入路模式图(Al-Mefty)
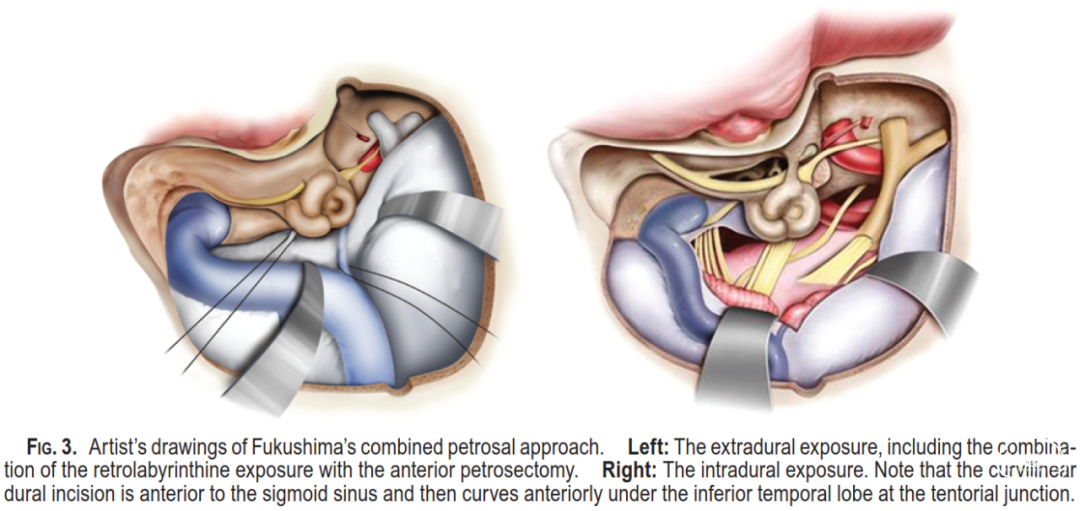
图1-2. 联合经岩入路模式图,保留骨迷路并以其为轴心,与Sekhar的PLPA入路不同(Fukushima)
联合经岩入路并非单纯等同于Kawase入路+乙状窦前入路,其实质是Hakuba后方经岩入路的改良进化版。为避免影响Labbé静脉,经典的颞枕开颅硬膜内颞下入路存在两种改良途径[Fukushima 2009,Fukushima 2010]:
一种是改为扩大中颅底入路,使用前部颞下的术野角度。
另一种则是联合经岩入路,仅选择性磨除部分乳突,不要求成为标准的乙状窦前入路,也不同于耳鼻喉科所强调的通过磨除乳突获得标准的中耳显露,目的主要为处理后方岩骨嵴的三棱形骨锥,并松解其对中颅底硬膜的束缚,仍以中颅底为主体,但可获取更大的显露空间及多个术野角度,抵达病变距离更短,类似于翼点入路手术中对蝶骨嵴的处理[Fava 2022]。

图1-3. 联合经岩入路解剖图,同时暴露周围更大范围的结构以便理解(Miranda)

1.2. 中颅底(岩斜区+海绵窦区)肿瘤手术的关键之处
颅底入路:涉及骨质磨除范围与术野角度(trajectory)等,是以往关注的重点,目前已被神经外科医生所熟知。
颈内动脉:对于受累颈内动脉的处理和保护是全切肿瘤的重中之重,由于high-flow bypass 以及Fukushima bypass技术的存在,这部分困难已得到妥善解决。
颅底静脉结构:以往处于被忽视的位置导致研究有限,随着手术精致化与功能保护的理念逐渐深入人心,术者越来越重视对其的保护。
硬膜切开方法:不仅与保护颅底静脉结构密切相关,良好的硬膜切开方法也对术区显露、离断肿瘤基底血供及脑膜瘤Simpson I级切除至关重要。
因此,结合笔者的颅底外科实践经验,本文重点探讨联合经岩入路手术中相关静脉结构的保护及硬膜切开方法。
2. 相关静脉结构
![]()
![]()
2.1. 颅底静脉损伤可能产生严重的后果
术中出血
静脉性脑肿胀
静脉性脑梗死
2.2. 小脑幕上与幕下的静脉结构均有各自的焦点区域
本文重点探讨前者,后者的结构包括:髁前静脉汇,髁后导静脉,髁外侧静脉,枕下海绵窦,乳突导静脉,边缘窦,枕窦等,同样非常重要,将另文撰述。
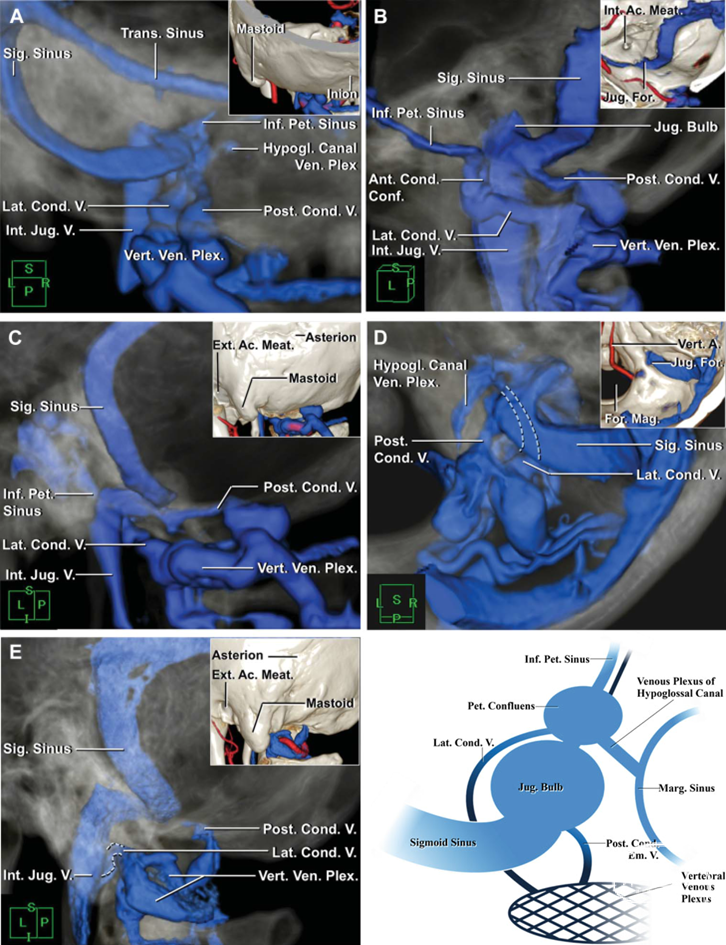
图2-1. 幕下手术涉及的静脉结构(Matsushima)
2.3. 重要静脉结构的分组
笔者认为,重要的静脉结构按照引流的层次和沟通方式可分为4组:
第1组:SMCV(大脑中浅静脉,又称侧裂浅静脉),蝶基底静脉与蝶岩静脉(后两者实际上是小脑幕窦的胚胎残余[Ichimura 2012])。
第2组:蝶顶窦,海绵窦,翼静脉丛。
第3组:岩上静脉。Labbé静脉等颞底桥静脉[Sakata 2000],引流小脑幕上血流;另外还包括岩上静脉,引流小脑幕下血流。
第4组:TS-SS(横窦-乙状窦),SPS(岩上窦),其中SPS引流岩上静脉和部分患者的前置Labbé静脉。
2.4. 上述静脉分组的意义
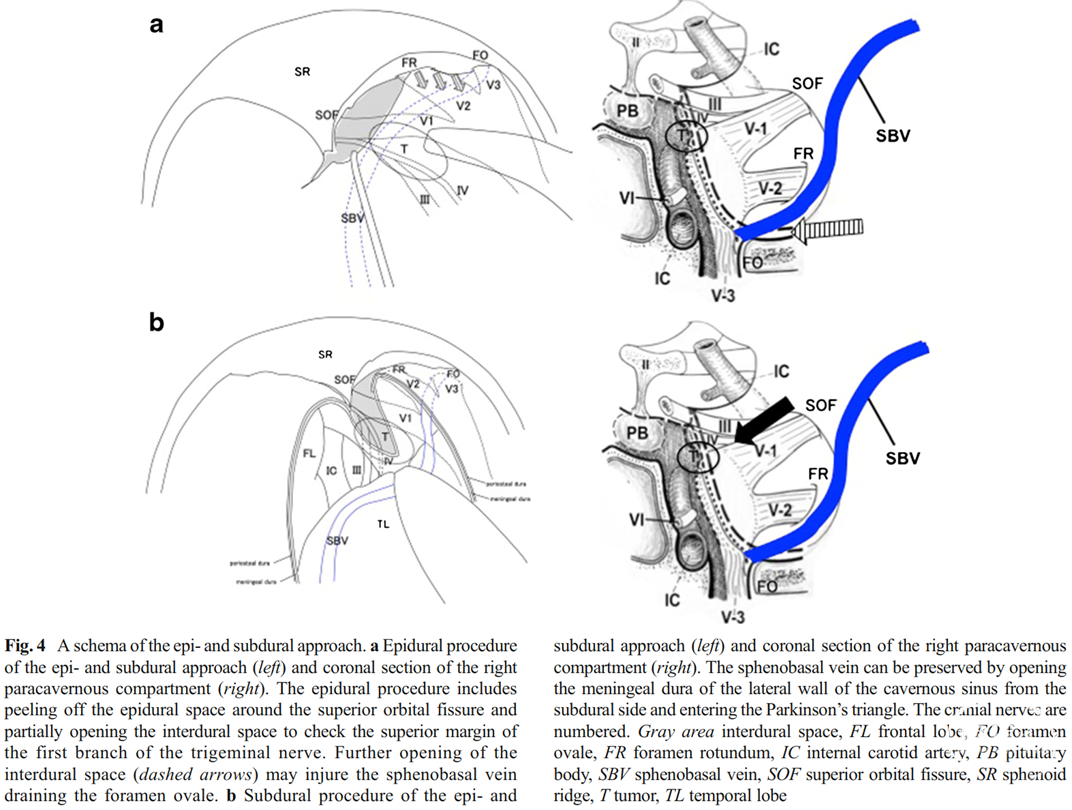
操作方面,联合经岩入路手术包括前方经岩与后方经岩入路的处理,本质仍是以中颅底为主体。前方经岩的处理可以借鉴Kawase入路(狭义的Kawase入路,并非与Dolenc入路的联合),重点关注SMCV及相关静脉窦(丛);后方经岩的处理重点关注SPS、Labbé静脉和岩上静脉等。二者并非互不相关,各静脉结构遵循一致的引流层次关系,且蝶岩静脉是SMCV的引流静脉,向后引流至SPS。
关注SMCV的原因在于其为大脑血流的“闸门”。对于SMCV的血流,备选引流通路首先是Trolard静脉和Labbé静脉,其次是3个主要的颅底通路性静脉,即蝶基底静脉、蝶岩静脉和岩上静脉,三者呈由前至后的位置关系。
尤其在首要备选通路不发达时,颅底通路性静脉将发挥重要作用,其中:
向前直接或通过蝶顶窦引流入海绵窦是常规路线;
向前下可通过卵圆孔的蝶基底静脉或棘孔的脑膜中静脉引流入翼静脉丛;
向后通过蝶岩静脉引流入SPS、TS-SS。

2.5. 一般性策略
以往处理皮层静脉的常用方法是Sugita-Kobayashi等主张的软脑膜松解技术,这是一种硬膜内策略[Sugita 1982]。Kyoshima等提出硬膜外剥离移动技术[Kyoshima 2001]。在联合经岩入路时,Shibao等将这一策略进行了进一步的规定与辨析。首先要区分桥静脉(指引流入中颅底而非小脑幕的桥静脉)与小脑幕窦,重点是按照其位于硬膜内、硬膜间或介于二者之间进行划分。硬膜外剥离移动技术即在桥静脉进入硬膜处的前方切开硬膜;静脉在未进入硬膜间的阶段即使与硬膜粘连也属于硬膜内区域,可通过游离血管获得切开硬膜的空间[Shibao 2019]。

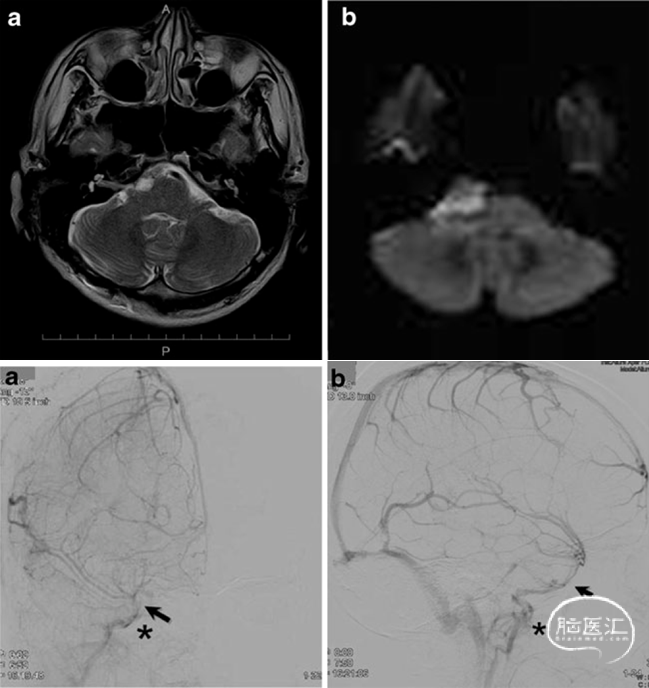
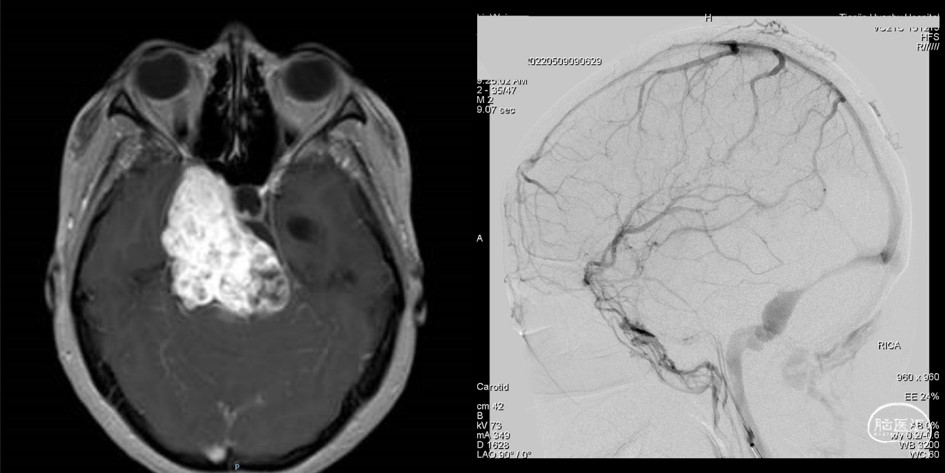
岩斜区脑膜瘤患者的SMCV引流途径(环湖病例1). 女,46岁,DSA侧位图像显示Trolard静脉、Labbé静脉、海绵窦及翼静脉丛对于大脑中浅静脉的引流均通畅。

岩斜区脑膜瘤患者的SMCV引流途径(环湖病例2). 女,52岁,DSA侧位图像显示缺乏典型的Trolard静脉,同侧乙状窦闭塞,无明显海绵窦、翼静脉丛引流,引流以Labbé静脉为主、蝶岩静脉为辅,通过岩上窦-残余的同侧横窦-对侧横窦、乙状窦引流,故在行联合经岩入路时切勿损伤岩上窦。

岩斜区脑膜瘤患者的SMCV引流途径(环湖病例3). 女,47岁,DSA侧位图像显示缺乏典型的Trolard静脉,无明显海绵窦引流,主要由Labbé静脉和翼静脉丛引流,故若采用联合经岩入路,其硬膜外途径有利于保护Labbé静脉,但有损伤前方翼静脉丛的风险,若选用硬膜下入路,Dolenc-Kawase前外侧入路也可以避开Labbé静脉。
2.6. SMCV引流方式分型及相应的岩前入路改良策略
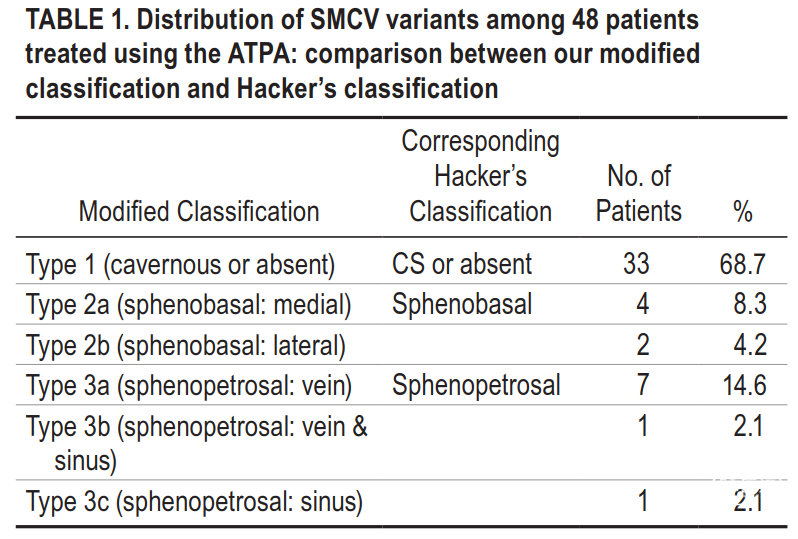
对于SMCV的引流方式,基础版是Hacker的4分型:海绵窦型(直接或间接通过蝶顶窦引流入海绵窦),蝶基底型(通过蝶基底静脉向前引流),蝶岩型(通过蝶岩静脉向后引流),缺如型。
Keio大学团队针对Hacker的4分型进行了细化改良,以指导单纯硬膜外Kawase前方经岩入路手术中的硬膜切开[Shibao 2016]。
将Hacker分型的海绵窦型与缺如型归为Type 1;
将蝶基底型分为2个亚型:以蝶基底静脉通过卵圆孔的内侧(Type 2a)或外侧(Type 2b)区分;
将蝶岩型分为3个亚型:以蝶岩静脉属于静脉型(Type 3a)、静脉-窦型(Type 3b)或窦型(Type 3c)区分[Shibao 2016]。
手术原则是尽可能不要切断SMCV的主引流途径,依据此原则进行硬膜切开策略的调整及手术入路的选择。尤其注意评估静脉引流的其他可能代偿路径,若缺乏良好的代偿,则更应避免损伤主引流途径。
具体策略分述如下:
Type 1均可选择单纯硬膜外岩前入路,可在硬膜外避开SMCV的引流血管。同样,Type 2a及Type 3b也可选择单纯硬膜外岩前入路。
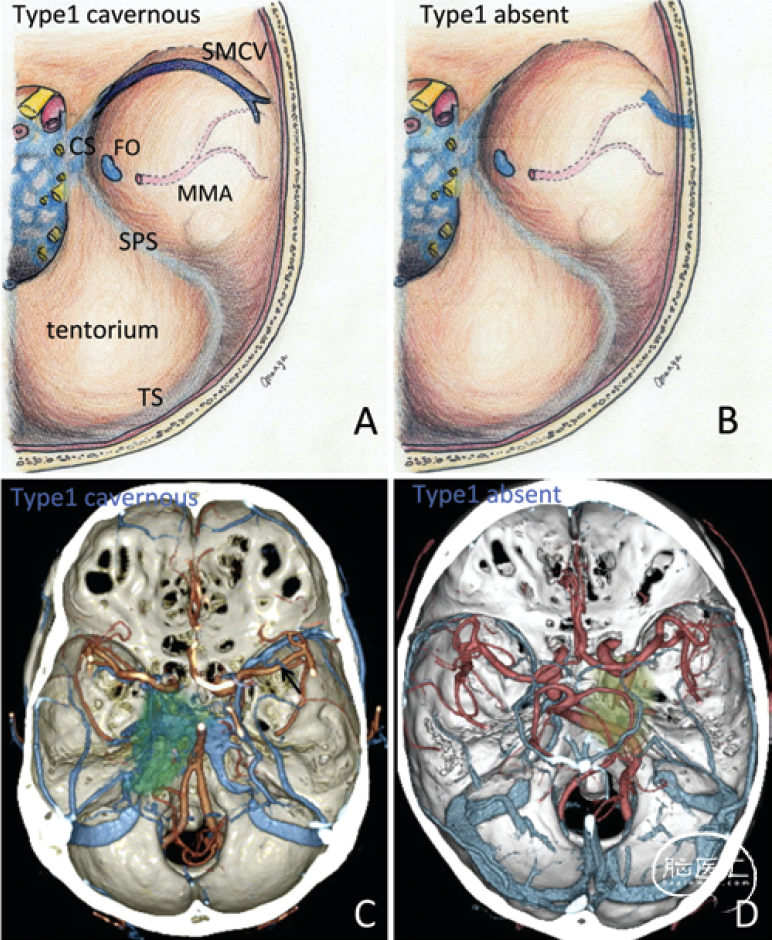
图2-3. Type 1模式图及CTV实例
Type 2b引流静脉位于卵圆孔的外侧,卵圆孔作为向翼静脉丛引流的骨性通道,术前可通过DSA或CTV评估确认。对于此类型,采用单纯硬膜外路径无法保护静脉,应以硬膜外路径为主,但应先切开硬膜,通过硬膜内确认从而避开静脉。
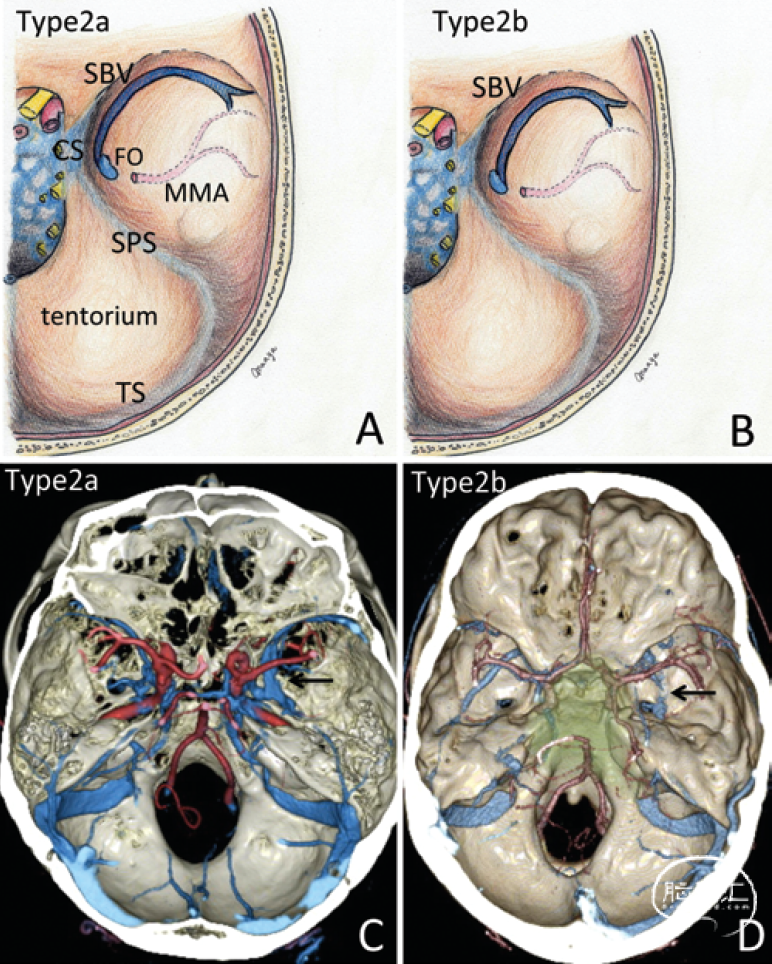
图2-4. Type 2模式图及CTV实例
Type 3b是中间过渡类型,则需要改良硬膜切开方法。Type 3c不可采用硬膜外路径,其可伤及以静脉窦形式引流的蝶岩静脉,只能选择单纯硬膜内入路,由硬膜内磨除岩尖骨质。
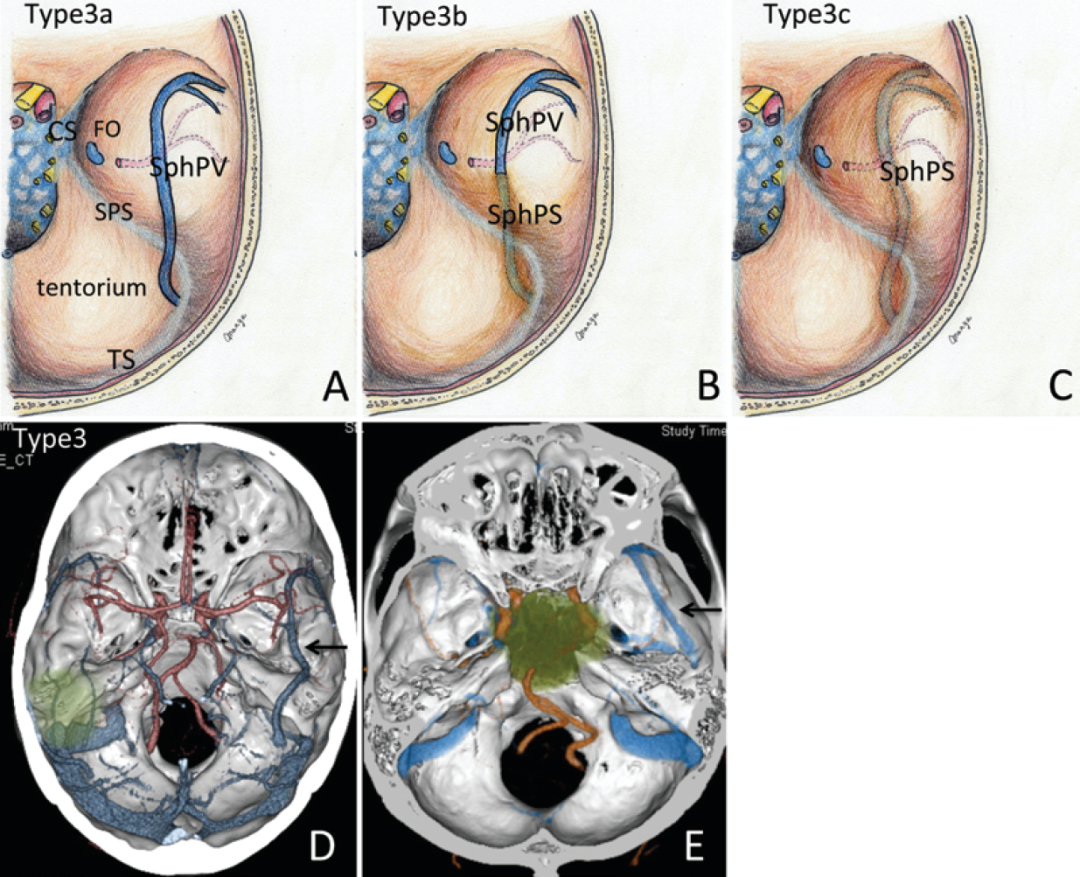
图2-5. Type 3模式图及CTV实例
上述Keio分型对于硬膜切开方法与入路选择的总结见下图。
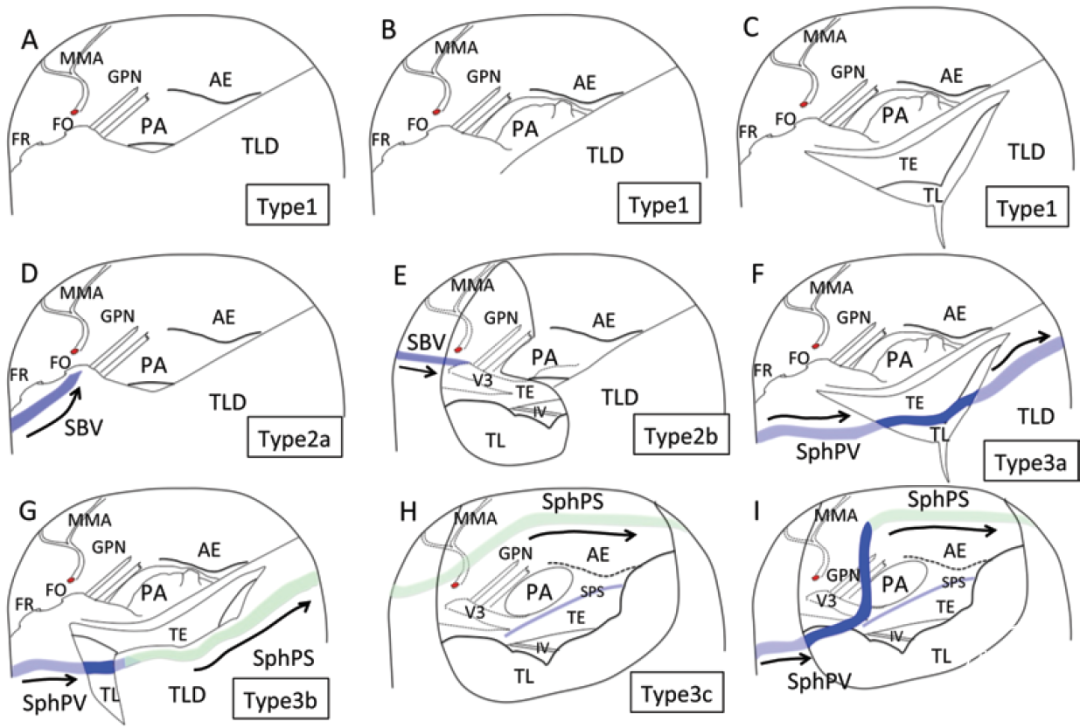
图2-6. Keio分型与手术策略
2.7. 实例
2.7.1. Type 2b
切除位于右侧CPA区的胆脂瘤。SMCV通过蝶基底静脉引流入翼静脉丛。切开颞叶前部的硬膜,由硬膜内牵拉颞极,直视找到蝶基底静脉,在静脉后方切开底部硬膜,由硬膜外牵拉颞叶后部,磨除岩尖骨质。然后,由岩浅大神经内侧沿岩尖向后切开硬膜,后颅窝硬膜在切开过程中先离断SPS,然后直至小脑幕游离缘[Ichimura 2012]。

另一例胆脂瘤病例。上一例用DSA术前评估,本例则是用CTV,可见SMCV引流进入卵圆孔的外侧[Shibao 2016]。

Matsushima切除岩斜区脑膜瘤对Type2b的手术演示(手术视频1)[Matsushima 2019]。

所选的是鞍旁脊索瘤病例。蝶岩静脉引流分为静脉与静脉窦两部分,术中照片可见二者的过渡区,静脉部分可采用硬膜外途径,但继续分离会伤及静脉窦,需要切开硬膜采用硬膜内途径。硬膜切开的位置在过渡区的前方、静脉窦的内侧[Shibao 2016]。
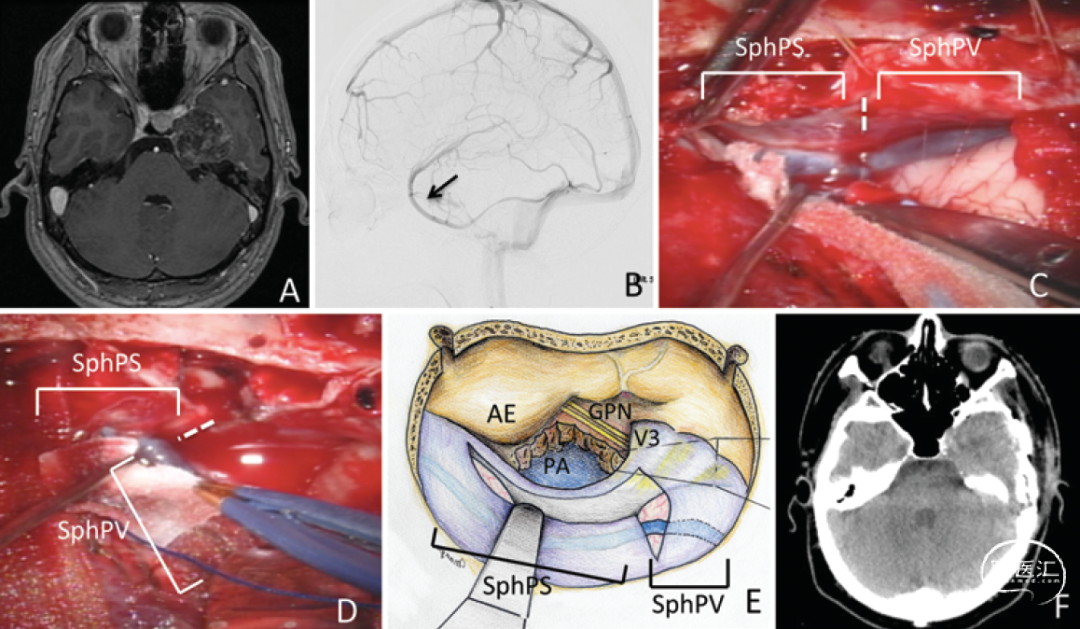
图2-9. Type 3b实例
病例为疝入脑干的斜坡肿瘤。本例是SMCV通过蝶岩静脉以静脉窦的形式引流,但并非引流入SPS或TS-SS,而是又折回前内方向到达卵圆孔。选择单纯硬膜内途径,从硬膜内磨除岩尖骨质。

图2-10. Type 3c实例
2.8. 海绵窦肿瘤与岩斜区肿瘤的静脉引流差异
笔者认为,以上研究主要针对岩斜区肿瘤,但海绵窦肿瘤具有自身的特殊性:
对与SMCV的引流,尤其应该关注Trolard静脉、Labbé静脉以及SPS,若三者均不发达,则仅有海绵窦和翼静脉丛两条引流途径。
海绵窦肿瘤的特点在于肿瘤已破坏海绵窦,故仅存翼静脉丛路径,引流静脉通常变得极为粗大、明显。而海绵窦手术的入路极易将卵圆孔、棘孔附近的通路静脉破坏,须格外注意。
Adachi等所论述的在岩斜区脑膜瘤侵入海绵窦对颅底静脉引流模式的影响,可以印证上述观点:如果肿瘤未侵入海绵窦,由海绵窦经岩下窦(IPS)引流至颈内静脉是SMCV的主要引流通路;如果海绵窦受累无法有效引流,蝶基底静脉至翼静脉丛将是主要引流通路;但若肿瘤进一步发展使上述两条路径均无法利用时,大脑半球的血流只能依靠Torlard静脉和Labbé静脉引流[Adachi 2016]。
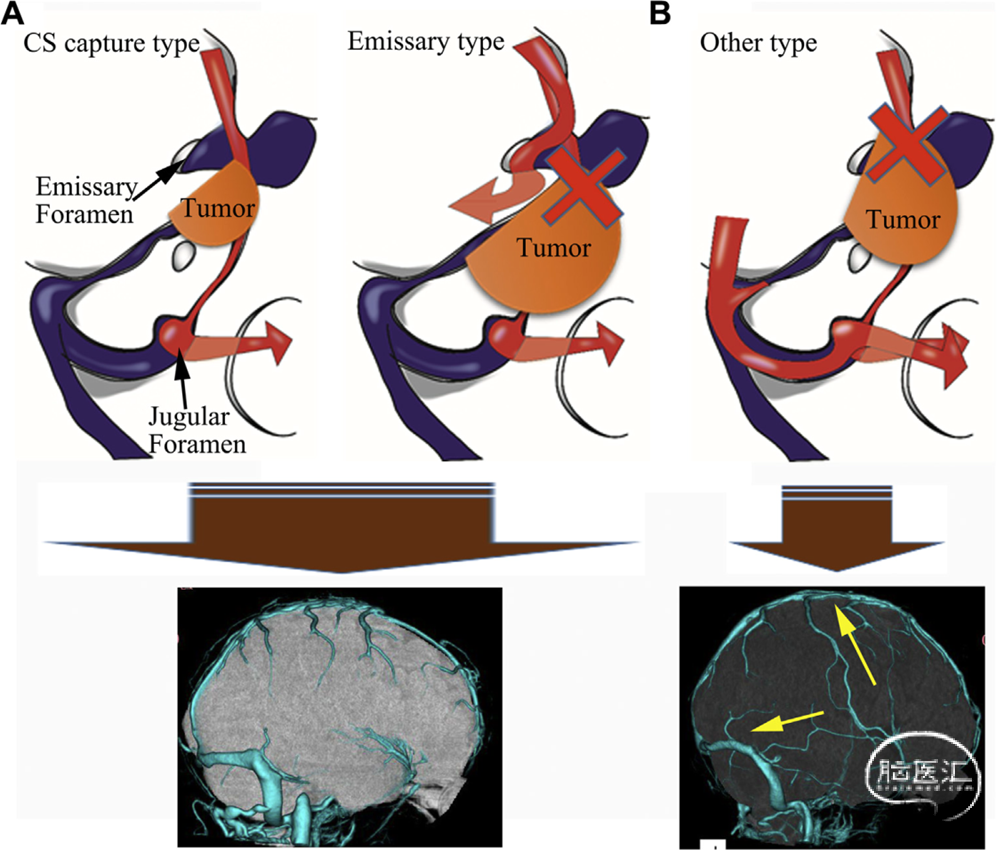
图2-11. 随着肿瘤不断累及海绵窦,SMCV引流途径出现变化(Adachi)
2.9. 参考颞极入路的静脉保护策略理解联合经岩入路
颞极入路(temporopolar approach)又称颞前入路(pretemporal approach),属于Dolenc-Kawase前外侧入路的范畴,比联合经岩入路更靠前方。该入路也涉及对颅底静脉的保护。
颞极入路的经典形式是Evandro-Rhoton的硬膜内路径,由颞极将颞叶向后上方牵拉时,该入路的缺点是必须要切断颞极桥静脉,该桥静脉恰是SMCV向蝶顶窦引流的主要通路[Seoane 2000]。
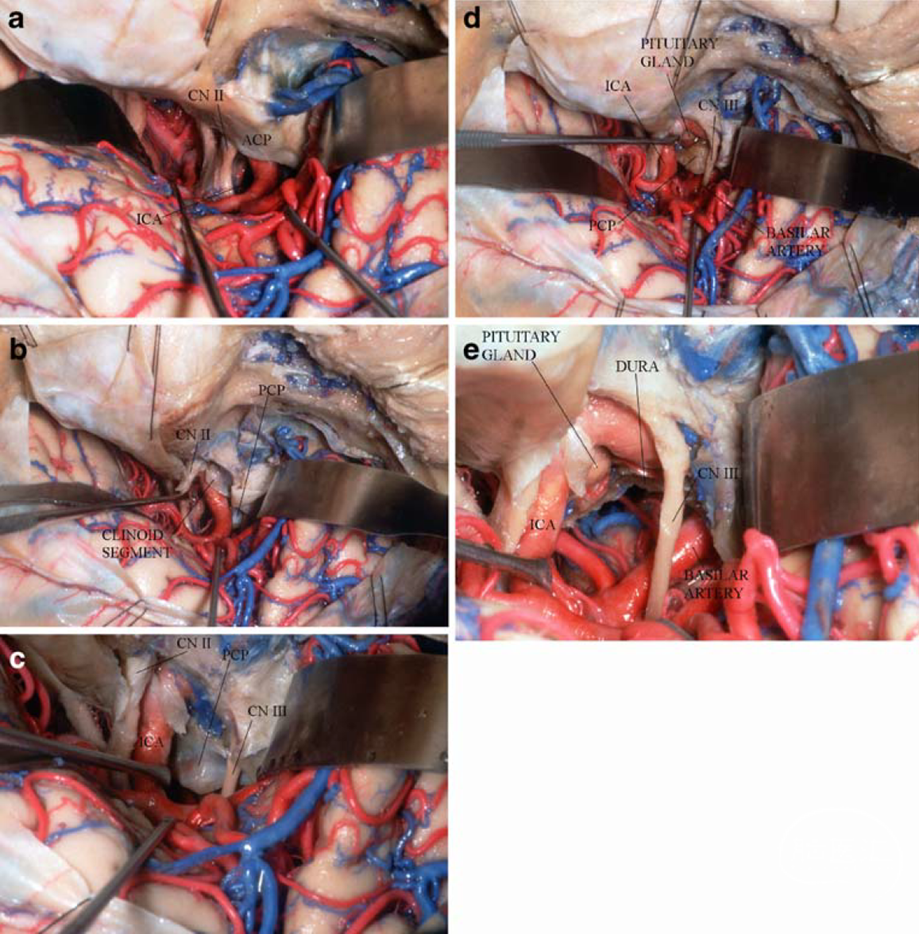
图2-12. 经典的Evandro-Rhoton硬膜下颞极入路暴露
在保护颞极桥静脉的改良策略中,具有代表性的是Fukushima所提出的硬膜外颞极入路。该技术的实质是将海绵窦外侧壁硬膜间、Meckel腔、Dolenc硬膜外前床突三角以及硬膜内空间,共4部分间隙打通,彻底去除对颞极硬膜的束缚,达到自硬膜外有效移动、牵拉颞极的目的[Day 1994,Day 2012]。
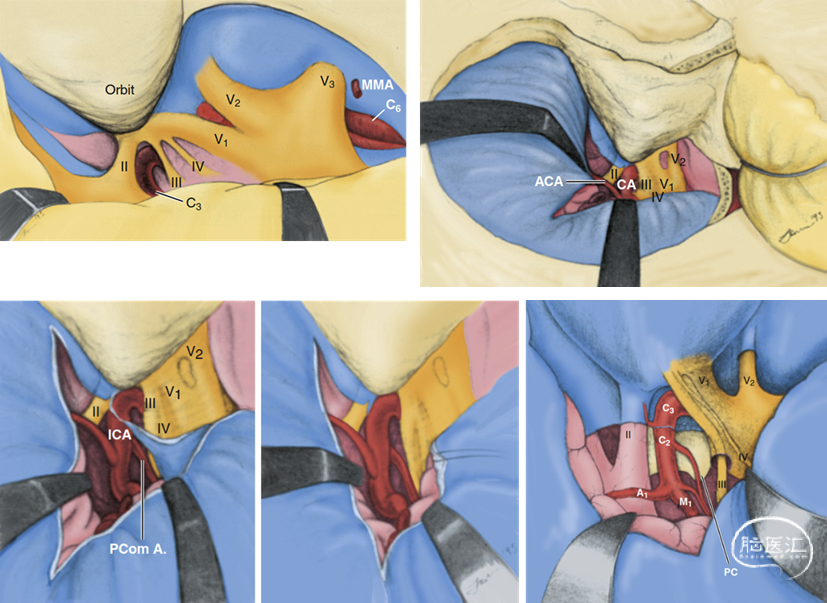
图2-13. Fukushima硬膜外颞极入路步骤
旭川红十字会-祯心会团队提出的“蝶顶窦移位技术”与“Fukushima硬膜外颞极入路”实质相同。配套手术视频强化了这一事实,即采用硬膜内路径时,SMCV与颞极桥静脉阻碍侧方观察颈内静脉后方的区域,而若改为从硬膜外牵拉颞叶,这些静脉无需被切断,将与硬膜一道被完整地向后牵拉,从而获得保留(手术视频2)[Niibo 2020]。
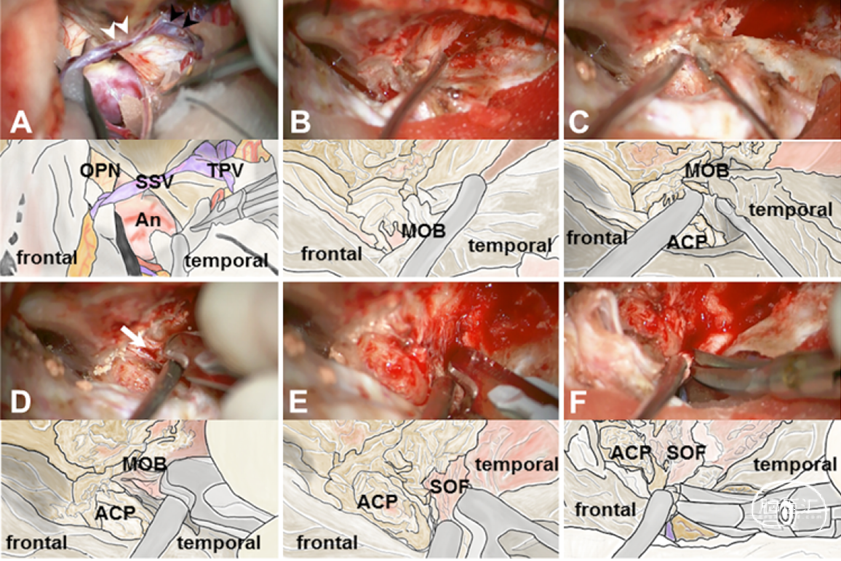
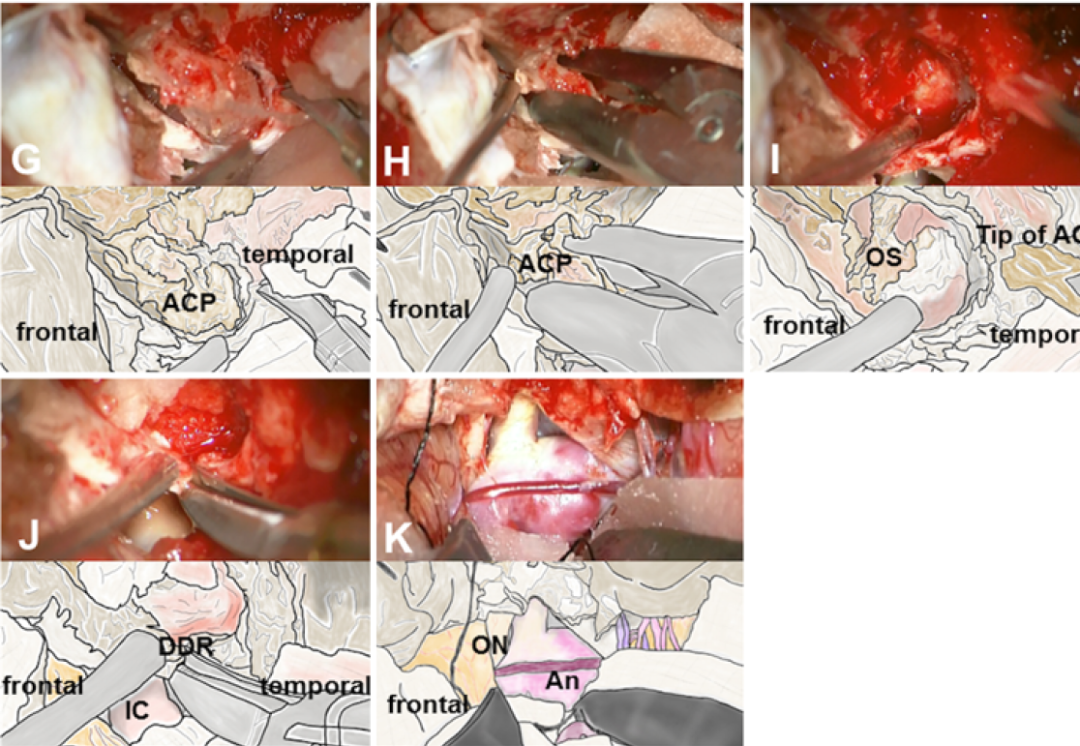
图2-14. 蝶顶窦移位技术

手术视频2
当处理海绵窦肿瘤时,Dolenc入路也有可能损伤SMCV向翼静脉丛引流的蝶基底静脉,故也涉及保护静脉的问题。类似于上述Keio分型中Type 2b静脉引流类型的切开方法,但联合经岩入路是由蝶基底静脉的外侧切开颅底硬膜,而此处则是由静脉的内侧切开。
所选的是一例海绵窦内三叉神经鞘瘤,具体而言,先在硬膜外找到上颌神经后,沿侧裂“线形”切开硬膜,观察到蝶基底静脉,再沿上颌神经上缘继续切开至海绵窦外侧壁的脑膜层,之后由硬膜外打开Parkinson三角[Shibao 2016]。
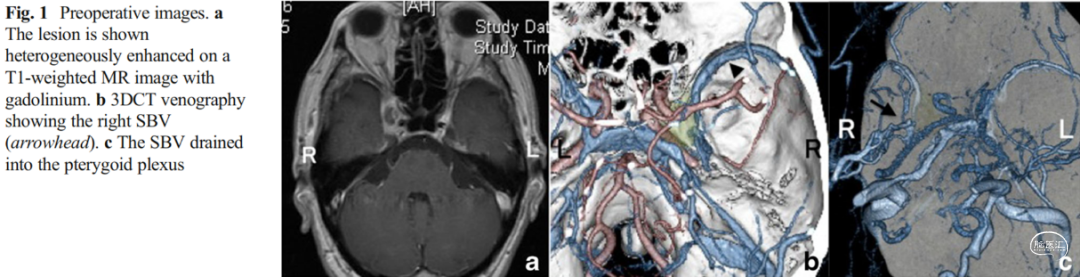
图2-15-1. Dolenc入路保护蝶基底静脉
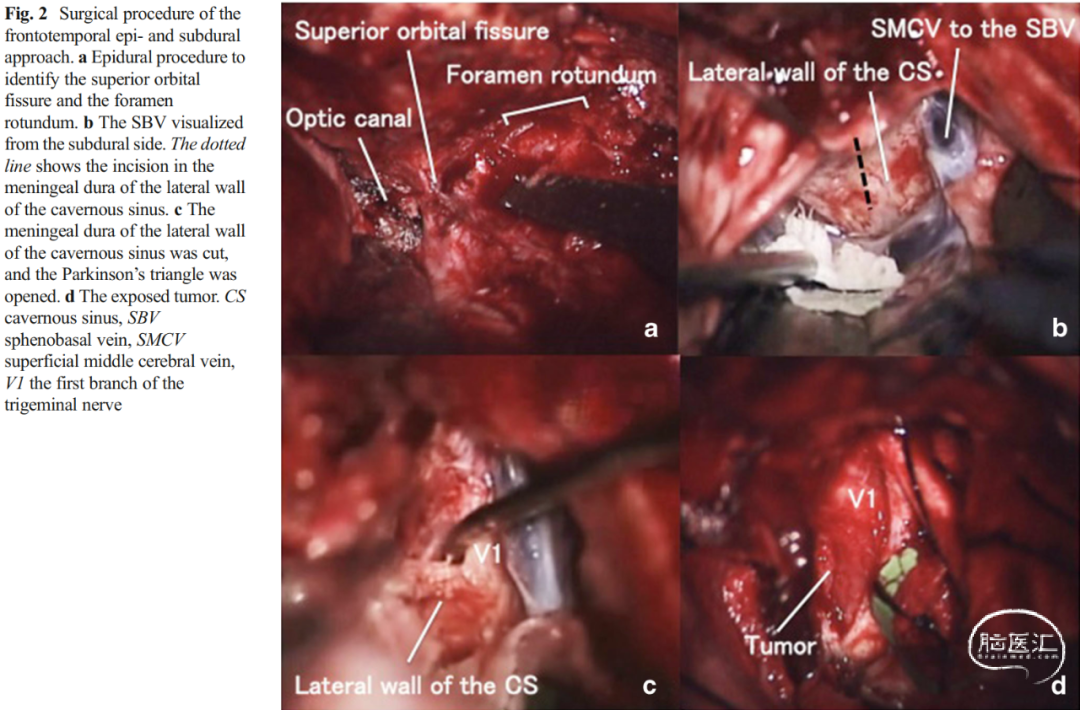
图2-15-2. 从硬膜外转入硬膜内,直视下在蝶基底静脉内侧切开硬膜
2.10. 参考前床突脑膜瘤手术时的静脉保护策略理解联合经岩入路
在保留静脉血供的前提下,前床突脑膜瘤手术入路的显露空间也与SMCV引流的类型密切相关;所需关注的静脉与处理前述岩斜区-海绵窦等中颅底病变时类似,但对于手术实施造成的影响和技术策略均不同。
对此,Nagata等将静脉引流情况分为3型。皮层型:SMCV通过皮层静脉引流入上矢状窦,此型最为常见。蝶基底型:通过蝶基底静脉向下引流入翼静脉丛,向后通过蝶岩静脉引流入横窦的情况也归入此类。海绵窦型:通过蝶顶窦引流入海绵窦。
上述分型对于手术的影响在于:皮层型引流静脉不影响牵拉颞叶,术野宽阔;蝶基底型与海绵窦型均向内侧引流,故会影响向后外侧牵拉颞叶。后两者的区别在于蝶基底型是向下或向后引流,利用硬膜外分离海绵窦外侧壁的技术,可增大硬膜外牵拉颞叶的程度,并可将引流静脉一起移位,虽然受限但也能获得相对较宽的术野;但对于海绵窦型,颞叶被向前的引流静脉束缚,只能通过牵拉额叶获得一定空间,且硬膜外磨前床突也受限,术野相对最窄,只能逆向地分离颈内动脉、大脑中动脉并切除肿瘤[Nagata 2013]。
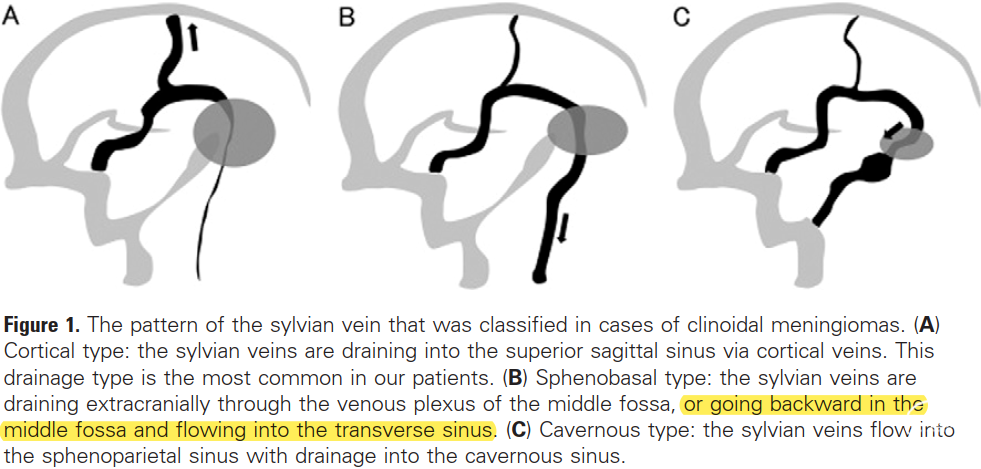
图2-16-1. 前床突脑膜瘤时的SMCV引流分型

图2-16-2. 各型引流对前床突脑膜瘤手术的影响
参考文献
![]()
![]()
专家简介
![]()
![]()
佟小光 主任医师
天津市环湖医院
主任医师,医学博士
天津市环湖医院(天津市脑系科中心医院,天津医科大学神经内外科及神经康复临床学院)党委副书记、院长、神经外科专家组组长,天津市神经外科研究所所长,天津市神经外科研究所显微神经外科解剖实验室主任。担任天津医科大学及天津大学博士研究生导师。师从Albert Rhoton教授在Florida大学进行显微神经外科学博士后研究
擅长脑血管病的介入与外科治疗及复合手术、侧颅底与内镜中线区复杂及难治性颅底肿瘤的手术,擅长各种类型脑血管搭桥术,开创了大量脑血流重建创新术式,尤其是复杂颅底搭桥及后循环搭桥,居国际领先地位
目前任北美颅底外科学会委员、国家卫健委神经外科技术基础培训组组长、卫生部脑卒中筛查与防治工程全国中青年专家委员会常务委员、中华医学会神经外科学分会中青年委员、中国神经外科学医师学会脑血管病介入治疗组专家委员、中华中青年神经外科交流协会副会长,国家卫健委《脑血管搭桥手术规范》的召集人、起草人,国家卫健委“颈动脉内膜剥脱术培训基地”负责人,入选天津市“131”人才工程第一层次人才及首届创新团队带头人、天津市海河学者。承担国家重点研发计划、天津市科委科技支撑重大项目多项,获得天津市科技进步二等奖。学术成果发表于《Neurosurgery》手术版、《JNS》、《World Neurosurgery》、《Neurosurgical Review》等
王轩 副主任医师
天津市环湖医院
天津市环湖医院(天津市脑系科中心医院,天津市神经外科研究所,天津医科大学神经内外科及神经康复临床学院)神经外科副主任医师,天津医科大学硕士研究生导师。博士毕业于首都医科大学,随于春江教授主攻颅底脑干肿瘤手术
目前在佟小光教授指导下从事复杂脑血管病搭桥、介入复合手术及复杂颅底肿瘤的临床工作及应用研究。主持国家自然科学基金、天津市自然科学基金、天津市卫健委科技项目、天津市临床重点学科(专科)建设项目子课题
作为神经外科代表获评天津市首届青年医学新锐,并被遴选为天津市首届“131”创新型人才团队核心成员,《中国颅内破裂动脉瘤诊疗指南2021》执笔专家。学术成果发表于《Neurosurgery》手术版、《Neuro-Oncology》等。担任中国医师协会神经介入专业委员会中国颅内动脉瘤计划研究组专家委员,北京围手术期医学研究会神外专业委员会常务委员,北京神经科学学会儿童神经发育及相关疾病研究专业委员会委员,天津市神经科学学会青年委员,天津市整合医学学会脑卒中综合治疗专业委员会委员
![]()
声明:脑医汇旗下神外资讯、神介资讯、神内资讯、脑医咨询、Ai Brain 所发表内容之知识产权为脑医汇及主办方、原作者等相关权利人所有。







