
瑞兔辞旧岁,龙腾新年来。《Neuro-Oncology》文献速览已经走过五年的征程,五年来,数十位编译专家共同努力,为全国读者奉献了近1000篇各类文献的速递,文章涵盖神经肿瘤多个领域,既包括基础研究、转化研究、临床研究,还有一些大数据研究、影像学研究等,尤其是部分诊疗指南和综述的内容,在日常的科研和临床工作中都使读者获益匪浅。在此,我们为参加编译工作的所有编译工作者致以诚挚的节日问候和祝福,衷心感谢所有编译者的倾情付出!
新春来临之际,我们针对去年的百余篇Article进行回顾总结,共分为四个主题,分别是:胶质瘤临床研究和流行病学研究,脑胶质瘤基础研究、儿童神经肿瘤研究和其他神经肿瘤研究等分别进行汇总整合。为所有关注《Neuro-Oncology》文献速览的专家提供一份更有分量的学术年货,希望对您的临床和基础研究工作能够有所帮助。
在此,祝所有支持和帮助《Neuro-Oncology》文献速览的专家新年快乐,万事如意!
2022年度《Neuro-oncology》文献速览最佳编译
山西医科大学第一医院 万大海
空军军医大学唐都医院 翟玉龙
中国医科大学第一医院 林毅
中国科学技术大学附属一院 程传东
浙江大学第二附属医院 徐锦芳
德国埃尔朗根-纽伦堡大学医学院 杨志荣
王樑 教授
唐都医院
胶质母细胞瘤切除范围新分类系统的预后验证--RANO切除组的报告
Prognostic validation of a new classification system for extent of resection in glioblastoma: A report of the RANO resect group
Philipp Karschnia , Jacob S Young , Antonio Dono…
Neuro Oncol. 2023 May 4;25(5):940-954. doi: 10.1093/neuonc/noac193.
编译:刘志强 万大海 (山西医科大学第一附属医院)
胶质母细胞瘤患者肿瘤切除程度与预后相关,但在临床试验中,描述胶质母细胞瘤切除程度(EOR)的术语具有很大差异,不利于不同研究或报告之间的比较分析。本研究基于术后MR上的残留肿瘤体积[残留对比增强(CE)和残留非CE肿瘤]和相对肿瘤体积缩小率(%),重新设计了“RANO胶质母细胞瘤切除范围分类系统”,并研究其预后价值。国际RANO切除小组根据WHO 2021分类,对美国和欧洲的7个神经肿瘤学中心以前编制的数据库进行了回顾性搜索(2003-2022年),确定了1008例新诊断的胶质母细胞瘤IDH-wt患者数据。从手术前后(术后72h内获得)的MRI中收集临床和体积信息,根据绝对肿瘤残留体积数据(cm³)和相对肿瘤体积缩小率进行分类。数据由D‘Agostino-Pearson检验、非配对t检验等统计方法进行分析。结果表明,744例IDHwt胶质母细胞瘤术后按EORTC-26981/22981(TMZ/RT→TMZ)放化疗方案进行治疗。我们根据残存的CE和非CE肿瘤体积(以cm³为单位)定义了四个切除类别(类别1:“超最大CE切除”,类别2:“最大CE切除”,类别3:“次最大CE切除”,类别4:“活检”)(图4D)。每种切除类别的无进展生存期分别为11(CI:9-13)vs 9(CI:8-10)vs 8(CI:7-9)vs 5(CI:4-6)月;P=0.001;图4E]和OS[24(CI:20-41)vs 19(CI:17-20)vs 15(CI:12-17)vs 10(CI:8-12)月;P=0.001。当对不同的切除类型进行单独测试时,预后相关性仍然成立。在这些接受均质治疗的患者中,较低的绝对残留肿瘤体积与有利预后结果相关:与“CE次全切除”或“CE部分切除”相比,“完全CE切除”患者的存活率更高”;与“近全切除”的患者相比,接受“完全CE切除”的患者的预后较好。非CE肿瘤切除的范围越大,无论是相对缩小的肿瘤体积还是绝对残留的肿瘤体积都与生存期延长相关。当仅依靠术后肿瘤体积作为分层标准时,“最大CE切除”(2级)的患者比“次最大CE切除”(3级)或“活检”(4级)的患者有更好的结果。广泛切除非CE肿瘤(残留≤5cm³的非CE肿瘤)与完全CE切除的患者相比,与更好的生存期相关,因此定义为1类(“超最大CE切除”)。在对分子和临床标记物进行调整后,多因素分析肯定了切除类型的预后价值。这一易于使用但预后较高的分层系统被称为“RANO胶质母细胞瘤的EOR分类”。本研究建议的“胶质母细胞瘤切除范围的新RANO分类”具有很高的预后价值,可用于临床试验的分层和总体设计。切除超出CE肿瘤边界的非CE肿瘤可能转化为额外的生存益处,这为明确命名这种“超最大CE切除”提供了理论基础。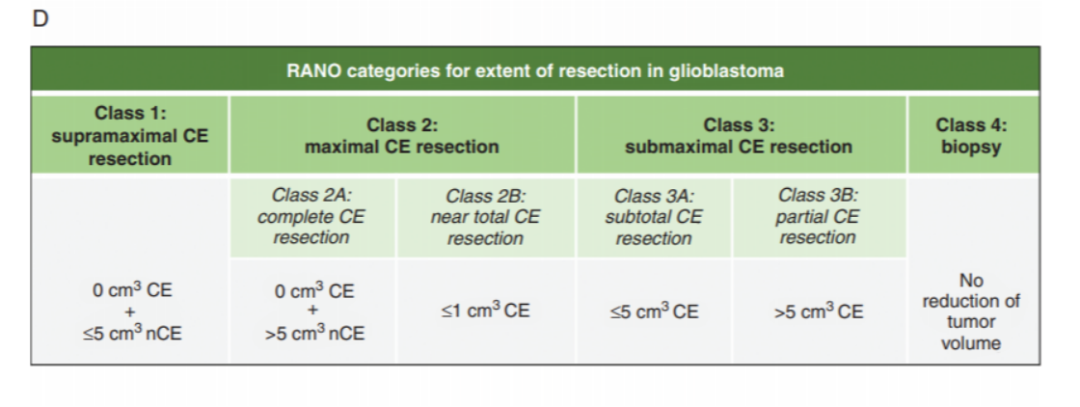
采用新的RANO切除范围分类法对复发性胶质母细胞瘤再次切除的预后进行评估:RANO切除组的报告
Prognostic evaluation of re-resection for recurrent glioblastoma using the novel RANO classification for extent of resection: A report of the RANO resect group
Philipp Karschnia and others
Neuro-Oncology, Volume 25, Issue 9, September 2023, Pages 1672–1685, doi: /10.1093/neuonc/noad074
编译:翟玉龙(空军军医大学唐都医院)
对复发性胶质母细胞瘤进行再切除的价值仍存在争议,因为从伦理角度来看,有意不完全切除并进行随机试验是不合理的。在此,本研究的目的是:(1) 利用之前提出的神经肿瘤学反应评估(RANO)分类法(基于残留对比增强(CE)和非CE肿瘤),探讨再切除范围对预后的影响与作用;(2) 确定手术对预后影响的综合因素。RANO再切除小组回顾性地整理了8个中心的队列,其中包括首次复发的胶质母细胞瘤患者。分析了再次切除和其他临床因素与预后的关系。为了将混杂效应降至最低,在比较不同的RANO类别时,采用了倾向评分匹配分析。作者对681例首次复发的IDH野生型胶质母细胞瘤患者进行了研究,其中包括310例接受了再切除术的患者。即使在多变量分析中对分子和临床混杂因素进行分层,再次切除与生存期延长有关;与非手术治疗相比,残留CE肿瘤≤1cm³与生存期延长有关。"最大切除"(2级)与 "次最大切除"(3级)相比,生存率更高。在术后无功能缺损的情况下进行放射/化疗可提高较小残留CE肿瘤患者的生存率。相反,非CE肿瘤的 "超极限切除"(1级)与生存期延长无关,且经常伴有术后功能障碍。残留CE肿瘤的预后作用在倾向评分分析中得到了证实。RANO再切除分类可用于对再次切除胶质母细胞瘤的患者进行分层。结果显示,RANO再切除分级1和2是提高预后的关键因素。
最大范围切除手术策略对胶质母细胞瘤患者各亚组的术后神经功能缺陷、患者生活质量和生存期的影响
Impact of maximal extent of resection on postoperative deficits, patient functioning, and survival within clinically important glioblastoma subgroups
Jasper K W Gerritsen, Rosa H Zwarthoed…
Neuro Oncol. 2023 May 4;25(5):958-972. doi: 10.1093/neuonc/noac255.
编译:徐锦芳,季剑雄(浙江大学医学院附属第二医院)
目前尚不清楚切除范围(EOR)、残余肿瘤体积(RTV)和大体全切除(GTR)对胶质母细胞瘤亚组的影响。本研究旨在分析它们对胶质瘤患者亚组的影响及与神经和功能结果的相关性。本研究募集了2010年至2020年间在四个三级中心接受过胶质母细胞瘤肿瘤切除术的患者,共3919例。共有1047名患者被纳入研究。在所有亚组中,较高的EOR和较低的RTV与OS和PFS改善情况显著相关,但RTV是更强的预后因素。基于RTV的GTR改善了整个队列(19.0个月,p<0.0001)以及IDH野生型肿瘤亚组(18.5个月,p=0.00055)、MGMT甲基化肿瘤(35.0个月,p<0.0001)、年龄<70(20.0个月,p<0.0001)、NIHSS 0-1(19.0个月,p=0.0038)、KPS 90-100(19.5个月,p=0.0012)和KPS≤80(17.0个月,p=0.036)的中位 OS。GTR与整个队列中OS的改善(HR 0.58,p=0.0070)以及NIHSS 0-1亚组中PFS的改善(HR 0.47,p=0.012)显著相关。GTR与保留神经功能(OFO 1 级)组合可获得最长的生存时间(中位OS 22.0个月,p<0.0001),清醒映射组(50.0%)比睡眠组(21.8%)更容易实现这一目标(p<0.0001)。最大切除术对于年龄<70岁、NIHSS 0-1和KPS 90-100的亚组尤其有益,且不会增加术后NIHSS或KPS恶化的风险。这些发现可能有助于个别胶质母细胞瘤患者的手术决策。
DNA甲基化亚类预测IDH-野生型胶质母细胞瘤患者肿瘤全切除的收益
DNA methylation subclasses predict the benefit from gross total tumor resection in IDH-wildtype glioblastoma patients
Richard Drexler , Ulrich Schüller , Alicia Eckhardt …
Neuro Oncol. 2023 Feb 14;25(2):315-325. doi: 10.1093/neuonc/noac177.
编译:程传东 陈一楠(中国科学技术大学附属第一医院)
最大限度安全切除是胶质母细胞瘤治疗的基石,切除范围(EOR)是决定更有利预后的主要因素之一。在过去的几年里,利用基于DNA甲基化的分类器,胶质母细胞瘤可以被划分为不同的亚类,其中在成人患者中,最常见的甲基化亚类包括RTK I、RTK II和MES。但是,这些表观遗传学亚组对胶质母细胞瘤患者治疗的预后意义在很大程度上尚不清楚。因此本研究调查了整体甲基化分析在为胶质母细胞瘤患者提供基于甲基化的治疗指导方面的效用,特别是在预测手术切除的是否获益方面。在本期的Neuro-Oncology中,Drexler等人采用多中心队列研究方法对包括430例新诊断的胶质母细胞瘤患者进行了整体DNA甲基化分析。结果345例患者(80.2%)符合纳入标准,305例患者接受了联合辅助治疗。根据甲基化亚类对接受联合治疗的研究人群进行分层后,生存分析显示RTK I、RTK II和间充质细胞(MES)之间的OS(p=0.06)和PFS(p=0.52)没有显著差异。虽然在MES亚类中没有观察到GTR或在GTR附近的OS延长,但是在RTK I型患者或RTK II接受总全切除(GTR)或在GTR附近的肿瘤比部分切除的患者有更长的OS和PFS。在联合队列中甲基化的MGMT启动子状态可以良好的预测OS(HR 0.51;p<0.01)和PFS(HR 0.44;p<0.01)。然而,使用Cox回归模型对协变量进行调整后,MGMT启动子甲基化状态仍然是RTK I(HR 0.37;p<0.01)和RTK II (HR 0.56;p=0.02)肿瘤,而MES亚类(HR 0.52 ;p=0.06)的治疗反应预测值不明显。为了研究在二线治疗前复发切除作为一种治疗选择的好处,作者将这68例接受重新切除并接受辅助治疗的患者与44例在开始二线治疗前未重新切除的患者进行了比较,结果显示对于局部复发,再切除可促进进展到总生存期(POS),这在RTK I(p=0.03)和RTK II(p<0.01)肿瘤中明显,但在MES肿瘤中不明显(p=0.33)。并且接受放化疗的70岁及以上老年患者在MES亚类中有良好的OS和PFS。需要注意的是,DNA甲基化谱来确定术后亚类大约需要1周。综上所述本研究证明了最大化EOR对新诊断和复发的RTK I和RTK II胶质母细胞瘤的生存获益,但不是MES亚类。然而,对于MES子类是否治疗时应进行最大限度的手术切除是一个争论点,尤其是当肿瘤位于重要区域或者处于复发状态时。
手术损伤小脑顶核和导水管周围灰质破坏中脑环路导致小脑性缄默综合症
Fastigial nuclei surgical damage and focal midbrain disruption implicate PAG survival circuits in cerebellar mutism syndrome
Samuel S McAfee , Silu Zhang , Ping Zou…
Neuro Oncol. 2023 Feb 14;25(2):375-385. doi: 10.1093/neuonc/noac168.
编译:林毅(中国医科大学附属第一医院)
儿童术后小脑缄默综合症(CMS)是一种罕见但重要的髓母细胞瘤术后综合症,对患者的表达性言语、运动、认知和情绪调节造成毁灭性损害,降低生活质量。CMS产生的解剖和神经机制仍不清楚。我们通过分析CMS的髓母细胞瘤患者的手术损伤和继发轴突变性规律研究了这一问题。我们分析了CMS高风险的髓母细胞瘤患儿(肿瘤位于脑室内)T1影像,采用特殊开发的算法分析了手术损伤的部位。共采用了三种互补的空间计算方法鉴定CMS诊断和手术损伤的关系。采用磁化转移率(MTR)影像分析小脑下游解剖区域的脱髓鞘部位代表有神经功能损伤的部位。空间分析提示小脑顶核及其相关的小脑皮层的损伤与产生CMS最相关。CMS相关的MTR在导水管周围腹侧灰质下降最显著,与左侧红核高度一致。这些证据指向由顶核传出的中断很可能是CMS产生的原因。我们提出CMS的核心症状是由于导水管周围灰质调节的行为,包括发声和有自发动作的控制触发中断引起的。顶核是从小脑至导水管周围灰质传出的最密集部位,因此术中保留这些结构很可能避免CMS的产生。
利用细胞状态可塑性开展新型胶质母细胞瘤放射治疗方案的I期研究
Phase I study of a novel glioblastoma radiation therapy schedule exploiting cell-state plasticity
Jamie A Dean, Shyam K Tanguturi , Daniel Cagney…
Neuro Oncol. 2023 Jun 2;25(6):1100-1112. doi: 10.1093/neuonc/noac253.
编译:王樑(空军军医大学附属唐都医院)
胶质母细胞瘤主要由高度异质性的细胞组成,表现为对耐药干细胞样细胞和和治疗敏感细胞的动态变化、双向可塑性,现有治疗方案很少考虑这种变化和可塑性。因此我们基于临床前实验设计一个数学模型来描述这一过程,并优化了放射治疗分级方案,该方案相对于小鼠胶质母细胞瘤模型中的标准分级大大提高了生存率。基于此前临床前研究中观察小鼠模型生存获益的情况,设计了一个放疗治疗生存获益的数学预测模型,本次使用该模型预测不同干预措施对胶质母细胞瘤患者生存获益的影响,从而优化胶母再照射的分级治疗方案,并注册首个人体试验(NCT03557372)来评估方案的可行性和安全性。与标准计划相比,运用统计模型评估新放疗计划的风险比为0.74。预测模型表明,复发性胶质母细胞瘤患者再放疗的实用的、接近最佳效果的方案是3.96 Gy×7(1次/天),其次是1.0 Gy×9(3次/日)。本次参与实验的14/14(100%)患者均由运用优化方案指导后续治疗。基于细胞状态可塑性,通过数学预测模型设计新型放射治疗方案也是可行和安全的。
基于大脑解剖表面深度学习确定全脑放疗相关的结构改变与年龄老化相似
Whole-brain radiotherapy associated with structural changes resembling aging as determined by anatomic surface-based deep learning
Nikhil Rammohanand others
Neuro-Oncology, Volume 25, Issue 7, July 2023, Pages 1323–1330,doi: 10.1093/neuonc/noad029
编译:冀培刚(空军军医大学唐都医院)
脑转移瘤是成人最多见的颅内肿瘤,且与显著的死亡率相关。在当代,随着局部和系统治疗的改进,脑转移瘤患者的生存显著延长。依据最新的分级预后量表,转移灶≥5个、体力状态良好、颅外病变局限和靶向治疗史的患者中位生存期约为3-4年。在治疗1-4个脑转移瘤时,由于立体定向放射外科具有良好的神经认知特征和同等的生存率,全脑放疗的使用已逐渐减少,而更多的选择立体定向放射外科。但许多脑转移瘤患者并不适合SRS,包括脑膜转移和/或多发转移的患者。尽管存在认知受损风险,全脑放疗仍是一种被广泛采用的姑息治疗方式。WBRT后神经认知功能下降与多种缺陷相关,包括对记忆、解决问题和执行功能的影响。放疗也会导致大脑皮质体积损失,这可能以不同区域敏感性的剂量依赖方式发生,并显著影响神经认知功能。本期作者开发了一个基于脑表面的深度学习模型,利用高分辨率MRI对脑表面解剖形态进行分析,从而准确预测年龄(误差4.58岁)、性别(准确率87.99%)。众所周知,衰老会影响大脑的形状。鉴于此,作者尝试研究WBRT对大脑老化速度的影响。通过研究健康对照和脑转移瘤患者,并检查WBRT前后脑表面的解剖数据,进一步开发了一个混合效应线性模型来比较WBRT前后全貌和亚结构的估计年龄。共分析4220例受试者(4148例健康对照和72例患者)。中位照射剂量为30Gy(25-37.5Gy)。与健康对照组相比,接受放疗患者的整个大脑和亚结构经历了类似快速老化的结构变化。整个大脑“衰老”加快9.32倍,皮层快8.05倍,皮层下结构快12.57倍,海马快10.14倍。在亚组分析中,与海马回避WBRT相比,常规WBRT后患者的海马“衰老”速度快8.88倍。本研究结果表明WBRT导致大脑及其亚结构以正常衰老13倍的速度发生结构改变,其中海马回避提供了局部结构保护。这项研究表明,与衰老类似的快速、全面的结构变化可能是导致放疗后神经认知障碍的原因之一。
通过NMDA受体拮抗剂美金刚联合高压氧治疗恢复颅脑调强放疗的神经损伤
Recovery from the damage of cranial radiation modulated by memantine, an NMDA receptor antagonist, combined with hyperbaric oxygen therapy
Yohei Hokama, Masahiko Nishimura, Ryoichi Usugi, Kyoko Fujiwara, Chiaki Katagiri ...
Neuro-Oncology, Volume 25, Issue 1, January 2023, Pages 108–122, https://doi.org/10.1093/neuonc/noac162
编译:冀培刚(唐都医院)
放射治疗是中枢神经系统恶性肿瘤的一种重要的治疗选择。然而,颅脑放疗会引起海马功能障碍和白质损伤,这会造成认知功能障碍,并导致患者生活质量下降。通过N-甲基-D-天冬氨酸受体(NMDAR)的兴奋性谷氨酸信号传导在海马神经发生和大脑少突胶质细胞的髓鞘形成中起重要作用。美金刚是一种非竞争性拮抗剂,可恢复海马中的双皮质素(DCX)阳性神经前体细胞和大脑中的少突胶质细胞(髓鞘形成细胞)。在临床前模型和人体临床试验中,美金刚表现出神经保护作用,并阻止了病理性NMDAR介导的信号传导。高压氧(HBO)预处理可减轻老年大鼠术后认知障碍,并通过减弱促炎细胞因子的产生来刺激周围神经鞘再生。在人类中,HBO在左侧大脑半球的额上回、运动前区腹侧、顶叶和颞中回皮层的背侧注意通路中以及在左楔叶、视皮层和扣带回后皮层的默认模式网络中诱导区域性相对脑血流量(rCBF)增加,这表明在静息状态下可能对改善认知状态有益。本研究中共有173名患者(包括61名接受放疗的恶性肿瘤患者)和36名健康志愿者参加了这项研究。通过量化人类受试者在肿瘤治疗期间活体大脑的神经发生,并通过神经影像学检查人类脑疾病患者的海马记忆通路。在此研究中,研究者开发了海马功能诊断和治疗方法,可适用于接受头颅放疗以后认知能力下降的患者。放射治疗期间联合高压氧和美金刚神经调节治疗有助于海马功能和白质完整性的恢复,并改善接受颅脑放射治疗的患者的高级认知功能。重要的是虽然放疗导致神经发生减少,但患者海马的神经发生可通过治疗恢复。
放疗联合纳武单抗或替莫唑胺治疗新诊断的MGMT启动子区非甲基化胶质母细胞瘤:一项国际多中心III期临床试验
Radiotherapy combined with nivolumab or temozolomide for newly diagnosed glioblastoma with unmethylatedMGMT promoter: An international randomized phase III trial
Antonio Omuro, Alba A Brandes, Antoine F Carpentier, Ahmed Idbaih, David A Reardon ...
Neuro-Oncology, Volume 25, Issue 1, January 2023, Pages 123–134, https://doi.org/10.1093/neuonc/noac099
编译:李佩静(浙江省肿瘤医院)
在替莫唑胺(TMZ)的基础上引入放疗(RT),可以提高新诊断胶质母细胞瘤(nGBM)患者的总生存期(OS),但实际上MGMT启动子区非甲基化的nGBM患者获益甚微。CheckMate 498研究是一项开放标签的III期临床试验,旨在比较nivolumab (NIVO) + RT与TMZ + RT治疗MGMT启动子区非甲基化nGBM患者的疗效。本研究通过将560例MGMT启动子区非甲基化nGBM患者1:1随机分配到RT (60 Gy) + NIVO(240mg,Q2W,8周期,维持:480mg,Q4W)组或RT + TMZ(放疗期间:75mg/m²/天,维持:150-200mg/m²/天,D1-5,Q4W)组,每组280例。主要研究终点为OS。该研究结果显示:NIVO+RT组有效率为7.8%(9/116),TMZ+RT组有效率为7.2%(8/111)。NIVO+RT组的中位OS和PFS分别为13.4个月(95% CI,12.6-14.3)和6.0个月(95% CI,5.7-6.2);TMZ+RT组的中位OS和PFS分别为14.9个月(95% CI,13.3-16.1)和6.2个月(95% CI,5.9-6.7);OS的HR为1.31,95% CI:1.09-1.58,P=0.0037。NIVO+RT组和TMZ+RT组的2年OS分别为10.3%(95% CI:6.8-14.6)和21.2%(95% CI:16.4-26.5)。两组3-4级治疗相关不良事件(TRAE)发生率分别为21.9%和25.1%,任何级别严重TRAE发生率分别为17.3%和7.6%。
纳武单抗联合或不联合伊匹单抗治疗儿童高级别中枢神经系统恶性肿瘤的安全性、有效性、生物标志物和药代动力学研究——CheckMate 908
Nivolumab with or without ipilimumab in pediatric patients with high-grade CNS malignancies: Safety, efficacy, biomarker, and pharmacokinetics—CheckMate 908
Ira J Dunkeland others
Neuro-Oncology, Volume 25, Issue 8, August 2023, Pages 1530–1545,doi: 10.1093/neuonc/noad031
编译:刘竞辉(空军军医大学唐都医院)
儿童中枢神经系统恶性肿瘤的治疗选择非常有限。CheckMate 908 (NCT03130959)是一项开放标签、序贯组、1b/2期临床研究,评估纳武单抗(NIVO)和NIVO+伊匹单抗(IPI)治疗儿童高级别CNS恶性肿瘤患者。本研究共纳入166名患者,分别接受NIVO 3mg/kg,每2周1次(Q2W)或NIVO 3mg/kg+IPI 1mg/kg每3周1次(共4次)后,后续给与NIVO 3mg/kg,每2周1次(Q2W)治疗。主要终点包括总生存期(OS;新诊断的弥漫性内生性桥脑胶质瘤(DIPG))和无进展生存期(PFS;其他复发/进展或复发/耐药中枢神经系恶性肿瘤队列)。次要终点包括其他疗效指标和安全性。探索性终点包括药代动力学和生物标志物分析。截至2021年1月13日,NIVO组和NIVO+IPI组初诊DIPG患者的中位OS(80% CI)分别为11.7(10.3~16.5)和10.8(9.1~15.8)个月。在复发/进展的高级别胶质瘤中,NIVO组和NIVO+IPI组的中位PFS(80% CI)分别为1.7(1.4~2.7)和1.3(1.2~1.5)个月;复发/耐药髓母细胞瘤的中位PFS (80% CI)分别为1.4(1.2~1.4)个月和2.8(1.5~4.5)个月;复发/耐药室管膜瘤组中位PFS分别为1.4(1.4~2.6)个月和4.6(1.4~5.4)个月。其他复发/进展CNS肿瘤患者的中位PFS (95% CI)分别为1.2(1.1~1.3)和1.6(1.3~3.5)个月。3/4级治疗相关不良事件发生率分别为14.1%(NIVO)和27.2% (NIVO+IPI)。NIVO和IPI首剂谷浓度在年龄最小和体重最低的患者中较低。基线PD-L1的表达与生存无关。相对于历史数据,NIVO±IPI并未显示出临床获益。总体安全性可控,无新的安全不良事件。
奥卢他昔尼(FT-2102)在复发或难治性IDH1突变胶质瘤患者中的应用:一项多中心、开放性、Ib/II期试验
Olutasidenib (FT-2102) in patients with relapsed or refractoryIDH1-mutant glioma: A multicenter, open-label, phase Ib/II trial
Macarena I de la Fuente, Howard Colman, Mark Rosenthal, Brian A Van Tine, Danijela Levacic ...
Neuro-Oncology, Volume 25, Issue 1, January 2023, Pages 146–156, https://doi.org/10.1093/neuonc/noac139
编译:范治成(唐都医院)
IDH1-132位点突变(R132X)在胶质瘤患者中较为常见,其突变产物R-2-HG在胶质瘤的发生、代谢、表观遗传调节等方面发挥关键作用,因此,靶向抑制IDH1突变位点成为了一种潜在的治疗策略。而奥卢他昔尼 (FT-2102)是一种强效、口服、脑穿透性和选择性的IDH1突变位点抑制剂,一项正在进行的I/II期研究显示,奥卢他昔尼在复发/难治性急性髓系白血病(AML)和骨髓增生异常综合征(MDS)患者中有着初步的临床治疗效应。本篇作者报道了一项评估奥卢他昔尼单药治疗在含有IDH1突变的复发或难治性胶质瘤患者中的安全性、耐受性、药代动力学(PK)和临床活性的Ib/II期研究。结果显示,入选的26例患者中,中位随访时间为15.1个月(7.3-19.4)。在单药治疗胶质瘤患者队列中未观察到剂量限制毒性(dlt),药代动力学结果支持奥卢他昔尼 150 mg BID作为II期推荐剂量。在治疗效应评估人群中,疾病控制率(客观响应加疾病稳定)为48%。2例(8%)患者表现为部分缓解,8例(32%)患者病情稳定至少4个月。3-4级不良事件(≥10%)包括丙氨酸转氨酶升高和天冬氨酸转氨酶升高(各3例[12%])本研究证实奥卢他昔尼 150 mg BID在IDH1 R132X突变的复发/难治性胶质瘤患者中耐受良好,并在这一人群中显示出初步的临床治疗效应。
可穿透脑的突变IDH1抑制剂DS-1001应用于复发或进展的IDH1突变胶质瘤的第一次应用于人类的I期临床研究
The first-in-human phase I study of a brain-penetrant mutant IDH1 inhibitor DS-1001 in patients with recurrent or progressive IDH1-mutant gliomas
Atsushi Natsume , Yoshiki Arakawa , Yoshitaka Narita , Kazuhiko Sugiyama…
Neuro Oncol. 2023 Feb 14;25(2):326-336. doi: 10.1093/neuonc/noac155.
编译:林毅(中国医科大学附属第一医院)
约70%的低级别胶质瘤有IDH1突变,导致致瘤代谢物D-2-HG积聚,引起表观遗传学调控紊乱,瘤变,随之克隆扩增。DS-1001是一种口服的可通过血脑屏障的特异性抑制突变IDH1的抑制剂,本研究第一次在人身上使用DS-1001,探究了其安全性、药物动力学和药物代谢,及其有效性。本研究是多中心开放性剂量递增的,I期入组47名复发/进展性IDH1-突变(R132)的胶质瘤患者(NCT03030066)。DS-1001剂量125-1400mg每日两次口服。采用改良持续重评估法进行剂量递增。研究结果报道的最大耐受剂量未达到。在统计数据时仍有8名患者在持续用药。大多数不良事件为1-2级。20名患者(42.6%)有至少一次3级不良事件。没有4级或5级不良事件或者严重的药物相关不良事件报告。常见的不良事件(>20%)有皮肤色素沉着,腹泻,瘙痒,脱发,关节疼痛,恶心,头痛,皮疹和皮肤发干。对药物的反应率在有增强的肿瘤为17.1%,没有增强的肿瘤为33.3%。中位无进展生存时间有增强的肿瘤为10.4个月(95%可信区间[Cl],6.1-17.7月),没有增强的肿瘤无进展生存时间尚未到达(95%CI,24.1月-未到达)。对比7例接受药物治疗中的肿瘤标本,与药物治疗前保存的标本对比D-2HG水平明显降低。DS-1001耐受性良好,脑组织分布良好。复发/进展的IDH1-突变胶质瘤患者对治疗有反应。一项研究DS-1001对未经化疗或放疗的IDH1-突变WHO2级胶质瘤的临床试验正在进行中(NCT04458272)。
治疗EGFR扩增的成人新诊断脑胶质母细胞瘤:III期随机临床试验
Depatuxizumab mafodotin in EGFR-amplified newly diagnosed glioblastoma: A phase III randomized clinical trial
Andrew B Lassman , Stephanie L Pugh , Tony J C Wang…
Neuro Oncol. 2023 Feb 14;25(2):339-350. doi: 10.1093/neuonc/noac173.
编译:李佩静(中国科学院大学附属肿瘤医院)
约50%的新诊断胶质母细胞瘤(GBM)携带表皮生长因子受体基因扩增(EGFR-amp)。Depatuxizumab mafodotin(depatux-m)是一种抗体偶联药,由EGFR抗体(结合野生型过表达和EGFRvIII突变体EGFR)和微观抑制剂构成。临床前和早期临床数据已证实该药在GBM中具有抑瘤活性。该研究将中心确认的EGFR-amp成人新诊断GBM患者1:1随机分配至试验组(放疗+TMZ+ depatux-m)和对照组(放疗+TMZ+安慰剂)采用方案规定的预防性和支持性措施联合治疗角膜上皮病。研究共入组639名患者,中位年龄60(范围:22-84)岁,62%为男性。预先设定的中期分析发现,试验组与对照组的OS无显著性差异,mOS分别为18.9和18.7个月,HR=1.02,95% CI 0.82-1.26,单侧p=0.63。试验组的无进展生存期(PFS)优于对照组,mPFS分别为8.0和6个月,HR=0.84,95% CI 0.70-1.01,p=0.029;EGFRvIII突变型患者(mPFS:8.3 vs. 5.9个月,HR=0.72,95% CI 0.56-0.93,单侧p=0.002)或MGMT无甲基化患者(HR=0.77,95% CI 0.61-0.97,单侧p=0.012)的PFS获益更为显著,但均无OS的改善。试验组94%的患者发生角膜上皮病变(3-4级:61%),导致12%的患者停药。该试验的中期分析结果表明,depatux-m治疗EGFR-amp的成人新诊断GBM无OS获益,同时未发现新的重要安全性风险。
在复发性胶质母细胞瘤患者中使用MDNA55靶向IL4受体:IIb期试验的结果
Targeting the IL4 receptor with MDNA55 in patients with recurrent glioblastoma: Results of a phase IIb trial
John H Sampson , Achal Singh Achrol , Manish K Aghi…
Neuro Oncol. 2023 Jun 2;25(6):1085-1097. doi: 10.1093/neuonc/noac285.
编译:李志键 杨建凯(河北医科大学第二医院)
研究显示白细胞介素-4受体(IL4R)高表达与复发胶质母细胞瘤的预后不良相关,美国杜克大学神经外科John教授等开展了一项用MDNA55靶向治疗复发性胶质母细胞瘤患者的IIb期临床试验,结果提示与目前所批准的治疗方法相比,MDNA55治疗表现出了良好的生存期,并在预期预后较差的人群中显示出了可以被接受的风险受益。MDNA55的单次治疗使mOS提高了50%,12个月的PFS提高了近100%。先进的对流增强递送(CED)可实现精确的导管放置,并通过实时成像来可视化药物分布。该研究是一项开放式、单臂的IIb期研究,MDNA55被用于首次或复发的具有侵袭性的胶质母细胞瘤患者(原发性GBM、IDH野生型,复发时不可切除)。MDNA55是可靶向在GBM中表达IL4R的细胞和肿瘤微环境中的某些细胞的一种免疫毒素,可诱导细胞凋亡。但不表达IL4R靶点的细胞不结合MDNA55,不受MDNA55的影响。该研究将MDNA55用于肿瘤内注射,作为单剂量治疗(剂量范围为18至240 ug),使用CED给药,最多放置4个给药导管。MDNA55与造影剂共同注入,以评估其在肿瘤边缘和周围的分布。每根导管的流速不超过10μL/min,确保输注时间不超过48 h。主要临床终点指标为中位生存期,次要临床终点指标为IL4R高表达或低表达状态对中位生存期和无进展生存期的影响。结果显示MDNA55在剂量高达240 μg时显示出可以被接受的安全性。在所有可评估的患者(n=44)中,中位生存期为11.64个月(80%单侧CI 8.62,15.02),OS-12为46%。由IL4R高表达和IL4R低表达患者组成的亚组(n=32)接受高剂量MDNA55(>180 ug)治疗,显示最大中位生存期为15个月,OS-12为55%。根据mRANO标准,81%(26/32)的患者观察到肿瘤进展被控制,且包括那些表现出假性进展的患者(15/26)。
一项口服强效溴结构域和末端外抑制剂——Trotabresib治疗高级别胶质瘤的I期 “机会之窗”研究
Trotabresib, an oral potent bromodomain and extraterminal inhibitor, in patients with high-grade gliomas: A phase I, “window-of-opportunity” study
Victor Moreno, Juan Manuel Sepúlveda…
Neuro Oncol. 2023 Jun 2;25(6):1113-1122. doi: 10.1093/neuonc/noac263.
编译:王樑(空军军医大学附属唐都医院)
由于多种原因,胶质瘤的有效治疗具有挑战性,中枢神经系统治疗药物的渗透性被限制,药物通过血脑屏障(BBB)的扩散仅限于分子量为<400 Da的脂溶性化合物。溴结构域和末端外蛋白(BET)抑制剂Trotabresib对包括高级胶质瘤在内的晚期实体瘤患者显示出抗肿瘤活性。CC-90010-GBM-001(NCT04047303)是一项I期研究,研究Trotabresib在计划挽救性切除的复发性高级别胶质瘤患者中的药代动力学、药效学和中枢神经系统渗透。本次纳入20位采取挽救性切除的复发性高级别胶质瘤患者,在手术前1-4天接受Trotabresib30mg/天治疗,血小板计数不低于100 000/mL,符合要求的患者在第4天给药后6-24小时内进行手术。术后康复且距离术前第一次给药时间间隔4周以上,患者可以开始接受Trotabresib单药45 mg/天的维持治疗,每28天一治疗周期,治疗4天,休息24天,主要观察切除组织中的血浆药代动力学和药物浓度。次要和探索性终点包括安全性、药效学和抗肿瘤活性。20名患者在术前接受了Trotabresib治疗进行手术,16例患者在术后恢复后接受了Trotabresib维持治疗。Trotabresib的血浆药代动力学与以前的数据一致。Trotabresib脑肿瘤组织与血浆的平均比值为0.84,在血液和脑肿瘤组织中均观察到药效学标志物的变化。安全性结果显示Trotabresib具有良好的耐受性,维持治疗期间最常见的3/4级治疗相关不良事件是血小板减少症(5/16名患者)。6个月无进展生存率为12%。两名患者在第25周期和第30周期病情稳定,仍在接受治疗。Trotabresib可穿透复发性高级别胶质瘤患者的血脑肿瘤屏障,并在切除的肿瘤组织中显示靶向性参与治疗。本次实验结果与Trotabresib在晚期实体瘤患者中的血浆药代动力学、血液药效学和安全性与之前的结果一致。NCT04324840实验对新诊断的胶质母细胞瘤患者进行辅助Trotabresib+替莫唑胺和联合Trotabresib+替莫唑酰胺+放疗的研究正在进行中。
向颅内注射HER2靶向CAR-NK细胞治疗复发性胶质母细胞瘤患者
Intracranial injection of natural killer cells engineered with a HER2-targeted chimeric antigen receptor in patients with recurrent glioblastoma
Michael C Burger and others
Neuro-Oncology, Volume 25, Issue 11, November 2023, Pages 2058–2071, doi.org/10.1093/neuonc/noad087
目前对于复发性胶质母细胞瘤(GB)尚无公认的治疗方案。在这项I期首次人体临床试验中,我们研究了针对HER2的克隆嵌合抗原受体(CAR)-NK细胞(NK-92/5.28.z)的过继转移的安全性和可行性,其中HER2在部分胶质母细胞瘤中表达水平升高。对9例复发性HER2阳性GB患者进行单次给药,剂量为1×107、3×107或1×108个经过照射的CAR-NK细胞,在复发手术期间注入手术腔边缘。在基线和随访期间进行成像,对周围血淋巴细胞进行表型分析,并对免疫结构进行多重免疫组化分析和空间数字分析。发现没有出现剂量限制性毒性,且患者均未发生细胞因子释放综合征或免疫效应细胞相关的神经毒性综合征。5名患者在复发手术后和CAR-NK注射后病情稳定,持续时间为7-37周。4名患者病情进展。2名患者在注射部位出现假性进展,提示治疗诱发的免疫反应。对于所有患者,中位无进展生存期为7周,中位总生存期为31周。此外,在CAR-NK细胞注射前,复发性肿瘤组织中CD8+T细胞浸润水平与进展时间呈正相关。复发性GB患者中注射针对HER2的CAR-NK细胞是可行且安全的。对于后续的扩大队列,1×108个NK-92/5.28.z细胞被确定为可重复局部注射CAR-NK细胞的最高可行剂量。

![]()




