![]()
![]()
病情摘要
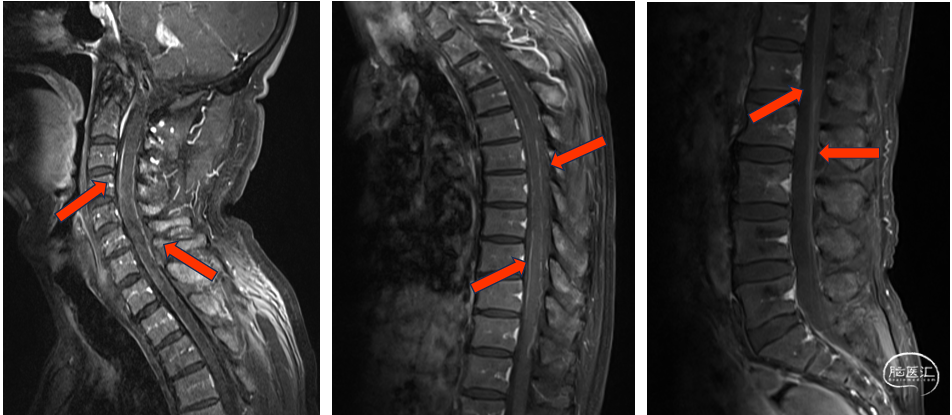
患者老年男性,主因头痛头晕伴记忆力下降入院。神经系统查体:意识清楚,轻度认知障碍,反应略迟缓,言语稍含糊,左侧肢体轻力弱,生活能力无明显受损。核磁结果提示右侧颞叶内侧累及海马,底节区占位,双侧脑室旁,第四脑室结节状异常强化灶,部分病变沿侧脑室生长,双侧小脑表面可见广泛脑膜强化。进一步完善全脊柱核磁扫描提示颈椎、胸椎脊膜可见弥漫增厚并强化,腰椎脊膜局部亦可见强化。脑膜转移及播散不除外。腰穿脑脊液检查结果(单次)提示:ICP初压170mmH2O,蛋白含量偏高(1.1g/l),脱落细胞学检查未见肿瘤细胞。
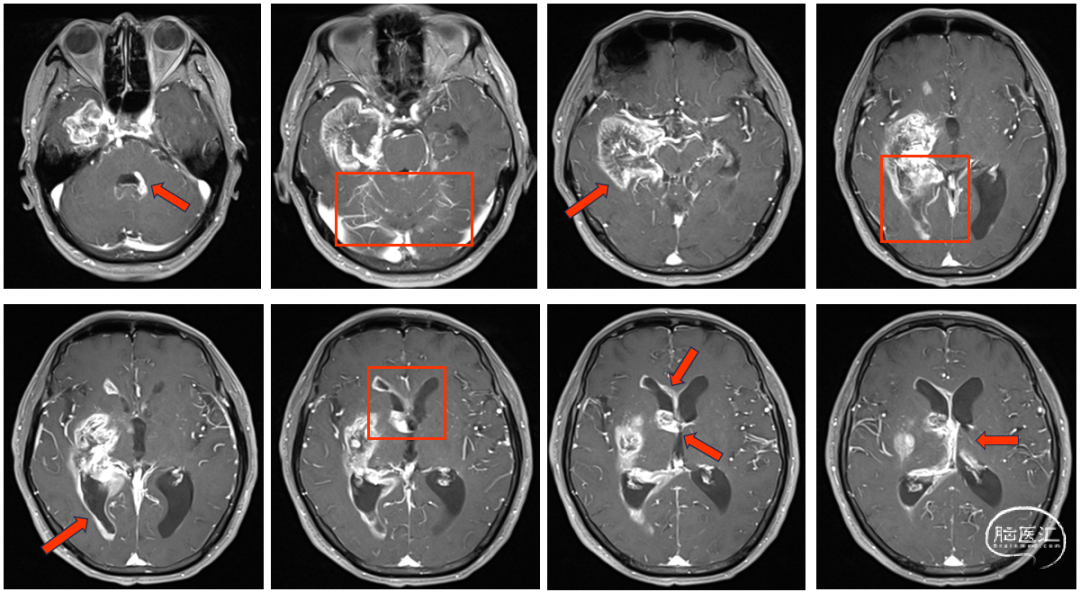
结合病史和影像学资料,初步诊断为右侧颞叶内侧高级别胶质瘤或胶质肉瘤可能,考虑患者颅内多发且合并广泛软脑膜浸润转移及脑脊液播散,提示预后较差。但因肿瘤体积较大,存在占位效应,且位于可切除部位,经MDT综合会诊后,认为患者一般生活状态暂无明显受限,参考中国胶质瘤临床管理指南(2020),肿瘤主体部分可切除计划在80%以上,有手术指征,在尽可能保护功能前提下切除病灶,以期达到减瘤目标,为后续治疗创造时间和空间。术后拟予以全脑全脊髓放疗,同步替莫唑胺化疗或联合贝伐单抗、鞘内化疗及电场治疗,延长患者生存期。
手术步骤
手术在全程规范化下进行,应用磁共振弥散张量成像(DTI)进行多模态融合和三维重建,明确传导束的走形,从而更好的保护患者功能。术前行荧光素钠皮试,并于麻醉前30min由静脉一次性推注给药。麻醉成功后,患者仰卧位头左偏,三钉头架固定,选择经额颞改良翼点入路逐层切开头皮。术中骨窗暴露范围至中颅窝底部及颞窝前部。剪开硬膜后,见颞叶前部皮质膨隆,侧裂受压,神经导航确认肿瘤大体边界,解剖侧裂前部,至颈内动脉分叉处,初步明确视束、大脑中动脉、大脑后动脉走形位置。于颞叶前部皮层隆起处切开深下2cm见肿瘤,为鱼肉样,质软,稀碎,血供丰富。显微镜切换YELLOW 560黄荧光,术中神经导航及黄荧光引导下由浅及深分块切除肉眼可见肿瘤。前方颞极、内侧深部之颞叶钩回、海马旁回完全切除。部分肿瘤自颞叶后部由下向上进入外侧纹状体区,此部肿瘤予部分切除。切除肿瘤后部同时打开侧脑室三角部,见脉络丛组织及脑脊液溢出。移除肿瘤后可见小脑幕缘,仔细保护幕缘下方之动眼神经、小脑上动脉及大脑后动脉。关颅过程中通过硬脑膜减张缝合以及去除颞肌下部分颅骨已期达到进一步减压目的。切除标本送常规病理及分子病理检查,结果回报:(右颞部)胶质母细胞瘤,WHO/CNS分级:4级,局部侵及软脑膜。免疫组化结果:IDH野生型,MGMT启动子无甲基化,EGFR(2+),Ki-67(+,40%)。分子病理结果:1p(缺失)/19q(未缺失)。
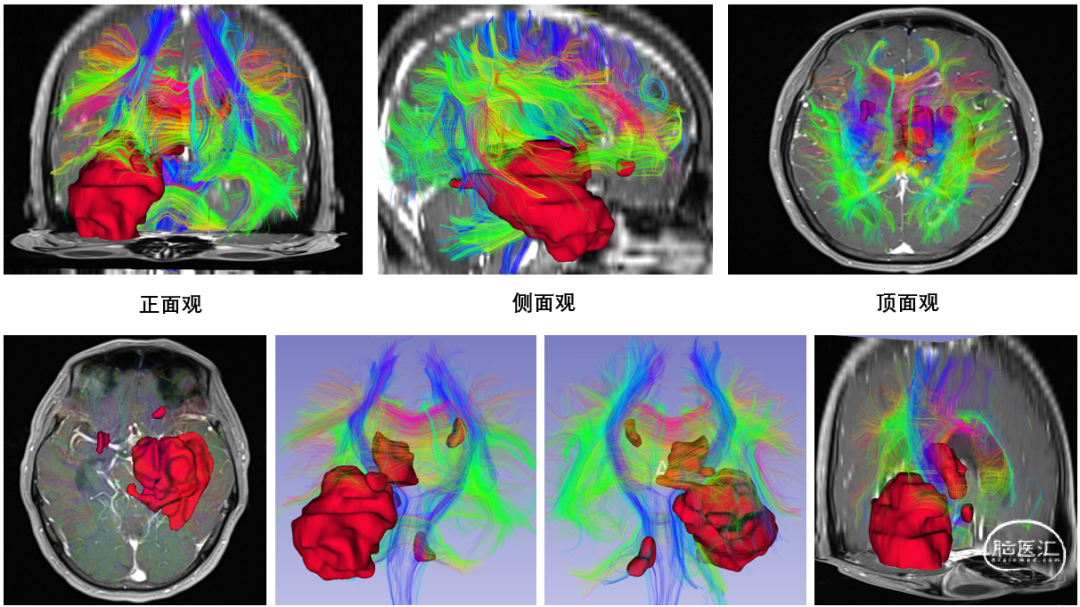
图2. 应用DTI进行术前传导束的重建,从而更好的保护患者功能。
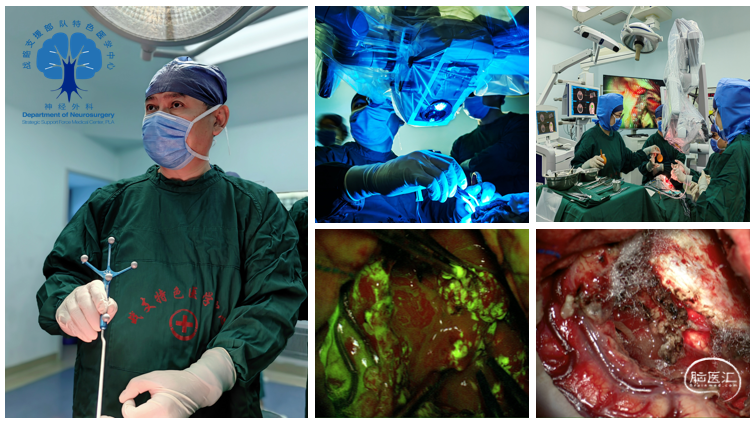
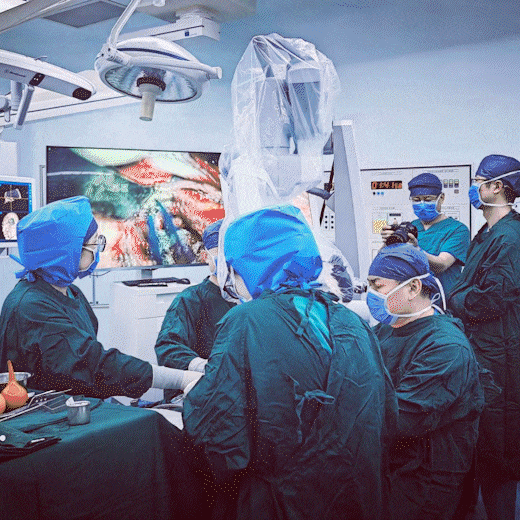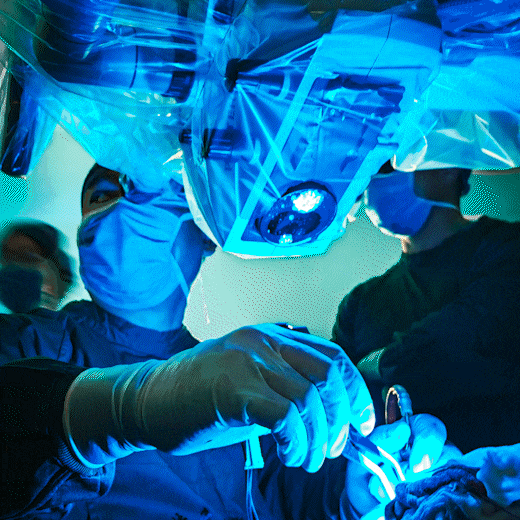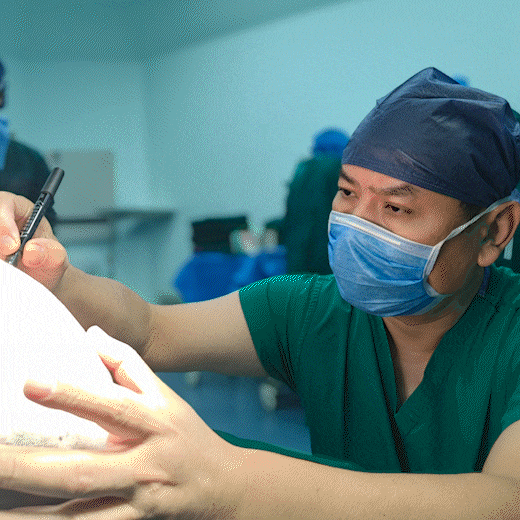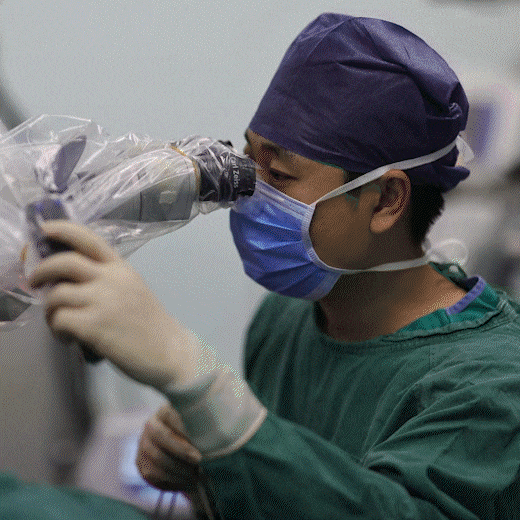
图3. 术中神经导航及黄荧光引导下由浅及深分块切除肉眼可见。
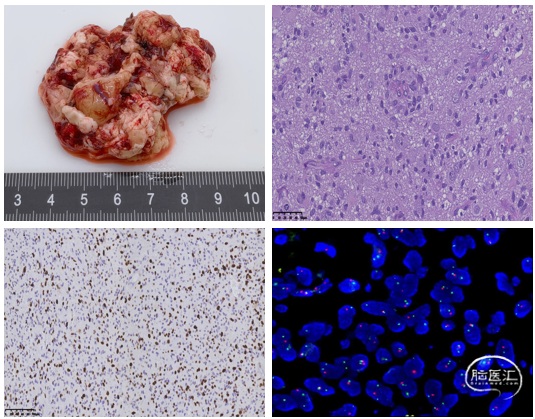
图4. 组织病理提示胶质细胞来源,肿瘤细胞弥漫侵润,异型性大,细胞密度高,血管增生。分子病理提示1p(缺失)/19q(未缺失)。
讨论
01
胶质瘤因其具有侵袭性生长的特性,往往使得医生难以分辨其与脑组织的界限,因此在以往的手术中,只能依靠术者的肉眼、器械切除的手感等临床经验完成手术操作。随着技术飞跃发展,术前重建病灶,血管及神经纤维束,术中神经导航精准定位肿瘤位置,荧光素钠清晰描绘肿瘤边界,实现最大程度的切除肿瘤的同时,保护正常脑组织的目的。
02
高级别胶质瘤伴软脑膜转移的诊疗要点:
颅内原发肿瘤合并软脑膜、脊髓广泛转移通常多见于髓母细胞瘤、生殖细胞瘤及脑室系统肿瘤,而在胶质瘤中并不多见。原发颅内胶质瘤的侵袭途径通常是沿脑白质,包括联系纤维和胼胝体等,恶性胶质瘤(分级≥III级)伴软脑膜转移(Leptomeningeal Metastases ,LM)通常被认为是一种罕见且严重的疾病,约占进展期实体性肿瘤的4%。其转移播散转移机制可能为1. 与脑脊液通路直接接触,肿瘤细胞直接“脱落”到脑脊液中;2. 手术加重理论;3. 肿瘤进入软脑膜间隙并通过软脑膜间隙扩散。目前对此类疾病尚无共识。
Christopher Dardis在一项34例高级别胶质瘤(III-IV级)合并软脑膜转移的回顾性研究中指出,发展为LM的中位时间为16.4月,LM后疾病进一步进展的中位时间为4.9月。高级别胶质瘤合并LM的中位生存期(OS)为10.2月。Witham在一篇报道中指出,GBM合并LM的中位OS为9.9个月,而III级胶质瘤脑膜转移为18.9个月,诊断LM时较高的KPS评分与OS相关(KPS<90的OS为7.8个月)。
LM的诊断最终取决于临床,通常从影像学及脑脊液中寻求证据。胶质瘤软脑膜转移的影像学表现可为点片状或弥漫性的脑膜强化,部分患者可出现脑室壁结节状强化,当胶质瘤合并脑积水时,要充分怀疑是否存在LM可能。如肿瘤侵犯血管可造成影像上类梗死灶样改变。对于LM患者,脑脊液找到肿瘤细胞是直接证据,但脑脊液细胞学阳性并非诊断必须且阳性率较低。必要时可通过提高CSF样本量及采样频次或借助免疫组化染色技术来提高诊断率。
胶质瘤放疗中国专家共识(2017)曾提及胶质瘤可以通过脑脊液播散和种植,预后较差,治疗主要目的在于缓解症状和尽可能改善患者生存质量,但不延长生存时间。有文献指出,在诊断为LM时,某些形式的治疗(化疗和/或放疗vs不治疗)增加了OS(11.7 vs. 3.3个月)。总体而言,胶质瘤合并LM患者的治疗上可参照复发胶质瘤的治疗原则,目前支持最大限度的治疗,特别是在 KPS ≥70的情况下,这种治疗通常包括最大耐受剂量的全脑放射治疗(30Gy),局部、脊髓转移病灶立体定向放疗,同步进行的辅助化疗(包括口服烷基化剂及鞘内注射阿糖胞苷化疗)和抗血管生成靶向治疗。对于肿瘤体积较大,占位效应显著患者,手术减瘤联合去骨瓣或颞肌下减压可延长生存期,对于软脑膜转移播散导致脑积水患者,采用脑室腹腔分流术一般短期内有望改善症状。
本例患者为高级别胶质母细胞瘤合并早期广泛软脑膜转移,考虑原因如下:(1)肿瘤生长位置特殊,核磁示肿瘤主体位于颞叶,向内上方进入岛叶内侧,后方临近侧脑室三角部,部分病变沿脑室生长包绕,脑室侵犯增加肿瘤沿临近脑脊液通路播散机会;(2)肿瘤病理类型特殊,IDH野生型GBM,表现为侵袭性强,侵润范围广泛等特点。大体组织病理提示EGFR呈弥漫性强阳性,40%的增殖指数以及符合小细胞型胶质母细胞瘤(SCGBM)的形态学特征。此类肿瘤通常位于软膜下区域,血管再生能力强,易于经蛛网膜下腔或室管膜迁延,并具有脑脊液播散种植倾向。
团队带头人介绍
顾建文 主任
战略支援部队特色医学中心主任,技术少将,主任医师,神经外科专家,博士研究生导师
第十三届全国政协委员,中国科学院大学博士导师、北京航空航天大学博士生导师
现任中华医学会理事,全军首批高层次科技创新领军人才,享受国务院特殊津贴及军队专业技术人才一类岗位津贴,获得中国医师奖
先后获得国家自然科学基金6项,国家科技部重大专项、军队重点及高新技术项目十余项,并以第一完成人获全军科技进步一等奖、四川省科技进步一等奖各1项,获全军科技进步二等奖3项,发明国家专利12项,出版专著10部,以第一或通讯作者在国际杂志上发表SCI论文70篇,撰写并公开发表科研科普文章4000余篇
王涛 主任
战略支援部队特色医学中心神经外科主任
第二军医大学神经外科博士,美国加州大学戴维斯分校神经科学中心联合培养博士,访问学者
现任中国抗癫痫协会青年委员,北京抗癫痫协会委员,享受军队优秀专业技术人才岗位津贴。长期从事神经外科工作,尤其擅长立体定向与功能神经外科、神经创伤与重症的综合管理
在颅脑创伤、数字神经外科等领域积累了一定经验并开展了相关临床及研究工作。承担课题或研究项目5项,经费累计达170余万元。以第一作者或通讯作者发表SCI及核心期刊文章近20篇,授权专利及软件著作权8项
声明:脑医汇旗下神外资讯、神介资讯、神内资讯、脑医咨询、AiBrain 所发表内容之知识产权为脑医汇及主办方、原作者等相关权利人所有。






