
近日,空军军医大学唐都医院神经外科屈延团队在Advanced Science(IF:15.1,JCR Q1,中科院1区)发表题为“Astrocyte-Derived Extracellular Vesicular miR-143-3p Dampens Autophagic Degradation of Endothelial Adhesion Molecules and Promotes Neutrophil Transendothelial Migration after Acute Brain Injury”的研究论文,揭示了急性脑损伤后星形胶质细胞加重继发性脑损伤的新机制。唐都医院屈延教授和葛顺楠副教授为该论文共同通讯作者,吴勋博士、刘海啸博士、胡清博士和王晋博士为该论文共同第一作者。
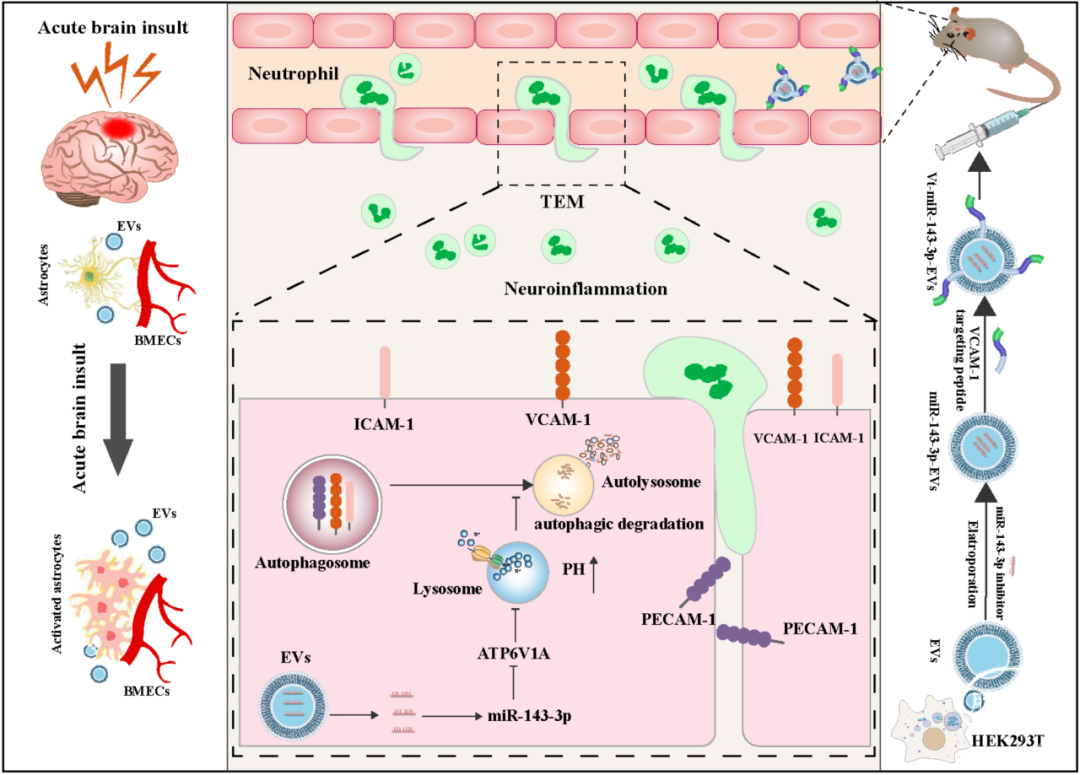
星形胶质细胞通过分泌EVs-miR-143-3p调控脑微血管内皮细胞(BMECs)屏障功能和中性粒细胞跨内皮细胞迁移(TEM)的机制及靶向干预策略示意图
血脑屏障(BBB)破坏和免疫细胞浸润是颅脑损伤(TBI)和脑出血(ICH)等急性脑损伤疾病继发损伤过程中重要的细胞与分子事件。BBB是存在于中枢神经系统和血液循环系统之间的一种高度选择性的半透性边界,能够保护脑组织免受外界有害物质的侵害。在急性脑损伤中, 血脑屏障受到破坏,脑微血管内皮细胞(BMECs)通透性增加,伴随着大量外周免疫细胞进入脑组织,加剧脑水肿和继发损伤。维持BBB的屏障功能,以及控制外周免疫细胞浸润,对于减轻继发性脑损伤至关重要。本研究通过对ICH患者血浆样本进行测序分析发现,EVs-miR-143-3p的水平与患者脑水肿进展和神经功能预后密切相关。
进一步的实验表明,ICH后升高的EVs-miR-143-3p主要由激活的星形胶质细胞分泌,促使BMECs活化,并高表达炎性细胞黏附因子(CAMs)包括VCAM-1、ICAM-1和PECAM-1等。增高的CAMs可导致循环中性粒细胞与BMECs的粘附增强,从而促进中性粒细胞的跨内皮细胞迁移(TEM)与脑内浸润。
研究团队构建了一种经VCAM-1靶向肽修饰的EVs递药系统,将miR-143-3p抑制剂靶向递送至炎性BMECs中,并在ICH和TBI小鼠模型中证实了其神经保护作用。该研究揭示了星形胶质细胞在急性脑损伤后BMECs屏障功能障碍与中性粒细胞TEM中的作用机制,并利用工程化构建了可靶向减轻BMECs中CAMs分泌的核苷酸药物递送系统,为未来临床治疗急性脑损伤提供了新的思路。
本研究得到国家自然科学基金重点项目和青年项目的资助。
通讯作者简介
屈延 教授
葛顺楠 副教授
第一作者简介
吴勋
声明:脑医汇旗下神外资讯、神介资讯、神内资讯、脑医咨询、AiBrain 所发表内容之知识产权为脑医汇及主办方、原作者等相关权利人所有。










