入院后完善各项检查(图1A、B),根据患者病史以及实验室检验结果,泌乳素水平:2721mIU/L(非妊娠女性正常范围:59-619 mIU/L),其余垂体激素水平正常;诊断考虑泌乳素垂体腺瘤。术前经科室讨论,结合影像考虑为Knosp0级,界限清楚,神经内镜经鼻蝶手术有较高的内分泌缓解率,且患者药物副作用大,手术意愿强烈,决定行神经内镜下经鼻蝶入路手术切除。手术过程顺利,术后MRI提示肿瘤全切无残留(图1C、D);术后第一天泌乳素水平下降至正常:201mIU/L,术后无尿崩、垂体功能低下、脑脊液鼻漏等手术并发症发生。
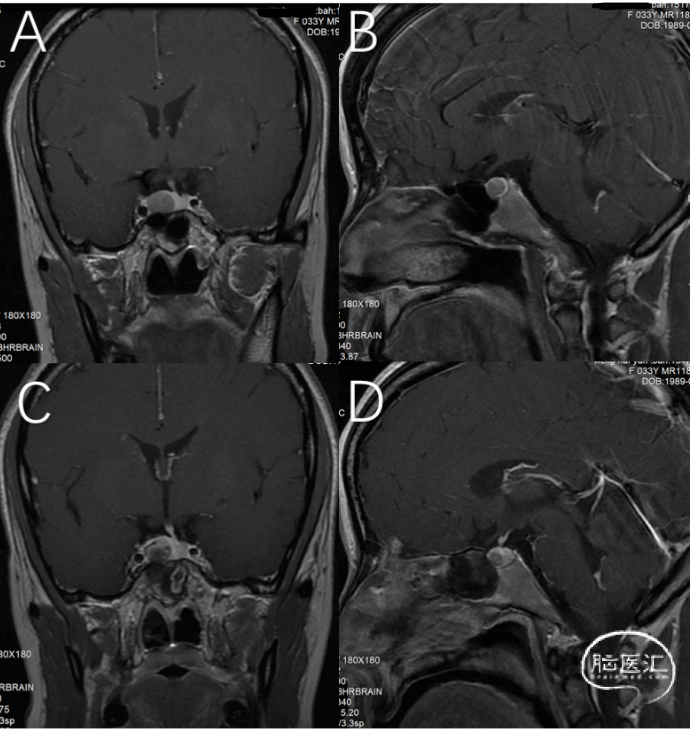
图1. A、B:术前MRI影像提示垂体内可见类圆形低信号,大小约12*10*8mm。C、D:术后MRI影像提示病灶全切无残留。A、C:T1冠状位增强相;B、D:T1矢状位增强相。(垂体)垂体腺瘤/垂体神经内分泌肿瘤。结合免疫组化,符合致密颗粒型泌乳素激素细胞肿瘤。
免疫组化结果:PIT-1 +,T-PIT -,SF-1 -,GATA-3 少量弱+,ER-alpha(SP1) -,GH -,Prolactin 弥漫胞浆+,TSH-beta -,ACTH -,LH-beta -,FSH-beta -,CAM5.2 少量胞浆+,AMA 少量弱+,Ki-67 <3%+,P53 个别弱+,SSTR2 1+,Syn + 。
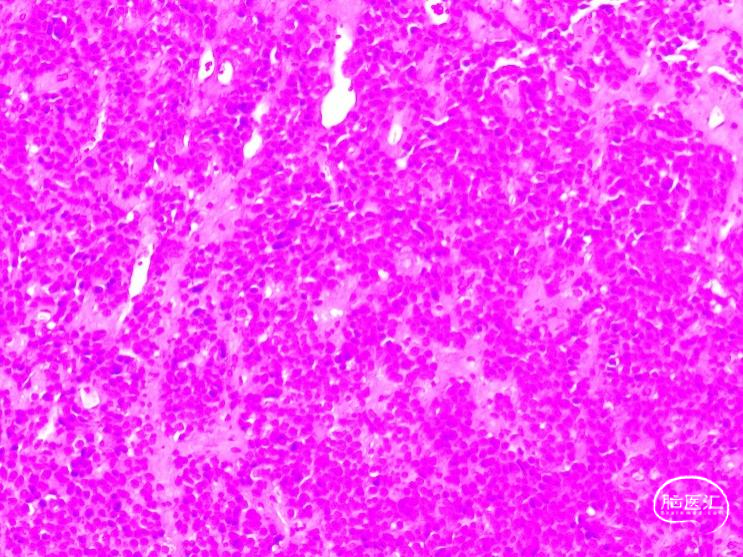
图2. 术后病理示致密颗粒型泌乳素激素细胞肿瘤。
讨论
“路漫漫其修远兮,吾将上下而求索”,垂体瘤的内镜经蝶手术正是经历了历代医学家的求索专研、才迎来了黄金时代(图3):经蝶术式最早可以追溯到古埃及时期,工匠们在处理木乃伊时发现鼻腔与大脑是联通的,这可以被认为是人类历史上最早的经蝶操作。1889年,Victor Horsley第一次采用经额下入路手术治疗垂体腺瘤,这是历史上第一台垂体肿瘤手术,人类正式向垂体瘤发起挑战。1907年,Hermann Schloffer在奥地利完成第一台经鼻蝶垂体肿瘤切除手术。1909,美国医生Harvey Cushing采用Schloffer的方法开展了他的第一台经蝶入路手术。提出了著名的“Cushing入路”。1929年,Cushing几乎将经蝶窦入路完全摒弃。1938年,关颂韬教授在北京协和医院实施了中国第一例垂体腺瘤开颅手术;1923年,苏格兰的小伙Norman Dott从导师Cushing那里将经蝶手术手艺传承了下来,成为当时世界上唯一一位坚持使用这项技术的医生。1956年,法国医生Gerard Guiot接过了这颗火种并积累了超过1000例患者的治疗经验,并第一次尝试用内镜,由于当时的内镜照明系统较差,最终不得不放弃了内镜技术。同时,加拿大医生Jules Hardy向Guiot学习经鼻入路垂体瘤切除术,在1967年第1次把手术显微镜技术应用于该手术,并设计手术器械,经蝶手术正式跨入显微神经外科时代。1979年,北京协和医院神经外科王维钧教授与耳鼻喉科王直中教授一起完成国内第一例经蝶垂体腺瘤切除术,填补了我国医疗史上的空白,在此之后,国内各中心相继开展了经蝶垂体腺瘤切除术。

泌乳素瘤是最常见的良性垂体腺瘤,各占女性和男性垂体腺瘤的50%。泌乳素瘤主要影响25~44岁女性。女性的标准化发病率是男性的3倍[1]。泌乳素微腺瘤(最大直径<10mm)是最常见的泌乳素瘤类型[2]。
垂体泌乳素瘤可引发垂体激素分泌紊乱,从而导致一系列临床症状,包括高泌乳素血症和性腺功能减退症以及其他垂体激素缺乏的表现。部分泌乳素瘤患者可出现下丘脑-垂体-性腺轴抑制。女性患者表现为月经稀少或闭经(伴或不伴溢乳),男性患者可出现勃起功能障碍;男女都会出现性欲减退和不育。垂体泌乳素瘤的治疗包括多巴胺受体激动剂、手术和放射治疗(图4)。
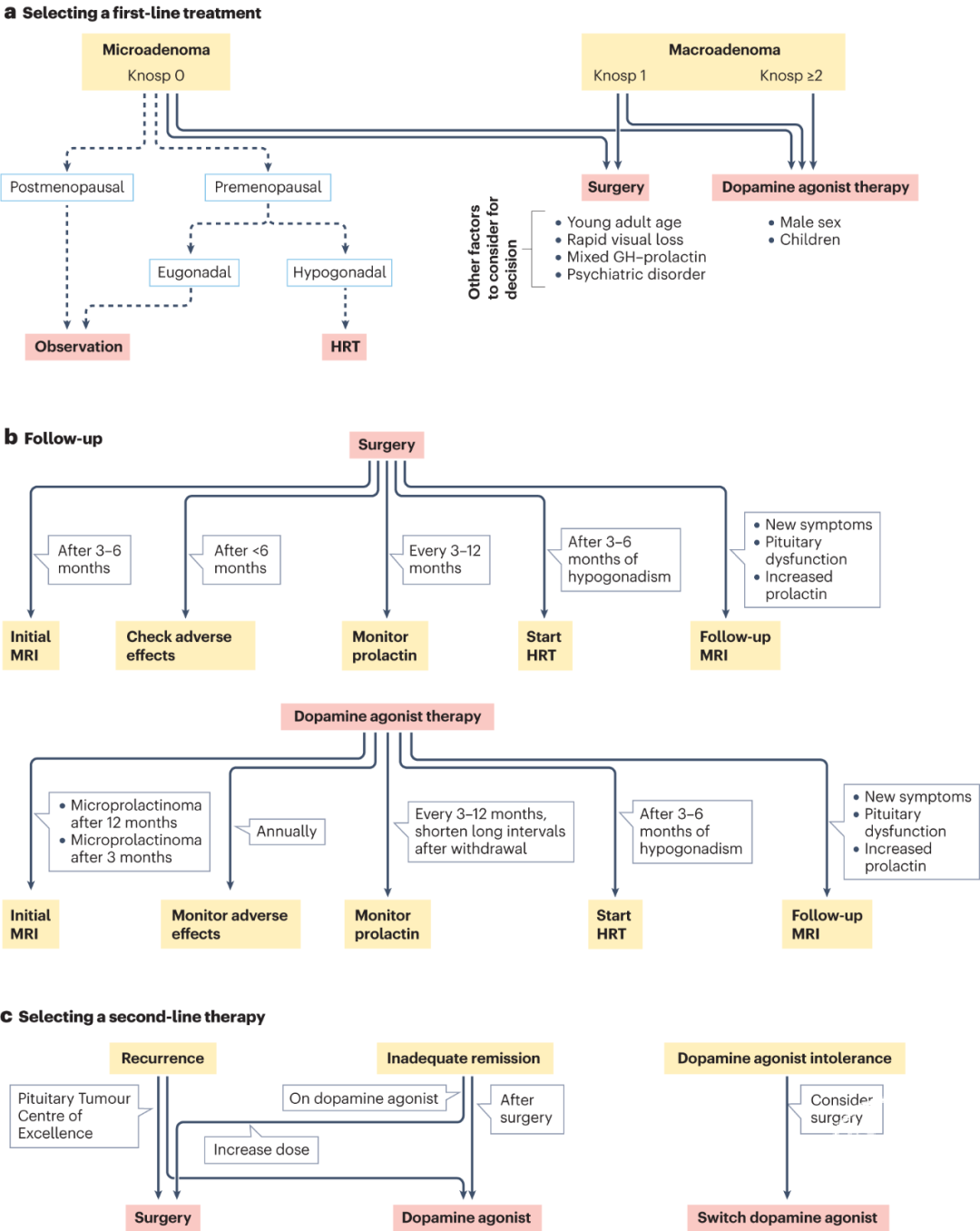
图4. 泌乳素腺瘤治疗流程[5]:a:一线治疗;b:随访;c:二线治疗’。
2023年9月5日,内分泌和垂体研究领域的顶刊《Nature Reviews Endocrinology》(IF=40.5)杂志在线发表了由Stephan Petersenn、Maria Fleseriu、Felipe F Casanueva等36位学者联合撰写的《垂体泌乳素腺瘤的诊断和治疗:垂体学会国际共识声明》。国际垂体学会(The Pituitary Society)曾于2006年以及于2011年与内分泌学会(the Endocrine Society)联合发表泌乳素腺瘤的诊断和管理指南[3][4]。12年后,国际垂体学会再度发表这项重要共识,图4就是该国际共识声明提出的泌乳素腺瘤治疗流程。更新了不少内容,其中最主要的就是重新评估了手术治疗在泌乳素瘤整体治疗中的地位,提出在部分泌乳素腺瘤手术和药物治疗同样是治疗的一线选择。
关于手术治疗的描述从2011年的临床实践指南《高泌乳素血症的诊断和治疗》中的:对不能耐受大剂量卡麦角林、或对多巴胺激动剂治疗无效的催乳素瘤患者,建议采用经蝶手术(建议)到2023年以共识的形式确定针对微腺瘤和界限清楚的大腺瘤(Knosp分级为0级和1级),手术作为首选治疗,有着极大的临床指导意义。在共识的药物治疗章节,提到了对于微腺瘤和包裹良好/边界清晰的大泌乳素瘤,在开始药物治疗前,应在多学科团队中与患者讨论手术的治疗潜力和风险(强烈推荐)。在外科治疗章节提出上诉的特定泌乳腺瘤亚型,有很高的治愈机会,具有成本效益,并且避免了长期的药物治疗。因此,由垂体神经外科医生进行的手术应与药物治疗一起讨论,作为这一亚型患者的一线选择(强烈推荐)。尤其是年轻女性病人,避免长期的乃至数十年的药物治疗。共识还指出:想要怀孕的女性也可以选择手术,因为生殖能力通常在泌乳素腺瘤切除后得以恢复,并且对于泌乳素大腺瘤患者,孕前腺瘤充分减容可避免妊娠期出现有症状的肿瘤增大。如果在怀孕前进行经蝶手术,症状性泌乳素大腺瘤增大的风险从21%降低到4.7%。外科治疗指征还包括:服药过程中肿瘤增大压迫视神经、不能耐受长期服药、服药出现脑脊液漏。
共识提出前几年来,越来越多的文献指出对特定亚型的泌乳素腺瘤,包括微腺瘤和界限清楚的大腺瘤,手术作为首选治疗,并且由经验丰富的神经内镜医生手术切除,治愈机会大,成本效益高,可避免长期多巴胺激动剂治疗[6][7],这一理念被绝大多数学者越来越认可和推荐。对于因鞍区肿块占位效应或卒中导致的快速进行性视力丧失的患者,可推荐手术治疗而不是药物治疗。对于长期多巴胺激动剂(DA)治疗耐药或不能耐受的患者可进行手术治疗。对年轻女性可能倾向于选择手术治疗,以避免在数十年内需要进行多巴胺激动剂治疗。对于希望怀孕的患者,对泌乳素大腺瘤手术是DA治疗的替代方案,因为它降低了未来妊娠期间症状性肿块增大的风险。一些文献指出高泌乳素血症显微术后缓解率为71-93%,内镜手术后缓解率为81-100%,并且围手术期及术后并发症发生率低[8][9]。短期随访(≤3个月),与DA治疗相比,泌乳素微腺瘤的手术治疗无显著差异。随访≥12个月时,DA治疗的缓解率(96%)高于手术的(86%),但手术治疗后不进行DA治疗的患者在最终随访时的缓解率高于DA治疗后停药患者的(78%对44%)[10]。另外两项荟萃分析也证实了泌乳素微腺瘤的类似结果。一项荟萃分析显示,38%的耐药或DA不耐受泌乳素瘤患者无需进一步治疗即可通过后续手术获得缓解,62%的患者通过多模式治疗获得缓解。手术并发症发生率低:0%死亡率,2%永久性尿崩症,3%脑脊液漏[11]。值得注意的是,停用DA治疗后的长期缓解率仅为34%,而手术后为67%。在另一项荟萃分析中,88%接受手术治疗的患者和52%接受DA治疗的患者实现了长期缓解[12]。
内镜En bloc切除技术即假包膜外整块切除对于泌乳素微腺瘤和界限清楚的泌乳素大腺瘤(Knosp 0级和1级)的患者的治疗有着突出的优势,因该特定泌乳腺瘤亚型假包膜的发生率在75%以上,经验丰富的神经内镜医生可采取En bloc切除技术,充分利用内镜高清成像及视野更广阔灵活的优势,术中更准确及全面地观察肿瘤假包膜,从而实现肿瘤全切率更高、并发症更少。
但需要重点提出的是,泌乳素腺瘤的手术治疗还应建立在一个具有垂体瘤诊治卓越中心、多学科联合诊治(MDT)团队以及一个经验丰富的神经外科内镜专家团队的基础上,才能让患者得到最大的手术获益。浙医二院神经外科神经内镜工作,是国内较早开展神经内镜工作的单位之一,是浙江省神经内镜的摇篮和发源地。目前亚专科由吴群主任医师牵头,以及洪远主任医师和闫伟主任医师为骨干的团队,经过十余年的发展,积累了较丰富的经验,取得了丰硕成果,内镜年手术量1500台,垂体瘤年手术量今年将超700台。我们回顾分析了吴群内镜亚专业组近3年41例泌乳素腺瘤患者的数据,对于女性患者术后即刻高泌乳素血症缓解率可达78.6%,育龄女性(40岁以下)患者,术后即刻高泌乳素血症缓解率可达91.7%,对于垂体微腺瘤(肿瘤最大直径<10mm)术后即刻以及术后半年缓解率均为100%(图5),围手术期及术后并发症发生率低(<2%),死亡率为0%,达到了国际一流水平(女性患者71%缓解率和垂体微腺瘤82%缓解率)(图6)。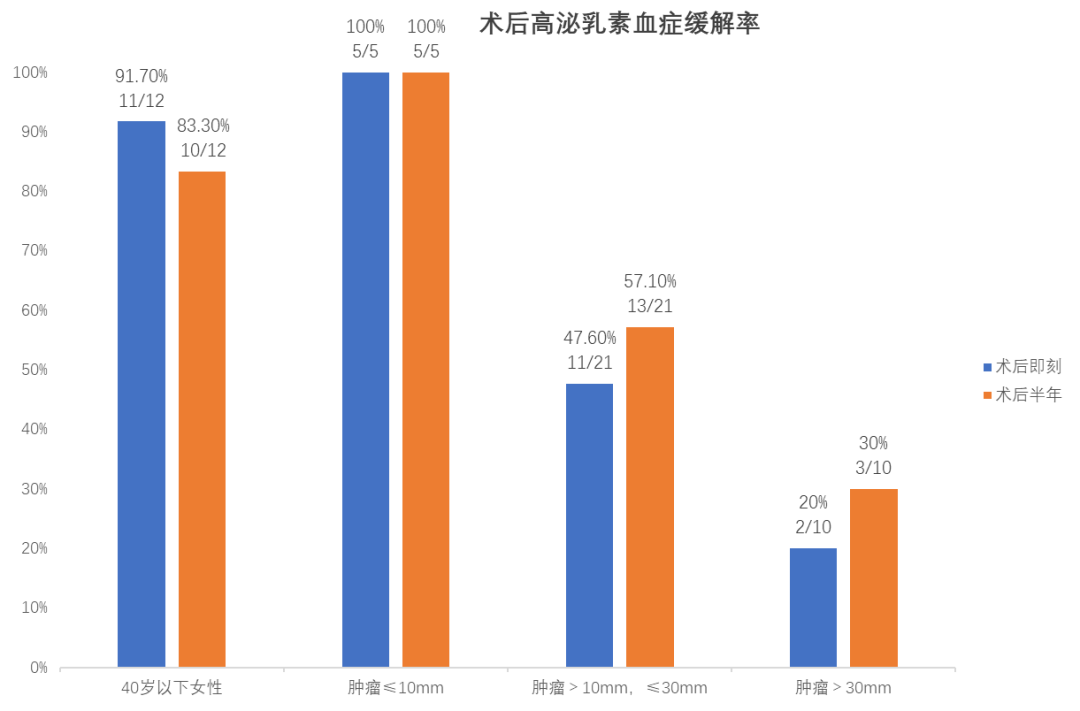
图5. 本组近3年泌乳素型垂体腺瘤患者各亚组的高泌乳素血症术后缓解率。
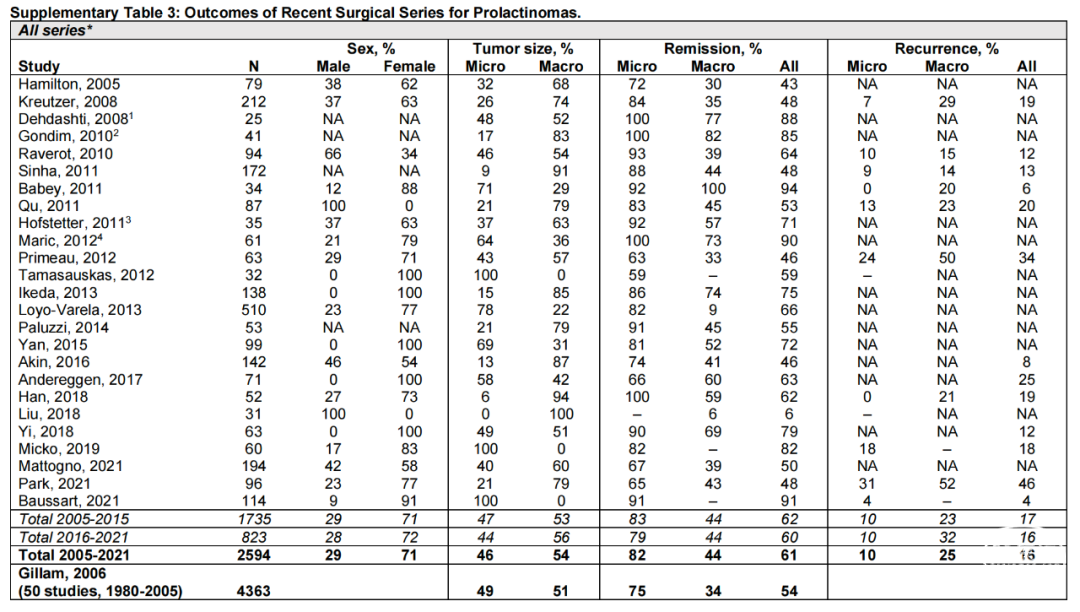
图6. 近年泌乳素腺瘤手术治疗缓解率的文献汇总[5]。
最后需要提及的是该患者的手术是在国产4K第2代神经内镜主机和国产超高清4mm光学内镜下完成。吴群主任创新团队依托浙江大学平台,和浙大光电、机械以及之江实验室人感知研究中心、海康威视开展医工交叉合作,成绩斐然,两年多的临床实践已证明国产内镜完全能替代进口同类产品。随着神经导航及神经内镜等手术相关设备发展和微创技术水平的提高,以及合理的多学科团队术前评估(腺瘤大小、临床因素和患者意愿),内镜手术具有更精确、更安全、并发症更少的优势,使其成为部分泌乳素型垂体腺瘤患者的一线治疗方案。











