![]()
脑膜瘤是成人最常见的原发性中枢神经系统肿瘤。外科手术是脑膜瘤最重要的治疗手段;大部分脑膜瘤可以通过手术切除获得良好控制,但仍有少部分脑膜瘤患者存在术后复发,甚至是多次复发的情况,引起程度更严重的临床症状,给患者和家庭带来巨大负担。术前预测脑膜瘤的WHO级别和某些重要病理指标将有助于制定更适合患者的包括手术方案在内的临床治疗方案,但目前尚无可靠的预测工具可以实现此目的。最近,复旦大学附属华山医院神经外科宫晔教授团队联合复旦大学脑科学研究院吴瑞琪课题组在《European Radiology》上发表了题为《Predicting meningioma grades and pathologic marker expression via deep learning》的研究论文。此项研究通过整合临床资料、病理数据和磁共振成像,使用人工智能算法,构建了基于影像组学的深度学习模型。该模型对脑膜瘤的WHO级别、Ki-67增殖指数、H3K27me3和孕激素受体状态做出准确预测,有助于临床制定个性化治疗方案。

复旦大学附属华山医院神经外科宫晔教授及复旦大学脑科学研究院的吴瑞琪研究员为本文的通讯作者,复旦大学附属华山医院神经外科陈嘉伟博士、任磊豪硕士、复旦大学脑科学研究院的薛彦平博士为本文的共同第一作者。
![]()
背景
脑膜瘤约占成人原发性中枢神经系统肿瘤的40.8%,年发病率约为9.73/10万人。根据2021年WHO中枢神经系统肿瘤分级标准,80%的脑膜瘤属于WHO 1级,大部分患者通过手术治疗可以实现治愈,但仍有少数患者出现术后肿瘤复发等情况;15~20%的脑膜瘤为WHO 2级,1~3%的脑膜瘤为WHO 3级,这些肿瘤恶性程度较高,且术后复发风险较大。
既往的研究表明,脑膜瘤的Ki-67增殖指数、组蛋白H3赖氨酸27(K27)的三甲基化(H3K27me3)和孕激素受体(PR)表达情况等和脑膜瘤术后复发风险存在一定联系,适合成为预测脑膜瘤复发风险的病理指标。Ki-67增殖指数是衡量肿瘤细胞增殖情况的重要指标,该指标的升高与WHO 1级脑膜瘤术后复发风险较高存在密切联系。H3K27me3通过同源重组修复通路调控双链DNA损伤修复,它的缺失与WHO 1级和2级脑膜瘤术后复发风险上升存在密切联系。脑膜瘤上PR的阳性表达与脑膜瘤患者术后预后情况良好,肿瘤复发风险较低存在一定联系。
近年,影像组学研究发展迅猛,该技术通过采集影像特征建立预测模型进而实现非侵入性的肿瘤评估。基于深度学习模型的影像组学可以自动采集处理高通量的影像特征,建立更复杂更完善的肿瘤预测模型,进一步扩大预测的范围和提高预测的精度。目前该技术已经被应用于术前预测脑膜瘤的级别和肿瘤对静脉窦和脑组织的侵犯等,也被应用于术前预测胶质瘤的一系列重要病理指标。
为了帮助神经外科医生制定更合适脑膜瘤患者的治疗策略,本研究回顾了多个医疗中心的脑膜瘤病例,收集相对应的临床病理数据和MRI影像数据,构建了基于影像组学的深度学习模型,实现了对脑膜瘤级别和病理指标的术前预测,进而识别肿瘤复发风险较高的患者。
方法
本研究回顾性收集了1038例在复旦大学附属华山医院接受过手术治疗的脑膜瘤患者作为训练集、内部验证集和内部测试集。纳入标准为:(1)根据WHO分级标准确诊为脑膜瘤的病例;(2)具有Ki-67、H3K27me3和PR的免疫组化染色信息;(3)术前2周内完成MRI影像的病例;(4)年龄大于等于18岁。本研究的排除标准为:(1)复发脑膜瘤的病例;(2)MRI影像质量不合格的病例。
我们对所有病例的WHO级别、Ki-67、H3K27me3和PR等病理信息进行回顾收集,对术前MRI图像(T1增强图像)进行数据增强、重采样、信号归一化等预处理后,采用深度学习算法进行高通量影像组学特征提取并构建预测模型,使用内部测试集和外部验证集数据评估该模型的各项性能(包括准确度、敏感性、特异性、F1分数和曲线下面积)。我们的研究路线如图1所示。

图1. 研究路线图
结果
脑膜瘤患者的临床病理特征
来自内部队列的1038例脑膜瘤患者包括328例男性和710例女性患者,平均年龄为54.63 ± 10.58岁,其中,有798例(76.88%)为WHO 1级脑膜瘤,240例(22.83%)为WHO 2级脑膜瘤,3例(0.29%)为WHO 3级脑膜瘤。来自外部队列的154例脑膜瘤患者包括55例男性和99例女性患者,平均年龄为52.47 ± 12.53岁,其中,有127例(82.47%)为WHO 1级脑膜瘤,23例(14.94%)为WHO 2级脑膜瘤,4例(2.59%)为WHO 3级脑膜瘤。如表1所示。

表1. 内部队列和外部队列的脑膜瘤患者的临床特征。

表2. 内部队列和外部队列的WHO 1级脑膜瘤患者的临床病理特征。
数据增强和深度学习模型的构建
由于不同中心的数据差异和部分数据分布不均,我们在模型建构之前进行了数据增强处理,结果如图2所示。

我们采用经过增强后的数据进行建模分析,采集到各组的数据分布如表3所示。

表3. 来自内部队列和外部队列的训练集(Training set)、验证集(Validation set)和测试集(Testing set)的建模数据分布。
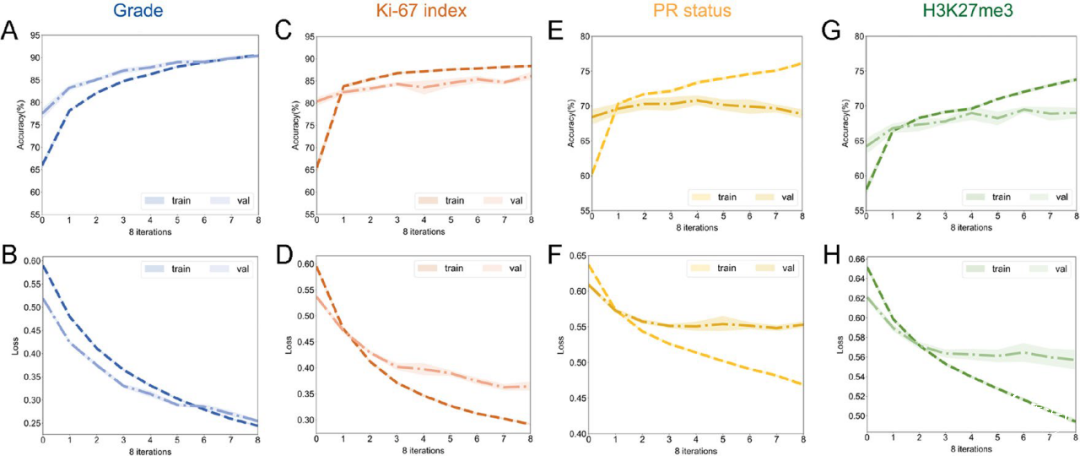
深度学习模型的内部评估和验证
我们对深度学习模型进行评估,准确度、敏感性、特异性、F1分数和曲线下面积如表4所示。

表4. 内部验证集和内部测试集的预测模型性能。
混淆矩阵中的对角线元素表示模型预测与实际相符时的标签数,非对角线元素表示预测错误的标签数。颜色阴影越深,分类性能越好,诊断准确率越高。经过10次内部验证后,各个指标的混淆矩阵如图4A所示,受试者工作特征(ROC)曲线如图4B所示。WHO级别、Ki-67指数、PR和H3K27me3状态的曲线下面积分别是0.971(95%CI 0.965–0.977),0.873(95%CI 0.867–0.879),0.744(95%CI 0.735–0.753)和0.702(95%CI 0.689–0.715)。

我们在内部测试集也做了相同的分析。经过10次内部测试后,各个指标的混淆矩阵如图5A所示,ROC曲线如图5B所示。WHO级别、Ki-67指数、PR和H3K27me3状态的曲线下面积分别是0.966(95%CI 0.957–0.975),0.905(95%CI 0.895–0.915),0.771(95%CI 0.750–0.792)和0.773(95%CI 0.760–0.786)。

图5. 经过10次内部测试后WHO级别和病理指标预测的混淆矩阵(A)和ROC曲线(B)。
深度学习模型的外部验证

图6. 经过10次外部验证后WHO级别和病理指标预测的混淆矩阵(A)和ROC曲线(B)。

表5. 外部验证集的预测模型性能。
结论
第一作者简介
陈嘉伟
复旦大学附属华山医院神经外科
复旦大学附属华山医院神经外科2020级博士研究生,师从宫晔教授
曾获欧洲神经肿瘤协会青年研究员旅行奖学金(EANO Young Investigator Travel Scholarship)
2021~2023年在瑞士苏黎世大学医院神经科学中心联合培养,研究方向为脑膜瘤的免疫治疗
作为第一作者在Eur Radiol、World Neurosurg、J Neurosurg、Front Oncol等杂志发表SCI论文7篇
通讯作者简介
宫晔 教授
复旦大学附属华山医院神经外科
复旦大学附属华山医院神经外科副主任
主任医师、教授、博士研究生导师
上海市领军人才
上海市医师协会神经外科分会副会长
华山医院神经外科脑膜肿瘤亚专科负责人
先后主持十二五科技公关项目1项、十三五重点研发项目1项、国家自然科学基金6项;上海市科委重点专项研究6项等多项课题。获华夏医学科技奖二等奖、教育部科技进步奖二等奖、中国老年保健医学研究会科学技术奖一等奖、上海医学科技奖三等奖、上海市科技进步奖三等奖等多项奖项
以第一作者及通讯作者在Neuro oncol、J Neurosurg等SCI杂志共发表学术论文60余篇
吴瑞琪 研究员
复旦大学脑科学研究院
复旦大学脑科学研究院/脑科学前沿科学中心/脑功能与脑疾病全国重点实验室,研究员,PI,博士研究生导师
上海市脑中心“求索杰出青年”项目获得者
上海市神经科学学会疼痛转化研究分会委员
主持国家自然科学基金及上海市自然科学基金等科研基金项目多项
致力于神经影像学方法及应用研究,研究成果发表在NeuroImage、J Neurosci、PNAS、Neuron、Nat Commun、MRM等专业SCI期刊
声明:脑医汇旗下神外资讯、神介资讯、神内资讯、脑医咨询、AiBrain 所发表内容之知识产权为脑医汇及主办方、原作者等相关权利人所有。








